Кинетика и катализ, 2020, T. 61, № 3, стр. 343-348
Синергизм смеси 3-бутил-5-амино-6-метилурацила и бутилгидрокситолуола при ингибировании окисления стирола
А. В. Антипин a, *, С. А. Грабовский a, Ю. С. Грабовская a, Н. Н. Кабальнова a
a Уфимский институт химии УФИЦ РАН
450054 Уфа, просп. Октября, 71, Россия
* E-mail: rincewind@anrb.ru
Поступила в редакцию 31.07.2019
После доработки 15.11.2019
Принята к публикации 06.12.2019
Аннотация
Изучено антиоксидантное действие смеси 3-бутил-5-амино-6-метилурацила и бутилгидрокситолуола (ионола) в модельной системе инициированного радикально-цепного окисления стирола в хлорбензоле при 310 К. Максимальный синергетический эффект наблюдался при соотношении концентраций производного урацилa к ионолу ≈ 0.75. Обсужден механизм синергетического действия.
Многие лекарственные препараты, являющиеся синтетическими модификациями природных соединений, обладают как биологической, так и антиоксидантной активностью и используются в моно- и комплексной терапии для профилактики и лечения различных заболеваний [1–3]. Интерес к антиоксидантным свойствам производных урацила обусловлен широким спектром их фармакологической активности и относительно высокими константами скорости реакции с пероксильными радикалами [4]. Алкилирование атомов азота урацильного кольца увеличивает растворимость в органических неполярных растворителях [5, 6], что позволяет сравнивать эти производные урацила с традиционными фенольными ингибиторами, а также изучать их совместное действие в присутствии других ингибиторов радикально-цепного окисления.
Одним из приемов повышения эффективности ингибитора является использование его в смеси с другими компонентами [7]. Считается, что для достижения фактической защиты биологических и технических материалов от окисления желательно использовать синергетическое действие различных антиоксидантов [7, 8]. Проявление синергизма в действии антиоксидантов выявляется, как правило, эмпирическим путем. В связи с этим экспериментальное подтверждение гипотез, связывающих эффективность и химическое строение антиоксидантов с целью прогнозирования возможности синергизма или антагонизма в их совместном действии, представляется важным и актуальным [9].
В данной работе было изучено антиоксидантное действие смеси 3-бутил-5-амино-6-метилурацила и бутилгидрокситолуола (ионола) – одного из нетоксичных, официально разрешенных к использованию антиоксидантов в модельной системе инициированного радикально-цепного окисления стирола.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
2,2'-Азо-бис-изобутиронитрил (AIBN) очищали двукратной перекристаллизацией из 96%-ного этилового спирта. Стирол (St) освобождали от ингибитора на колонке с окисью алюминия с последующей вакуумной перегонкой при 40°С (15 мм рт. ст.). Бутилгидрокситолуол (ионол, “Merck”) очищали сублимацией в вакууме. Растворители хлорбензол, ацетон (“ч. д. а.”) и этилацетат перегоняли непосредственно перед использованием. Этанол обезвоживали над гидридом кальция.
Физико-химические методы
Спектры ЯМР 1Н, 13С и 15N регистрировали на импульсном спектрометре Bruker Avance-III (“Bruker”, Германия) с рабочей частотой 500.13 МГц (1H), 125.47 МГц (13C) и 50.58 МГц (15N) с использованием 5-мм датчика PABBO с Z-градиентом при постоянной температуре образца 298 К. Химические сдвиги в спектрах ЯМР 1Н и 13С приведены (в м. д.) относительно сигнала внутреннего стандарта – тетраметилсилана, а в спектрах ЯМР 15N – относительно сигнала внешнего стандарта (жидкого аммиака). Отнесение сигналов в спектрах ЯМР проводили с использованием одномерных и двумерных спектров: DEPT-90, DEPT-135, {1H, 1H} gsCOSY, {1H, 13C} gsHSQC, {1H, 13C} gsHMBC, {1H, 15N} gsHMBC и {1H, 15N} gsHSQC.
Электронные спектры поглощения записывали на спектрометре SPECORD M40 VEB (“Carl Zeiss JENA”, Германия).
Данные элементного анализа получали на приборе Perkin Elmer Ser. II CHNS/0 2400 (США).
Температуру плавления определяли с помощью автоматизированной системы Optimelt MPA100 (“Stanford Research Systems”, Англия) в открытых капиллярах без корректировки.
Структура ингибитора I
3-Бутил-5-амино-6-метилурацил (I) получали восстановлением соответствующего нитропроизводного 10% Pd/C в этилацетате [5] и перекристаллизовывали из этанола. Исходный 3-бутил-5-нитро-6-метилурацил получали по методике [10].
3-Бутил-5-нитро-6-метилурацил: выход 47%. ЯМР 1H (DMSO-d6), δ, м. д.: 0.894 (т, J = 7.4 Hz, 3H, CH2CH3), 1.286 (сик., J = 7.4 Hz, 2H, CH2CH3), 1.507 (п, J = 7.4 Hz, 2H, N(3)CH2CH2), 2.300 (с, 3H, C(6)CH3), 3.766 (т, J = 7.4 Hz, 2H, N(3)CH2), 12.106 (HN(1)). ЯМР 13C (DMSO-d6), δ, м. д.: 13.54 (CH2CH3), 16.30 (C(6)CH3), 19.51 (CH2CH3), 28.93 (N(3)CH2CH2), 40.13 (N(3)CH2), 126.99 (С5), 149.00 (С2), 152.02 (С6), 155.50 (С4). Рассчитано для C9H13N3O4, %: C 47.57, H 5.77, N 18.49. Найдено, %: C 47.55, H 5.79, N 18.45.
3-Бутил-5-амино-6-метилурацил (I): выход 94%. ЯМР 1H (DMSO-d6), δ, м. д.: 0.887 (т, J = 7.4 Hz, 3H, CH2CH3), 1.263 (сик., J = 7.4 Hz, 2H, CH2CH3), 1.484 (п, J = 7.4 Hz, 2H, N(3)CH2CH2), 1.978 (с, 3H, C(6)CH3), 3.777 (т, J = 7.5 Hz, 2H, N(3)CH2), 3.792 (с, 2H, NH2). ЯМР 13C (DMSO-d6), δ, м. д.: 13.62 (CH2CH3), 13.78 (C(6)CH3), 19.57 (CH2CH3), 29.35 (N(3)CH2CH2), 39.55 (N(3)CH2), 117.36 (C5), 126.40 (C6), 149.17 (C2), 160.22 (C4). ЯМР 15N (ДМСО-d6), δ, м. д.: 32.5 (NH2), 126.5 (N1), 160.3 (N3). Рассчитано для C9H15N3O2, %: C 54.81, H 7.67, N 21.30. Найдено, %: C 54.85, H 7.63, N 21.33.
Инициированное окисление стирола
Антиоксидантную активность изучали в модельной системе инициированного AIBN окисления стирола (St) в хлорбензоле при 310 К в атмосфере воздуха (P0 = 1 атм), объем жидкой и газовой фаз 4 и 19.5 мл, соответственно [5]. В предварительных экспериментах с использованием УФ-спектрофотометрии и высокоэффективной жидкостной хроматографии (ВЭЖХ) было установлено, что соединения не расходуются в насыщенных кислородом растворах как в отсутствие AIBN, так и в его присутствии без кислорода. Количество поглощенного кислорода определяли с помощью манометрической дифференциальной установки с датчиком перепада давления в кинетическом режиме, коэффициент Генри равен 0.198 для смеси хлорбензол–стирол при 310 К, как описано ранее [5]. Скорость инициирования wi предварительно определяли в серии экспериментов из значений периода индукции (tind), используя α-токоферол (α-TP) в качестве эталонного антиоксиданта: wi = 2[α-TP]0/tind [11]. Константу продолжения цепи вычисляли из фактора окисляемости k2(2k6)–1/2. Определение периода индукции, расчет констант скорости реакции с пероксильными радикалами и стехиометрического коэффициента ингибирования проводили аналогично приведенным в работе [12]. Скорость поглощения кислорода wt определяли численным дифференцированием сглаженной усреднением кинетической кривой, после повторного сглаживания численным интегрированием вычисляли индукционный период:
где w0 – скорость поглощения кислорода без ингибитора.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
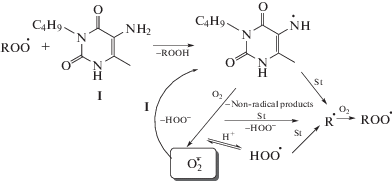
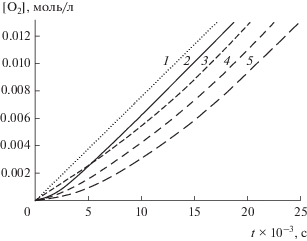
При окислении стирола в присутствии 3-бутил-5-амино-6-метилурацила (I), ионола (II) и их смесей скорость поглощения кислорода снижается и наблюдается индукционный период (рис. 1). Из зависимостей поглощения кислорода от времени численным дифференцированием были рассчитаны скорости поглощения кислорода. После завершения индукционного периода скорость поглощения кислорода была равна скорости без добавок I и II, т.е. продукты не ингибируют окисление.
Рис. 1.
Типичные кинетические кривые поглощения кислорода при инициированном окислении стирола в хлорбензоле ([St] = 1.71 моль/л, wi = 1.31 × 10–7 моль л–1 с–1, 310 К) в различных условиях: 1 – без ингибиторов (w0 = = 7.9 × 10–7 моль л–1 с–1), 2 – [I]0 = 2.4 × 10–5 моль/л, 3 – [II]0 = 5 × 10–5 моль/л, 4 – [I]0 = 2.5 × 10–5 моль/л и [II]0 = = 5 × 10–5 моль/л, 5 – [I]0 = [II]0 = 5 × 10–5 моль/л.
Расчет кинетических параметров проводили в рамках механизма цепного окисления:
По кинетическим кривым поглощения кислорода были рассчитаны начальная скорость окисления w, период индукции tind и длина цепи окисления ν = w/wi (табл. 1). В присутствии ингибитора ν > 5–6, что свидетельствует о протекании радикально-цепного процесса.
Таблица 1.
Кинетические параметры ингибирования окисления стирола*
| [I]0 × 10–5, моль/л | [II]0 × 10–5, моль/л | w × 10–7, моль л–1 с–1 |
ν | $\sum {{{t}_{{{\text{ind}}}}}} ,$ c | SE, % | f | f∑ | F | |
|---|---|---|---|---|---|---|---|---|---|
| эксперимент | расчет | ||||||||
| 2.40 | 0 | 2.03 | 14 | 1885 | – | – | 1.1 | – | 3.7 |
| 0 | 5.0 | 4.9 | 35 | 7836 | – | – | 2.1 | – | 1.0 |
| 1.20 | 1.20 | 4.33 | 30 | 1904 | 2571 | –26 | 0.22** | 1.1 | 1.3 |
| 1.25 | 5.0 | 2.9 | 20 | 6599 | 8036 | –18 | –0.6** | 1.5 | 2.4 |
| 1.50 | 5.0 | 2.16 | 16 | 9436 | 8789 | 7 | 1.6** | 1.9 | 3.3 |
| 2.50 | 5.0 | 1.57 | 11 | 10 208 | 8929 | 14 | 1.7** | 1.9 | 4.9 |
| 3.75 | 5.0 | 1.15 | 8 | 11 376 | 9821 | 16 | 1.6** | 1.8 | 6.9 |
| 5.00 | 5.0 | 0.76 | 5 | 11 173 | 11 464 | –2.5 | 0.9** | 1.5 | 10.1 |
| 7.50 | 5.0 | 0.88 | 6 | 10 633 | 13 375 | –20 | 0.5** | 1.1 | 8.6 |
* Условия окисления: [St] = 1.71 моль/л, 310 К, 2k6 = 5.5 × 107 л моль–1 с–1 [13], k2 = 29.5 л моль–1 с–1, wi = (1.3–1.4) × × 10–8 моль л–1 с–1. ** В смеси I и II для I f = (tindwi − f2[II]0)/[I]0.
Для индивидуальных ингибиторов были рассчитаны значения степени торможения (F)
где w0 – скорость поглощения кислорода не ингибированного окисления. Из концентрационной зависимости была вычислена константа скорости ингибирования fk7, которая для I составляет 1 × 105 л моль–1 с–1 ([InH]0 – начальная концентрация ингибитора). Стехиометрический коэффициент ингибирования (f) рассчитывали по формуле $f$ = ${{{{w}_{{\text{i}}}}{{t}_{{{\text{ind}}}}}} \mathord{\left/ {\vphantom {{{{w}_{{\text{i}}}}{{t}_{{{\text{ind}}}}}} {{{{{\text{[InH]}}}}_{{\text{0}}}}}}} \right. \kern-0em} {{{{{\text{[InH]}}}}_{{\text{0}}}}}}.$ Для II константа скорости ингибирования fk7 и стехиометрический коэффициент ингибирования f совпали с литературными данными [14].В присутствии I f равен 1.1 (табл. 1), что типично для 5-аминопроизводных урацила [5]. Введение в систему соединений I и α-TP увеличивает индукционный период аддитивно. Так, для их смеси равного состава (по 1.2 × 10–5 моль/л) и wi = = 1.35 × 10–8 моль л–1 с–1 индукционный период составляет 2755 с.
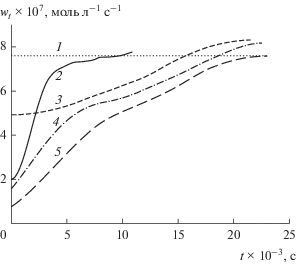
Как видно на рис. 2, в присутствии смеси соединений I и II (кривые 4 и 5) период индукции увеличивается. При этом начальная скорость поглощения кислорода становится меньше, чем для индивидуальных ингибиторов. Для смеси рассчитывали стехиометрический коэффициент ингибирования f∑ в пересчете на сумму концентраций двух ингибиторов. При некотором соотношении соединений I и II в смеси достигается максимальное значение стехиометрического коэффициента ингибирования f (табл. 1).
Рис. 2.
Изменение скорости поглощения кислорода при инициированном окислении стирола в хлорбензоле ([St] = 1.71 моль/л, wi = 1.31 × 10–7 моль л–1 с–1, 310 К) в различных условиях: 1 – без ингибиторов, 2 – [I]0 = 2.4 × 10–5 моль/л, 3 – [II]0 = 5 × 10–5 моль/л, 4 – [I]0 = 2.5 × 10–5 моль/л и [II]0 = 5 × 10–5 моль/л, 5 – [I]0 = [II]0 = 5 × 10–5 моль/л.
Синергетический эффект (SE) принято оценивать по увеличению индукционного периода [15–17]:
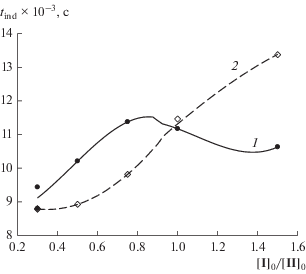
Для оценки синергетического эффекта смеси ингибиторов рассчитывали ожидаемый аддитивный индукционный период из равенства:
Рис. 3.
Зависимость периода индукции (1) и аддитивного периода индукции (2) от соотношения концентрации ингибиторов.
Так же был рассчитан стехиометрический коэффициент ингибирования [18] для I в смеси, который оказался равным 1.7 (см. табл. 1), исходя из предположения, что для II коэффициент неизменен (f = 2). Таким образом, в смеси он увеличивается и близок к значению для фенольных антиоксидантов [19, 20].
Ранее было предположено, что ингибирование окисления стирола в присутствии аминоурацилов можно описать схемой [5].
Для I стехиометрический коэффициент ингибирования значительно меньше 2, так как I ингибирует окисление, замедляя передачу цепи, а не обрывая ее, как при ингибировании фенолами.
Согласно классификации синергетических смесей, предложенной в работе [21], первая группа объединяет смеси, в которых оба компонента взаимодействуют с радикалами (ROO·). Проявление синергетического эффекта в такой смеси определяется взаимодействием промежуточных продуктов ингибиторов. Например, в системе, содержащей фенил-N-β-нафтиламин и ионол (ArOH), между аминильными и феноксильными радикалами устанавливается равновесие [22]:
Равновесие сдвигается вправо при условии, что энергия диссоциации связи DNH > DOH. В нашем случае, вероятно, при добавлении фенольного ингибитора равновесие между радикалами ингибиторов смещается в сторону образования феноксильных радикалов, так как энергии диссоциации DNH ≈ 85 ккал/моль для 5-аминоурацилов (UrNH2) и DOH = 80.5 ккал/моль для ионола [5]:
ЗАКЛЮЧЕНИЕ
Впервые была изучена эффективность совместного действия бинарных смесей 3-бутил-5-амино-6-метилурацила и ионола и обнаружен синергетический эффект в реакции инициированного окисления стирола в растворе хлорбензола при 310 К. Константа скорости реакции с пероксильными радикалами близка к значению 1 × 105 л моль–1 с–1, при этом стехиометрический коэффициент ингибирования равен 1.8 ± 0.2. Максимальный синергетический эффект наблюдается при соотношении концентраций урацил : : ионол ≈ 0.75. Предположительно, происходит замещение более активных N-центрированных радикалов 3-бутил-5-амино-6-метилурацила на феноксильные в обменной реакции с ионолом.
Список литературы
Бурлакова Е.Б. // Росс. хим. журн. 2007. Т. 51. № 1. С. 3.
Kancheva V.D., Kasaikina O.T. // Curr. Med. Chem. 2013. V. 20. P. 4784.
Kancheva V.D., Angelova S.E. Lipid Peroxidation: Inhibition, Effects and Mechanisms / Ed. Catalá A. N.Y.: Nova Science Publishers, Inc., 2017. Chapter 4. P. 49.
Муринов Ю.И., Грабовский С.А., Кабальнова Н.Н. // Изв. АН. Сер. хим. 2019. Т. № 5. С. 946.
Grabovskii S.A., Antipin A.V., Grabovskaiy Y.S., Andriayshina N.M., Kabal’nova N.N. // Lett. Org. Chem. 2017. V. 14. P. 24.
Grabovskiy S.A., Murinov Yu.I., Kabal’nova N.N. // Curr. Org. Chem. 2012. V. P. 2389.
Карпухина Г.В., Эмануэль Н.М. // Докл. АН СССР. 1984. Т. 276. № 5. С. 1163.
Viglianisi C., Menichetti S., Morelli P., Baschieri A., Amorati R. // Heteroatom Chem. 2018. V. 29. № 5–6. P. 1.
Перевозкина М.Г. Тестирование антиоксидантной активности полифункциональных соединений кинетическими методами. Новосибирск: Изд-во СибАК, 2014. 240 с.
Uchiyama K., Takamoto K., Umezome T. Pat. Jpn. 2013006813, 2013.
Burton G.W., Doba T., Gabe E.J., Hughes L., Lee F.L., Prasad L., Ingold K.U. // J. Am. Chem. Soc. 1985. V. 107. P. 7053.
Loshadkin D., Roginsky V., Pliss E. // Int. J. Chem. Kinet. 2002. V. 34. № 3. P. 162.
Howard J.A., Ingold K.U. // Can. J. Chem. 1965. V. 43. P. 2729.
Howard J.A., Ingold K.U. // Can. J. Chem. 1962. V. 40. P. 1851.
Zhi-Sheng Jia, Bo Zhou, Li Yang, Long-Min Wu and Zhong-Li Liu // J. Chem. Soc. Perkin Trans. 2. 1998. P. 911.
Frankel E.N. Lipid Oxidation. Dundee: The Oily Press, 1998.
Kancheva V.D., Slavova-Kazakova A., Fabbri D., Dettori M.A., Delogu G., Janiak M., Amarowicz R. // Food Chem. 2014. V. 157. P. 263.
Massaro M., Riela S., Guernelli S., Parisi F., Lazzara G., Baschieri A., Valgimigli L., Amorati R. // J. Mater. Chem. B. 2016. V. 4. P. 2229.
Ingold K.U. Essays on Free Radical Chemistry / Eds. Hey D.H., Waters W.A., Norman R.O.C. London: Chemical Society, 1970, Special publications, № 24. P. 285.
Mahoney L.R. // Angew. Chem. Int. Ed. Engl. 1969. V. 8. P. 547.
Карпухина Г.В., Эмануэль Н.М. // Докл. АН СССР. 1984. Т. 276. № 5. С. 1163.
Денисов Е.Т., Азатян В.В. Ингибирование цепных реакций. Черноголовка: Изд-во РАН, 1997. 266 с.
Денисов Е.Т., Саркисов О.М., Лихтенштейн Г.И. Химическая кинетика. М.: Химия, 2000. 568 с.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ