Кинетика и катализ, 2020, T. 61, № 3, стр. 436-442
Влияние допирования нитратом лития на фазовый состав алюмохромовых катализаторов
Н. Н. Болдырева a, *, В. В. Чесноков a, Л. С. Довлитова a, А. С. Чичкань a, b
a ФИЦ Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
b Новосибирский государственный технический университет
630073 Новосибирск, просп. К. Маркса, 20, Россия
* E-mail: boldnn@catalysis.ru
Поступила в редакцию 28.06.2019
После доработки 12.11.2019
Принята к публикации 20.12.2019
Аннотация
Методами дифференцирующего растворения (ДР) и рентгеновской дифракции (РФА) исследовано влияние модифицирующей добавки нитрата лития (LiNO3) на генезис фазового состава алюмохромовых катализаторов. Показано, что LiNO3 с чистым носителем (Al2O3) образует алюминат лития, двойной оксид Al4Li2O7 со структурой шпинели и смешанный гидроксид LiAl2(OH)7(H2O)2. Взаимодействие алюмохромового катализатора с LiNO3 также приводит к появлению алюмината лития и двойного оксида Al4Li2O7, но смешанный гидроксид не формируется. При взаимодействии катионов лития с активным компонентом Сr(VI) катализатора дополнительно образуется хромат лития. Проведен сравнительный анализ результатов фазового анализа алюмохромового катализатора с добавками LiCl и LiNO3. Обнаружено, что в зависимости от природы добавки фазовый состав катализатора частично меняется. В случае введения хлорида лития формируются твердые растворы Сr(III) и Li(I) в оксиде алюминия, а при использовании нитрата лития образуются двойной оксид Al4Li2O7 и алюминат лития. Результаты исследования активности образцов катализатора 0.5–3% Li + 9.5% Cr + Al2O3 (Li вводили из LiCl и из LiNO3) показали, что замена модифицирующей добавки LiCl на LiNO3 приводит к некоторому изменению каталитических свойств алюмохромовых катализаторов. Образец, допированный нитратом лития, на 4–8% более активный, чем допированный хлоридом лития. Это можно объяснить тем, что в случае добавки LiNO3 концентрация образовавшихся активных фаз Li2CrO4 и Cr2O3 выше. У катализаторов, модифицированных солями лития (хлоридом и нитратом), селективности различаются незначительно по причине формирования одинаковых активных фаз.
ВВЕДЕНИЕ
В настоящее время более половины мирового рынка промышленных катализаторов дегидрирования парафинов С3–С5 занимают алюмохромовые катализаторы [1–7]. С использованием комплекса физико-химических методов анализа было показано присутствие различных состояний нанесенного оксида хрома в катализаторах. В реакции дегидрирования наиболее важную роль играют две разновидности хрома – Cr(III) и Cr(VI). Авторы [8, 9] на основании результатов проведенных исследований утверждают, что активными центрами в реакции дегидрирования легких парафинов являются поверхностные координационно ненасыщенные ионы Cr3+. Вышеуказанные ионы пытаются создать стабильную конфигурацию путем захвата молекул алкана из газовой фазы. Было показано, что на таком Cr3+-ионе могут адсорбироваться две молекулы NO [10]. Каталитическая активность обеспечивается фазой дисперсных ионов Cr3+, в то время как другие сосуществующие фазы отвечают за ее пополнение во время каталитического процесса. По мнению авторов работы [8] поверхностные ионы Cr6+/5+ являются предшественниками активных центров Cr3+. При изучении методом in situ ЭСДО катализаторов 0.1–8.0% Cr/Al2O3 было установлено, что поверхностные ионы Cr6+ восстанавливаются при температуре реакции в присутствии н-бутана или изобутана в основном до псевдооктаэдрических ионов Cr3+. Таким образом, поверхностные ионы Cr3+ образуются в реакционных условиях при расходовании Cr6+ [11]. В отработанных катализаторах ионы Cr6+ не обнаруживаются [12]. Также было показано, что количество поверхностных ионов Cr6+ уменьшается от цикла к циклу [13]. В свежеприготовленном катализаторе 13% Cr/Al2O3 в состоянии Cr6+ находилось 15% хрома, а после проведения 25 циклов – только 12.7%. Таким образом, часть Cr6+ была необратимо восстановлена до более низкой степени окисления.
Содержание Cr6+ на поверхности катализатора уменьшается из-за восстановления и растворения части ионов Cr3+ в носителе с образованием твердого раствора в Al2O3. Для большей эффективности работы катализатора нужно увеличивать содержание растворимых ионов шестивалентного хрома и дисперсных частиц оксида хрома. Для этих целей используются добавки щелочных металлов, церия и циркония, которые увеличивают количество хроматов. Другим направлением повышения активности и стабильности катализаторов может быть внедрение допирующих добавок в структуру носителя. Перспективными в этом отношении могут стать соли лития. Ионы лития обладают малым ионным радиусом и поэтому могут легко внедряться в оксид алюминия, тем самым препятствуя растворению ионов хрома в носителе.
Целью настоящей работы было изучение особенностей влияния допирования LiNO3 на фазовый состав и каталитическую активность алюмохромовых катализаторов и сравнение результатов с данными, полученными ранее для LiCl [14].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования
Для синтеза промотированных образцов катализатора и носителя применяли оксид алюминия γ-Al2O3 (марка А-1). Процесс приготовления допированного носителя состоял из стадий пропитки по влагоемкости дисперсного порошка γ-Al2O3 водными растворами нитрата лития. Далее порошок сушили при 150°С и прокаливали при 650°С в течение часа. Алюмохромовые катализаторы, допированные литием, получали пропиткой оксида алюминия γ-Al2O3 водными растворами нитрата лития и CrO3. Состав допированных нитратом лития образцов представлен в табл. 1.
Таблица 1.
Состав образцов, допированных нитратом лития
| № | Состав образца, массовая доля элемента и носителя, %* | Температура прокаливания, °С |
|---|---|---|
| 1 | 4.1% Li (72.6 г LiNO3 ⋅ 3H2O) + 95.9% γ-Al2O3 | 650 |
| 2 | 4.5% Li (80 г LiNO3 ⋅ 3H2O) + 9.5% Cr (18.2 г CrO3) + 86% γ-Al2O3 | 650 |
| 3 | 1.8% Li (33 г LiNO3 ⋅ 3 H2O) + 6.2% Cr (12.5 г CrO3) + 92% γ-Al2O3 | 650 |
| 4 | 1.2% Li (20 г LiNO3 ⋅ 3 H2O) + 7% Cr (12.5 г CrO3) + 91.8% γ-Al2O3 | 650 |
Метод дифференцирующего растворения
Для изучения генезиса фазового состава алюмохромового катализатора, промотированного литием, был применен оригинальный разработанный в Институте катализа СО РАН химический метод фазового анализа – метод дифференцирующего растворения (ДР), который дает возможность определять состав образующихся фаз и их распределение на поверхности и в объеме исследуемых объектов, получать уникальные данные о наличии и составе малых фаз, аморфных фаз и фаз переменного состава [15–17].
Исследования по дифференцирующему растворению проводили на приборе Стехиограф, созданном в Институте катализа СО РАН, в режиме стехиографического титрования [15–17]. Подробно способ выполнения стехиографического титрования для исследуемых образцов описан в [14]. Растворители дифференцирующего растворения были выбраны такие же, как и для исследования образцов с солью LiCl: H2O → 3 M HCl → 3.6 M HF. Начинали растворение в дистиллированной воде, затем в нее плавно, по линейному закону, добавляли хлористоводородную кислоту (HCl), повышая ее концентрацию за 30 мин до 3 M. Далее меняли состав растворителя с 3 M HCl на фтористоводородную кислоту HF, доводя за 15 мин ее концентрацию до 3.6 М, после чего растворение продолжалось одной 3.6 М HF. Одновременно с увеличением концентрации растворителя поднимали температуру от 22 до 90°С. В качестве детектора-анализатора “Стехиографа” использовали атомно-эмиссионной спектрометр с индуктивно-связанной плазмой PST (“BAIRD”, США).
Выбор условий проведения ДР-анализа, а также алгоритм расчета атомных соотношений элементов в исследуемых образцах и построения стехиограмм подробно описаны в работах [14, 16, 17]. Поскольку кислород, водород, азот, хлор и некоторые другие легкие элементы методом атомно-эмиссионной спектрометрии (АЭС-ИСП) не детектируются, стехиометрические формулы фаз представлены в тексте в их фрагментарной (неполной) форме. Например, соединения хрома Cr2O3 и CrO3 мы обозначаем как фрагментарную формулу (без кислорода) – Cr1 или Cr; соединение Li2CrO4 – как Li2Cr1; LiNO3 – как Li или Li1 и т.п.
Рентгенофазовый анализ
Рентгенофазовый анализ (РФА) выполняли на дифрактометре HZG-4C (“Freiberger Prazisionsmechanik”, Германия) с использованием излучения CuKα с длиной волны 1.54184 Е сканированием по точкам. Интервал сканирования 2θ = 10°–75°, шаг сканирования 0.1°, накопление в точке 10 с. Размер области когерентного рассеяния (ОКР) рассчитывали по формуле Селякова–Шеррера по интегральной полуширине дифракционных пиков 4.4.0 шпинельной структуры оксида алюминия; параметр элементарной ячейки определяли из положений пиков 4.4.0.
Весьма перспективно применение метода ДР совместно с традиционным рентгенофазовым анализом (РФА), так как они хорошо дополняют друг друга и дают возможность получить достаточно полную информацию о фазовом составе исследуемого твердого объекта: о его кристаллических и рентгеноаморфных фазах [18–21].
Каталитические исследования
На рис. 1 представлено схематическое изображение проточного кварцевого реактора, который использовали для проведения каталитических исследований.
Реакцию дегидрирования пропана проводили в лабораторном проточном реакторе диаметром 16 мм, который помещали в печь. Пропан подавали со скоростью 3 л/ч, навеска катализатора составляла 5.0 г. При загрузке в реактор фракцию (0.5–1.0 мм) катализатора разбавляли кварцем в массовом отношении катализатор : кварц = 1 : 10.
Продукты на выходе из реактора анализировали с помощью газового хроматографа Кристалл-2000 (“Хроматэк”, Россия), колонка с носителем Porapak T. Границы относительной погрешности измерений массовой доли массобаланса углерода были ±10 отн. %.
Конверсию (К) пропана определяли по формуле:
Селективность (S) реакции дегидрирования пропана по пропилену вычисляли по формуле:
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Фазовый состав образцов LiNO3 + γ-Al2O3
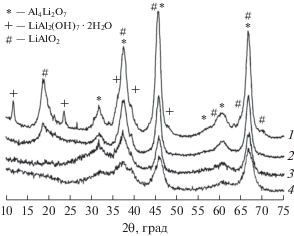
По данным РФА [14, 21] используемая нами исходная форма оксида алюминия марки А-1, высушенная при 150°С, содержит фазу γ-Al2O3 и в качестве примесей гидроксиды алюминия – гиббсит и байерит. Другие фазы оксида алюминия методом РФА не зарегистрированы. Прокаливание носителя А-1 при 650°С приводит к разложению фаз гидроксидов алюминия (гиббсита и байерита), при этом показатель дисперсности ОКР остается неизменным (45 Å) [14]. В результате пропитки раствором LiNO3 носителя γ-Al2O3 и прокаливания образца при 650°С появляются новые фазы, не обнаруженные при допировании солью LiCl. Так, в образце 4.1% Li + 95.9% γ-Al2O3 методом РФА (рис. 2) зафиксирована фаза Al4Li2O7 со структурой шпинели (ICSD#83017), фаза α-LiAlO2 (ICSD#28288) и фаза смешанного литий-алюминиевого гидроксида LiAl2(OH)7 ⋅ ⋅ 2H2O (ICSD#72979) [21].
Рис. 2.
Дифрактограммы прокаленных образцов: 1 – 4.1% Li + 95.9% γ-Al2O3; 2 – 4.5% Li + 9.5% Cr + 86% γ-Al2O3; 3 – 4.1% Li + 95.9% γ-Al2O3; 4 – носитель γ‑Al2O3.
Фазовый состав катализатора 4.1% Li + 95.9% γ-Al2O3 исследовали также методом ДР. На рис. 3 приведены кинетические кривые растворения найденных в этом образце фаз. Так, были обнаружены фаза LiNO3 (18 отн. %), смесь фаз LiAlO2 + + LiAl2(OH)7 ⋅ 2H2O (9 и 8 отн. % соответственно, Li2 + Al1 на рис. 3), смесь фаз Al4Li2O7 + Al2O3 (общее содержание 65 отн. %, Li3 + Al2 на рис. 3). Стехиограмма Li : Al демонстрирует степень смешения фаз Al4Li2O7 + Al2O3: ее переменный вид в пределах Li : Al = 0.1–0.2 : 1 моль/моль указывает на присутствие в образце смеси двух фаз.
Рис. 3.
Кинетические кривые растворения фаз в образце 4.1% Li + 95.9% γ-Al2O3: Li1 – фаза LiNO3; Li2 – фаза LiAlO2; Al1 – фаза LiAl2(OH)7·2H2O; Li3 – фаза Al4Li2O7; Al2 – фаза Al2O3.
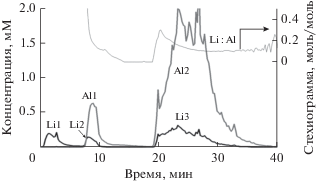
Таким образом, методами РФА и ДР в образце 4.1% Li + 95.9% γ-Al2O3 были зарегистрированы одни и те же фазы: Al4Li2O7, LiAlO2 и смешанного литий-алюминиевого гидроксида LiAl2(OH)7 · 2H2O. Методом ДР дополнительно обнаружена фаза LiNO3 – избыточное количество нитрата лития от того, что было взято для синтеза образца и не вошло в состав других найденных фаз.
Фазовый состав образца LiNO3 + CrO3 + γ-Al2O3
В изученном образце 4.5% Li + 9.5% Сr + 86% γ-Al2O3 методом РФА зарегистрирована фаза Al4Li2O7 со структурой шпинели (ICSD#83017) и фаза α-LiAlO2 (ICSD#28288).
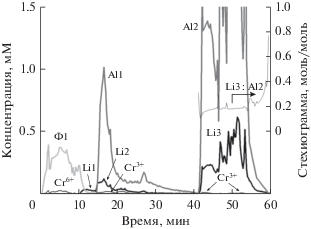
На рис. 4 приведены кинетические кривые растворения фаз, найденных в образце 4.5% Li + + 9.5% Сr + 86% γ-Al2O3 методом ДР. Были определены фаза Li2CrO4 с экранированным в ней остатком фазы CrO3, фаза LiNO3, включения фазы Cr2O3, фаза LiAlO2, смешанная с фазой Al2O3. Фазу Al4Li2O7, обнаруженную методом РФА, выделить не удалось, так как Al4Li2O7 растворяется одновременно с фазой Al2O3, которая не содержит в своем составе литий. Однако стехиограмма Li3 : Al2 имеет линейный участок со значением Li3 : Al2 = 0.18 ± 0.01, что указывает на пространственно однородное распределение лития во всем объеме γ-Al2O3. Это возможно при образовании стехиометрической смеси фаз Al4Li2O7 и Al2O3. Используя данные РФА относительно наличия фазы Al4Li2O7, можно сделать для нее количественный расчет.
Рис. 4.
Кинетические кривые растворения фаз, найденных в образце 4.5% Li + 9.5% Сr + 86% γ-Al2O3: Ф1 – Li2CrO4; Li1 – LiNO3; Li2 – LiAlO2; Al1 – Al2O3; Li3 – Al4Li2O7; Al2 – Al2O3; Cr6+ – CrO3; Cr3+ – Cr2O3.
Распределение общего хрома, алюминия и лития по фазам в катализаторе 4.5% Li + 9.5% Сr + + 86% γ-Al2O3 показано в табл. 2, 3 и 4 соответственно.
Таблица 2.
Распределение общего хрома (отн. %) по фазам согласно результатам ДР-анализа
| Образец | Li2CrO4(Ф1) | CrO3(Cr6+) | Cr2O3(Cr3+) |
|---|---|---|---|
| 4.5% Li + 9.5% Сr + 86.0% γ-Al2O3 | 86.5 | 4.7 | 8.8 |
| 1.8% Li + 6.2% Cr + 92.0% γ-Al2O3 | 65.2 | 13.0 | 21.7 |
| 1.2% Li + 7.0% Cr + 91.8% γ-Al2O3 | 27.3 | 18.2 | 54.5 |
Таблица 3.
Распределение общего алюминия (отн. %) по фазам согласно результатам ДР-анализа
| Образец | LiAlO2(Li2) + Al2O3(Al1) | Al4Li2O7(Li3) + Al2O3 (Al2) |
|---|---|---|
| 4.5% Li + 9.5% Сr + 86.0% γ-Al2O3 | 15.0 | 85.0 |
| 1.8% Li + 6.2% Cr + 92.0% γ-Al2O3 | 8.0 | 92.0 |
| 1.2% Li + 7.0% Cr + 91.8% γ-Al2O3 | 5.5 | 94.5 |
Таблица 4.
Распределение общего лития (отн. %) по фазам согласно результатам ДР-анализа
| Образец | LiAlO2(Li2) + Al2O3(Al1) | Al4Li2O7(Li3) + Al2O3 (Al2) |
|---|---|---|
| 4.5% Li + 9.5% Сr + 86.0% γ-Al2O3 | 15.0 | 85.0 |
| 1.8% Li + 6.2% Cr + 92.0% γ-Al2O3 | 8.0 | 92.0 |
| 1.2% Li + 7.0% Cr + 91.8% γ-Al2O3 | 5.5 | 94.5 |
В работе [14] нами был проведен фазовый анализ алюмохромового катализатора с добавками LiCl. В настоящей работе выполнено аналогичное исследование алюмохромового катализатора такого же состава, но с добавкой LiNO3. В табл. 5 приведены сравнительные результаты для обоих образцов.
Таблица 5.
Результаты фазового анализа методом ДР катализаторов 4.5% Li + 9.5% Сr + 86% γ-Al2O3, полученных с использованием добавок LiNO3 или LiCl, после прокаливания при 650°C
| Обнаруженная фаза | Содержание в образцах, отн. % | |
|---|---|---|
| добавка LiNO3 | добавка LiCl | |
| γ-Al2O3 | 17.8 | – |
| Al4Li2O7 | 39.8 | – |
| LiAlO2 | 3.5 | – |
| Cr2O3 | 8.8 (5.3акт + 3.5неакт) | 1 |
| CrO3 | 4.7 | – |
| Li2CrO4 | 20.9 | 4.4 |
| LiNO3 | 4.5 | – |
| LiCl | – | 6.1 |
| Твердый раствор активных ионов Cr 3+ в Al2O3 | – | 11.5 |
| Твердый раствор неактивных ионов Cr 3+ и Li+ в Al2O3 | – | 77 |
| Сумма фаз | 100 | 100 |
Фазовый состав образцов алюмохромового катализатора, допированных солями лития и прокаленных при 650°С, различен при использовании разных исходных солей лития. На формирование фаз оказывает влияние индивидуальная природа добавок. В случае с нитратом лития образуются хромат лития, алюминат лития, двойной оксид Al4Li2O7 со структурой шпинели и фаза Cr2O3 в виде включений в оксиде алюминия. В случае с хлоридом лития [14] обнаружены хромат лития, твердый раствор хрома(III) в оксиде алюминия, модифицированный хроматом лития, и трехкомпонентный твердый раствор хрома(III) и лития(I) в оксиде алюминия.
В заключительной части работы проведено исследование каталитической активности образцов LiCl + CrO3 + Al2O3 и LiNO3 + CrO3 + Al2O3 в реакции дегидрирования пропана. Результаты представлены на рис. 5. Видно, что для обоих катализаторов конверсия пропана и селективность в образовании пропилена проходят через максимум при увеличении количества модифицирующей добавки. Оптимальное содержание ионов Li+ в катализаторе составляет 1.4–1.5 мас. %.
Рис. 5.
Влияние содержания ионов Li+ в катализаторах LiCl + 18% CrO3 + Al2O3 и LiNO3 + 18% CrO3 + Al2O3 на конверсию и селективность реакции дегидрирования пропана при температуре 600°С.
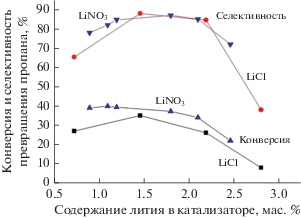
Конверсия пропана на катализаторе, допированном хлоридом лития, несколько ниже (на 4–8%), чем на образце, допированном нитратом лития, так как в случае добавки LiCl значительная часть ионов хрома уходит в объем носителя, и соответственно, концентрация образовавшихся активных фаз Li2CrO4 и Cr2O3 снижается. Селективность обоих катализаторов близка, так как они содержат одинаковые активные фазы.
ЗАКЛЮЧЕНИЕ
Совместное использование методов РФА и ДР позволило изучить генезис фазового состава алюмохромового катализатора с высоким (до 9.5%) содержанием хрома при введении модифицирующей добавки лития из LiNO3. Исследования показали, что добавка нитрата лития (4.5% Li) и температурное воздействие (прокаливание при 650°С) приводят к образованию фаз двойного оксида Al4Li2O7, LiAlO2, Li2CrO4 и Cr2O3. В образцах обнаружены также остатки исходных фаз γ-Al2O3, CrO3 и LiNO3.
Сравнение данных, полученных для катализаторов с добавками LiCl и LiNO3, показало, что природа допирующей добавки влияет на фазообразование. В случае с LiCl формируются неактивные твердые растворы ионов Cr3+ и Li+ в Al2O3, активные хромат лития и Cr2O3. В случае с LiNO3 твердые растворы ионов Cr 3+ и Li+ в Al2O3, выводящие хром из активной фазы, не образуются. Вместо них зарегистрирован неактивный двойной оксид Al4Li2O7. В обоих катализаторах присутствуют одинаковые активные фазы – хромат лития и Cr2O3.
Исследование каталитической активности образцов катализатора 0.5–3% Li + 9.5% Cr + Al2O3, полученных при использовании LiCl или LiNO3, показало, что замена модифицирующей добавки LiCl на LiNO3 приводит к изменениям в каталитических свойствах алюмохромовых катализаторов. Образец, допированный нитратом лития, оказалась несколько активнее, так как в этом случае концентрация образовавшихся активных фаз Li2CrO4 и Cr2O3 выше. Селективность катализаторов, допированных солями лития (хлоридом и нитратом), различается незначительно, поскольку они содержат одинаковые активные фазы.
Список литературы
Sanfilippo D., Miracca I. // Catal. Today. 2006. V. 111. № 1–2. P. 133.
Weckhuysen B., Schoonheydt R. // Catal. Today. 1999. № 51. P. 223.
Пахомов Н.А. // Промышленный катализ в лекциях. Москва: Калвис, 2006. № 6. С. 53.
Пахомов Н.А., Парахин О.А., Немыкина Е.И., Данилевич В.В., Чернов М.П., ПечериченкоВ.А. // Катализ в пром-ти. 2012. № 3. С. 65.
Немыкина Е.И., Пахомов Н.А., Данилевич В.В., Рогов В.А., Зайковский В.И., Ларина Т.В., Молчанов В.В. // Кинетика и катализ. 2010. Т. 51. № 6. С. 929.
Пахомов Н.А. // Промышленный катализ в лекциях. М.: Калвис, 2005. № 6. С. 87
Немыкина Е.И. Дис. … канд. хим. наук. Новосибирск: ИК РАН, 2012.
Weckhuysen B., Schoonheydt R. // Catal. Today. 1999. V. 51. P. 223.
De Rossi S., Ferraris G., Fremiotti S., Garrone E., Ghiotti G., Campa M., Indovina V. // J. Catal. 1994. V. 148. P. 36.
De Rossi S., Ferraris G., Fremiotti S., Cimino A., Indovina V. // Appl. Catal. A. Gen. 1992. V. 81. P. 113.
Weckhuysen B., Wachs I. // J. Phys. Chem. 1996. V. 100. P. 14 437.
Cavani F., Koutyrev M., Trifiro F. // J. Catal. 1996. V. 158. P. 236.
Hakuli A., Kutökivi A., Krause A., Suntola T. // J. Catal. 1996. V. 161. P. 393.
Чесноков В.В., Болдырева Н.Н., Довлитова Л.С., Зюзин Д.А., Пармон В.Н. // Кинетика и катализ. 2019. Т. 60. № 1. С. 118.
Малахов В.В., Васильева И.Г. // Успехи химии. 2008. Т. 77. № 4. С. 370.
Малахов В.В., Болдырева Н.Н., Власов А.А., Довлитова Л.С. // Журн. аналит. химии. 2011. Т. 66. № 5. С. 473.
Малахов В.В., Власов А.А. //. Журн. аналит. химии. 2011. Т. 66. № 3. С. 268
Болдырева Н.Н., Купцов А.В.// Заводская лаборатория. Диагностика материалов. 2014. Т. 80. № 10. С. 12.
Болдырева Н.Н., Купцов А.В. // Заводская лаборатория. Диагностика материалов. 2017. Т. 83. № 7. С. 7.
Плясова Л.М. // Введение в рентгенографию катализаторов. Новосибирск. Институт катализа им. Г.К. Борескова, 2010. С. 30.
База данных Inorganic Crystal Structure Database (ICSD), Copyright 2003–2011 Fachinformationszentrum (FIZ) Karlsruhe.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ