Кинетика и катализ, 2020, T. 61, № 3, стр. 366-381
Получение 1,3-бутадиена из 1-бутанола на пористом керамическом каталитическом [Fe,Cr]/γ-Al2O3(K,Ce)/α-Al2O3 конвертере
А. С. Федотов a, *, В. И. Уваров b, М. В. Цодиков a, И. И. Моисеев a, S. Paul c, S. Heyte c, P. Simon c, M. Marinova d, F. Dumeignil c
a ФГБУН Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Ленинский просп., 29, Россия
b ФГБУН Институт структурной макрокинетики и проблем материаловедения РАН
142432 Черноголовка, ул. Акад. Осипяна, 8, Россия
c Univ. Lille, CNRS, Centrale Lille, ENSCL, Univ. Artois, UMR 8181-UCCS-Unité de Catalyse et Chimie du Solide
F-59000 Lille, France
d Institut Chevreul, FR2638 CNRS, Bât. C6 Université Lille 1
F-59655 Villeneuve d’ Ascq, France
* E-mail: alexey.fedotov@ips.ac.ru
Поступила в редакцию 25.04.2019
После доработки 27.09.2019
Принята к публикации 22.01.2020
Аннотация
Разработан двухстадийный способ получения 1,3-бутадиена путем дегидратации 1-бутанола в смесь бутенов на гранулах γ-Al2O3, приготовленных самораспространяющимся высокотемпературным синтезом (СВС), с последующим дегидрированием бутеновой фракции в 1,3-бутадиен с использованием пористых керамических каталитических СВС-конвертеров состава [Fe,Cr]/γ-Al2O3(K,Ce)/α-Al2O3. Показано, что практически полная дегидратация 1-бутанола в смесь бутенов со ~100%-ой селективностью протекает на гранулах γ-Al2O3, полученных методом СВС, при температуре 300°С, что на 50 градусов ниже, чем на промышленных гранулах гамма-оксида алюминия. Применение оригинального гибридного каталитического мембранного реактора (ГКМР) с селективным отводом водорода из зоны реакции позволило увеличить выход по 1,3-бутадиену в ~1.3 раза со степенью извлечения ультрачистого водорода до 16 мол. % от общего количества получаемого водорода. За 20 ч проведения опыта не наблюдалось снижения каталитической активности системы в отличие от промышленных решений, в которых стадию регенерации катализатора осуществляют каждые 8–15 мин.
ВВЕДЕНИЕ
Сырьем для промышленного способа производства 1,3-бутадиена, одного из основных мономеров для получения искусственных каучуков, со времен С.В. Лебедева были спирты [1]. В наши дни ориентация на это сырье усилена общей тенденцией перехода на возобновляемые ресурсы.
Синтезу 1,3-бутадиена посвящено множество исследований [2, 3]. Несмотря на богатую историю разработки способов получения этого мономера, проблема селективности превращений остается нерешенной до настоящего времени. Вследствие эндотермичности реакции необходимо поддерживать высокую температуру внутри реактора, в результате чего происходит интенсификация побочных реакций, приводящих к быстрому закоксовыванию катализаторов [4]. В этой связи в ведущих научных школах мира ведется поиск альтернативных подходов к разработке экологически приемлемых и эффективных процессов получения 1,3-бутадиена [5].
1,3-Бутадиен – наиболее важный мономер с мировым объемом производства более 12 млн т/г [6], используемый главным образом для синтеза бутадиен-стирольных (28%) и полибутадиеновых (26%) каучуков, широко востребованных шинной промышленностью. В настоящее время 1,3-бутадиен получают тремя основными методами [7]: паровым крекингом парафиновых углеводородов, где бутадиен является побочным продуктом производства этилена (более 95% мирового производства); каталитическим дегидрированием бутан-бутеновых фракций (менее 2%); окислительным и пароокислительным дегидрированием бутенов (остальное). Важно отметить, что процессы получения мономеров включают в себя многочисленные стадии, такие как нефтепереработка, органический синтез, разделение углеводородных смесей и др. Таким образом, все предложенные до сих пор способы производства бутадиена являются капиталоемкими, а использование в качестве сырья ископаемых топлив увеличивает экологическую нагрузку на места его производства [8].
С точки зрения рационального природопользования для получения мономеров следовало бы утилизировать побочные продукты спиртового брожения, например, 1-бутанол [9], путем его дегидратации в бутеновую фракцию с ее последующим дегидрированием в 1,3-бутадиен.
В последнее время бутанол рассматривается как высокооктановая добавка к бензиновому топливу, технические характеристики которой существенно выше, чем у этанола. В этой связи в ряде крупных фирм намечено развитие процессов по увеличению производства бутанола [10–12]. Кроме того, 1-бутанол может служить сырьем для получения биотоплива [13, 14].
Бутанол, как и этиловый спирт, может быть синтезирован путем переработки сахара или крахмала сельскохозяйственных растительных культур (биобутанол I-го поколения), а также целлюлозы (биобутанол II-го поколения). С учетом того, что рынок биобутанола достигает 5 млрд л/г [15], он потенциально интересен для получения дополнительного количества бутадиена на децентрализованных малотоннажных предприятиях, что может представлять важность для регионов, удаленных от мест сосредоточения крупных нефтехимических производств. Так, например, в 2016 г. производство высокочистого био-1-бутанола было коммерциализировано британской компанией “Green Biologics Ltd.” на своих новых промышленных мощностях в городе Литл-Фолс (штат Миннесота, США) [16].
Важно также отметить, что в последнее время разработаны научные основы прорывных технологий прямого получения 1-бутанола из этанола при проведении реакции в закритическом состоянии EtOH с рекордным выходом 1-бутанола ~60%, при селективности 85–90%, в то время как выход 1-бутанола в процессах брожения не превышает 10% [12, 17, 18]. Таким образом, использование 1-бутанола для производства синтетических каучуков может стать очередным важным этапом развития экологически безопасных химических производств, базирующихся на возобновляемом сырье.
Одним из перспективных способов решения данной задачи представляется применение гибридной мембранно-каталитической технологии, позволяющей снизить общую энергетику процесса путем объединения в одном устройстве реакционной стадии, протекающей в каналах пористого каталитического конвертера, полученного самораспространяющимся высокотемпературным синтезом (СВС), со стадией сепарации водорода на интегрированной в полость конвертера палладийсодержащей мембране. Это позволяет значительно уменьшить габариты установки и упростить ее аппаратное оформление, а также получать на выходе из реактора продукты высокой степени чистоты с бóльшим выходом, чем в традиционном реакторе со стационарным слоем насыпного катализатора. Эффективность заявленного подхода подтверждена ранее проведенными исследованиями по получению ультрачистого водорода в процессах углекислотного, парового и смешанного риформинга метана, этанола, продуктов ферментации и диметилового эфира [19–21].
1. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1.1. Синтез пористых каталитических материалов для процесса получения 1,3-бутадиена из 1-бутанола
1.1.1. Получение методом СВС гранул γ-Al2O3. Для осуществления высокоселективного процесса получения бутеновой фракции из 1-бутанола с применением метода СВС были получены гранулы γ-Al2O3. Синтез осуществляли на основе геля псевдобемитной структуры AlOOH с использованием одностороннего прессования при давлении 30–90 МПа и последующим спеканием при температуре 750°C в атмосфере воздуха в течение 1 ч. Диаметр открытых пор синтезированного образца, определенный с помощью ртутного порометра и методом “пузырька”, составил ~1–3 мкм. Пористость образцов, измеренная методом гидростатического взвешивания, была ~40%.
1.1.2. Получение методом СВС трубчатой пористой керамической подложки, на основе α-Al2O3. В качестве исходного сырья для синтеза трубчатой пористой керамической подложки использовали порошок α-Al2O3 крупной фракции “Электрокорунд белый” с размером частиц 100 мкм (ООО “Литпром”).
С целью повышения механической прочности подложки и ее устойчивости к высокой температуре в исходный порошок α-Al2O3 вводили порошкообразные добавки эвтектического состава, а именно: оксида магния (ГОСТ 4526-75) производства завода “Красный химик” и карбида кремния в соотношении: α-Al2O3 – 90 вес. %; MgO – 3 вес. %; SiС – 7 вес. %. Эти соединения в ходе СВС-синтеза образуют активный SiO2, который связывает между собой частицы α-Al2O3 за счет их превращения в муллиты, индиалит (Mg2Al4Si5O18) и шпинель (MgAl2O4).
Указанные порошки смешивали в шаровой мельнице в течение 1 ч, после чего проводили одностороннее прессование готовой смеси под давлением 30–90 МПа и ее спекание при температуре 1300–1450°C в атмосфере воздуха в течение 1 ч, а затем охлаждали до комнатной температуры в течение 2 ч.
При температурах спекания порошков в области 1300–1450°C образуется жидкая фаза эвтектического состава, содержащая оксид магния и карбид кремния в виде клиноэнстатита, которая смачивает частицы Al2O3, образуя прочный пористый каркас подложки. Далее по тексту для простоты написания состава катализаторов обозначение трубчатой керамической подложки будет α-Al2O3, без упоминания добавок.
Пористая керамическая подложка представляет собой трубку, у которой один конец заглушен для обеспечения “принудительной” диффузии газов через рабочую поверхность цилиндра от наружной стенки к внутренней, а на другом находится прижимная гайка для герметичной стыковки трубчатой подложки с реактором через графитовую прокладку (рис. 1). Канал трубки предназначен для ввода водородселективной палладийсодержащей мембраны, а также для вывода из реактора непрореагировавших субстратов и неотфильтрованных продуктов реакции [19].
Геометрические размеры трубчатой подложки: общая длина – 137 мм; длина рабочей зоны – 120 мм; внешний диаметр трубки – 25 мм; толщина стенки – 7 мм.
Размер открытых пор трубчатой пористой керамической подложки оценивали по модели капиллярного вытеснения на основе формулы Лапласа для “модели цилиндрических пор” с использованием ртутного порометра и методом “пузырька” [22]. Диаметр открытых пор подложки составил ~1–3 мкм. Пористость, измеренная методом гидростатического взвешивания, составила более 50%.
1.2. Модификация трубчатой пористой керамической подложки железо-, хром- и марганецсодержащими моно- и биметаллическими катализаторами
Для придания трубчатой пористой керамической подложке каталитических свойств, необходимых для дегидрирования бутенов, ее модифицировали различными активными компонентами.
С целью определения оптимального состава катализатора дегидрирования бутенов на первом этапе исследования в проточном реакторе использовали модельные гранулированные катализаторы: Mn/γ-Al2O3(K,Ce); Fe, Mn/γ-Al2O3(K,Ce) (раздельное нанесение Fe и Mn); [Fe + Mn]/ γ-Al2O3(K,Ce) (совместное нанесение Fe и Mn); [Fe,Cr]/γ-Al2O3(K,Ce) (раздельное нанесение Fe и Cr).
В качестве носителя применяли γ-Al2O3 (сфера 0.8 мм; Sуд. = 205 м2/г) производства АО СКТБ “Катализатор”, Новосибирск. Во всех случаях сначала исходный γ-Al2O3 сушили в вакуумном шкафу при 100°С в течение 3 ч, затем вводили модифицирующие добавки методом раздельной пропитки оксида алюминия водными растворами карбоната калия (K2CO3) и нитрата церия [Ce(NO3)3 ⋅ ⋅ 6H2O]. Данные компоненты наносили на пористую керамическую подложку для подавления побочных реакций [23]. После пропитки модифицированный таким образом носитель сушили в токе теплого воздуха при 40°С, потом в сушильном шкафу при 120°С в течение 3 ч и прокаливали в муфельной печи при 500°С в течение 4 ч. Затем на него послойно наносили из водных и органических растворов прекурсоры активных компонентов.
Mn/γ-Al2O3(K,Ce): нанесение марганца осуществляли пропиткой модифицированного оксида алюминия водным раствором ацетата марганца Mn(OAc)2 · 4H2O.
Fe,Mn/γ-Al2O3(K,Ce): cначала наносили железо из водного раствора азотнокислого железа Fe(NO3)3 · 9H2O, затем, после сушки и термоудара при 500°С в течение 30 мин, наносили марганец из водного раствора ацетата марганца.
[Fe + Mn]/γ-Al2O3(K,Ce): совместное нанесение железа и марганца проводили из водного раствора, содержащего нитрат железа и ацетат марганца, с последующей сушкой и прокалкой.
[Fe,Cr]/γ-Al2O3(K,Ce): железо и хром наносили раздельной пропиткой толуольным или смешанным толуол-бензольным раствором, содержащим ацетилацетонаты железа и хрома – Fe(acac)3 и Cr(acac)3.
Окончательное двухступенчатое прокаливание всех образцов осуществляли в муфельной печи со скоростью подъема температуры 10 град/мин, выдерживая 3 ч при 500°С и 2 ч при 800°С.
Состав приготовленных катализаторов приведен в табл. 1.
Таблица 1.
Состав модельных катализаторов дегидрирования
| Катализатор | Состав (оксиды) | Содержание, г | Содержание, вес. % |
|---|---|---|---|
| Mn/γ-Al2O3(K,Ce) | γ-Al2O3 | 18.80 | 87.69 |
| K2O | 0.32 | 1.48 | |
| CeO2 | 0.21 | 0.97 | |
| Mn2O3 | 2.11 | 9.86 | |
| Fe,Mn/γ-Al2O3(K,Ce), раздельное нанесение Fe и Mn | γ-Al2O3 | 18.84 | 88.36 |
| K2O | 0.28 | 1.33 | |
| CeO2 | 0.21 | 0.96 | |
| Fe2O3 | 1.00 | 4.70 | |
| Mn2O3 | 0.99 | 4.65 | |
| [Fe + Mn]/γ-Al2O3(K,Ce), совместное нанесение Fe и Mn | γ-Al2O3 | 18.16 | 85.52 |
| K2O | 0.40 | 1.90 | |
| CeO2 | 0.18 | 0.85 | |
| (Fe,Mn)2O3 | 2.49 | 11.73 | |
| [Fe,Cr]/γ-Al2O3(K,Ce), раздельное нанесение Fe и Cr | γ-Al2O3 | 17.80 | 90.30 |
| K2O | 0.30 | 1.50 | |
| CeO2 | 0.16 | 0.80 | |
| (Fe,Cr)2O3 | 1.46 | 7.40 |
Трубчатые пористые керамические подложки с предварительно нанесенным промежуточным слоем γ-Al2O3, сформированным с целью увеличения поверхности пор, модифицировали аналогичным способом молекулярного наслаивания коллоидного раствора предшественников активных компонентов на поверхность пор. Для этого на первой стадии путем прокачки через поры образца наносили коллоидный раствор золя, состоящего из 0.03 мол. % H2O, 1.5 моль/л Al(OPri)3, 1.5 моль ацетилацетона в толуоле. После нанесения золя модифицированную пористую керамическую подложку сушили в токе воздуха в сушильном шкафу при 120°С в течение 1 ч, а затем проводили термообработку в режиме теплового удара при 500°С в течение 30 мин. Количество осажденного γ-Al2O3 оценивали по увеличению веса образца. Стадию пропитки повторяли 4 раза, пока прирост веса не достигал 4–5 вес. %. Затем наносили K2O и CeO2 раздельной пропиткой конвертера водным раствором карбоната калия и нитрата церия.
Раздельное нанесение активных Fe- и Cr-содержащих компонентов на модифицированную подложку осуществляли из толуольных растворов соответствующих ацетилацетонатных комплексов, содержащих 7.2 вес. % Fe(acac)3 и 7.4 вес. % Cr(acac)3. Для формирования оксидов Fe(III) и Cr(III) пропитанный образец прокаливали в муфельной печи в токе воздуха при различных температурах: 500°C – 2 ч, 600°C – 2 ч, 800°C – 1 ч. Количество нанесенных компонентов определяли по привесу образца после всех стадий термической обработки.
Содержание компонентов каталитических конвертеров [Fe,Cr]/γ-Al2O3(K,Ce)/α-Al2O3 дегидрирования бутеновой фракции приведено ниже:
Далее в тексте образец пористой керамической подложки, приготовленный на базе α-Al2O3 и модифицированной каталитически активными компонентами, мы будем называть “конвертер”. В каталитических экспериментах использовали как цельный конвертер, так и гранулы, полученные при его механическом дроблении (гранулированный конвертер).
1.3. Мембранно-каталитическая установка
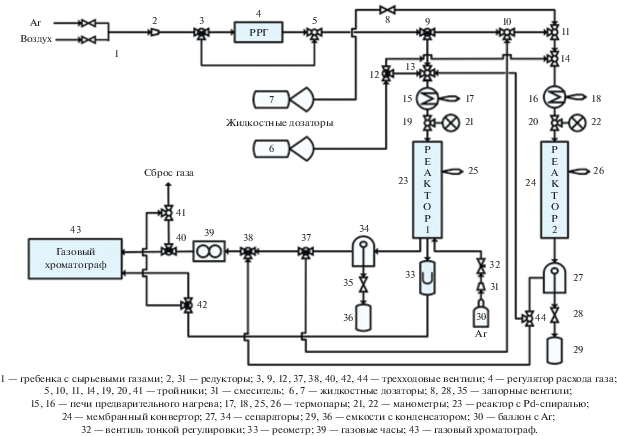
Двухстадийное превращение 1-бутанола в 1,3-бутадиен изучали с использованием разработанной мембранно-каталитической установки (рис. 2), в которой последовательно установлены реактор-1 (23) для дегидратации 1-бутанола в бутены и реактор-2 (24) для их последующего дегидрированием в 1,3-бутадиен.
Дегидратацию 1-бутанола (“Ч”, ГОСТ 6006-78 с изм. 1, 2) с образованием бутеновой фракции проводили, подавая его из жидкостного дозатора (6) по стальному трубопроводу в проточный реактор-1 (23), заполненный, в одном случае, коммерчески доступными гранулами γ-Al2O3, а во втором – гранулами γ-Al2O3, приготовленными методом СВС. Оба процесса осуществляли при одинаковых условиях, масса засыпного γ-Al2O3 составляла 20 г.
Газ-носитель – аргон – с расходом 3 н. л/ч подавали из газораспределительной гребенки (1) через электронный контроллер РРГ (“Элточприбор БУИП-1, Россия) (4). На гребенке (1) указан также воздух, необходимый для процесса окислительной регенерации катализаторов. Смешение аргона и 1-бутанола происходило в смесителе (13) с последующим предварительным подогревом в испарителе (15) до 200°С. Объемная скорость подачи парогазовой смеси Ar/1-BuOH = 2 в реактор-1 (23) составлял 228 ч–1 при общем давлении 1 атм. Температуру в реакторе-1 (23) регулировали в диапазоне Т = 300–350°С.
Полученную в реакторе-1 (23) разбавленную аргоном бутеновую фракцию отделяли от жидкой фазы, содержащей незначительное количество непрореагировавшего 1-бутанола и образовавшуюся в ходе процесса дегидратации воду, в сепараторе с водяным охлаждением (34). Осушенная аргон-бутеновая смесь, предварительно смешанная с водой для снижения парциального давления бутенов, по сети трубопроводов через тройники (37 и 10) попадала в реактор-2 (24) на стадию дегидрирования. Воду подавали из жидкостного дозатора (7) через тройник смешения (11) с последующим подогревом в испарителе (16). Дегидрирование бутенов в 1,3-бутадиен проводили на гранулах модельных катализаторов и на синтезированном трубчатом или гранулированном конвертере в гибридном мембранно-каталитическом реакторе (ГМКР) (рис. 3), аналогичном тому, что был описан в публикации [19]. Реактор изготовлен из стали марки 20Х23Х18. Условия проведения процесса дегидрирования соответствовали промышленным (за исключением массы загрузки катализатора): mгр. кат. = 14.75 г; избыток Н2О составлял: ×0, ×10, ×20, ×30; объемная скорость подачи паро-газовой смеси Qп-г = 597 ч–1; Т = 637°С; Робщ = 1 атм.
Рис. 3.
Гибридный каталитический мембранный реактор дегидрирования бутиленовой фракции с установленным трубчатым каталитическим конвертером состава [Fe,Cr]/γ-Al2O3(K,Ce)/α-Al2O3.

Полученную на выходе из реактора-2 (24) газовую смесь, содержащую целевой продукт – 1,3-бутадиен, отделяли от жидкой фазы в сепараторе с водяным охлаждением (27) и направляли на прибор (43) для газохроматографического online- анализа.
Для оценки вклада материала пустого реактора в процесс дегидрирования в нем был проведен сравнительный “холостой” эксперимент при таких же условиях, как и на каталитических конвертерах.
1.4. Методика анализа продуктов реакции
Содержание водорода, оксидов углерода и метана в продуктах реакции определяли online-методом газовой хроматографии на хроматографе КристалЛюкс 4000М (“Мета-хром”, Россия), детектор – катарометр, газ-носитель – аргон высокой чистоты с расходом 10 мл/мин, адсорбционная насадочная колонка 1 м × 3 мм. Наполнитель колонки – активированный уголь марки СКТ, размер частиц – 0.2–0.3 мм. Температура колонки, детектора и испарителя – 120°С. Концентрации газов находили по калибровочным кривым с использованием специализированного программного обеспечения NetChrom v2.1. Малые концентрации монооксида углерода определяли с помощью откалиброванного ИК-спектрометра RI-550A (“Riken Keiki”, Япония).
Углеводородные газы С1–С4 идентифицировали на хроматографе КристалЛюкс 4000М с применением пламенно-ионизационного детектора (ПИД), газ-носитель – гелий. Были установлены следующие расходы газов: гелий – 30 мл/мин; водород – 35 мл/мин; воздух – 300 мл/мин. Для анализа использовали хроматографическую колонку HP-PLOT/Al2O3 (“Agilent Technologies”, США), 50 м × 0.32.мм, толщина пленки 8.0 мкм. Температура колонки составляла 120°C, детектора – 230°C, испарителя – 250°C. Концентрации продуктов определяли по калибровочным кривым с помощью специализированного программного обеспечения NetChrom v2.1.
Жидкие органические продукты реакции в органической фазе идентифицировали методом ГЖХ на хроматографе Varian 3600 (“Varian Chromatography System”, США), ПИД, капиллярная колонка Хромтэк SE-30, 25 м × 0.25 мм, Df = 0.33 мкм. Температурный режим: 50°С (5 мин), 10°C/мин, 280°С, Тинж = 250°С, Ринж = 1 бар, деление потока 1/200, газ-носитель – гелий. Внутренние стандарты: трифторметилбензол для алкан-олефиновой фракции и 1-октан для спиртовой смеси. Остаточное содержание органических продуктов в водной фазе находили с помощью ГХ-МС по соотношению интегральных сигналов методом абсолютной градуировки.
1.5. Методика структурного анализа
Содержание углерода в отработанном катализаторе определяли в потоке воздуха с использованием термогравиметрического анализа (ТГА) на приборе SDT Q600 (“TA Instruments”, США) – ТГ-анализатор и дифференциальный сканирующий калориметр). Условия проведения ТГА: вес образца – 26.2 г; скорость нагрева – 10°C/мин, расход воздуха – 100 мл/мин; температурный диапазон – 25–700°C.
Термопрограммируемое восстановление водородом (ТПВ-Н2) исходного конвертера состава [Fe,Cr]/γ-Al2O3(K,Ce)/α-Al2O3 проводили на приборе AutoChem II 2920 Chemisorption Analyzer (“Micromeritics” США). Условия экспериментов: вес образца – 0.2 мг; состав газовой смеси – 5% H2 + Ar; расход газа – 50 мл/мин; скорость нагрева – 10°C/мин; температурный диапазон – 25–1000°C.
Фотомикрографии конвертеров и распределение элементов на поверхности были получены при помощи сканирующей электронной микроскопии с энергодисперсионным рентгеновским спектроскопическим анализом (СЭМ-ЭДС) на приборе S-3600N (“Hitachi”, Япония) при следующих рабочих параметрах: ускоряющее напряжение – 20.0 кВ; 200-кратное разрешение.
Структура материала каталитического конвертера и распределение элементов на его поверхности были изучены с использованием просвечивающей электронной микроскопии на приборе TEM TITAN Themis 300 (“FEI”, США).
Анализ поверхности при помощи рентгеновской фотоэлектронной спектроскопии (РФЭС) осуществляли на приборе Axis Ultra DLD (“Kratos Analytical Ltd.”, Великобритания) с монохроматическим рентгеновским излучением AlKα (15 кВ, 15 мА, 1486.6 эВ). Все спектры были откалиброваны по энергии с использованием положения пика C1s, соответствующего связям C–C, C–H при 284.8 эВ.
1.5. Методика расчетов
Расчет показателей процесса осуществляли по формулам (1)–(6).
Конверсия бутанола:
(1)
${{X}_{{{\text{BuOH}}}}} = \frac{{{{n}_{{{\text{Бутены}}}}}}}{{{{n}_{{{\text{BuOH}}}}}}} \times 100{\text{\% }}.$(2)
${{X}_{{{\text{Бутены}}}}} = \frac{{{{n}_{{{\text{Бутены}}\,\,{\text{превращенные}}}}}}}{{{{n}_{{{\text{Бутены}}\,\,{\text{поданные}}}}}}} \times 100{\text{\% }}.$(3)
${{x}_{{1,3{\text{ - бутадиен}}}}} = \frac{{{{n}_{{1,3{\text{ - бутадиен}}}}}}}{{{{n}_{{{\text{Бутены}}\,\,{\text{поданные}}}}}}} \times 100{\text{\% }}.$(4)
${{S}_{{{\text{BuOH}}}}} = \frac{{{{n}_{{1,3{\text{ - бутадиен}}}}}~}}{{{{n}_{{{\text{BuOH}}}}}}} \times 100{\text{\% }}.$(5)
${{\rho }_{{1,3{\text{ - бутадиен}}}}} = \frac{{{{V}_{{1,3{\text{ - бутадиен}}}}}}}{{{{m}_{{{\text{акт}}.{\text{комп}}.}}}}}{\text{\;}}.$(6)
${{N}_{{{\text{водород}}}}} = \frac{{{{n}_{{{\text{водород}}\,\,{\text{экстр}}.}}}}}{{{{n}_{{{\text{водород}}\,\,{\text{сумм}}.}}}}} \times 100{\text{\% }}.$nБутены – мольный поток образовавшихся бутенов в ходе дегидратации 1-бутанола, ммоль/ч;
nBuOH – мольный поток поданного на дегидратацию 1-бутанола, ммоль/ч;
nБутены превращенные – мольный поток превращенных в ходе дегидрирования бутенов, ммоль/ч;
nБутены поданные – мольный поток поданных на дегидрирование бутенов, ммоль/ч;
n1,3-бутадиен – мольный поток образовавшегося 1,3-бутадиена в ходе дегидрирование бутенов, ммоль/ч;
nводород экстр. – мольный поток экстрагированного на палладийсодержащей мембране водорода, ммоль/ч;
nводородсумм. – суммарный мольный поток водорода, включающий в себя экстрагированный и неэкстрагированный водород, ммоль/ч;
V1,3-бутадиен – объемный поток образовавшегося 1,3-бутадиена в ходе дегидрирования бутенов, л/ч;
mакт. комп. – масса нанесенного каталитически активного компонента на пористую поверхность конвертера, г.
2. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
2.1. Получение 1,3-бутадиена
Стадия 1: Дегидратация 1-бутанола; получение бутеновой фракции. Каталитическая дегидратация 1-бутанола приводит к образованию четырех бутеновых изомеров:
(I)
$\begin{gathered} {\text{BuOH}} \rightleftarrows ({\text{бутен - }}1 + цис{\text{ - бутен - }}2 + \\ + \,\,транс{\text{ - бутен - }}2 + изо{\text{ - бутен}}) + {{{\text{Н}}}_{{\text{2}}}}{\text{О}}, \\ \Delta Н = 34\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}{\text{.}} \\ \end{gathered} $В наших опытах на промышленных гранулах γ-Al2O3 и образце, полученном СВС-методом, при дегидратации 1-бутанола образуется бутеновая фракция, содержащая преимущественно бутен-1 (табл. 2). Концентрация бутена-1 зависит от условий процесса и типа используемого катализатора. В присутствии коммерчески доступных гранул γ-Al2O3 это значение достигает 97% при 300°С. На образце, приготовленном методом СВС, при той же температуре селективность по бутену-1 несколько ниже и составляет 83%, что, вероятно, обусловлено меньшей кислотностью активных центров синтезированного материала [24]. Кроме бутена-1 изомерный состав бутеновой фракции представлен цис-, транс- и разветвленными изомерами, при этом с повышением температуры до 350°С доля последних увеличивается до 24% для коммерчески доступных гранул и до 63% для синтезированного образца. Следует сказать, что изменение доли изомеров никаким образом не влияет на последующий процесс дегидрирования ввиду того, что все четыре изомера превращаются в 1,3-бутадиен [25]. Среди побочных продуктов идентифицированы следы углеводородов гидрирования, крекинга и изомеризации, таких как этилен, пропилен, бутан и изобутан, а также водорода. Общая концентрация побочных продуктов не превышала 0.12% (табл. 2). Важно отметить, что дибутиловый эфир в продуктах обнаружен не был. Это, по всей видимости, указывает на преимущественное протекание реакции дегидратации 1-бутанола на различных активных центрах, значительно удаленных друг от друга, что исключает взаимодействие адсорбированных молекул бутанола между собой. Другой причиной практически полного отсутствия продуктов этерификации является низкое парциальное давление субстрата [24, 26, 27]. Снижения активности исследуемых катализаторов в ходе всего экспериментального периода (30 ч) не наблюдалось.
Таблица 2.
Состав продуктов реакции дегидратации 1-бутанола 300 и 350°С на промышленных гранулах γ-Al2O3 и на синтезированном методом СВС гранулированном γ-Al2O3
| Компонент смеси продуктов | Промышленные гранулы γ-Al2O3 | Синтезированный методом СВС гранулированный γ-Al2O3 | ||
|---|---|---|---|---|
| 300°С, XBuOH = 66% | 350°С, XBuOH = 100% | 300°С, XBuOH = 100% | 350°С, XBuOH = 100% | |
| С, об. % | С, об. % | С, об. % | С, об. % | |
| Этилен | 0 | 0 | 0 | 0.03 |
| Пропилен | 0 | 0 | 0 | 0.03 |
| Бутен-1 | 96.75 | 76.20 | 83.26 | 36.35 |
| изо-Бутен | 0.11 | 0.12 | 0.11 | 0.21 |
| транс-Бутен-2 | 0.83 | 6.60 | 3.95 | 29.67 |
| цис-Бутен-2 | 2.31 | 17.08 | 12.57 | 33.59 |
| 1,3-Бутадиен | 0 | 0 | 0 | 0 |
| Водород | 0 | 0 | 0.03 | 0.06 |
| н-, изо-Бутан | 0 | 0 | 0.08 | 0.06 |
При 300°С конверсия 1-бутанола на промышленных гранулах γ-Al2O3 составляет ~66%, тогда как на образце γ-Al2O3, приготовленном методом СВС, она близка к 100% (табл. 2). Установлено, что практически полная конверсия 1-бутанола на промышленных гранулах γ-Al2O3 достигается только при 350°С.
Можно предположить, что повышение конверсии 1-бутанола при 300°С на гранулах γ-Al2O3, синтезированных методом СВС, обусловлено улучшенным массо- и теплопереносом субстрата в синтезированном пористом материале по сравнению с промышленными гранулами.
После отделения в сепараторе образовавшейся воды и следовых количеств непрореагировавшего 1-бутанола продукты реакции без предварительной газовой очистки и фракционирования направляли во второй реактор для дегидрирования бутеновой фракции в 1,3-бутадиен.
Стадия 2: Дегидрирование бутеновой фракции; получение 1,3-бутадиена. Каталитическое дегидрирование бутеновой фракции с получением 1,3-бутадиена является эндотермическим процессом, который протекает в соответствии со следующими уравнениями [25]:
(II)
$\begin{gathered} {\text{бутен - }}1 \rightleftarrows ~1,3{\text{ - бутадиен}} + {{{\text{Н}}}_{2}}, \\ \Delta Н = 110\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}, \\ \end{gathered} $(III)
$\begin{gathered} цис{\text{ - бутен - }}2{\text{/}}транс{\text{ - бутен - }}2{\text{/}}изо{\text{ - бутен}} \rightleftarrows \\ ~ \rightleftarrows 1,3{\text{ - бутадиен}} + {{{\text{Н}}}_{2}}, \\ \Delta Н = 120\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}. \\ \end{gathered} $Результаты “холостого” опыта в незагруженном катализатором проточном реакторе, изготовленном из нержавеющей стали, показали значительное преобладание побочных процессов деструкции углеродного скелета сырьевой бутеновой фракции с образованием большого количества кокса.
С целью нахождения оптимальных условий процесс проводили как в проточном режиме (контактор), используя традиционный реактор с насыпным слоем гранулированного катализатора, так и в мембранном (экстрактор), применяя оригинальный гибридный мембранно-каталитический реактор с интегрированной водородселективной палладийсодержащей мембраной [19].
Для определения оптимальных условий осуществления процесса и состава катализатора дегидрирования бутенов на первом этапе исследования в проточном реакторе процесс изучали в присутствии модельных гранулированных катализаторов, а именно: α-Al2O3; Mn/γ-Al2O3(K,Ce); [Fe,Mn]/γ-Al2O3(K,Ce) (раздельное нанесение); [Fe + Mn]/γ-Al2O3(K,Ce) (совместное нанесение); [Fe,Cr]/γ-Al2O3(K,Ce) (раздельное нанесение).
Сначала проводили сравнительные опыты на синтезированной СВС-методом трубчатой подложке на основе α-Al2O3 и на марганецсодержащих модельных катализаторах. В результате было установлено, что 20-кратное разбавление реагентов водой оптимально и способствует увеличению выхода 1,3-бутадиена до ~9 раз по сравнению с опытами с меньшим разбавлением (табл. 3, опыты 5–20). Разбавление в 20 раз также снижает концентрации продуктов крекинга и пиролиза приблизительно в три раза. Тридцатикратное разбавление реагентов водой не приводит к значительному росту выхода 1,3-бутадиена, что, вероятно, связано с конкурирующей адсорбцией молекул воды на активных центрах катализатора (табл. 3, опыты 3, 4; 7, 8; 11, 12; 15, 16; 19, 20).
Таблица 3.
Дегидрирование бутеновой фракции*
| № опыта | Состав катализатора | Разбавление водой, х-кратное | Выход 1,3-бутадиена, % |
Селективность образования 1,3-бутадиена**, % | Производительность по 1,3-бутадиену, л ч–1${\text{г}}_{{{\text{акт}}{\text{.комп}}{\text{.}}}}^{{ - {\text{1}}}}$ |
|---|---|---|---|---|---|
| 1 | Реактор без катализатора: “холостой” опыт | 0 | 2.7 | 3.6 | – |
| 2 | 10 | 7.3 | 6.8 | – | |
| 3 | 20 | 6.4 | 6.2 | – | |
| 4 | 30 | 5.0 | 4.8 | – | |
| 5 | Трубчатая подложка α-Al2O3 | 0 | 3.8 | 5.0 | – |
| 6 | 10 | 8.5 | 9.1 | – | |
| 7 | 20 | 7.3 | 7.7 | – | |
| 8 | 30 | 6.1 | 6.1 | – | |
| Модифицированные промышленные гранулы α-Al2O3 в режиме без экстракции водорода (контактор) | |||||
| 9 | [Fe + Mn]/γ-Al2O3(K,Ce) | 0 | 1.4 | 2.0 | 0.2 |
| 10 | 10 | 9.5 | 10.4 | 1.1 | |
| 11 | 20 | 8.8 | 9.6 | 1.1 | |
| 12 | 30 | 8.7 | 9.2 | 1.0 | |
| 13 | [Fe,Mn]/γ-Al2O3(K,Ce) | 0 | 2.4 | 3.5 | 0.3 |
| 14 | 10 | 10.0 | 11.5 | 1.2 | |
| 15 | 20 | 11.8 | 13.7 | 1.5 | |
| 16 | 30 | 12.4 | 13.9 | 1.5 | |
| 17 | Mn/γ-Al2O3(K,Ce) | 0 | 1.3 | 1.8 | 0.1 |
| 18 | 10 | 8.5 | 8.8 | 0.9 | |
| 19 | 20 | 9.2 | 10.1 | 1.0 | |
| 20 | 30 | 10.4 | 11.6 | 1.1 | |
| 21 | [Fe,Cr]/γ-Al2O3(K,Ce) | 20 | 9.0 | 8.3 | 1.1 |
| Гранулированный модифицированный конвертер в режиме без экстракции водорода (контактор) | |||||
| 22 | [Fe,Cr]/γ-Al2O3(K,Ce)/α-Al2O3 | 20 | 4.2 | 9.2 | 1.6 |
| Гранулированный модифицированный конвертер в режиме с экстракцией водорода (экстрактор) | |||||
| 23 | [Fe,Cr]/γ-Al2O3(K,Ce)/α-Al2O3 | 20 | 7.8 | 11.7 | 2.0 |
| Цельный модифицированный конвертер в режиме без экстракции водорода (контактор) | |||||
| 24 | [Fe,Cr]/(K,Ce)γ-Al2O3/α-Al2O3 | 0 | 1.7 | 2.0 | 0.2 |
| 25 | 10 | 13.1 | 14.6 | 1.6 | |
| 26 | 20 | 18.8 | 19.2 | 2.3 | |
| Цельный модифицированный конвертер в режиме с экстракцией водорода (экстрактор) | |||||
| 27 | [Fe,Cr]/(K,Ce)γ-Al2O3/α-Al2O3 | 20 | 23.2 | 23.7 | 2.9 |
* Условия процесса: nбутены = 66.90 ммоль/ч, Т = 637°С, Робщ = 1 атм. ** Селективность образования 1,3-бутадиена в пересчете на исходный 1-бутанол. Прочерки означают, что в незагруженном реакторе и на гранулах оксида алюминия не представляется возможным посчитать производительность на грамм активного компонента ввиду его отсутствия.
С использованием полученных данных по оптимальным условиям разбавления бутеновой фракции водяным паром, был проведен опыт по получению 1,3-бутадиена на синтезированном модельном [Fe,Cr]/γ-Al2O3(K,Ce) катализаторе, в состав которого входят активные компоненты, аналогичные тем, что содержатся в применяемом в промышленности катализаторе для процессов дегидрирования бутан-бутеновой фракции (табл. 4, опыт 26).
Таблица 4.
Состав и мольные потоки (ммоль/ч) продуктов дегидрирования бутенов на гранулированном и цельном конвертерах [Fe,Cr]/γ-Al2O3(K,Ce)/ α-Al2O3 в режиме без экстракции и с экстракцией ультрачистого водорода из зоны реакции на Pd–Ru-мембране*
| Конвектор/режим | Конверсия сырьевой бутеновой фракции, % |
Продукты реакции**, ммоль/ч | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| бутены | H2 (экстрагированный на Pd–Ru-мембране) | Н2 (в смеси продуктов на выходе из реактора) |
СН4 | С2Н6 | С2Н4 | С3Н8 | С4Н10 | 1,3-C4H6 | ||
| Гранулированный/ контактор | 46 | 35.9 | 0 | 23.6 | 5.6 | 0 | 3.0 | 0 | 0.1 | 2.8 |
| Гранулированный/ экстрактор | 58 | 28.0 | 4.2 | 22.6 | 9.8 | 0 | 7.0 | 0.1 | 0.1 | 5.1 |
| Цельный/контактор | 53 | 30.4 | 0 | 20.6 | 4.3 | 0.3 | 1.4 | 2.4 | 0.1 | 12.3 |
| Цельный/экстрактор | 65 | 23.0 | 3.7 | 19.3 | 5.4 | 0.4 | 1.8 | 3.0 | 0.1 | 15.5 |
Учитывая бóльшую стабильность в изучаемом процессе по сравнению с марганецсодержащими катализаторами, железо-хромсодержащая система была выбрана для приготовления конвертера [Fe,Cr]/(K,Ce)γ-Al2O3/α-Al2O3. По данным опыта 26 (табл. 4) выход 1,3-бутадиена на синтезированном цельном конвертере составил 18.8% при селективности ~19.2% в пересчете на исходный 1-бутанол.
Использование цельного [Fe,Cr]/γ-Al2O3(K,Ce)/ α-Al2O3-конвертера в режиме экстрактации водорода из зоны реакции на палладийсодержащей мембране позволяет увеличить выход и производительность по 1,3-бутадиену приблизительно в 1.3 раза (табл. 3, опыт 27).
Рост выхода 1,3-бутадиена в случае использования цельного конвертера может указывать на повышение вероятности контакта молекул субстрата с активной поверхностью при проведении реакции в режиме “принудительной” диффузии в ограниченном пространстве каталитических каналов конвертера.
Показано, что дегидрирование бутенов на конвертере [Fe,Cr]/γ-Al2O3(K,Ce)/α-Al2O3 в режиме экстракции ультрачистого водорода из зоны реакции на палладийсодержащей мембране способствует интенсификации процесса в целом (табл. 4)
Помимо основной реакции дегидрирования при температуре выше 600°С протекают побочные реакции крекинга с образованием, главным образом, пропилена, этилена и метана (табл. 4).
Таким образом, применение разработанной двухстадийной схемы превращения 1-бутанола в 1,3-бутадиен позволяет с высокой эффективностью получать ценный мономер из продуктов ферментации биомассы с одновременным выделением ультрачистого водорода, являющегося востребованным сырьем органического синтеза, а также экологически безопасным топливом для водородных двигателей внутреннего сгорания и топливных элементов.
Важно отметить, что протекание процесса в каталитических каналах мембраны существенно уменьшает интенсивность коксообразования. Так, при проведении реакции на гранулированном конвертере каталитическая активность системы снижается уже после 20–30 мин. работы. Палладийсодержащая водородселективная мембрана ГМКР, примененная в процессе дегидрирования бутеновой фракции с использованием цельного конвертера остается чистой (рис. 4а), тогда как после аналогичного по длительности эксперимента на гранулированном конвертере такого же состава мембрана подвергается зауглероживанию (рис. 4б).
Рис. 4.
Водородселективная палладийсодержащая мембрана после процесса дегидрирования бутеновой фракции с использованием цельного конвертера [Fe,Cr]/γ-Al2O3(K,Ce)/α-Al2O3 (а) и на гранулированном конвертере того же состава (б).

Существенно более высокая устойчивость цельного конвертера к зауглероживанию поверхности подтверждена данными термогравиметрического и структурного анализа.
3. ИССЛЕДОВАНИЯ ПОВЕРХНОСТИ КАТАЛИТИЧЕСКОГО КОНВЕРТЕРА
В результате ТГ-анализа в токе воздуха установлено незначительное зауглероживание отработанного цельного конвертера [Fe,Cr]/γ-Al2O3(K,Ce)/ α-Al2O3 (рис. 5).
Рис. 5.
ТГ-анализ в токе воздуха конвертера состава [Fe,Cr]/γ-Al2O3(K,Ce)/α-Al2O3. Малые пики в области температур 100–150°C соответствуют десорбции воды.
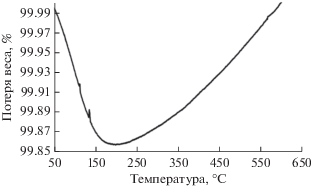
Данные термогравиметрии свидетельствуют, что за 20 ч протекания процесса степень зауглероживания образца составила всего 0.005 вес. %. Окислительную регенерацию проводили при 450–600°C.
Установлено, что дегидрирование бутеновой фракции в 1,3-бутадиен в течение 20 ч не приводит к заметному снижению каталитической активности изучаемой системы, что радикально отличает ее от промышленного катализатора дегидрирования бутан-бутеновой фракции, регенерацию которого проводят каждые 8–15 мин [28].
Таким образом, можно сделать вывод, что разработанные цельные конвертеры [Fe,Cr]/ γ-Al2O3(K,Ce)/α-Al2O3 обладают устойчивостью к зауглероживанию в процессе дегидрирования бутеновой фракции в 1,3-бутадиен, что делает их перспективными для практического использования. Этот результат хорошо согласуется с ранее проведенными исследованиями, показавшими интенсификацию протекания углекислотного риформинга метана в открытых каталитических каналах пористого конвертера с существенно более высокой устойчивостью к зауглероживанию по сравнению с традиционным проточным реактором с загруженным слоем гранулированного катализатора [19–21, 29].
Анализ СЭМ-ЭДС позволил оценить размерный фактор и распределение активных компонентов на поверхности конвертера [Fe,Cr]/ γ-Al2O3(K,Ce)/α-Al2O3 (рис. 6а). Распределение нанесенных компонентов – K, Ce, Fe и Cr – на поверхности носителя достаточно однородно (рис. 6б–6е). Размеры частиц не превышают 6 нм. Содержание углерода в отработанном образце низкое, что указывает на незначительное коксование катализатора в процессе дегидрирования бутеновой фракции. Данные по распределению углерода, представленные на рис. 6б, относятся к углероду фиксирующего клея на органической основе, необходимого для закрепления изучаемого образца на предметном столике электронного микроскопа.
Рис. 6.
Изображение сканируемой поверхности отработанного конвертера [Fe,Cr]/γ-Al2O3(K,Ce)/α-Al2O3 (а) и распределение активных компонентов на ней (б–е) по данным СЭМ-ЭДС-анализа: С (б), K (в), Cr (г), Fe (д), Ce (е).

С помощью анализа ПЭМ-ЭДС были визуализированы и спектрально идентифицированы активные компоненты конвертера [Fe,Cr]/ γ-Al2O3(K,Ce)/α-Al2O3, а также определена их дисперсность на поверхности носителя до и после каталитических испытаний.
На исходном катализаторе железо- и хромсодержащие компоненты однородно распределены по поверхности носителя α-Al2O3, но в некоторых областях обнаруживаются хорошо различимые кластеры с размером до 100–150 нм, содержащие высокодисперсные частицы металлсодержащих активных компонентов (рис. 7a–7в).
Рис. 7.
Изображение сканируемой поверхности исходного конвертера [Fe,Cr]/γ-Al2O3(K,Ce)/α-Al2O3 (а) и распределение частиц и агломератов Fe (б) и Cr (в) на ней.

На использованном конвертере не выявлено видимых изменений дисперсности осажденных компонентов Fe и Cr. Зауглероживания поверхности не обнаружено, что свидетельствует о высокой устойчивости образца к коксообразованию в процессе дегидрирования бутенов.
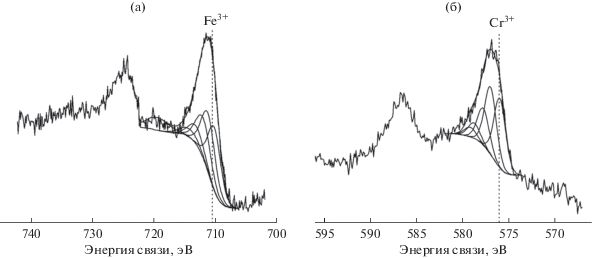
На рис. 8 представлены РФЭ-спектры Fe2p и Cr2р исходного конвертера [Fe,Cr]/γ-Al2O3(K,Ce)/ α-Al2O3. Для обоих металлов только часть спектра 2p3/2 была обработана после вычитания фоновой составляющей по методу Ширли. Спектры идентифицированы на основании базы данных [30].
Установлено, что в соответствии с результатами разложения спектра Fe2p железо находится в степени окисления +3, при этом энергия связи основного пика составляет 710.2 эВ, а сателлитного – на 9.3 эВ выше.
В спектре Cr2p имеется основной пик с энергией связи 576.0 эВ и четыре мультиплетных пика, наличие которых свидетельствует, что на исходном конвертере помимо оксидов железа содержатся частицы оксида хрома Cr2О3.
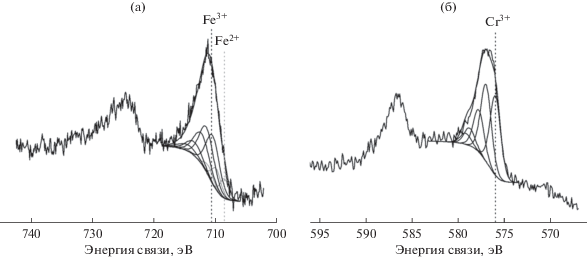
Данные, полученные при разложении спектра Fe2p (рис. 9a), предполагают присутствие восстановленных форм железа в использованном конвертере.
Результаты изучения методом РФЭС отработанного конвертера свидетельствуют о наличие в нем как компонентов Fe3+, так и Fe2+, пик которого локализован в области энергии 708.5 эВ. Было установлено, что содержание Fe2+ составляет ~25% общего количества железа в образце. Это говорит о частичном восстановлении железа водородом во время каталитического процесса.
Изменений в спектре Cr2p после катализа отмечено не было, что. Это означает, что хром в ходе процесса не меняет своей степени окисления и находится, как и в исходном образце, в зарядовом состоянии Cr+3 (рис. 9б).
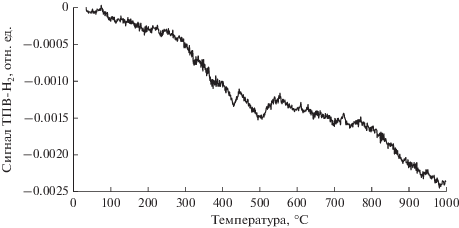
Данные программированного термовосстановления водородом показали наличие небольшого пика (0.00184 ммоль/г) в области температур 494.5°C исходного конвертера [Fe,Cr]/γ-Al2O3(K,Ce)/α-Al2O3. При этих температурах оксид Fe(III) частично восстанавливается до нестехиометрического магнетита (рис. 10):
(IV)
$3{\text{F}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + {{{\text{H}}}_{2}} \to 2{\text{F}}{{{\text{e}}}_{{\text{3}}}}{{{\text{O}}}_{4}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Полученный результат хорошо коррелирует с данными РФЭС, указывая на то, что отработанный образец в процессе дегидрирования восстанавливается выделяемым водородом до нестехиометрического магнетита, в котором часть ионов Fe+3 восстановлена до Fe+2.
ЗАКЛЮЧЕНИЕ
Синтезированный каталитический [Fe,Cr]/ γ-Al2O3(K,Ce)/α-Al2O3-конвертер, содержащий открытые каналы с размером 1–3 мкм, характеризуется высокой пористой структурой и может рассматриваться как ансамбль микрореакторов. Диффузия паров реагентов в столь ограниченном объеме пор, по-видимому, приводит к возрастанию поперечной диффузии и повышению вероятности контакта газообразных субстратов с активной поверхностью [31]. Этой особенностью можно объяснить интенсификацию протекания каталитических реакций, в частности, реакции дегидрирования, и повышение устойчивости к коксообразованию.
Список литературы
Лебедев С.В. // ЖРХО. 1909. Т. 41. С. 42.
White W.C. // Chem. Biol. Interact. 2007. V. 166. № 1–3. P. 10
Doelle H.W., Rokem J.S., Berovic M. Biotechnology, V. IV: Fundamentals in Biotechnology, 2009.
Ochoa J.V., Bandinelli C., Vozniuk O., Chieregato A., Malmusi A., Recchi C., Cavani F. // Green Chem. 2016. V. 18. I. 6. P. 1653.
Farzad S., Mandegari M.A., Görgens J.F. // Bioresour. Technol. 2017. V. 239. P. 37.
IHS Markit, Chemical Economics Handbook, Global butadiene production overview. https://ihsmarkit.com/products/butadiene-chemical-economics-handbook.html, 2018 (accessed July 25, 2019).
Makshina E.V., Dusselier M., Janssens W., Degrève J., Jacobs P.A., Sels B.F. // Chem. Soc. Rev. 2014. V. 43. № 22. P. 7917.
Arpe H-J., Hawkins S. Industrial Organic Chemistry, 5th Edition: Wiley: USA, 2010. 525 p.
Кондаков И.Л. Синтетический каучук его гомологи и аналоги: Тип. Маттисена, 1912. С. 151.
Zhang J., Wang S., Wang Y. Advances in Bioenergy, Ch. One: Biobutanol Production from Renewable Resources Recent Advances. Elsevier: Netherlands, 2016. V. 1. P. 1.
Doelle H.W., Rokem J.S., Berovic M. / BIOTECHNOLOGY, V. VI: Fundamentals in Biotechnology, 2009.
Silvester L., Lamonier J.F, Lamonier C., Capron M., Vannier R.N., Mamede A.S., Dumeignil F. // ChemCatChem. 2017. V. 9. №. 12. P. 2250.
Tsodikov M.V., Yandieva F.A., Kugel V.Y., Chistyakov A.V., Gekhman A.E., Moiseev I.I. // Catal. Lett. 2008. V. 121. № 3–4. P. 199.
Tsodikov M.V., Chistyakov A.V., Nikolaev S.A., Kriventsov V.V., Gekhman A.E., Moiseev I.I. / Chemistry of biomass. Biofuels and bioplastics: Scientific Word, 2017. P. 223.
Research and Markets, Global Bio-Butanol Market. Segmented by Application and Geography 2017–2022. https://www.researchandmarkets.com/reports/4390693/ global-bio-butanol-market-segmented-by, 2017 (accessed July 25, 2019).
Biomass Magazine, Minnesota n-butanol plant comes online. http://biomassmagazine.com/articles/14006/ minnesota-butanol-plant-comes-online, 2018 (accessed July 25, 2019).
Стабников В.Н. Перегонка и ректификация этилового спирта. Изд. 2-е. M.: Пищевая промышленность, 1969. С. 456.
Chistyakov A.V., Zharova P.A, Tsodikov M.V., Nikolaev S.A., Krotova I.N., Ezzhelenko D.I. // Kinet. Catal. 2016. V. 57. № 6. P. 803.
Fedotov A.S., Antonov D.O., Uvarov V.I., Tsodikov M.V. // Int. J. Hydrogen Energy. 2018. V. 43. № 14. P. 7046.
Tsodikov M.V., Fedotov A.S., Antonov D.O., Uvarov V.I., Bychkov V.Y., Luck F.C. // Int. J. Hydrogen Energy. 2016. V. 41. № 4. P. 2424.
Fedotov A.S., Antonov D.O., Bukhtenko O.V., Uvarov V.I., Kriventsov V.V., Tsodikov M.V. // Int. J. Hydrogen Energy. 2017. V. 42. № 38. P. 24131.
Кантаев А.С., Брус И.Д. Определение размера пор фильтрующего элемента: Издательство Томского политехнического университета, 2014. С. 16.
Guczi L., Erdöhelyi A. Catalysis for alternative energy generation. Springer Science & Business Media, 2012. P. 538.
Khan Y., Marin M., Karinen R., Lehtonen J., Kanervo J. // Chem. Eng. Sci. 2015. V. 137. P. 740.
Grub J., Löser E. Butadiene, Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2012.
Berteau P., Ruwet M., Delmon B. // Bull. Des Sociétés Chim. Belges. 1985. V. 94. № 11–12. P. 859.
Phung T.K., Lagazzo A., Rivero Crespo M.Á., Sánchez Escribano V., Busca G. // J. Catal. 2014. V. 311. P. 102.
Тюряев И.Я. // Успехи химии. 1966. V. 35. Вып. 1. P. 121.
Fedotov A.S., Antonov D.O., Uvarov V.I., Tsodikov M.V., Khadzhiev S.N. // Pet. Chem. 2018. V. 58. № 1. P. 62.
Biesinger M.C., Payne B.P., Grosvenor A.P., Lau L.W., Gerson A. R., Smart R.S.C. // Appl. Surf. Sci. 2011. V. 257. № 7. P. 2717.
Teplyakov V.V., Tsodikov M.V. Porous Inorganic Membrane Reactors. In Simulation of Membrane Reactors, Ed. A. Basile and F. Gallucci. Nova Science Publishers: New York, 2009. P. 123. ISBN: 9781-60692-425-9208.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ