Кинетика и катализ, 2020, T. 61, № 3, стр. 410-427
Влияние температуры прокаливания на эффективность Ni/Al2O3 в реакции гидродехлорирования
Е. В. Голубина a, *, Е. С. Локтева a, Н. Е. Кавалерская a, К. И. Маслаков a
a ФГБОУ ВО МГУ им. М.В. Ломоносова, Химический факультет
119991 Москва, ГСП-1,
Ленинские горы, 1, стр. 3, Россия
* E-mail: golubina@kge.msu.ru
Поступила в редакцию 23.09.2019
После доработки 26.12.2019
Принята к публикации 11.02.2020
Аннотация
Методом пропитки получены образцы предшественников катализаторов Ni/Al2O3 с различным содержанием металла (2–10 мас. % Ni) и температурой прокаливания. Их состав и физико-химические свойства исследованы методами низкотемпературной адсорбции азота, атомно-абсорбционной спектроскопии, сканирующей электронной микроскопии, просвечивающей электронной микроскопии высокого разрешения (ПЭМ ВР), рентгеновской фотоэлектронной спектроскопии (РФЭС) и температурно-программированного восстановления водородом (ТПВ). Методом ТПВ-Н2 изучено формирование свободных и химически связанных с носителем форм никеля. Прокаливание при температурах выше 400°С приводит к полному связыванию никеля с Al2O3 с образованием никель-алюминиевой шпинели. По данным ТПВ-Н2 в составе образцов, прокаленных при 550°С, свободный NiO появляется только при содержании никеля 10%. Определена устойчивость восстановленных катализаторов к окислению на воздухе и влияние температуры обработки водородом на восстановление связанных с носителем форм никеля. Методами РФЭС и ТПВ-Н2 показано, что окисление восстановленного никеля на воздухе обеспечивает переход от прочно связанных к слабо связанным с поверхностью формам Ni2+, которые легче подвергаются восстановлению. В работе рассмотрены закономерности каталитического действия в реакции гидродехлорирования хлорбензола (ГДХ ХБ) образцов, различающихся соотношением слабо и сильно связанных форм Ni. Восстановление водородом шпинельных форм, малоактивных в ГДХ ХБ, обеспечивает образование Ni0, формирующего высокоэффективные в гидродехлорировании активные центры. Активные центры, полученные восстановлением слабо связанных с носителем форм Ni2+, стабильны в условиях реакции ГДХ ХБ.
1. ВВЕДЕНИЕ
Никелевые катализаторы проявляют активность в различных промышленных процессах, таких как паровой риформинг метана [1, 2] или этанола [3], гидрирование различных органических субстратов [4, 5]. В реакциях гидродехлорирования алифатических и ароматических углеводородов Ni-катализаторы являются перспективной альтернативой палладийсодержащим системам [6–8]. Каталитические системы представляют собой наночастицы никеля, нанесенные на носители различной природы, например, углеродные [9] или оксид кремния [8]. Благодаря механической прочности, варьированию кристаллической структуры в процессе приготовления и модификации в ходе дополнительных обработок значительный интерес в качестве носителя для катализаторов гидродехлорирования представляет Al2O3 [7, 10, 11].
Перспективы использования системы Ni/Al2O3 определяются возможностью образования широкого спектра каталитически активных фаз различной природы, начиная от нанесенных металлических частиц Ni до структур типа шпинели [12–14]. Однако выявление и идентификация конкретного типа работающей в определенной реакции формы никеля является актуальной задачей. Влияние состояния никеля в Ni/Al2O3 на каталитическую активность наблюдали в различных реакциях, например, гидрировании 2-этилгексанола [15], разложении аммиака [16], риформинге метана [17]. В литературе есть свидетельства, что для реакции гидродехлорирования (ГДХ) также важно состояние никеля в Ni/Al2O3-катализаторах. Так, каталитическая активность в превращениях 1,2,4-трихлорбензола напрямую связана с наличием форм оксида никеля, восстанавливающихся при определенных температурах [11]. С наибольшей селективностью бензол образовывался в присутствии катализатора, в состав предшественника которого входили октаэдрические частицы NiO. Необходимое зарядовое состояние активного компонента скорее всего достигается именно за счет нанесения частиц Ni на поверхность носителя [18]. Поскольку реакцию ГДХ часто осуществляют с участием водорода, важную роль играют процессы его спилловера, способные протекать в системе Ni/Al2O3 [19]. Реакцию ГДХ многие авторы относят к структурно-чувствительным, поэтому не только состав, но и структура активных фаз имеют решающее значение для эффективной работы катализатора [20–23]. Наиболее очевидным способом варьирования характеристик активного центра является изменение условий приготовления. Так, в ходе термического разложения солей металлов, например, Ni(NO3)2, в атмосфере водорода после нанесения на подложку образуется значительное количество воды, воздействующей на носитель и формирующиеся частицы металла; на конечную дисперсность металла может влиять также выделение тепла при протекании экзотермических реакций [24].
Различия в силе связи металла с носителем в составе систем Ni/Al2O3 могут возникать еще на стадии взаимодействия прекурсоров в растворе. Так, в работе [25] было установлено, что при осаждении никеля на Al2O3 при рН близком к нейтральному (7 < pH < 8.2) возможно образование структур типа гидротальцита, включающих ионы Al3+. На стадиях перемешивания и прокаливания при замещении Ni2+ на Al3+ вероятно формирование ряда соединений, варьирующихся по составу от NiO/Al2O3 до NiAl2O4/Al2O3 [26]. Авторы [16, 27, 28] выделяют четыре формы нанесенного на оксид алюминия NiO: α, β1, β2, γ. Частицы α-типа слабо взаимодействуют с оксидом алюминия, их авторы назвали “свободным” NiO. Более сильно связанные с Al2O3 частицы NiO относят к β-типу. Оксид никеля типа β1 представляет собой обогащенную никелем фазу смешанного оксида, он восстанавливается при температурах 577–597°С; тип β2 – это обогащенная Al фаза смешанного оксида с температурой восстановления 697–737°С. Самая прочно связанная с поверхностью форма NiO, γ-форма, представляет собой алюминат никеля со структурой шпинели и температурой восстановления 800–830°С.
Таким образом, очень важно учитывать процессы, происходящие в ходе прокаливания и восстановления, и влияние, которое оказывает каждый из параметров процесса на состав и свойства получаемых катализаторов. Сложность идентификации конкретного типа активной формы никеля, работающего в определенной реакции, обусловлена тем, что характеристические параметры этих соединений Ni при исследовании различными физико-химическими методами очень близки, и, кроме того, наблюдаются их изменения в зависимости от степени кристалличности и размера частиц.
В настоящей работе проведено систематическое исследование процесса формирования никельсодержащих активных форм в катализаторах Ni/Al2O3 в зависимости от температуры прокаливания и содержания никеля. Каталитические свойства исследовали в реакции парофазного гидродехлорирования хлорбензола.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Катализаторы готовили методом влажной пропитки с длительным выдерживанием носителя в растворе соли при перемешивании. По данным [29] метод позволяет добиться равномерного распределения металла по поверхности носителя, включая внутреннюю поверхность гранулы. К рассчитанному количеству носителя γ-Al2O3 (“Engelhard”, США, удельная поверхность SБЭТ = = 149 ± 15 м2/г) добавляли дистиллированную воду и в полученную суспензию по каплям при постоянном перемешивании вводили водный раствор соли Ni(NO3)2 ⋅ 6H2O (ООО “АО РЕАХИМ”, Россия). Затем растворитель медленно выпаривали при нагревании на водяной бане и с использованием магнитной мешалки. После этого носитель с нанесенным на него нитратом никеля сушили при 110°С в течение 3 ч и прокаливали при требуемой температуре в течение 3 ч. Восстановление катализатора проводили непосредственно перед каталитическим экспериментом в токе Н2. В зависимости от содержания металла и температуры термической обработки приготовленные образцы обозначены X% Ni/Al2O3-[Tc/Tr], где X – содержание никеля в образце (мас. %), Tc и Tr – температуры (°С) обработки на воздухе (прокаливания) и восстановления соответственно.
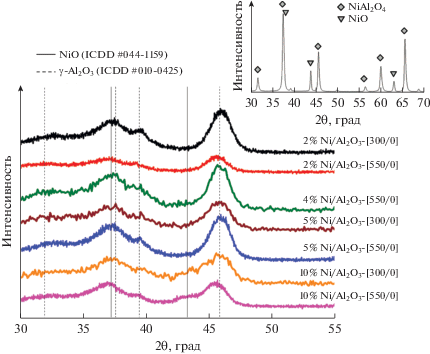
Для исследования взаимного влияния различных никельсодержащих фаз в ходе восстановления был приготовлен образец сравнения NiO/NiAl2O4 перемешиванием нитратов никеля и алюминия в растворе с последующим высушиванием при 110°С и прокаливанием при 1050°С. Его фазовый состав был определен методом РФА (вставка на рис. 1): он включает фазы NiAl2O4 и NiO. Содержание Ni, входящего в состав NiO, рассчитанное по данным ТПВ-Н2, составляет 6 мас. %.
Рис. 1.
Дифрактограммы невосстановленных образцов NiО/Al2O3, содержащих 2–10% Ni и прокаленных при 300 и 550°С. На вставке приведена дифрактограмма образца сравнения NiO/NiAl2O4.
Удельную поверхность катализаторов измеряли на приборе ГХ-1 методом низкотемпературной десорбции азота. При вычислении удельной поверхности использовали сравнительный метод, основанный на сопоставлении количества азота, сорбированного в одинаковых условиях образцом с известной поверхностью (стандарт – Al2O3, имеющий SБЭТ = 135 м2/г) и исследуемым образцом.
Рентгенофазовый анализ осуществляли с использованием автоматического порошкового дифрактометра STOE STADI-P (“STOE & Cie GmbH”, Германия), CuKα1-излучение. Диапазон углов съемки 2θ составлял от 20° до 70° с шагом 0.05° и временем накопления 5 с на точку. Фазовый состав анализировали, сравнивая полученные данные с данными библиотеки JCPDS PDF1 (база данных ICDD).
Температурно-программированное восстановление водородом (ТПВ-Н2) проводили на лабораторной установке, включающей систему подготовки газов, реактор с трубчатой печью и детектор по теплопроводности. Невосстановленный образец (50 мг) помещали в кварцевый реактор между слоями кварцевой бумаги. Восстановление осуществляли смесью газов 5% H2 в Ar (23 мл/мин) в условиях линейного нагрева со скоростью 12°С/мин. Изменения концентрации водорода в потоке непрерывно контролировали при помощи детектора по теплопроводности непосредственно на выходе из реактора. Сигнал детектора обрабатывали с применением пакета программ “Экохром”.
Содержание металла в образцах контролировали методом атомно-абсорбционной спектроскопии (ААС) на спектрометре iCE 3000 (“Thermo Fisher Scientific”, США). Навеску катализатора растворяли в смеси кислот: разбавленной HNO3 (1 : 1 по объему), HF (конц.) и разбавленной H2SO4 (1 : 1 по объему) в соотношении 1 : 0.1 : 0.5 (по объему), а затем подогревали с помощью горячей воды (80–90°С). Полученную смесь доводили до требуемого объема добавлением дистиллированной воды.
Морфологию образцов изучали методом сканирующей электронной микроскопии (СЭМ) на приборе JSM 6490 LV (“JEOL”, Япония). Снимки просвечивающей электронной микроскопии высокого разрешения (ПЭМ ВР) получены с использованием прибора JEM 2100 (“JEOL”, Япония) с ускоряющим напряжением 200 кВ, размер пучка в сканирующем режиме – 1 нм. Оба микроскопа имели приставки для локального энергодисперсионного анализа (ЭДА). Обработку микрофотографий ПЭМ проводили с помощью программы ImageJ [30].
Рентгеновские фотоэлектронные спектры (РФЭС) снимали с неизмельченных гранул катализатора на спектрометре Axis Ultra DLD (“Kratos Analytical Ltd.”, Великобритания) с применением монохроматического AlKα-излучения при мощности рентгеновской пушки 150 Вт. Для устранения эффекта зарядки образцов съемку спектров проводили с использованием нейтрализатора. Спектры регистрировали при энергии пропускания, равной 160 эВ для обзорного спектра и 20 эВ для спектров отдельных линий. Размер анализируемой области составлял около 300 × 700 мкм. Проведенная предварительно калибровка шкалы энергии отвечала следующим значениям пиков стандартов (очищенных ионным распылением поверхностей металлов): Au4f5/2 – 83.96 эВ, Cu2p3/2 – 932.62 эВ, Ag3d5/2 – 368.21 эВ. Полученные спектры калибровали по энергии связи линии 1s электронов углерода, адсорбированного на поверхности образцов, которая была принята равной 285.0 эВ.
Гидродехлорирование (ГДХ) хлорбензола (ХБ) (“Acros Organics”, 95%) осуществляли в реакторе проточного типа с неподвижным слоем катализатора (навеска катализатора составляла 50 мг). Перед опытом образцы восстанавливали в токе водорода (12 мл/мин) при заданной температуре в течение 3 ч. Затем, не выключая поток Н2, реактор охлаждали до температуры реакции и подавали реакционную смесь в реактор снизу. Смесь ХБ с водородом (мольное соотношение ХБ : Н2 = 1 : 50) получали при пропускании потока H2 (12 мл/мин) через барботер, содержащий хлорбензол. Эксперименты проводили при ступенчатом повышении температуры: после установления постоянной величины конверсии (изменение не более 1–2% при заданной температуре), подачу хлорбензола прекращали и повышали температуру до следующего значения при пропускании через реактор Н2. Конверсию ХБ сравнивали в интервале температур 100–350°С. Пробы отбирали на выходе из реактора каждые 20–30 мин. Состав продуктов анализировали при помощи газо-жидкостного хроматографа 6890N (“Agilent”, США) с капиллярной колонкой DBWax длиной 30 м, пламенно-ионизационный детектор.
3. ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
3.1. Исследование катализаторов методами низкотемпературной адсорбции N2, РФА, СЭМ, ПЭМ
В работе приготовлены семь образцов-прекурсоров катализаторов Ni/Al2O3, содержание металла в которых варьировали от 2 до 10 мас. %. Согласно результатам ААС, содержание никеля во всех образцах соответствует заданному:
| Заданное значение | 2 | 3 | 4 | 5 | 6 | 8 | 10 |
| По данным ААС | 1.9 ± 0.1 | 3.0 ± 0.1 | 4.0 ± 0.1 | 4.9 ± 0.1 | 6.1 ± 0.1 | 7.9 ± 0.2 | 9.9 ± 0.2 |
Удельная площадь поверхности исходного Al2O3 составляет 149 ± 15 м2/г. Нанесение металла и прокаливание при высоких температурах может влиять на пористую структуру носителя вследствие закупоривания пор и спекания. Однако из данных, приведенных ниже, следует, что для наших образцов, прокаленных при 550°С, SБЭТ не зависит от содержания Ni:
| Содержание Ni, мас. % | 2 | 3 | 4 | 5 | 6 | 8 | 10 |
| Удельная площадь поверхности, м2/г | 131 ± 13 | 152 ± 15 | 139 ± 14 | 150 ± 15 | 148 ± 15 | 149 ± 15 | 142 ± 14 |
Для образца с содержанием никеля 2 мас. % изучено влияние температуры прокаливания на этот параметр, результаты представлены ниже:
| Температура обработки на воздухе, °С | 110 | 200 | 300 | 400 | 500 | 550 |
| Удельная площадь поверхности, м2/г | 143 ± 14 | 154 ± 15 | 162 ± 16 | 164 ± 16 | 137 ± 14 | 131 ± 13 |
Видно, что прокаливание не приводит к заметному спеканию образца: SБЭТ не меняется при повышении температуры прокаливания от 200 до 400°С и незначительно снижается при 500–550°С. Таким образом, температурные обработки, которым подвергали катализаторы в настоящей работе, не приводят к заметным изменениям структурных и текстурных характеристик.
Фазовый состав катализаторов после термических обработок контролировали методом РФА. На дифрактограммах (рис. 1) всех прокаленных образцов, независимо от содержания никеля и температуры прокаливания, присутствуют рефлексы при 2θ = 37°, 39° и 46°, которые можно отнести к граням (311), (222) и (400) γ-Al2O3 (карта ICDD-PDF № 04-088), но не наблюдаются характерные для NiO или NiAl2O4 рефлексы даже при относительно высокой концентрации никеля (10%). Следовательно, структура носителя существенно не меняется, что согласуется с отсутствием изменения величины SБЭТ после нанесения никеля, а фазы, включающие никель, рентгеноаморфны. К сожалению, при такой высокой дисперсности активного компонента по результатам РФА невозможно выявить присутствие в катализаторах NiO или шпинельных форм, образующихся в ходе взаимодействия NiO с Al2O3. Рефлексы, характерные для фаз NiO и NiAlO4, ярко проявляются на дифрактограмме сравнительного образца NiO/NiAlO4 (вставка на рис. 1).
На рис. 2 приведены микрофотографии СЭМ носителя Al2O3 и невосстановленных образцов NiО/Al2O3, прокаленных при 300°С, с содержанием никеля 2, 4, 6 и 10 мас. %, а также карты распределения Ni, полученные методом ЭДА. Видно, что частицы катализатора имеют неправильную форму, характерную для исходного Al2O3. Таким образом, процесс нанесения никеля пропиткой раствором нитрата никеля не влияет на текстурные и морфологические характеристики Al2O3, использованного в работе. Во всех образцах Ni распределен по поверхности частиц оксида алюминия равномерно, области его повышенной или пониженной концентрации отсутствуют.
Рис. 2.
Микрофотографии образцов, прокаленных при 300°С, и карты распределения никеля для образцов 2% Ni/Al2O3 (а); 4% Ni/Al2O3 (б); 6% Ni/Al2O3 (в); 10% Ni/Al2O3 (г) и исходного Al2O3 (д).

С целью выявления возможного влияния температуры прокаливания на размер частиц NiO и его распределение по поверхности Al2O3 образцы NiО/Al2O3, прокаленные при 300 и 550°С, изучали методом ПЭМ ВР (рис. 3). Поскольку на воздухе никель, содержащийся в восстановленных катализаторах, быстро окисляется (см. раздел 3.2, ТПВ-Н2), восстановительную обработку перед ПЭМ-исследованием не проводили. Анализ карт распределения никеля и спектров ЭДА, полученных в ходе ПЭМ, показал отсутствие областей локализации Ni, что согласуется с данными СЭМ-ЭДА.
Рис. 3.
Микрофотографии ПЭМ ВР предшественников катализаторов 5% Ni/Al2O3-[300/0] (а) и 5% Ni/Al2O3-[550/0] (б). На вставках Фурье-образ, полученный методом FFT.

Природу нанесенных частиц, содержащих никель, изучали методом ПЭМ ВР (рис. 3а). Измерение межплоскостных расстояний дало для этих частиц величины 0.20 и 0.23 нм, что соответствует плоскостям NiO [200] и NiO [111 ] . Обработка микрофотографий ПЭМ ВР отдельных частиц с использованием быстрого преобразования Фурье (FFT) подтвердила кубическую структуру NiO (рис. 3а). В составе образцов, прокаленных при различных температурах, можно выделить некоторые отличия. Так, на снимках ПЭМ прекурсора 5% Ni/Al2O3-[300/–] имеется достаточно большое количество хорошо различимых частиц NiO в виде темных пятен, размер частиц составляет 2–10 нм. На микрофотографиях невосстановленного 5% Ni/Al2O3-[550/–] количество видимых частиц NiO значительно меньше, хотя их размер примерно такой же (2–8 нм). Кроме того, для указанного образца на микрофотографиях высокого разрешения отчетливо наблюдаются кристаллические участки округлой формы размером 2–4 нм (рис. 3б). Эти участки также соответствуют NiO, что подтверждается размером межплоскостных расстояний и результатами обработки методом FFT (рис. 3б). По-видимому, в образце, прокаленном при 550°С, некоторое количество частиц NiO имеют более плоское строение и менее заметны на снимках ПЭМ. Можно предположить, что эти 2D-частицы представляют собой NiO, сильно связанный с Al2O3 в результате прокаливания при повышенной температуре. Крайней формой сильного связывания является образование шпинели, мало контрастной по отношению к Al2O3 на микрофотографиях ПЭМ.
Таким образом, исследование методом ПЭМ подтверждает более сильное связывание никеля с носителем в ходе прокаливания при 550°С.
3.2. Температурно-программированное восстановление никеля в системе NiО/Al2O3: влияние температуры прокаливания
Метод ТПВ-Н2 очень информативен при исследовании восстановления Ni2+ в форме NiO и Ni-Al-шпинелей, поскольку эти процессы происходят при различных температурах. Он позволяет качественно и количественно определить содержание каждой из форм Ni2+ в образце.
Профили поглощения водорода при ТПВ-Н2 предшественников 2% Ni/Al2O3, обработанных на воздухе при температурах от 110 до 550°С, представлены на рис. 4а. Как и ожидалось, температура прокаливания оказывает существенное влияние на процесс восстановления прекурсоров катализаторов. Температуры максимумов поглощения водорода в профилях ТПВ-Н2 всех предшественников катализаторов отличаются от характерных для сравнительных образцов массивных NiO (Тмакс = = 455°С) и Ni(NO3)2 · 6H2O (Tмакс = 388°С), профили восстановления которых также приведены на рис. 4а.
Рис. 4.
Профили ТПВ-Н2: а – NiO, Ni(NO3)2 · 6H2O и предшественники катализатора 2% Ni/Al2O3, обработанные на воздухе при температурах от 110 до 550°С; б – предшественники катализаторов с содержанием никеля 2, 4 и 6 мас. %, обработанные на воздухе при 110°С.
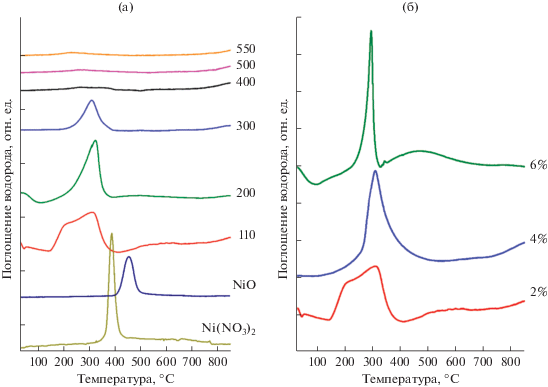
Профиль ТПВ-Н2 образца 2% Ni/Al2O3-[110/–], который подвергался только сушке при 110°С, включает два пика поглощения водорода с максимумами при 210 и 310°С. По литературным данным полное разложение массивного Ni(NO3)2 · nH2O на воздухе происходит при 310°С, если скорость нагрева составляет 1°/мин [31, 32], и при 400°С, если скорость нагрева равна 10 град/мин [33]. В работе [31] было установлено, что в результате нанесения на Al2O3 механизм разложения Ni(NO3)2 · · nH2O меняется: температура полного разложения Ni(NO3)2 · nH2O снижается на 30°С, а выделение воды заканчивается при нагреве до 200°С. Поэтому в образцах, прокаленных при температурах до 300°С, ожидаемо присутствие неразложившегося Ni(NO3)2, а также интермедиатов, образующихся в ходе его разложения, например, Ni(NО3)(OH) [33] или xNi(NO3)2 ⋅ yNi(OH)2 [32].
Низкотемпературный пик с максимумом при 210°C четко проявляется только при ТПВ-Н2 образца 2% Ni/Al2O3–[110/–]. В профиле ТПВ-Н2 образца 2% Ni/Al2O3-[200/–] этот пик присутствует в виде широкого плеча, а для 2% Ni/Al2O3-[300/–] практически отсутствует. Появление этого пика может быть связано с восстановлением аниона ${\text{NO}}_{{\text{3}}}^{ - }$ [33]. Кроме того, не исключено, что в этом температурном интервале происходит разложение и восстановление промежуточных гидроксидных форм никеля, образовавшихся при неполном разложении Ni(NO3)2. Повышение температуры прокаливания приводит к более полному разложению нитрата и гидроксинитратов никеля xNi(NO3)2 ⋅ yNi(OH)2, что снижает интенсивность поглощения водорода в этом интервале в ходе ТПВ-Н2.
Пик поглощения водорода при 310°С наблюдается в профилях ТПВ-Н2 трех образцов, прокаленных при 110, 200 и 300°С. Поскольку температура его максимума практически не изменяется, можно предположить, что во всех этих образцах имеется одинаковая форма никеля. По-видимому, этот пик обусловлен восстановлением оксидов никеля (в основном NiO и небольших количеств Ni2O), т.к. в образце, прокаленном при 300°С, присутствие гидроксидов уже маловероятно. Известно, что анион ${\text{NO}}_{{\text{3}}}^{ - }$ в ходе разложения нитрата может окислять часть Ni2+ в Ni3+ с образованием Ni2O3, который в условиях ТПВ-Н2 восстанавливается при 321°С [33]. Пик поглощения водорода при температурах около 320°С может отвечать восстановлению частиц NiO, не связанных химически с поверхностью Al2O3 [28, 34].
При восстановлении образцов, прокаленных при температурах ≥400°С, в исследованном интервале температур поглощения водорода не зарегистрировано. Исчезновение пиков в низкотемпературной области может свидетельствовать об образовании соединений типа никель-алюминиевой шпинели, хотя в работе [35] химическое взаимодействие компонентов с формированием шпинели наблюдали при более высокой температуре прокаливания Ni/Al2O3 (≥750°С). Восстановление NiAl2O4 водородом происходит при температурах >800°С [28, 36–39]. И действительно, в профилях ТПВ-Н2 этих образцов отмечается небольшое увеличение поглощения водорода при температурах выше 800°С.
Таким образом, чтобы обеспечить присутствие NiO в катализаторах, прокаливание следует проводить при температуре 200–300°С. Полученный результат хорошо согласуется с данными работы [24], в которой авторы предлагают прокаливать предшественник катализатора Ni/Al2O3, полученный из нитрата, медленно нагревая его до 230°С, а затем выдерживая при этой температуре в течение часа до полного превращения нитрата в NiO.
Изменения в химическом состоянии нанесенного предшественника никеля при различных температурах прокаливания также проявляются в окрашивании образца. Так, непрокаленный образец имеет зеленоватую окраску, характерную для Ni(NO3)2. Образцы, прокаленные при температурах 200, 300 и 400°С, обладают темной окраской вследствие разложения нитрата никеля и образования NiO. Темнее всего был образец, прокаленный при 300°С. Более светлая окраска образца, прокаленного при 400°С, указывает на образование шпинели.
Профили ТПВ-Н2 высушенных при 110°С образцов с различным содержанием никеля представлены на рис. 4б. Видно, что при увеличении содержания Ni от 2 до 4 мас. % первый низкотемпературный пик практически исчезает, положение максимума второго пика сохраняется (310°С), однако происходит его уширение в области высоких температур. В профиле ТПВ-Н2 образца 6% Ni/Al2O3 наблюдается пик с максимумом при 300°С, а также малоинтенсивный широкий пик в области 350–600°С.
Тот факт, что максимум пика поглощения водорода при 310°С практически не меняется при изменениях температуры прокаливания от 110 до 300°С и содержания никеля, свидетельствует о том, что во всех образцах природа и морфология частиц NiO практически одинаковая. Так, изменение размера частиц сказалось бы на положении максимума температуры восстановления. В работе [40] было показано, что увеличение размера частиц никеля в результате спекания приводит к повышению температуры восстановления.
Уширения в области 350–500°С и широкий пик в области 350–600°С в профилях образцов, в состав которых входит 4 и 6 мас. % Ni (рис. 4б), отвечают присутствию Ni, сильно связанного с носителем. Схожим образом в [28] появление высокотемпературных пиков объясняют восстановлением шпинельных форм на поверхности катализатора.
Анализ результатов ТПВ-Н2 показывает, что при содержании Ni 4 мас. % и выше наблюдается сильное взаимодействие Ni(NO3)2 и Al2O3, которое возникает уже в ходе пропитки. Вероятно, это связано с образованием соединений типа слоистых двойных гидроксидов, состоящих из положительно заряженных слоев, образованных ионами Al3+, Ni2+ и ОН–, и подвижных анионов ${\text{NO}}_{{\text{3}}}^{ - },$ расположенных в межслоевом пространстве. В литературе [7, 41] отмечается, что восстановление слоистых двойных гидроксидов со структурой типа гидротальцита и таковита, появление которых возможно в процессе взаимодействия солей Ni и Al в растворе, происходит при температурах 370–600°С.
Полученный результат согласуется с данными ПЭМ о снижении наблюдаемого количества частиц NiO в образце, прокаленном при 550°С, по сравнению с прокаленным при 300°С, за счет химического взаимодействия части оксида никеля с Al2O3. Считается доказанным [28, 36, 37], что с ростом температуры прокаливания увеличивается вероятность образования сильно связанного с поверхностью NiO и снижается содержание слабо связанного (посредством адсорбционных взаимодействий) NiO. При прокаливании системы NiО–Al2O3 при высоких температурах образуется NiAl2O4 [28, 42].
3.3. Влияние содержания никеля на взаимодействие с носителем
На основании результатов, полученных для образца 2% Ni/Al2O3, для исследования влияния содержания никеля на его взаимодействие с оксидом алюминия были выбраны два режима прокаливания, при 300 и 550°С, которые, соответственно, приводят к образованию никеля в виде относительно слабо или сильно связанного с носителем оксида. Профили ТПВ-Н2 образцов с содержанием Ni от 2 до 10 мас. %, прокаленных при 300°С, приведены на рис. 5а. Видно, что в профиле ТПВ образца 2% Ni/Al2O3-[300/–] имеется пик поглощения водорода с максимумом при 310°С, который, в соответствии с литературными данными [34], отвечает восстановлению NiO, слабо связанного с носителем. При увеличении содержания Ni от 4 до 10% максимум этого пика поглощения сдвигается в низкотемпературную область; кроме того, в профиле ТПВ-Н2 появляются широкие пики поглощения водорода в интервале температур от 400 до 650°С. Эти пики обусловлены присутствием на поверхности Ni2+, сильно связанного с поверхностью Al2O3 [16, 27]. Появление не одного, а нескольких пиков восстановления в высокотемпературной области свидетельствует о наличии разных форм сильно связанного с носителем никеля. Расчет количества поглощенного водорода показывает, что содержание слабосвязанного NiO в образцах остается практически одинаковым при увеличении общего содержания Ni от 4 до 10 мас. %, однако возрастает доля Ni2+, который восстанавливается при более высоких температурах (400–700°С). Высокотемпературный широкий пик можно отнести к восстановлению сильно взаимодействующего с носителем NiO, вероятнее всего, в составе поверхностного смешанного Ni-Al-оксида, обогащенного Ni, а также к началу восстановления (при температурах >600°С) смешанного оксида, обогащенного Al [16, 27].
Рис. 5.
Профили ТПВ-Н2 предшественников катализаторов Ni/Al2O3, содержащих 2–10% мас. % Ni и прокаленных при 300 (а) и 550°С (б).
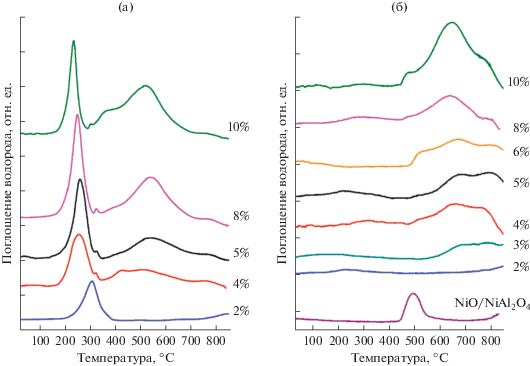
При повышении температуры прокаливания до 550°С вид профилей ТПВ-Н2 заметно меняется (рис. 5б). В профиле ТПВ-Н2 предшественника 2% Ni/Al2O3 практически не наблюдается поглощение водорода в исследованном интервале температур, кроме небольшого пика при 230°С, который связан с восстановлением NiO. При содержании никеля 4 мас. % и более отмечается появление состояний никеля, восстанавливающихся при высоких температурах (500–900°С, тип β-NiO). Так, в профиле предшественника 4% Ni/Al2O3 появляются высокотемпературные пики (>600°С). Увеличение содержания никеля от 4 до 6 и 10% приводит к появлению пиков восстановления при температуре около 500°С. Это связано с присутствием на поверхности соединений Ni2+, сильно связанных с поверхностью Al2O3, но не образующих объемной фазы шпинели [43]. Из результатов ТПВ-Н2 следует, что при малом содержании никеля образуются более сильно связанные с носителем формы Ni2+, а при его повышении – менее сильно связанные, но все они отличаются от NiO, не связанного химически с поверхностью носителя.
Для подтверждения причин появления пиков поглощения водорода проведено исследование модельного образца NiO/NiAl2O4, который, согласно данным РФА, включает оксид никеля и объемную шпинель NiAl2O4. В профиле ТПВ-Н2 этого образца (рис. 5б) имеется единственный пик с максимумом при 500°С, отвечающий восстановлению NiO. Расчет количества поглощенного водорода показал, что содержание никеля, отвечающего этому пику, оставляет 6 мас. %. В области >800°С наблюдается увеличение поглощения водорода, обусловленное началом восстановления шпинели NiAl2O4. На основании данных ТПВ-Н2 можно заключить, что пики поглощения водорода в интервале от 550 до 750°С для образцов, прокаленных при 550°С, соответствуют соединениям Ni, отличающимся и от NiO, и от шпинели NiAl2O4. Промежуточное состояние, вероятнее всего, представляет собой Ni, занимающий октаэдрические вакансии Al2O3 при образовании нестехиометрических смешанных оксидов, т.к. из литературы известно, что Ni в октаэдрическом окружении восстанавливается легче, чем в тетраэдрическом [44]. Наряду с этим состоянием в прокаленных при 550°С образцах присутствует и шпинель NiAl2O4. Полученные данные хорошо согласуются с результатами работ [16, 27], согласно которым пики восстановления в интервале температур 697–737°С в профиле ТПВ-Н2 относятся к фазе смешанного Ni-Al-оксида, обогащенного Al. Сравнение профилей ТПВ-Н2 NiO/NiAl2O4 и образцов NiO/Al2O3, прокаленных при 550°С, показывает, что NiO, не связанный химически с поверхностью Al2O3, появляется в образцах только при содержании никеля 10%. При более низких содержаниях металла никель, скорее всего, находится на поверхности в составе нестехиометрических шпинелей.
3.4. Влияние температуры восстановления на содержание различных форм Ni в катализаторах
Важную роль в приготовлении катализаторов играют условия восстановления. Поскольку, согласно результатам ТПВ-Н2, в составе катализаторов в зависимости от температуры прокаливания и содержания никеля присутствуют различные формы никеля, температура восстановления будет играть важную роль при формировании активных центров. Более полное восстановление никеля приведет к максимально эффективному использованию активного компонента.
Для изучения условий полного восстановления никеля проведен эксперимент по восстановлению катализатора 10% Ni/Al2O3-[300/–] при двух температурах: 250 и 450°С. После восстановления образцы исследовали методом ТПВ-Н2 (рис. 6а). В профиле ТПВ-Н2 образца, восстановленного 3 ч при 250°С, значительно снижается площадь первого, низкотемпературного пика, однако полностью он не исчезает. Это может быть связано с тем, что NiO, слабо связанный с поверхностью, либо не восстанавливается полностью, либо образуется из восстановленного Ni0 при контакте с воздухом.
Рис. 6.
Профили ТПВ-Н2 катализаторов: а – 10% Ni/Al2O3, прокаленный при 300°С: невосстановленный (1) и восстановленный при 250 (2) и 450°С (3); б – 6% Ni/Al2O3, прокаленный при 300°С: невосстановленный (1), восстановленный при 450°С (2) и после обработки водородом в условиях ТПВ-Н2 до 850°С.
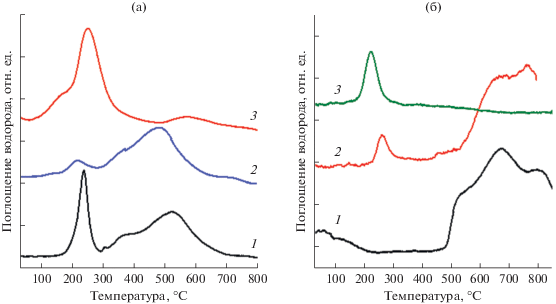
Температуры максимумов и количество поглощенного водорода в высокотемпературной части профиля ТПВ-Н2 не меняются. Таким образом, формы NiO, сильно связанные с поверхностью, не восстанавливаются при температуре 250°С.
На профиле ТПВ-Н2 того же образца, но прокаленного при 450°С, практически отсутствует поглощение водорода при температурах выше 400°С, однако появляется новый пик поглощения с максимумом при 250°С. Наблюдаемое изменение вида профиля ТПВ-Н2 можно объяснить тем, что в атмосфере водорода при 450°С происходит восстановление сильно связанных форм NiO до Ni0, который при контакте с воздухом в промежутке между проведением восстановления и анализа методом ТПВ-Н2 окисляется с образованием слабосвязанной формы NiO. Также необходимо отметить появление плеча в области температур около 170°С, что может быть связано с формированием на поверхности носителя небольшой доли высокодисперсных частиц NiO, которые восстанавливаются при чуть более низких температурах по сравнению с основной долей образующихся частиц NiO. Таким образом, изменяя температуру восстановления, можно регулировать состав поверхности, а, следовательно, и каталитические свойства образцов.
Аналогичные явления наблюдаются и в случае 6% Ni/Al2O3-[550/–] (рис. 6б). После восстановления этого образца при 450°С (кривая 2) пик поглощения водорода при 580°С, который наблюдался в профиле ТПВ-Н2 невосстановленного образца (кривая 1), исчезает. Однако при этом появляется низкотемпературный пик с максимумом при 270°С, обусловленный восстановлением NiO, образовавшегося в результате окисления Ni0 кислородом воздуха.
Чтобы избежать контакта образца с воздухом в промежутке между восстановлением и исследованием ТПВ-Н2, образцы 5% Ni/Al2O3-[550/–] и 6% Ni/Al2O3-[550/–] восстанавливали в реакторе ТПВ-Н2, а затем, не вынимая из реактора, охлаждали их в восстанавливающей смеси и проводили ТПВ-Н2. В этом случае в профиле ТПВ-Н2 не наблюдалось никаких пиков поглощения водорода. После выдерживания образца на воздухе при комнатной температуре в профиле ТПВ-Н2 появляется пик при 250°С (рис. 6б, кривая 3). Этот факт свидетельствует о том, что в атмосфере водорода окисленные никелевые формы восстанавливаются полностью, но некоторая их часть быстро окисляется при контакте с кислородом воздуха.
Результаты ТПВ-Н2 подтверждаются данными РФЭС. Так, в спектре РФЭС Ni2p-электронов для образца 6% Ni/Al2O3-[300/300] (рис. 7) не обнаружено пиков, отвечающих металлическому Ni. Пик с максимумом энергии связи при 856.1 эВ соответствует состоянию Ni2p3/2-электронов в Ni(OH)2 [45, 46] и немного сдвинут в область пониженных энергий по сравнению с NiAl2O4 [46]. Видно также, что пик в области меньших энергий уширен, поэтому можно говорить о наличии компоненты с энергией 854.5 эВ, отвечающей присутствию в образце NiO. На рис. 7 также представлен спектр РФЭС в области Ni2p-электронов катализатора 6% Ni/Al2O3-[550/450], который подтверждает, что часть Ni после восстановления при 450°С находится в состоянии Ni0, причем, в соответствии с расчетами, его поверхностная концентрация составляет ~8% от всего никеля в образце.
Рис. 7.
РФЭ-спектр в области Ni2p-электронов для образцов 6% Ni/Al2O3-[300/300] и 6% Ni/Al2O3-[550/450].
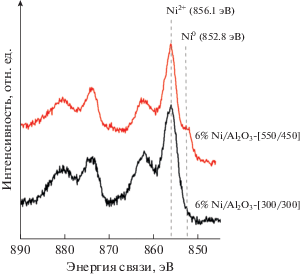
Проведенные исследования показывают, что полное восстановление никеля в Ni/Al2O3 представляет сложную задачу. Поскольку катализаторы окисляются при контакте с воздухом, их восстанавливали в каталитическом реакторе непосредственно перед проведением каталитических испытаний. Из данных ТПВ-Н2 следует, что восстановительная обработка водородом при температуре 450°С образцов, прокаленных при 300°С, позволяет перевести большую часть Ni из сильно связанных с носителем форм в состояние Ni0. В катализаторах, прокаленных при 550°С, такая обработка дает возможность восстановить только NiO, без восстановления сильно связанных с носителем форм Ni (смешанный оксид и шпинель).
3.5. Каталитическая активность Ni/Al2O3-катализаторов
На основании результатов физико-химических исследований методом ТПВ-Н2 с привлечением данных РФЭС установлено, что температурный интервал прокаливания от 300 до 450°С является ключевым для формирования активных центров различной природы. Поэтому в первую очередь мы сравнили образцы, прокаленные при температурах выше и ниже этого интервала, чтобы выявить роль слабосвязанных и шпинельных форм в формировании каталитической активности катализаторов.
Реакция ГДХ часто сопровождается дезактивацией катализаторов под действием выделяющихся значительных количеств HCl вследствие хлорирования нанесенного металла [47, 48]. Поэтому важно сравнить стабильность работы катализаторов в реакционных условиях. На рис. 8а и 8б представлены зависимости конверсии ХБ от времени для катализаторов 4% Ni/Al2O3, прокаленных при 300 или 500°С и восстановленных при 300°С.
Рис. 8.
Зависимость конверсии ХБ от времени в режиме повышения температуры реакции для катализаторов 4% Ni/Al2O3-[300/300] (а); 4% Ni/Al2O3-[550/300] (б); 6% Ni/Al2O3-[550/300] (в) и образца 2% Ni/Al2O3-[300/450] при 250°С (г).
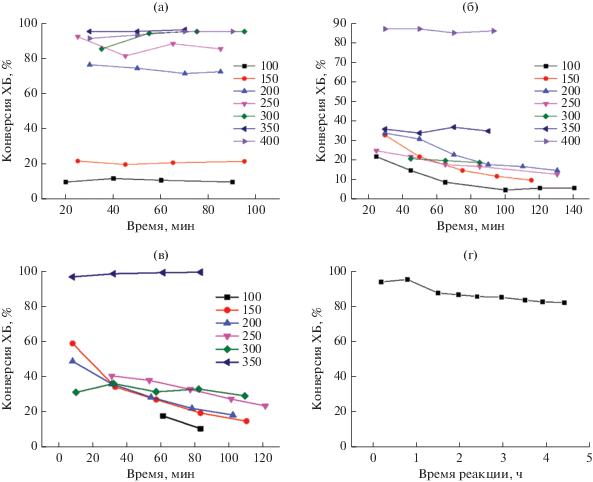
Сравнение каталитической активности 4% Ni/Al2O3-[300/300] (рис. 8а) и 4% Ni/Al2O3-[550/300] (рис. 8б) показывает, что под действием реакционной среды катализаторы ведут себя по-разному. Катализатор Ni/Al2O3-[300/300] работает стабильно, а при каждой температуре реакции изменение значений конверсии не превышает 10% за все время опыта. Катализатор, прокаленный при 550°С, существенно менее эффективен. Так, в температурном интервале до 350°С включительно конверсия ХБ не превышает 40%. Только при последующем повышении температуры до 400°С этот показатель приближается к 90%. Также из рис. 8б видно, что при температурах 100–300°С в начальный период реакции конверсия ХБ снижается со временем и выходит на постоянное значение только через 1–1.5 ч после начала опыта. Наблюдаемая зависимость эффективности от температур прокаливания и восстановления сохраняется для катализаторов независимо от содержания никеля. Для примера на рис. 8в приведены зависимости конверсии ХБ от времени в присутствии 6% Ni/Al2O3-[550/300]. Увеличение концентрации никеля для этого типа катализатора не приводит к существенному улучшению эффективности: катализатор стабильно и активно работает только при 350°С. При более низких температурах величина конверсии ХБ относительно низкая, а при 100–250°С в начале реакции она снижается под действием реакционной смеси. С течением времени реакции это снижение замедляется. В качестве примера на рис. 8г приведены результаты продолжительных испытаний 2% Ni/Al2O3-[300/450] при 250°С. Несмотря на некоторое падение конверсии в начале пропускания реакционной смеси, катализатор стабильно работает в течение 4.5 ч, и за это время изменение конверсии составляет менее 10%.
Для выявления различий каталитической активности разных форм никеля были выбраны образцы с содержанием никеля 6 мас. %: 6% Ni/Al2O3-[110/450]; 6% Ni/Al2O3-[550/300], 6% Ni/Al2O3-[550/450], а также 6% Ni/NiAl2O4, полученный восстановлением NiO/NiAl2O4 при 450°С в течение 3 ч. Зависимость конверсии ХБ от температуры в режимах ее повышения и понижения приведена на рис. 9. Видно, что на образце 6% Ni/NiAl2O4 кривые совпадают, т.е. не происходит значительных изменений свойств активных фаз на поверхности под воздействием реакционной среды в режимах повышения и понижения температуры реакции.
Рис. 9.
Зависимость конверсии ХБ от температуры в присутствии катализатора 6% Ni/Al2O3 после окислительно-восстановительных обработок при различных температурах и образца 6% Ni/NiAl2O4. Сплошные линии – режим повышения температуры; пунктирные линии – режим понижения температуры.
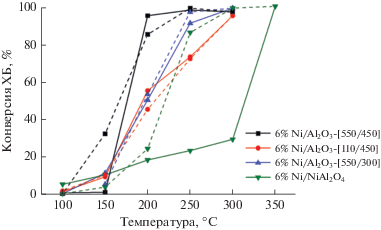
В присутствии катализатора 6% Ni/Al2O3-[550/300] наблюдается значительный положительный гистерезис в диапазоне 200–300°С. Как уже отмечалось, этот образец мало активен при температурах до 300°С: при этой температуре конверсия ХБ составляет всего 20%, но повышение температуры до 350°С обеспечивает конверсию ХБ, близкую к 100%. При последующем снижении температуры реакции активность этого катализатора была существенно выше: конверсия ХБ близка к 100% при 300°С и составляет более 80% даже при 250°С, что сопоставимо со значениями, характерными для 6% Ni/NiAl2O4. Наибольшую активность проявил катализатор 6% Ni/Al2O3-[550/450], восстановленный при 450°С. В его присутствии также отмечается положительный гистерезис зависимости конверсии от температуры в области относительно более низких температур: при 150°С в ходе подъема температуры образец не активен, а в ходе снижения температуры конверсия ХБ составляет около 30%.
Катализатор 6% Ni/Al2O3-[110/450], не подвергавшийся высокотемпературному прокаливанию, интервале 100–200°С обеспечивает примерно такую же конверсию ХБ, что и 6% Ni/NiAl2O4, и немного менее активен при 250°С. Для этого образца наблюдается совсем незначительный гистерезис в режимах повышения–понижения температуры – лишь при 200°С в режиме понижения температуры значение конверсии ХБ на 10% выше.
Для образцов с различным содержанием никеля (сравнение образцов, содержащих 4 и 6% Ni, приведено на рис. 10а), но подвергнутых одинаковой обработке (прокаленных при 550°С и восстановленных при 300°С) наблюдается схожая тенденция к положительному температурному гистерезису: конверсия ХБ остается небольшой до температуры 300–350°С, а затем заметно растет и сохраняет высокие значения в широком интервале в режиме понижения температуры реакции.
Рис. 10.
Влияние содержания Ni, температуры прокаливания и восстановления на активность катализаторов Ni/Al2O3. Сплошные линии – режим повышения температуры; пунктирные линии – режим понижения температуры.
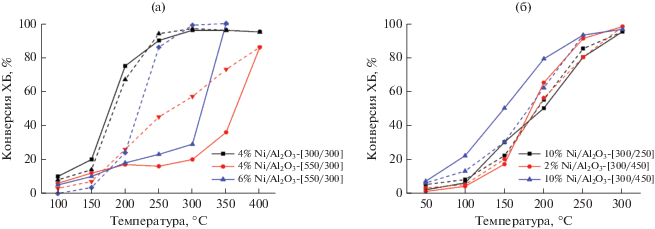
На рис. 10б приведены зависимости конверсии ХБ от температуры в присутствии катализаторов, прокаленных при 300°С, с малым (2%) и высоким (10%) содержанием никеля. Для этих образцов также не наблюдается широкого гистерезиса, то есть состав и свойства активных фаз в ходе проведения каталитических испытаний если и меняется, то незначительно. Восстановление 10% Ni/Al2O3, прокаленного при 300°С, проводили при двух температурах: при 300°С, когда, по данным ТПВ-Н2, восстанавливается около 4 мас. % Ni, и при 450°С, когда происходит практически полное восстановление Ni (10 мас. %). В режиме повышения температуры наибольшие значения конверсии ХБ во всем исследованном диапазоне отмечали в присутствии 10% Ni/Al2O3-[300/450]. Ход кривых зависимости конверсии ХБ от температуры для образцов 10% Ni/Al2O3-[300/300] и 2% Ni/Al2O3-[300/450], а также для 10% Ni/Al2O3-[300/450] при ступенчатом охлаждении практически совпадает.
4. ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
Сопоставление данных ТПВ-Н2 и каталитических испытаний в восстановительном дехлорировании хлорбензола водородом оказалось весьма информативным для выявления природы превращений, происходящих в ходе приготовления катализаторов Ni/Al2O3. В реакционной среде обязательно присутствует Н2 и НСl, неизбежный продукт ГДХ, то есть в ходе реакции может происходить как окисление, так и восстановление (при повышенных температурах реакции) никеля в составе катализатора. Поэтому наличие разных форм никеля с различной степенью окисления и степенью связывания с поверхностью играет определяющую роль для создания эффективных катализаторов ГДХ.
Хлорирование активного компонента отмечается во многих статьях и напрямую зависит от количества образующегося HCl. Так, для биметаллических Ni-Pd-катализаторов было показано, что степень хлорирования поверхности увеличивается с повышением активности катализатора [49]. Поэтому наблюдаемое в настоящей работе снижение активности в начальный период реакции может быть связано с хлорированием высокоактивных центров. При переходе от одной температуры реакции к другой в токе водорода и в отсутствие подачи ХБ окисленные формы никеля на поверхности катализатора, например, в виде образовавшегося под действием HCl хлорида, подвергается дополнительному восстановлению. Однако далее при возобновлении подачи ХБ в реакционную смесь Ni центры либо дезактивируются, либо водород и ХБ конкурируют за адсорбционные места на поверхности. При высоких температурах реакции разница между начальной величиной конверсии ХБ при определенной температуре и стационарным значением, наблюдаемым после пропускания реакционной смеси в течение продолжительного времени, уменьшается. По всей видимости, при повышенных температурах реакции десорбция HCl происходит быстрее, и это снижает дезактивацию катализатора. Авторы [8] на примере ГДХ хлорфенола в присутствии Ni/SiO2 предположили, что необходимым условием успешного протекания реакции ГДХ является диссоциативная адсорбция обоих реагентов, Н2 и хлорфенола, на поверхности катализатора. При этом водород и хлорфенол, по мнению авторов, не конкурируют за адсорбционные места на поверхности. В ходе реакции поверхность насыщается адсорбированным HCl, и это приводит к дезактивации катализатора.
В катализаторе, находящемся в реакционной среде, активной фазой являются наночастицы Ni0, на которых происходит адсорбция реагентов, ХБ и водорода. Реакция протекает по электрофильному механизму, включающему образование делокализованного карбокатиона в качестве переходного состояния [50]. Образование бензола происходит при взаимодействии этого переходного интермедиата с адсорбированным на поверхности катализатора водородом. Водород, активированный на металле, по механизму спилловера перетекает на носитель и может находиться там в виде атомов Н, ионов Н+ и частиц Н3 [50].
Сопоставление данных ТПВ-Н2 и каталитических испытаний также показало, что форма никеля в предшественнике катализатора оказывает влияние на каталитические свойства частиц Ni0. Методом ТПВ-Н2 продемонстрировано, что условия температурной обработки на стадии приготовления существенным образом сказываются на степени взаимодействия никеля с поверхностью Al2O3 и определяют способность прекурсора к восстановлению. Так, в ходе каталитических испытаний низкую активность проявил катализатор Ni/Al2O3-[550/300], прокаленный при 550°С и восстановленный при 300°С. Методом ТПВ-Н2 установлено, при 300°С практически не происходит восстановления сильно связанных форм NiO, а присутствующие на поверхности шпинельные формы малоактивны в ГДХ [51]. Возрастание конверсии при высоких температурах реакции (350–400°С) связано с увеличением содержания активной фазы вследствие восстановления Ni2+ водородом из реакционной смеси.
Полученный результат показывает, что шпинельные формы никеля, Ni2+, вероятно, обладают некоторой активностью в ГДХ хлорбензола. Это видно по значительной начальной конверсии ХБ в присутствии катализаторов, прокаленных при высокой температуре (550°С) и содержащих именно никель-алюминиевую шпинель. Однако такие формы быстро дезактивируются в реакционной среде. Принято считать, что активность в ГДХ свойственна восстановленным формам металлов, например, Ni, Pd, Pt. В тоже время в работах [52, 53] было отмечено, что для эффективного протекания реакции ГДХ требуется присутствие одновременно Pd0, ответственного за активацию Н2, и окисленной формы Pdn+, на которой происходит активация хлорированного органического соединения.
Для стабильной работы катализатора в ГДХ необходимо наличие в прекурсоре слабо связанного с поверхностью NiO, который легче восстанавливается с образованием центров Ni0. Подтверждением служит высокая устойчивость при продолжительных испытаниях в изотермическом режиме при 250°С катализатора 2% Ni/Al2O3-[300/450] с низкой концентрацией никеля (рис. 8г): наблюдается лишь незначительное (всего на 10%) снижение конверсии ХБ за 4.5 ч реакции. Присутствие Ni0 на поверхности Al2O3 обеспечивает активацию водорода, который может перетекать на поверхность носителя. Кислотные центры поверхности Al2O3, являющиеся акцепторами электронов, облегчают перенос водорода от металлических частиц [19]. Активированный водород, появляющийся на поверхности носителя за счет спиловера с частиц Ni, участвует в гидрогенолизе связи C–Cl [19, 50].
Различия в каталитической активности образцов, полученных из прекурсоров с разным соотношением слабо и сильно связанных форм никеля, продемонстрированы на примере катализаторов, содержащих 6% Ni, но прокаленных и восстановленных в различных условиях (рис. 9). На основании результатов ТПВ-Н2 можно предположить, что образец 6% Ni/NiAl2O4 содержит Ni и шпинель NiAl2O4; образец 6% Ni/Al2O3-[550/450] включает Ni и поверхностные NiAlO-шпинельные формы, которые восстанавливаются при более низких температурах, чем объемная шпинель NiAl2O4. На поверхности катализатора 6% Ni/Al2O3-[550/300] присутствует только NiAlO-шпинельная форма. Невысокая конверсия ХБ на образце 6% Ni/Al2O3-[550/300] при температурах 100–300°С скорее всего связана с отсутствием Ni0 на поверхности. Основной вклад в превращение ХБ в этом случае вносят менее активные и стабильные шпинельные формы. Резкое возрастание конверсии ХБ при 350°С вызвано появлением Ni0 в ходе восстановления поверхности водородом из реакционной смеси. Образующаяся активная фаза обеспечивает высокую конверсию ХБ в режиме снижения температуры реакции. Более того, присутствие в образце металлических частиц Ni может способствовать дополнительному восстановлению никеля из смешаннооксидных соединений [54] в условиях реакции (при температуре ≥ 300°С). Весьма вероятно, что высокая активность 6% Ni/Al2O3-[550/450] также связана с наличием частиц Ni0, которые образовались в результате восстановления катализатора при 450°С.
Наблюдаемая общая тенденция к положительному температурному гистерезису конверсии ХБ для катализаторов Ni/Al2O3-[550/300], отличающихся содержанием металла (рис. 10а), свидетельствует о схожей природе активных фаз, по всей видимости, сформированных шпинельными формами NiAlOx. Результаты ТПВ-Н2 и каталитических испытаний показывают, что восстановление при 300°С прокаленных при 550°С образцов не обеспечивает образование на поверхности Ni0, необходимого для высокой эффективности в ГДХ ХБ. Бóльшую активность проявляют катализаторы, восстановленные при 450°С.
Сравнение каталитических свойств 6% Ni/Al2O3-[550/450] и 6% Ni/Al2O3-[110/450] (рис. 9) свидетельствует, что важным фактором является природа соединения, из которого на поверхности формируются центры Ni0. Наибольшей активностью обладают центры, появившиеся из окисленных шпинельных форм, образующихся при высокотемпературном прокаливании катализатора в процессе приготовления. Еще один путь получения Ni0 включает восстановление слабосвязанного NiO, который, по данным ТПВ-Н2, образуется на поверхности катализатора в ходе прокаливании при температурах не выше 300°С. Из рис. 10а видно, что катализаторы 4% Ni/Al2O3, восстановленные при 300°С и прокаленные при различных температурах, ведут себя по-разному. Как и предполагалось, восстановление прокаленного при 300°С образца ведет к формированию высокоактивного катализатора, обеспечивающего конверсию ХБ более 50% уже при относительно низких температурах реакции (в интервале от 150 до 200°С), когда практически не наблюдается гистерезис кривых в режиме нагрев–охлаждение. Следовательно, на поверхности катализатора не происходит существенных изменений под действием реакционной среды, как в случае Ni/Al2O3-[550/300].
Увеличение общего содержания Ni от 2 до 10 мас. % (рис. 10б) не приводит к существенным изменениям в конверсии ХБ. Важно отметить, что и повышение содержания его восстановленной формы также мало сказывается на значениях конверсии. По-видимому, причиной является присутствие во всех образцах, прокаленных при 300°С, одинаковых форм NiO, что установлено при исследовании методом ТПВ-Н2.
Интересно, что для катализатора 10% Ni/Al2O3-[300/450] обнаружен отрицательный гистерезис зависимости конверсии ХБ от температуры. Повышенная активность в ходе подъема температуры может быть связана с присутствием легко восстанавливающихся форм Ni2+, которые наблюдали в профиле ТПВ-Н2 в виде плеча с максимумом при 170°С (рис. 6а, кривая 3). Скорее всего, при высоких температурах реакции образовавшиеся восстановленные формы дезактивируются. Так, нельзя исключать возможности спекания частиц Ni. Из литературы известно, что при восстановлении NiO, слабо взаимодействующего с носителем, возможна его быстрая агрегация с формированием крупных частиц Ni [16, 37, 55]. Оставшиеся активные фазы отвечают пику восстановления в профиле ТПВ-Н2 при 250°С. Согласно данным ТПВ-Н2, в образцах, прокаленных при 300°С, количество слабосвязанной формы NiO практически одинаково и не зависит от содержания никеля. По этой причине каталитические свойства мало различаются для образцов с разным общим содержанием Ni.
Сравнение с образцом 15 мас. % Ni/Al2O3, полученным в сходных условиях [7], показывает, что исследованные в нашей работе катализаторы проявляют активность в реакции ГДХ ХБ в проточных условиях в более низкотемпературной области. Так, температура, при которой конверсия составляет 50% (T50), для образца 15 мас. % Ni/Al2O3 лежит в интервале от 250 до 300°С, тогда как для большинства синтезированных в настоящей работе систем, кроме Ni/Al2O3-[550/300], значения T50 находятся в интервале 150–200°С.
Проявляющаяся при низких температурах реакции повышенная начальная активность катализаторов, полученных восстановлением шпинельных форм, наиболее вероятно обусловлена появлением на поверхности Ni0. В литературе имеются сведения о влиянии природы предшественника на размер частиц никеля. Так, восстановление из шпинельной фазы NiAl2O4 приводит к образованию небольших частиц Ni0 (6 нм), тогда как восстановление NiO, слабо связанного с поверхностью Al2O3, способствует формированию более крупных частиц (23 нм) [56]. Реакция ГДХ является структурно-чувствительной, и скорость реакции снижается с уменьшением размера частиц [23]. Для повышения активности и стабильности катализатора необходимо присутствие более крупных частиц, которые характеризуются большей устойчивостью к дезактивации. Казалось бы, высокотемпературные обработки должны приводить к агрегации небольших частиц никеля. Однако в работе [57] для Ni/Al2O3-катализаторов, отличающихся содержанием никеля и температурами окислительно-восстановительных обработок, было показано, что размер кристаллитов определяется в большей степени природой взаимодействия между никелем и носителем и практически не зависит от содержания металла и условий предшествующей обработки. Схожее заключение высказывают авторы [16], которые считают, что Al2O3 способствует стабилизации кристаллитов металлического никеля. С помощью хемосорбции H2 и О2 на поверхности Ni/Al2O3 они показали, что в широком диапазоне концентраций никеля (от 4 до 63%) на поверхности Al2O3 стабилизируются частицы Ni0 размером менее 5 нм. По всей видимости, в рассматриваемых в работе катализаторах при восстановлении шпинельных форм происходит образование более дисперсных частиц Ni0, которые менее эффективны в реакции ГДХ.
Обобщая полученные каталитические результаты, можно выделить основные особенности состава и структуры Ni/Al2O3-катализаторов, влияющие на их каталитическую эффективность в восстановительных реакциях, например, гидродехлорировании.
1) Шпинельные формы малоактивны в ГДХ ХБ. Они способны восстанавливаться водородом с образованием Ni0 в условиях реакции (при температурах >300°С), что приводит к повышению каталитической активности.
2) Каталитически активная фаза Ni0, формирующаяся при восстановлении шпинельных форм, обладает малой стабильностью; под действием реакционной среды происходит ее частичная дезактивация. Поэтому в изотермических условиях со временем происходит падение конверсии ХБ и значение конверсии на стационарном участке ниже начального значения. Дезактивированные формы способны восстанавливаться в ходе обработки водородом при переходе к более высокой температуре реакции, то есть наблюдающаяся дезактивация по большей части не является необратимой.
3) Активная фаза, полученная восстановлением слабо связанных с носителем форм Ni2+, стабильна в условиях реакции ГДХ ХБ.
5. ЗАКЛЮЧЕНИЕ
В работе показано влияние температуры прокаливания на степень взаимодействия металл–носитель в системе Ni/Al2O3. Установлено, что прокаливание при температурах выше 400°С приводит к химическому связыванию никеля с Al2O3 в виде шпинельных форм. Химически связанная форма никеля может быть переведена в NiO посредством окислительно-восстановительных обработок катализатора. Слабо связанные с поверхностью формы Ni2+ легче подвергаются восстановлению по сравнению с химически связанными формами. Формирующиеся после восстановления частицы Ni0 стабильны в условиях реакции гидродехлорирования хлорбензола, что оказывает существенное влияние на эффективность катализаторов.
Список литературы
Sprung C., Arstad B., Olsbye U. // Top. Catal. 2011. V. 54. P. 1063.
Zhou L., Guo Y., Zhang Q., Yagi M., Hatakeyama J., Li H., Chen J., Sakurai M., Kameyama H. // Appl. Catal. A: General. 2008. V. 347. P. 200.
Buitrago-Sierra R., Ruiz-Martínez J., Serrano-Ruiz J.C., Rodríguez-Reinoso F., Sepúlveda-Escribano A. // J. Colloid Interface Sci. 2012. V. 83. P. 48.
Kirumakki S., Shpeizer B., Sagar G., Chary K., Clearfield A. // J. Catal. 2006. V. 42. P. 19.
Pina G., Louis C., Keane M.A. // Phys. Chem. Chem. Phys. 2003. V. 5. P. 1924.
Estellé J., Ruz J., Cesteros Y., Fernández R., Salagre P., Medina F., Sueiras J.-E. // J. Chem. Soc., Faraday Trans. 1996. V. 92. P. 2811.
Feng J.-T., Lin Y.-J., Evans D.G., Duan X., Li D.-Q. // J. Catal. 2009. V. 266. P. 351.
Shin E.-J., Spiller A., Tavoularis G., Keane M.A. // Phys. Chem. Chem. Phys. 1999. V. 1. P. 3173.
Яковлев В.А., Симагина В.Н., Трухан С.Н., Лихолобов В.А. // Кинетика и катализ. 2000. Т. 41. № 1. С. 31.
Kim P., Kim H., Joo J.B., Kim W., Song I.K., Yi J. // J. Mol. Catal. A: Chem. 2006. V. 256. P. 178.
Cesteros Y., Salagre P., Medina F., Sueiras J.E. // Appl. Catal. B: Env. 1999. V. 22. P. 135.
Cuenya B.R. // Thin Solid Films. 2010. V. 518. P. 3127.
Jolivet J.-P., Cassaignon S., Chanéac C., Chiche D., Durupthy O., Portehault D. // Comptes Rendus Chim. 2010. V. 13. P. 40.
Jongnam P., Jin J., Gu K.S., Youngjin J., Taeghwan H. // Angew. Chem. Int. Edit. 2007. V. 46. P. 4630.
Yang R., Li X., Wu J., Zhang X., Zhang Z., Cheng Y., Guo J. // Appl. Catal. A: General. 2009. V. 368. P. 105.
Zhang J., Xu H., Jin X., Ge Q., Li W. // Appl. Catal. A: General. 2005. V. 290. P. 87.
Boukha Z., Jiménez-González C., de Rivas B., González-Velasco J.R., Gutiérrez-Ortiz J.I., López-Fonseca R. // Appl. Catal. B: Env. 2014. V. 158–159. P. 190.
Amorim C., Wang X., Keane M.A. // Chin. J Catal. 2011. V. 32. P. 746.
Amorim C., Keane M.A. // J. Hazar. Mater. 2012. V. 211–212. P. 208.
Díaz E., Faba L., Ordóñez S. // Appl. Catal. B: Env. 2011. V. 104. P. 415.
Liu X., Chen J., Zhang J. // Indust. Eng. Chem. Res. 2008. V. 47. P. 5362.
Bae J.W., Kim I.G., Lee J.S., Lee K.H., Jang E.J. // Appl. Catal. A: General. 2003. V. 240. P. 129.
Keane M.A., Park C., Menini C. // Catal. Lett. 2003. V. 88. P. 89.
Bartholomew C.H., Farrauto R.J. // J. Catal. 1976. V. 45. P. 41.
d’Espinose de la Caillerie J.-B., Kermarec M., Clause O. // J. Amer. Chem. Soc. 1995. V. 117. P. 11471.
Puxley D.C., Kitchener I.J., Komodromos C., Parkyns N.D. The effect of preparation method upon the structures, stability and metal/support interactions in nickel/alumina catalysts / In: Studies in Surface Science and Catalysis, Eds. Poncelet G., Grange P. and Jacobs P.A. Elsevier, 1983. p. 237.
Zhao A., Ying W., Zhang H., Ma H., Fang D. // Catal. Commun. 2012. V. 17. P. 34.
Rynkowski J.M., Paryjczak T., Lenik M. // Appl. Catal. A: General. 1993. V. 106. P. 73.
Lysova A.A., Koptyug I.V. // Chem. Soc. Rev. 2010. V. 39. P. 4585.
Schneider C.A., Rasband W.S., Eliceiri K.W. // Nature Methods. 2012. V. 9. P. 671.
Małecka B., Łącz A., Drożdż E., Małecki A. // J. Therm. Anal. Calorim. 2015. V. 119. P. 1053.
Elmasry M.A.A., Gaber A., Khater E.M.H. // J. Therm. Anal. Calorim. 1998. V. 52. P. 489.
Ho S.-C., Chou T.-C. // Indust. Eng. Chem. Res. 1995. V. 34. P. 2279.
Heracleous E., Lee A.F., Wilson K., Lemonidou A.A. // J. Catal. 2005. V. 231. P. 159.
Li J., Ren Y., Yue B., He H. // Chin. J. Catal. 2017. V. 38. P. 1166.
Li C., Chen Y.-W. // Thermochim. Acta. 1995. V. 256. P. 457.
Li G., Hu L., Hill J.M. // Appl. Catal. A: General. 2006. V. 301. P. 16.
Bolt P.H., Habraken F.H.P.M., Geus J.W. // J. Catal. 1995. V. 151. P. 300.
Cesteros Y., Salagre P., Medina F., Sueiras J.E. // Chem. Mater. 2000. V. 12. P. 331.
Turlier P., Martin G.A. // React. Kinet. Catal. Lett. 1982. V. 19. P. 275.
Velu S., Suzuki K., Kapoor M.P., Tomura S., Ohashi F., Osaki S. // Chem. Mater. 2000. V. 12. P. 719.
Molina R., Poncelet G. // J. Catal. 1998. V. 173. P. 257.
Gil-Calvo M., Jiménez-González C., de Rivas B., Gutiérrez-Ortiz J.I., López-Fonseca R. // Appl. Catal. B: Env. 2017. V. 209. P. 128.
de Bokx P.K., Wassenberg W.B.A., Geus J.W. // J. Catal. 1987. V. 104. P. 86.
Mansour A.N. // Surf. Sci. Spectra. 1994. V. 3. P. 239.
Salvati L., Makovsky L.E., Stencel J.M., Brown F.R., Hercules D.M. // J. Phys. Chem. 1981. V. 85. P. 3700.
Aramendía M.A., Boráu V., García I.M., Jiménez C., Lafont F., Marinas A., Marinas J.M., Urbano F.J. // J. Catal. 1999. V. 187. P. 392.
Choi Y.H., Lee W.Y. // Catal. Lett. 2000. V. 67. P. 155.
Seshu Babu N., Lingaiah N., Sai Prasad P.S. // Appl. Catal. B: Env. 2012. V. 111–112. P. 309.
Keane M.A. // ChemCatChem. 2011. V. 3. P. 800.
Навалихина М.Д., Кавалерская Н.Е., Локтева Е.С., Перистый А.А., Голубина Е.В., Лунин В.В. // Журн. физ. химии. 2012. V. 86. P. 1792.
Gómez-Sainero L.M., Seoane X.L., Fierro J.L.G., Arcoya A. // J. Catal. 2002. V. 209. P. 279.
Li R., Zhou Z., Chen J., Wang S., Zheng J., Chu C., Zhao J., Fan H., Han D. // New J. Chem. 2019. V. 43. P. 6659.
Cesteros Y., Salagre P., Medina F., Sueiras J.E. // Appl. Catal. B: Env. 2000. V. 25. P. 213.
Mile B., Stirling D., Zammitt M.A., Lovell A., Webb M. // J. Mol. Catal. 1990. V. 62. P. 179.
Jiménez-González C., Boukha Z., de Rivas B., Delgado J.J., Cauqui M.Á., González-Velasco J.R., Gutiérrez-Ortiz J.I., López-Fonseca R. // Appl. Catal. A: General. 2013. V. 466. P. 9.
Hoffer B.W., Dick van Langeveld A., Janssens J.-P., Bonné R.L.C., Lok C.M., Moulijn J.A. // J. Catal. 2000. V. 192. P. 432.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


