Кинетика и катализ, 2020, T. 61, № 3, стр. 428-434
О механизме превращения этанола на катализаторе 5% CuО/ZrO2 по данным ИК-спектроскопии in situ
О. Н. Сильченкова a, В. А. Матышак a, *, В. Ю. Бычков a, В. Н. Корчак a
a ФГБУН Институт химической физики им. Н.Н. Семенова РАН
119991 Москва, ул. Косыгина, 4, Россия
* E-mail: matyshak@polymer.chph.ras.ru
Поступила в редакцию 19.08.2019
После доработки 04.12.2019
Принята к публикации 10.12.2019
Аннотация
С помощью ИК-спектроскопии in situ в условиях превращения этанола на поверхности катализатора 5% CuО/ZrO2 обнаружены этоксигруппы, ацетатные комплексы, а также продукты уплотнения (ПУ). Формиатные комплексы в условиях реакции не наблюдались. В продуктах реакции зафиксированы ацетальдегид, ацетон, CO2 и этилен и в небольших количествах водород, бутен и толуол. Образование ацетальдегида обусловлено взаимодействием этоксигрупп и гидроксильных групп поверхности. Ацетон, бутен и толуол появляются в результате превращения ПУ. Малая скорость образования водорода на этом катализаторе связана с отсутствием на поверхности высокотемпературной формы формиатного комплекса.
ВВЕДЕНИЕ
В последнее время большое внимание уделяется процессам производства Н2-содержащих газовых смесей из этанола, что во многом обусловлено разработкой технологии топливных элементов, работающих на водороде. Смеси, богатые водородом, можно получать путем каталитического разложения, парового и автотермического риформинга этанола [1–4]. Очевидно, что для создания эффективных катализаторов этого процесса полезной является информация о механизме поверхностных реакций.
Литературные данные [5–9] свидетельствуют, что при взаимодействии этанола с оксидными катализаторами на поверхности формируются, как правило, этоксигруппы, формиатные, ацетатные и карбонатные комплексы. Однако роль этих комплексов в образовании продуктов процесса, в частности моно- и диоксидов углерода и водорода, не установлена, по-видимому, из-за отсутствия сопоставления скоростей превращения поверхностных комплексов и образования продуктов.
Ранее нами [10] с помощью ИК-спектроскопии in situ был изучен процесс конверсии этанола на катализаторах CeO2 и 5% CuO/CeO2. Было показано, что ключевыми в превращении этанола на поверхности катализатора являются этоксигруппы, ацетатный и формиатный комплексы, а также продукты уплотнения (ПУ). Ацетальдегид образуется в результате взаимодействия этоксигрупп и гидроксильных групп поверхности. Формирование тяжелых продуктов связано с разложением продуктов уплотнения. Появление водорода, CO и CO2 обусловлено превращением высокотемпературного формиатного поверхностного комплекса.
В настоящей работе аналогичное исследование роли поверхностных комплексов при конверсии этанола выполнено с использованием медьсодержащего катализатора на основе ZrO2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ZrO2 синтезировали по методике, описанной в [11]. По данным рентгенофазового анализа (РФА) полученный образец диоксида циркония представлял собой смесь двух фаз: моноклинной (m-ZrO2) и тетрагональной (t-ZrO2). Удельная поверхность образца составляла 116 м2/г. Медьсодержащий катализатор готовили нанесением 5% меди из водного раствора нитрата меди методом пропитки с последующим высушиванием при 100°С и прокаливанием при 500°С на воздухе в течение 2 ч.
Методом рентгенофазового анализа (РФА) фаза СuO в приготовленных таким образом образцах не наблюдалась. Состояние медных центров в катализаторах характеризовали методами адсорбции СО (1% СО в Не), термопрограммированного восстановления и электронной спектроскопии диффузного отражения (ЭСДО). Спектры порошковых образцов снимали на приборе Hitachi 330 (“Hitachi”, Япония). В качестве реагентов использовали газовую смесь 7% этанола в гелии.
Спектрокинетические исследования в условиях реакции превращения этанола проводили по методике, описанной в [12]. Экспериментальная установка включала ИК-Фурье-спектрометр IFS-45 (“Brucker”, Германия), проточную обогреваемую кювету-реактор объемом 1 см3, блок подготовки газов и систему анализа продуктов и реагентов. Образец в виде таблетки массой 20–30 мг и площадью 2 см2 помещали в кювету, которая одновременно служила каталитическим проточным реактором. Перед регистрацией спектров образец обрабатывали в потоке инертного газа He при 400°С в течение 1 ч, охлаждали до необходимой температуры и включали поток реакционной смеси (30 мл/мин).
Методика нестационарных спектрокинетических исследований заключалась в измерении концентрации поверхностных соединений методом ИК-спектроскопии in situ в процессе установления стационарного режима протекания реакции превращения этанола или при исключении этанола из потока реакционной смеси (изотермическая десорбция).
Интенсивность полос поглощения (п. п.) измеряли в единицах оптической плотности (А) в разностных спектрах, которые получали вычитанием из спектра образца в потоке реакционной смеси спектр этого же образца в потоке инертного газа при той же температуре. Обычное число сканирований – 64, разрешение – 4 см–1.
При измерении активности свежий образец (навеска 85 мг) предварительно обрабатывали в потоке He + O2 при температуре 400°С, затем охлаждали до Т = 30°С. Этиловый спирт подавали через барботер, продуваемый потоком Не, со скоростью 14 мл/мин. Образец нагревали до 500°С со скоростью 10°С/мин. Выходящий газ анализировали с помощью масс-спектрометра OmniStar GSD 301 (“Pfeiffer Vacuum”, Германия). Качественный состав продуктов оценивали по величине ионного тока. В этих же условиях изучали изменение веса при реакции этанола с 5% CuО/ZrO2 в термовесах SETSYS Evolution (“Setaram”, Франция).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Cтационарные измерения
На рис. 1 приведены ИК-спектры, зарегистрированные в процессе превращения этанола на CuО/ZrO2 при разных температурах. В спектре, полученном при 150°С, присутствуют полосы поглощения (п. п.) в области С–О-колебаний линейной (1100 и 1150 см–1) и мостиковой (1060 см–1) этоксигрупп [13, 14]. Этоксигруппам принадлежит и п. п. при 1380 см–1 (колебание δs СН2). При Т > 200°С в ИК-спектрах наблюдаются п. п. ацетатных комплексов при 1550 и 1440 см–1 [13]. С повышением температуры до 300–350°С форма п. п. ацетатных комплексов усложняется и наблюдается их уширение. Такие изменения свидетельствуют о появлении в этой области спектра п. п. дополнительных поверхностных соединений.
Рис. 1.
ИК-спектры, полученные в условиях превращения этанола (7 об. % в He) на образце 5% Cu/ZrO2 при T = 100 (1), 150 (2), 200 (3), 250°С (4) и на носителе ZrO2 при 250°С (5).

Для сравнения на этом же рисунке представлен спектр этанола (рис. 1, кривая 5), адсорбированного в аналогичных условиях на носителе ZrO2. Видно, что набор п. п. на носителе и катализаторе одинаков при разном соотношении их интенсивностей. Отмечается также некоторое различие в частотах соответствующих полос поглощения (1–5 см–1). Вероятно, разное соотношение интенсивностей и частот п. п. связано с тем, что нанесение CuO приводит к изменению свойств поверхности катализатора.
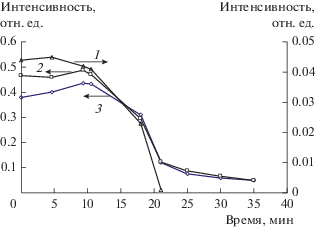
На рис. 2а и 2б приведены температурные зависимости интенсивностей полос поглощения и концентрации этанола и продуктов его превращения на медьсодержащем катализаторе.
Рис. 2.
Зависимости от температуры: а – интенсивностей полос поглощения при 1057 (1), 106 (2), 1152 (3), 1440 (4), 1560 (5) см–1; б – концентраций продуктов превращения этанола: H2 (1), CO2 (2), ацетона (3), ацетальдегида CH3–CH=O (4), CO (4), бутена (5), толуола (6), этилена (7); в – веса образца 5% Cu/ZrO2, измеренного в процессе реакции.

Из рис. 2б видно, что образование Н2, СО2 и ацетона (кривые 1, 2, 3) наблюдается при Т > 200°С и проходит через максимум в области 300–350°С. Появление ацетальдегида в продуктах отмечается при 150°С, на графике зависимости его концентрации от температуры (кривая 4) также имеется максимум при ~240°С. При Т > 280°С обнаружены следовые количества бутена и толуола (кривые 5, 6). При температуре около 350°С начинается образование этилена (кривая 7). Таким образом, выше 400°С основным продуктом реакции является Н2 с примесью этилена.
На рис. 2в приведена зависимость веса образца, измеренного в условиях реакции, от температуры. Важно отметить, что увеличение и последующее снижение веса катализатора происходит в области температур 170–350°С. Именно в этом интервале наблюдается образование тяжелых продуктов.
На рис. 2а показано, как влияет температура на интенсивности п. п. поверхностных соединений. Видно, что уменьшение интенсивности п. п. этоксигрупп (кривые 1–3) сопровождается возрастанием и последующим падением интенсивности п. п. ацетатных комплексов (кривые 5, 6). В свою очередь снижению интенсивности п. п. этоксигрупп и ацетатных комплексов соответствует десорбция продуктов реакции. Отметим, что описанные изменения происходят в том же температурном интервале, что и изменения веса образца.
Сложная форма п. п. ацетатных комплексов (рис. 1, кривые 2–4) не исключает наличия на поверхности катализатора CuО/ZrO2 формиатных, карбонатных комплексов или продуктов уплотнения.
Нестационарные измерения
После установления стационарных значений концентрации поверхностных соединений (в потоке 7% этанола в гелии) и исключения этанола из реакционной смеси осуществляли изотермическую десорбцию поверхностных соединений в потоках Не или смеси Не и паров воды. По ИК-спектрам следили за интенсивностями п. п. ацетатных комплексов, а также мостиковой и линейной этоксигрупп. На рис. 3 приведены результаты опыта при 300°С. При этой температуре этоксигруппам соответствует слабое поглощение в области 1097–1025 см–1. С увеличением времени опыта скорость падения интенсивности п. п. ацетатных комплексов возрастает. Отметим, что, в отличие от катализатора CuО/CeO2, для образца 5% CuO/ZrO2 по мере снижения интенсивности п. п. ацетатных комплексов появления п. п. формиатных комплексов не обнаружено.
Рис. 3.
ИК-спектры образца 5% Cu/ZrO2, полученные в условиях переключения потока этанола (7 об. % в He) на поток He в нестационарном опыте при 300°С при различном времени пропускания He: спектр в этаноле (1) и спектры через 4 (2), 8 (3), 18 (4) и 25 мин (5) после переключения потока.

На рис. 4 приведены результаты обработки данных спектрокинетического опыта при 300°С. Видно, что при этой температуре концентрация ацетатных комплексов начинает уменьшаться только тогда, когда концентрация этоксигрупп на поверхности катализатора 5% CuO/ZrO2 становится пренебрежимо мала. Отличия от результатов аналогичного исследования на CuО/CeO2 заключаются как в составе поверхностных комплексов (отсутствует формиатный комплекс), так и в составе продуктов (практически нет водорода и СО) Кинетические закономерности превращения этоксигрупп и ацетатных комплексов на CuО/CeO2 и CuO/ZrO2 качественно похожи; различаются скорости их превращения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Модель активной поверхности
При исследовании образца 5% CuО/ZrO2 методом ТПВ-Н2 [15] было обнаружено по крайней мере три разных состояния оксида меди с температурами восстановления 140, 190 и 210°С. Высокотемпературное состояние на основе данных РФА идентифицируется определяется как фаза CuO. Результаты ТПВ-Н2 свидетельствуют также об отсутствии растворения CuO в объеме ZrО2. Эти факты и литературные данные [16, 17] позволяют отнести низкотемпературные состояния CuO к кластерам, отличающимся размерами и локализованным, по-видимому, на разных плоскостях кристаллитов ZrО2.
В электронных спектрах диффузного отражения образца 5% CuО/ZrО2 [18] имеются полоса переноса заряда при 36 360 см–1 и полосы d–d-переходов при 12500 (2B1g → 2B2g и 2B1g → 2Eg) и 5200 см–1 (2B1g → 2A1g). В соответствии с [19] такой спектр принадлежит высокодисперсным ионам Cu2+ в октаэдрической координации с тетрагональным искажением (крупные частицы оксида меди из-за обменных взаимодействий методом ЭСДО не наблюдаются). Похожие результаты получены при проведении ТПВ-Н2 образца 5% CuO, нанесенного на t-ZrO2 [16, 20].
Адсорбция тест-молекулы СО [21] показывает образование на поверхности двух типов карбонильных (Cu+–CO) комплексов. Карбонильный комплекс с частотой 2120 см–1 образован на Cu+ в координации тетрагональной пирамиды [22]. Естественно полагать, что такая координация может реализоваться в объемных кластерах относительно большого размера. Отметим, что карбонильный комплекс этого типа слабо связан с поверхностью – максимальная скорость десорбции наблюдается при 100°С.
Карбонильный комплекс с частотой 2110 см–1 образован с участием Cu+ в координации “плоский квадрат” [22]. Можно полагать, что такая координация может существовать в плоских кластерах небольшого размера. Связь этого типа карбонильного комплекса с поверхностью значительно прочнее – с максимальной скоростью десорбция протекает при 200°С. Карбонатные комплексы десорбируются в интервале 150–250°С.
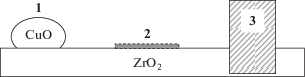
Совокупность приведенных данных позволяет предложить следующую модель активной поверхности:
где 1, 2 – кластеры CuO разного размера, 3 – частица фазы CuO.
Факт образования Cu+ может быть объяснен тем, что в присутствии СО уже при 40°С происходит восстановление ионов меди. Легкость восстановления обусловлена, очевидно, тем, что в координационное окружение иона Cu2+ входят анионные вакансии [19], заполненные активными формами кислорода.
Различие в природе медных центров на оксиде церия и циркония связано, прежде всего, со способностью CeO2 растворять в себе оксид меди. Это обстоятельство приводит к активации объемного кислорода, в результате чего прочность связи карбонильных и карбонатных комплексов с поверхностью CeO2 меньше, чем с поверхностью ZrO2.
Превращение поверхностных соединений
Этоксигруппы. Образование линейных и мостиковых этоксигрупп при взаимодействии этанола с поверхностью ZrО2 происходит с участием, соответственно, терминальных и мостиковых гидроксильных групп поверхности [18]. При этом формирование этоксигрупп может сопровождаться разрывом как связи О–Н, так и связи С–О в молекуле спирта в зависимости от основности или кислотности гидроксильных групп.
Согласно литературным сведениям при изучении гидроксильного покрова оксида циркония были обнаружены гидроксильные группы первого и третьего типа [23]. Соответственно, при адсорбции метанола и этанола в работах [23, 24] наблюдали метоксигруппы и этоксигруппы двух типов. Полученная нами информация об образовании этоксигрупп при адсорбции этанола на ZrO2 и CuO/ZrO2 практически совпадают с данными, приведенными в работе [25], где три типа этоксигрупп были отнесены к линейной и мостиковой формам. Отличия в спектральных проявлениях связаны, по-видимому, с различными способами приготовления образцов, которые приводят к тому, что поверхность кристаллитов заканчивается разными гранями [26].
Ацетатные комплексы. В ИК-спектрах, записанных в условиях реакции на 5% CuО/ZrО2 (рис. 1), наблюдаются п. п. при 1550, 1440 и 1340 см–1, принадлежащие колебаниям в поверхностных ацетатных комплексах. Падение интенсивности п. п. этоксигрупп с температурой (рис. 2а) сопровождается ростом интенсивности п. п. ацетатов. Этот факт позволяет предполагать, что источником образования ацетатов являются этоксигруппы.
Еще одним доказательством вышеуказанного предположения служат данные по зависимости интенсивностей п. п. ацетатов и этоксигрупп от времени в опытах по изотермической десорбции поверхностных соединений при 300°С (рис. 4). Видно, что интенсивность п. п. ацетатов (кривая 4) остается практически неизменной до тех пор, пока не израсходуются все этоксигруппы (кривые 1, 2). Такое возможно, если убыль ацетатов, заполняющих все отведенные для них места, постоянно пополняется за счет превращения этоксигрупп. Местом локализации этоксигрупп с большой вероятностью являются активные центры на поверхности носителя, поскольку интенсивность полос поглощения и их частоты практически одинаковы и на носителе, и на катализаторе.
Продукты уплотнения. Интенсивность п. п. ацетатных комплексов при 250°С соответствует заполнению поверхности катализатора больше монослойного. Такой факт является серьезным признаком наличия продуктов уплотнения. Источниками образования продуктов уплотнения могут быть все перечисленные выше поверхностные комплексы, а ключевую роль играют, скорее всего, этоксигруппы, поскольку формирование ПУ прекращается при отсутствии этоксигрупп на поверхности (рис. 2а, 2в). ИК-спектральный анализ, проведенный в [10, 27] показал, что в составе ПУ имеются сопряженные двойные связи (около 1600 см–1), связи C–H и C–O (1550–1380 см–1), а также ацетатные комплексы.
Образование продуктов
Ацетальдегид. Концентрация ацетальдегида при повышении температуры проходит через максимум (рис. 2б, кривая 4). Такой вид зависимости можно объяснить тем, что ацетальдегид образуется из этоксигрупп при участии гидроксильных групп, концентрация которых с температурой падает. Подтверждает такой механизм и тот факт, что выделение ацетальдегида сопровождается образованием такого же количества водорода (рис. 2б, кривая 1):
Ацетон, бутен, толуол. Как следует из данных рис. 2, ацетон, бутен и толуол в присутствии этанола в газовой фазе образуются в результате превращения продуктов уплотнения. Выше упоминалось, что подходящие “заготовки” в составе ПУ для этого есть. Детальный механизм превращения ПУ требует дальнейшего изучения. Отметим, что в литературе появление этих сложных продуктов описывается с помощью сложных схем без учета возможного существования на поверхности ПУ [13].
Водород, СО2. Зависимость концентрации водорода от температуры характеризуется двухпиковой картиной (рис. 2, кривая 1). Низкотемпературный пик соответствует стехиометрии реакции образования ацетальдегида. Высокотемпературный пик (при практически полном отсутствии на поверхности CuO/ZrO2 формиатных комплексов) – относится к образованию водорода в результате рекомбинации на кластерах меди атомов водорода, появляющихся в стадиях превращения поверхностных комплексов. Схема превращения поверхностных комплексов, в которых участвуют атомы водорода, обсуждается в [10].
Основным источником образования СО2 является, по-видимому, разложение ацетатного комплекса с выделением в качестве побочного продукта этилена.
Сравнение катализаторов 5% CuO/ZrO2 и 5% CuО/CeO2
Различие в природе медных центров на оксидах церия и циркония связано, прежде всего, со способностью CeO2 растворять в себе оксид меди. Это обстоятельство приводит к активации объемного кислорода, в результате чего прочность связи карбонильных и карбонатных комплексов с поверхностью CeO2 меньше, чем с поверхностью ZrO2.
Отметим также, что по той же причине связь ацетатных комплексов с поверхностью 5% CuО/ZrO2 значительно прочнее, чем с поверхностью катализатора на основе CeO2 [10], что в совокупности с максимальным заполнением поверхности ацетатами препятствует, по-видимому, образованию формиатных комплексов.
Отсутствие формиатных комплексов на поверхности 5% CuО/ZrO2 приводит к изменению состава продуктов. Положительным с точки зрения получения водорода для топливных элементов является то, что в составе продуктов нет СО. Отрицательным – малая концентрация водорода, снижающаяся к тому же с повышением температуры реакции.
ПУ на обоих катализаторах формируются в одном и том же температурном интервале. Это означает, что решающую роль в их образовании играют свойства активного компонента, но не носителя. Различия в природе активного компонента в составе 5% CuO/ZrO2 и 5% CuO/СеO2 меняют свойства ПУ и, соответственно, состав продуктов, получающихcя при превращении этанола [10].
Результаты исследования показывают, что перспективным может быть применение катализаторов на основе смешанных церий-циркониевых носителей. Можно надеяться, что в нем будут сочетаться положительные качества CuO/СеO2 – высокий выход водорода – и CuO/ZrO2 – отсутствие СО в составе продуктов.
ЗАКЛЮЧЕНИЕ
В условиях превращения этанола на поверхности катализатора 5% CuO/ZrO2 присутствуют этоксигруппы, ацетатные комплексы, а также продукты уплотнения. Формиатные комплексы обнаружены не были. В низкотемпературной области образование ацетальдегида связано со взаимодействием этоксигрупп и гидроксильных групп поверхности. Ацетон, бутадиен и толуол появляются в результате превращения ПУ. Малая скорость образования водорода на этом образце связана с отсутствием на поверхности катализатора высокотемпературной формы формиатного комплекса.
Список литературы
Idriss H., Diagne C., Hindermann J.P., Kiennemann A., Barteau M.A. // J. Catal. 1995. V. 155. P. 219.
Idriss H., Kim K.S., Barteau M.A. // J. Catal. 1993. V. 139. P. 119.
Madhavaram H., Idriss H. // J. Catal. 1999. V. 184. P. 553.
Ye J., Wang Y., Liu Y. // J. Rare Earths. 2008. V. 26. P. 831.
Shekhar R., Barteau M.A., Plank R.V., Vohs J.M. // J. Phys. Chem. 1997. V. 101. P. 7939.
Boujana S., Demri D., Cressely J., Kiennemann A., Hindermann J.P. // Catal. Lett. 1990. V. 7. P. 359.
Kiennemann A., Idriss H., Kieffer R., Chaumette P., Durand D. // Ind. Eng. Chem. Res. Dev. 1991. V. 30. P. 1130.
McCabe R.W., Mitchell P.J. // Ind. Eng. Chem. Res. Dev. 1984. V. 23. P. 196.
Idriss H., Libby M., Barteau M.A. // Catal. Lett. 1992. V. 15. P. 13.
Матышак В.А, Сильченкова О.Н., Бычков В.Ю., Тюленин Ю.П., Корчак В.Н. // Кинетика и катализ. 2018. Т. 59. С. 323.
Chuah G.K. // Catal. Today. 1999. V. 49. P. 131.
Matyshak V.A., Krylov O.V. // Catal. Today. 1996. V. 25. P. 1.
Yee A., Morrison S.J., Idriss H. // J. Catal. 1999. V. 186. P. 279.
Лабаки М., Ламонье Ж.-Ф., Сиффер Т. // Кинетика и катализ. 2004. Т. 45. № 2. С. 245.
Фирсова А.А., Хоменко Т.И., Сильченкова О.Н., Корчак В.Н. // Кинетика и катализ. 2010. Т. 51. С. 317.
Freitas I.C., Damyanova S., Oliveira D.C., Marques C.M.P., Bueno J.M.C. // J. Mol. Catal. A: Chem. 2014. V. 381. P. 26.
Wang L.-C., Liu Q., Chen M., Liu Y.-M, Cao Y., He H.-Y., Fan K.-N. // J. Phys. Chem. C. 2007. V. 111. P. 16 549.
Матышак В.А., Сильченкова О.Н., Исмаилов И.Т., Третьяков В.Ф. // Кинетика и катализ. 2010. Т. 51. С. 447.
Шинкаренко В.Г. Дисс. … канд. хим. наук. Институт катализа СО РАН. Новосибирск, 1978.
Dow W.-P., Wang Y.-P., Huang T.-J. // J. Catal. 1996. V. 160. P. 155.
Ильичев А.Н., Шашкин Д.П., Матышак В.А., Корчак В.Н. // Кинетика и катализ. 2015. Т. 56. С. 198.
Давыдов А.А. ИК-спектроскопия в химии поверхности окислов. Новосибирск: Наука, 1984. 241 с.
Alekseev A.V., Lopatin Yu.N., Tsyganenko A.A., Filimonov V.N. // React. Kinet. Catal. Lett. 1974. V. 1. P. 443.
Bensitel M., Moravek V., Lamotte J., Saur O., Lavalley J.-C. // Spectrochim. Acta. 1987. V. 43A. № 12. P. 1487.
Hussein G.A.M., Sheppard N., Zaki M.I., Fahim R.B. // J. Chem. Soc. Faraday Trans. 1991. V. 87. № 16. P. 2661.
Кузнецова Т.Г., Садыков В.А. // Кинетика и катализ. 2008. Т. 49. С. 886.
Лисовский А.В. Каталитическое окислительное дегидрирование алкилароматических углеводородов. Дисс. … докт. хим. наук. Новосибирск, 1978.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ