Кинетика и катализ, 2020, T. 61, № 4, стр. 504-508
Моделирование влияния адсорбированных на поверхности реактора ионов галогенов в комплексе с-молекулами воды на процессы цепного окисления пропана
Г. Н. Саргсян a, *, А. Б. Арутюнян a
a Институт химической физики им. А.Б. Налбандяна НАН Республики Армения
0014 Ереван, ул. П. Севака, 5/2, Армения
* E-mail: garnik@ichph.sci.am
Поступила в редакцию 04.10.2019
После доработки 19.02.2020
Принята к публикации 05.03.2020
Аннотация
Исследовано моделирование влияния очагов полярных частиц, в частности адсорбированных на поверхности реактора ионов галогенов, а также присутствующих в порах и микротрещинах поверхности реактора молекул воды на процесс низкотемпературного окисления водорода и органических соединений. В рамках предложенной модели соответствующими расчетами показано, что наличие указанных частиц в приповерхностном слое способствует превращению молекул H2O2 (промежуточного продукта реакций окисления водорода и органических соединений) в молекулы озона. Присутствие молекул озона в реакционной системе может вызывать изменение механизма химических превращений и теплового режима развития цепного процесса, в частности появление пульсационного режима течения процесса или возникновение вспышек в реакторе в связи с резкими колебаниями температуры. Объяснены наблюдаемые в экспериментах пульсационные изменения излучения реакционной среды при окислении пропана в условиях повышения давления в реакторе.
ВВЕДЕНИЕ
Известно, что молекулы воды, образующиеся в реакциях окисления водорода и органических соединений, могут адсорбироваться на поверхности реактора и, попадая в микропоры и трещины, присутствующие на поверхности, часто превращаются в капли воды, устойчиво удерживаемые поверхностными силами даже при глубоком вакууме и высоких температурах [1, 2].
Присутствие ионов галогенов на поверхности реакторов, как правило, обусловлено распространенным при исследовании цепных радикальных реакций подходом, состоящем в обработке поверхности реакторов различными солями, включая галогениды [3, 4]. Очевидно, что одновременное присутствие на поверхности воды и соли галогенида приведет в результате диссоциации к появлению катионов металлов и анионов галогенов, а также к образованию соответствующих комплексов с молекулами воды. Эти трансформации могут способствовать переносу заряда, в результате чего на поверхности реактора могут образоваться активные центры, влияющие на механизм протекающих химических превращений.
Данная работа посвящена моделированию влияния очагов полярных частиц (адсорбированных на поверхности реактора анионов галогенов (например, хлора) и молекул воды) на процессы низкотемпературного окисления органических соединений с учетом возможности превращения промежуточного продукта окисления этих соединений – пероксида водорода – в молекулу озона.
ОБРАЗОВАНИЕ КОМПЛЕКСА ВОДА–ОТРИЦАТЕЛЬНЫЙ ИОН ГАЛОГЕНА (АНИОН ХЛОРА) НА ПОВЕРХНОСТИ
С использованием программы ChemBio 12.0 было получено изображение комплекса, состоящего из аниона хлора и молекулы воды (врезка на схеме 1 ), а также получено следующее распределение заряда в нем (Mulliken atomic charges): O – –0.776275, H(1) – +0.359779, H(2) – +0.359878, Cl – –0.943382. Значение дипольного момента этого комплекса, рассчитанное по программе Gaussian 09W методом DFT на базе волновых функций 6-31G, составляет 2.12 D.
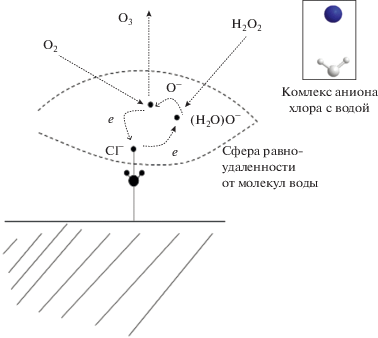
Такой комплекс аниона хлора с молекулой воды, сосредоточенный на поверхности реактора, может стать активным центром, если анион хлора способен отдать лишний электрон объемным частицам при их столкновении, а также захватить его обратно путем перезарядки. Благодаря этим трансформациям в приповерхностном слое становится возможным протекание ионно-молекулярных реакций, что, в свою очередь, приводит к изменению состава реакционной смеси.
Схема 1 . Трансформации, протекающие в приповерхностном слое с участием комплекса вода–анион хлора.
ТРАНСФОРМАЦИИ, ПРОТЕКАЮЩИЕ С УЧАСТИЕМ АНИОНА ХЛОРА, МОЛЕКУЛ О2 И H2O2 ПРИ НИЗКОТЕМПЕРАТУРНОМ ОКИСЛЕНИИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Для перехода электрона от аниона хлора, зафиксированного в приповерхностном слое, к другой частице из объема реактора (в частности, к пероксиду водорода – промежуточному продукту рассматриваемых реакций окисления) необходима дополнительная энергия. При столкновении молекулы пероксида водорода с анионом хлора (схема 1 ) перенос заряда может происходить в случае, если отрицательные ионы этих частиц обладают одинаковой энергией и находятся примерно на равной удаленности от молекул воды, удерживающих ион.
Рассмотрим обоснование возможности превращения молекулы пероксида водорода в отрицательный ион при столкновении с комплексом вода–анион хлора. Важной особенностью этого процесса является то, что после захвата электрона анион пероксида меняет свою структуру, превращаясь в комплекс, состоящий из молекулы воды и аниона кислорода [5]: (H2O2)– → (H2O)О–. С помощью несложных расчетов оценивается величина сродства молекулы пероксида водорода $A_{{\text{e}}}^{{{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}$ к электрону как алгебраическая сумма трех величин: энергии связи двух атомов кислорода в молекуле H2O2, равной 2.1 эВ [6], сродства атома кислорода к электрону, равное 1.46 эВ [7], а также энергии взаимодействия молекулы воды с ионом кислорода (–0.54 эВ) на расстоянии столкновения 3.2 Å, вычисленных с помощью программного комплекса ChemBio 12.0:
Такое же значение сродства к электрону для молекулы пероксида водорода было получено в работе [8].
Очевидно, что перенос заряда от отрицательного иона к другой частице произойдет, если его сродство к электрону меньше, чем у нейтральной частицы – партнера по столкновению. Так как в данном случае сродство к электрону у атома хлора ($A_{{\text{e}}}^{{{\text{Cl}}}}$ = 3.62 эВ [7]) выше, чем у молекулы пероксида водорода ($A_{{\text{e}}}^{{{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}$ = 3.02 эВ), то такой процесс невозможен при низких энергиях столкновения. Однако, как отмечалось выше, анион хлора в рассматриваемой системе присутствует в комплексе с молекулой воды, которая, благодаря большому значению дипольного момента, уменьшает прочность связи электрона с атомом хлора.
Оценку величины энергии взаимодействия (Е) одной молекулы воды с электроном можно проводить в приближении точечного диполя и точечного заряда аналогично формуле взаимодействия зарядов:
где r – расстояние между взаимодействующими частицами, d – дипольный момент молекулы воды, e – заряд электрона.Для усредненного значения величины r = 3.2 Å по формуле (1) величина энергии E получается равной ~0.613 эВ. Следовательно, прочность связи хлора с электроном уменьшается на эту величину (3.62 эВ – 0.613 эВ = 3.007 эВ). Полученное значение сопоставимо с приведенной выше величиной сродства молекулы H2O2 к электрону (3.02 эВ). Таким образом, при столкновении молекулы H2O2 с комплексом вода–анион хлора возможен переход электрона к молекуле пероксида водорода. В случае комплексов молекулы воды с другими наиболее часто применяемыми галогенами (бром или йод) процесс переноса заряда произойдет легче, поскольку у этих галогенов сродство к электрону меньше ($A_{{\text{e}}}^{{{\text{Br}}}}$ = 3.37 эВ, $A_{{\text{e}}}^{{\text{I}}}$ = 3.06 эВ [7]).
Процесс переноса заряда по суммарной реакции
Схема 2 . Перенос электрона от иона хлора к пероксиду водорода.
Для оценки величины сечения акта переноса электрона, приводящий к появлению комплексного иона (H2O)O–, можно воспользоваться известной формулой, полученной для расчета константы скорости ионных процессов по механизму кручения [9]:
(2)
$k = {\text{ }}2\pi {{\left( {{{\alpha {{e}^{2}}} \mathord{\left/ {\vphantom {{\alpha {{e}^{2}}} M}} \right. \kern-0em} M}} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{c}_{{\text{r}}}},$Следующий этап изображенных на схеме 1 трансформаций – это ионно-молекулярная реакция
Схема 3 . Образование комплекса, содержащего ион озона.
На следующем этапе трансформаций происходит перенос заряда от аниона озона к атому хлора с восстановлением первоначального активного центра комплекса вода–анион хлора на поверхности (схема 4 ):
Рассчитанная по формуле (2) величина константы скорости этого превращения составляет k3 ≈ 10–10 см3 молекула–1 с–1.
Схема 4 . Перенос электрона с образованием нейтральной молекулы озона в комплексе.
Исследование поведения комплекса, образованного после описанного акта перезарядки, в условиях протекания реальных химических превращений в реакторе (Т ≈ 600 К) в рамках программы ChemBio 12.0 показывает, что комплекс легко распадается на отдельные нейтральные молекулы – воду и озон.
ОБЪЯСНЕНИЕ ЭКСПЕРИМЕНТАЛЬНО НАБЛЮДАЕМЫХ ВСПЫШЕК В РЕАКТОРАХ ПРИ ЦЕПНОМ ОКИСЛЕНИИ УГЛЕВОДОРОДОВ
Представляло интерес оценить количество молекул озона, образующихся в приповерхностном слое реактора по приведенному выше механизму. Рассчитаем количество молекул озона, генерируемых активными центрами на поверхности за одну секунду. Учитывая, что лимитирующей стадией будет ионно-молекулярная реакция (H2O)O– + + O2 → ${\text{(}}{{{\text{H}}}_{2}}{\text{O}}){\text{O}}_{3}^{ - }$ с наименьшей константой скорости по сравнению с остальными каналами (k2 ≈ ≈10–11 см3 молекула–1 с–1 [9]) и что согласно приведенным выше данным k2 < k1 и k2 < k3, для оценки концентрации образующегося озона используем эту величину. При условии, что ионами комплекса (H2O)O– занято порядка 1014 адсорбционных центров на поверхности [10], за секунду эти активные центры будут генерировать 3 × 10–10 × 5 × 1015 × × 1014 ≈ 1.5 × 1020 частица (H2O)O–/см3 (где константа скорости перезарядки k1 ≈ 3 × 10–10 см3 молекула–1 с–1 получена по формуле (2), а концентрация пероксида водорода в реакторе составляет 5 × 1015 молекула/см3 [4]).
Если считать, что основным каналом расходования ионов (H2O)O– является реакция с молекулами кислорода, то простая оценка показывает, что количество озона, образующееся за секунду, равно равновесной концентрации ионов (H2O)O–, т.е. приблизительно 1.5 × 1020 частица/см3. Учитывая, что образовавшийся на поверхности озон реагирует с основным углеводородом в реакторе (в данном случае с пропаном), рассчитаем локальный прирост температуры на активных центрах, где присутствуют комплексы вода–анион хлора.
Для расчета прироста температуры воспользуемся формулой для идеального газа:
где Q – энергия, выделяемая в единице объема; T – конечная температура после израсходования озона; T0 – начальная температура в системе; m – масса газа в единице объема; c – изобарная теплоемкость газовой смеси.Поскольку в экспериментах по окислению пропана наблюдаемые времена вспышек меняются в пределах 0.003 с [11–13], то расход озона за это время составит 0.003 × 1.5 × 1020 = 4.5 × 1017 молекула/см3. Соответственно, при условиях, что за время вспышки 0.003 с расходуется именно такое количество озона, а в реакциях с органическими молекулами на одну молекулу озона выделяется ~3.63 эВ энергии [14], расчет по формуле (3) дает значение прироста температуры приблизительно 1600 К (условия эксперимента: давление 100 Торр, состав смеси пропан : воздух (50 : 50, %), где концентрация кислорода составляет 3.5 × 1017 молекула/см3).
Расчетным путем нетрудно показать, что за время вспышки 0.003 с выделяемое тепло не успевает уйти через стенки реактора и практически полностью расходуется на подогрев газовой смеси.
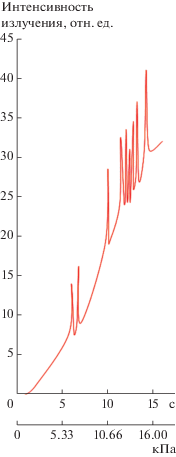
Таким образом, наблюдаемый в экспериментах [11–13] пульсационный характер излучения реакции окисления пропана (рис. 1) можно объяснить полным выгоранием горючего (пропана) и диффузионным затруднением его подачи в зону выгорания. Отметим, что окисление пропана изучалось в проточном режиме в условиях непрерывного повышения давления в реакторе, а инициирование реакции осуществлялось в статических условиях. После инициирования сразу подавались реагенты и включалось вакуумирование, причем скорость подачи реагентов превосходила скорость вакуумирования, что приводило к постепенному повышению давления в реакторе. Продолжение приведенной на рис. 1 пульсационной картины развития процесса связано с тем, что в изученных экспериментальных условиях реактор непрерывно заполнялся горючей смесью.
ЗАКЛЮЧЕНИЕ
Развитые нами представления позволяют найти обоснованную интерпретацию изменениям механизма и теплового характера развития цепных реакций окисления водорода и органических соединений в реакторах, поверхности которых обработаны или загрязнены солями галогенидов металлов. При этом решающую роль играют полярные и заряженные центры (комплексы молекул воды с анионами галогенов), адсорбированные на поверхности реакторов. Проведенные расчеты показали, что резонансная перезарядка по схеме H 2O2 + (H2O)Clˉ → (H2O)O– + (H2O)Cl увеличивает вероятность протекания ионно-молекулярной реакции (H2O)O– + О2 → (H2O)${\text{O}}_{3}^{ - }$, которая через канал резонансной перезарядки (H2O)${\text{O}}_{3}^{ - }$ + + (H2O)Cl → (H2O)Clˉ + O3 приводит к образованию молекул озона в приповерхностном слое.
Основываясь на известных литературных данных по константам скоростей приведенных ионных реакций, эти трансформации можно принять за виртуальные стадии брутто-процесса H2O2 + О2+ + ${\text{Cl}}_{{{\text{ад}}}}^{ - }$ → H2O + O3 + ${\text{Cl}}_{{{\text{ад}}}}^{ - }$.
Образование и дальнейшие реакции (а также распад) озона на поверхности реактора могут привести к вспышкам или воспламенению реакционной смеси, что часто экспериментально наблюдается на начальных стадиях процессов окисления водорода и органических соединений.
Список литературы
Адамсон А. Физическая химия поверхностей. М.: Мир, 1979. 568 с.
Pomeau Y., Villermaux E. // Physics Today. 2006. V. 59. № 3. P. 39.
Artsruni G.K., Beybutyan M.A., Nalbandyan A.B. // Oxid. Commun. 1983. V. 5. № 1–2. P. 225.
Варданян И.А. // Доклады НАН РА. 2017. Т. 117. № 2. С. 162.
Вирин Л.И., Джагацпанян Р.В., Караченцев Г.В., Потапов В.К., Тальрозе В.Л. Ион-молекулярные реакции в газах. М.: Наука, 1979. 548 с.
Гуревич Л.Б. Энергия разрыва химических связей. Потенциалы ионизации и сродство к электрону. М.: Наука, 1974. 351 с.
Физические величины. Справ. / Под ред. Григорьева И.С., Мейлихова Е.З. М.: Энергоатомиздат, 1991. 1232 с.
Muschlitz E.E., Bailey T.L. // J. Phys. Chem. 1956. V. 60. № 5. P. 681.
Месси Г. Отрицательные ионы. М.: Мир, 1979. 754 с.
Боровенская Т.С., Яблонский Г.С., Сазонов Л.А., Артамонов Е.В., Быков В.И. Химреактор-5. Тез. докл. 1974. Т. 1. С. 48.
Штерн В.Я. Механизм окисления углеводородов в газовой фазе. М.: Изд-во АН СССР, 1960. 497 с.
Саргсян Г.Н. // Журн. физ. химии. 2009. Т. 83. № 10. С. 1896.
Саргсян Г.Н. // Журн. физ. химии. 2012. Т. 86. № 11. С. 1871.
Химия плазмы. Сб. ст. Вып. 4 / Под ред. Смирнова Б.М. М.: Атомиздат, 1977. 224 с.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ