Кинетика и катализ, 2020, T. 61, № 4, стр. 568-576
Окисление поверхности высоко ориентированного пиролитического графита (ВОПГ) диоксидом азота при комнатной температуре в присутствии частиц нанесенного палладия
М. Ю. Смирнов a, *, А. В. Калинкин a, А. М. Сорокин a, В. И. Бухтияров a
a ФГБУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
* E-mail: smirnov@catalysis.ru
Поступила в редакцию 13.01.2020
После доработки 12.02.2020
Принята к публикации 14.02.2020
Аннотация
Методом рентгеновской фотоэлектронной спектроскопии (РФЭС) исследовано взаимодействие наночастиц палладия (средний размер ~3 нм), нанесенных на поверхность высоко ориентированного пиролитического графита (ВОПГ), с диоксидом азота при комнатной температуре и давлении 10–6 и 10–5 мбар. Показано, что в этих условиях происходит разрушение структуры нескольких поверхностных графеновых слоев, которое обусловлено окислением углерода в местах контакта Pd и ВОПГ. Реакция протекает при участии атомов кислорода, которые образуются в результате диссоциации молекул NO2 на поверхности палладия. Частицы палладия сохраняют металлическую природу, но при этом происходит их внедрение вглубь графита.
ВВЕДЕНИЕ
Активность нанесенных катализаторов на основе палладия в той или иной реакции сильно зависит от состояния окисления металла. В частности, в катализаторах поглощения–восстановления NOx скорость окисления NO в NO2 и дальнейшего превращения последнего в нитраты и нитриты в условиях окислительной среды значительно выше на металлическом палладии, нежели на его оксидах [1]. Восстановление NO2 метаном в присутствии кислорода [2] и разложение оксидов азота на N2 и O2 [3, 4] также более активно протекают на металлическом палладии, тогда как оксиды палладия оказываются активнее металла в реакциях окисления углеводородов с бóльшим, нежели у метана, числом атомов углерода [1, 4]. Сама реакционная среда может влиять на состояние окисления палладия и приводить, таким образом, к изменению активности катализатора [5].
Ранее нами был выполнен ряд работ по исследованию взаимодействия NO2, обладающего сильными окислительными свойствами, с наночастицами платины, золота и серебра, напыленными на высоко ориентированный пиролитический графит (ВОПГ) при комнатной температуре [6–10]. Перед напылением металлов поверхность ВОПГ была предварительно активирована травлением ионами Ar+ в мягких условиях [11, 12]. Взаимодействие с NO2 приводило к окислению частиц металла с образованием оксидов Pt(II) и Pt(IV) [6, 8, 9], Au(III) [7] и Ag(I) [10]. Чем меньше был размер частиц металла, тем легче происходило его окисление [6].
При взаимодействии каталитических систем с NO2 при комнатной температуре также наблюдалось образование поверхностных кислородных соединений на самом носителе (ВОПГ), по-видимому, локализованных в области контакта графита с частицами металла [6, 7, 9, 10]. В этой связи исследование взаимодействия NO2 с системами, содержащими металл на поверхности углеродного носителя (ВОПГ), может представлять интерес для осуществления регенерации зауглероженных катализаторов, а также для создания катализаторов окисления сажи, образующейся при работе дизельных двигателей. Во втором случае применение диоксида азота оправдано тем, что он может изначально входить в состав дизельного выхлопного газа (~5% от общего количества оксидов азота [13]) или целенаправленно быть в нем получен [14]. В настоящей работе с помощью метода рентгеновской фотоэлектронной спектроскопии (РФЭС) изучено взаимодействие NO2 с частицами палладия, нанесенными на активированную поверхность ВОПГ, в условиях, сопоставимых с использованными в работах [6–10] (комнатная температура, давление 10–6, 10–5 мбар). Интерес к системе Pd/ВОПГ вызван также широким применением нанесенного на углерод палладия для проведении реакций селективного гидрирования [15, 16], восстановительного дегалогенирования [17], реакции Хека (the Heck reaction) [15, 18], а также для процессов электрохимического окисления в топливных элементах [19–22].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для регистрации РФЭ-спектров был использован спектрометр SPECS (Германия), снабженный 9-канальным детектором и анализатором PHOIBOS-150. Фотоэмиссию возбуждали немонохроматизированным излучением AlKα с энергией квантов hν = 1486.6 эВ. Перед проведением измерений спектрометр калибровали по линиям Au4f7/2 и Cu2p3/2, энергии связи (Eсв) которых для фольг соответствующих металлов равны 84.0 и 932.7 эВ. Принимая во внимание хорошую проводимость графита, измерение Eсв осуществляли без корректировки на возможную зарядку образцов. В исходном образце ВОПГ энергия связи линии C1s составляла 284.4 эВ, что находится в соответствии с литературными данными [23–30]. Спектры снимали при двух значениях угла сбора фотоэлектронов относительно нормали к поверхности – 0° и 45°. Анализ спектральных линий с разложением на отдельные компоненты выполняли с помощью программы PeakXPS [31]. Линию фона задавали функцией Ширли.
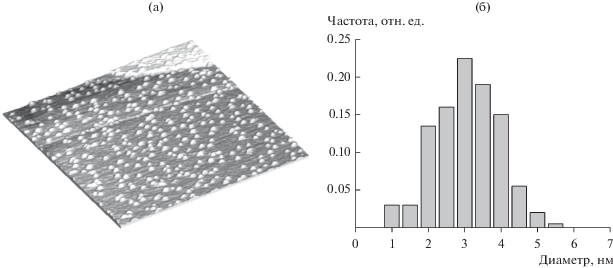
Образцы Pd/ВОПГ получали в камере подготовки РФЭ-спектрометра вакуумным напылением металлического палладия на поверхность ВОПГ, предварительно активированную травлением ионами аргона (кинетическая энергия – 0.5 кэВ, ионный ток – 50 мкА) в течение 10 с по методике, аналогичной примененной ранее для приготовления образцов M/ВОПГ (M = Pt, Au, Ag) [6, 7, 9, 10, 12]. На рис. 1а приведено изображение образца Pd/ВОПГ, полученное на вакуумном сканирующем туннельном микроскопе GPI-300.02 (НПФ “Сигма Скан”, Россия) с использованием платиновой иглы в качестве зонда при напряжении смещения 1 В и туннельном токе 0.3 нА. Видно, что поверхность ВОПГ равномерно покрыта частицами палладия округлой формы. Из гистограммы на рис. 1б следует, что размер частиц варьирует в диапазоне от 1 до 6 нм, а среднее значение составляет 3 нм. Для сравнения, в образцах Pd/ВОПГ, приготовленных в работе [32] с применением аналогичной методики вакуумного напыления на активированную поверхность ВОПГ, частицы металла имели латеральный размер 5.7–6.8 нм и высоту 1.6–1.8 нм. На поверхности ВОПГ, активированной травлением ионами азота (N+ + ${\text{N}}_{2}^{ + }$), были получены частицы палладия размером ~1.5–2 нм [33].
Рис. 1.
СТМ-изображение 200 × 200 нм (а) и распределение по размерам (б) наночастиц палладия на поверхности ВОПГ.
Для обработки образцов Pd/ВОПГ диоксидом азота использовали источник, принцип работы которого основан на термическом разложении нитрата свинца в вакууме [6]. Обработку проводили в камере подготовки РФЭ-спектрометра при комнатной температуре и давлении 10–6 или 10–5 мбар.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
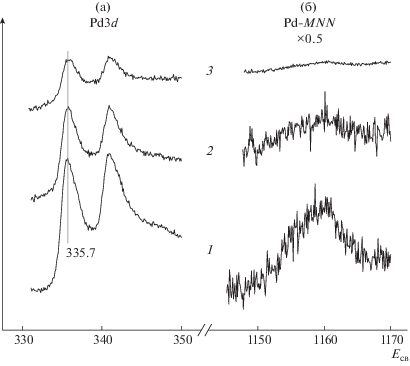
На рис. 2 представлены спектры Pd3d и Pd-MNN образца Pd/ВОПГ до и после взаимодействия с NO2 при комнатной температуре и давлении 10–6 (2) и 10–5 мбар (3) в течение 30 мин. Съемку спектров производили при угле сбора фотоэлектронов 0° относительно нормали к поверхности. В исходном образце энергия связи Есв(Pd3d5/2) составляла 335.6 эВ (1), что соответствует металлическому палладию в нанесенных частицах Pd малого размера [2, 33–35]. Из спектров 2 и 3 видно, что Есв(Pd3d5/2), а также форма фотоэмиссионной линии Pd3d и Оже-линии Pd-MNN после обработки образца в NO2 не меняются. В то же время наблюдается уменьшение интенсивности обеих линий, особенно заметное после взаимодействия при 10–5 мбар; эффект проявляется более существенно для Оже-линии. Причиной снижения абсолютных значений интенсивностей 3d- и MNN-линий палладия может быть: 1) спекание частиц Pd, 2) формирование на их поверхности пленки из инородного материала или 3) внедрение частиц вглубь носителя. В первом случае уменьшение интенсивности обусловлено сокращением числа атомов палладия в зоне анализа метода РФЭС с увеличением размера частиц [36, 37]. В двух других случаях ослабление сигнала палладия вызвано экранировкой фотоэмиссии слоем углеродного материала.
Рис. 2.
РФЭ-спектры в регионе Pd3d (а) и Оже-спектры Pd-MNN (б) образца Pd/ВОПГ до (1) и после взаимодействия с NO2 при комнатной температуре и давлении 10–6 (2) и 10–5 мбар (3) в течение 30 мин.
На рис. 3 представлены спектры, записанные в регионе C1s для исходного ВОПГ (1), ВОПГ после бомбардировки ионами аргона (2) и напыления на него палладия с последующим прогревом при 300°С (3). Также на этом рисунке показаны спектры после взаимодействия полученного образца Pd/ВОПГ с NO2 при комнатной температуре и давлении 10–6 (4) и 10–5 мбар (5). Съемку спектров производили при угле сбора фотоэлектронов 0° относительно нормали к поверхности. На рис. 3а приведены спектры, зарегистрированные в более широком интервале энергий связи, захватывающем наряду с линией C1s характерный для графита поверхностный плазмон при ~291 эВ [24, 25, 27, 30, 33]. Как видно из рис. 3а, после травления исходного ВОПГ ионами Ar+ (2) и последующего напыления палладия (3) интенсивность плазмона остается на исходном уровне. Этот результат противоречит данным работы [33], где травление ионами азота приводило к полному исчезновению плазмона из спектра C1s, что, вероятно, связано с более жесткими условиями травления. В нашем случае интенсивность пика плазмона уменьшается (4) только после взаимодействия с NO2. Практически полное его исчезновение после взаимодействия с NO2 при 10–5 мбар (5) указывает на аморфизацию поверхностного слоя графита, вызванную нарушением дальнего порядка в сопряженной системе π-связанных sp2-гибридных атомов углерода [38, 39].
Рис. 3.
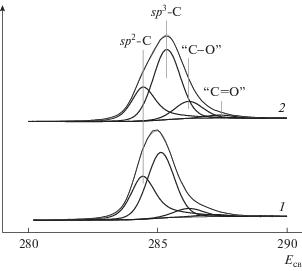
РФЭ-спектры в регионе C1s, записанные для ВОПГ в исходном состоянии (1), после бомбардировки ионами аргона (2), напыления палладия с последующим прогревом при 300°С (3) и после взаимодействия полученного образца Pd/ВОПГ с NO2 при комнатной температуре и давлении 10–6 (4) и 10–5 мбар (5) в течение 30 мин: а – спектры в широком интервале значений энергий связи, включающем область регистрации поверхностного плазмона (∼291 эВ); б – спектры в узком интервале энергий связи с разложением фотоэмиссионной линии C1s на компоненты.
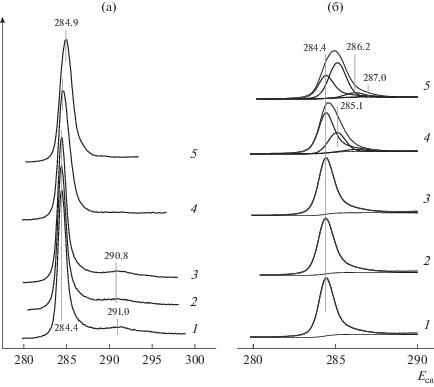
Состояние углерода со степенью гибридизации sp2 в спектре исходного ВОПГ представлено характерным для графита узким асимметричным пиком с энергией связи 284.4 эВ (рис. 3а, кривая 1), [23–25, 30, 40]. После ионного травления и напыления металлического палладия (рис. 3а, кривые 2 и 3) положение пика и его асимметрия сохраняются. Взаимодействие Pd/ВОПГ с NO2 (рис. 3а, кривые 4 и 5) приводит к смещению линии C1s в сторону бóльших энергий связи и ее уширению, что свидетельствует о появлении новых состояний углерода.
Подробнее изменения, происходящие с фотоэмиссионной линией C1s в ходе взаимодействия образца Pd/ВОПГ с NO2, отражены на рис. 3б, где спектры представлены в более узком интервале энергий связи. На основании на литературных данных, опубликованных для графита (ВОПГ), графена и его производных (главным образом для оксида графена), спектры 4 и 5, полученные после взаимодействия Pd/ВОПГ с NO2, были разложены на компоненты, отвечающие sp2-углероду в структуре графита [23–30], sp3-углероду, не связанному с атомами кислорода (связи C–C, C–H) [25, 27, 30, 41], атомам углерода, связанным с кислородом одинарной (C–OH, C–O–C) и двойной связью (C=O) [26, 41–44]. При разложении спектров с помощью программы PeakXPS полагалось, что ширина и параметры асимметрии у компонента, отвечающего sp2-углероду, такие же, как и в спектре исходного ВОПГ. Остальные компоненты, включая sp3-углерод, характеризуются симметричными линиями [45]. Из спектров, представленных на рис. 3б, видно, что взаимодействие с NO2 приводит к существенному ослаблению интенсивности пика sp2-углерода с одновременным усилением интенсивности пиков остальных компонентов. После проведения реакции при давлении 10–6 мбар в спектре 4 появляется пик с энергией связи 285.1 эВ, принадлежащий sp3-углероду, не связанному с кислородом, а также пик при 286.2 эВ от поверхностных соединений с одинарными связями C–O. После реакции при 10–5 мбар (5) за счет дальнейшего уменьшения интенсивности пика sp2-углерода растет интенсивность пика при 286.2 эВ, и дополнительно возникает пик с энергией связи 287.0 эВ, который можно отнести карбонильным соединениям с двойной связью C=O.
Для выделения поверхностных составляющих в РФЭ-спектре было проведено сравнение интенсивностей отдельных линий в спектрах C1s, полученных при разных углах выхода фотоэлектронов. На рис. 4 показаны спектры C1s для образца Pd/ВОПГ, обработанного в NO2 при 10–5 мбар, с регистрацией фотоэлектронов под углами 0° (1) и 45° (2). Видно, что с увеличением угла регистрации вклад в интенсивность линии C1s от пика sp2-углерода уменьшается (от 44 до 31%), и параллельно возрастает вклад от sp3-углерода (от 44 до 53%) и поверхностных соединений COx (от 12 до 16%). Это означает, что процессы, приводящие к разрушению структуры графеновых слоев и образованию COx-соединений, протекают главным образом на поверхности. С учетом длины свободного пробега в углеродных материалах для фотоэлектронов, испускаемых с уровня C1s под действием излучения AlKα (кинетическая энергия ~1202 эВ), λ = 3.31 нм [46], из отношения интенсивностей сигналов от sp2-углерода до и после взаимодействия с NO2 была выполнена оценка толщины разрушенного слоя, которая составила ~3–5 нм, что соответствует ∼10–15 графеновым слоям в структуре графита.
Рис. 4.
Спектры C1s образца Pd/ВОПГ после взаимодействия с NO2 при комнатной температуре и давлении 10–5 мбар с регистрацией фотоэлектронов под углами 0° (1) и 45° (2).
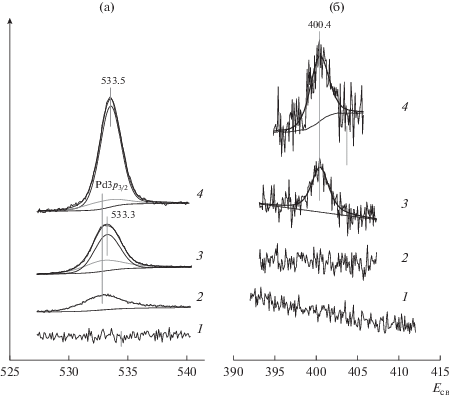
На рис. 5 изображены спектры, записанные в регионах O1s (рис. 5а) и N1s (рис. 5б) для ВОПГ (1) и Pd/ВОПГ до (2) и после обработки в NO2 при 10–6 (3) и 10–5 мбар (4). В спектрах 1 исходного ВОПГ линии кислорода и азота отсутствуют. После напыления палладия (2) в регионе, характерном для O1s, обнаруживается линия Pd3p3/2 с энергией связи 532.8–532.9 эВ. После взаимодействия с NO2 в этой области дополнительно появляется линия O1s с энергией связи ~533.5 эВ (рис. 5а, кривые 3 и 4), а в регионе N1s – линия с энергией связи 400.4 эВ (рис. 5б, кривые 3 и 4). Линия O1s с Есв = 533.5 эВ соответствует атомам кислорода, связанным с атомами углерода одинарными связями в фрагментах C–OH и C–O–C [47–49]. Линия N1s с энергией связи 400.4 эВ отвечает атомам азота, связанным с sp2-углеродом с образованием фрагментов со структурой пиррола [33, 40, 41, 50].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В отличие от наночастиц платины, серебра и золота, нанесенных на активированную ионным травлением поверхность ВОПГ [6–10], взаимодействие NO2 при комнатной температуре с системой Pd/ВОПГ не приводит к окислению частиц палладия. В то же время имеет место существенное уменьшение интенсивности линий, принадлежащих палладию (рис. 2), одной из причин которого может быть спекание частиц Pd. Из спектров, приведенных на рис. 2, следует, что сигнал от Оже-электронов Pd-MNN, обладающих кинетической энергией Eкин ≈ 330 эВ, ослабляется в существенно большей степени, нежели сигнал Pd3d с Eкин ≈ 1150 эВ. Так, отношение интенсивности Оже-линии к интенсивности фотоэмиссионной линии в исходном образце Pd/ВОПГ составляет ${{I}_{{MNN}}}/{{I}_{{3d}}}$ = 1.71, а после обработки в NO2 при 10–6 и 10–5 мбар оно уменьшается до 1.05 и 0.44 соответственно. Особенности изменения интенсивностей линий металла с сильно отличающимися Eкин с увеличением размера частиц этого металла на поверхности носителя проанализированы на примере системы Au/ВОПГ [51]. Было рассмотрено отношение интенсивностей линий Au4f и Au3d3/2, записанных с помощью излучения AgLα и имеющих Eкин ~2900 и ~690 эВ соответственно. Показано, что для частиц нанометрового размера отношение интенсивностей ${{{{I}_{{{\text{Au}}3d}}}} \mathord{\left/ {\vphantom {{{{I}_{{{\text{Au}}3d}}}} {{{I}_{{{\text{Au}}4f}}}}}} \right. \kern-0em} {{{I}_{{{\text{Au}}4f}}}}}$ выше величины такового для массивного золота, но асимптотически стремится к нему с ростом размера частиц.
Вернемся к системе Pd/ВОПГ. Длина свободного пробега в металлическом палладии для электронов, испускаемых с Pd3d-уровня, равна λ3d ≈ 1.55 нм, а для Оже электронов Pd-MNN – λMNN ≈ 0.66 нм [46]. Поскольку λ3d > λMNN, отношение интенсивностей ${{{{I}_{{MNN}}}} \mathord{\left/ {\vphantom {{{{I}_{{MNN}}}} {{{I}_{{3d}}}}}} \right. \kern-0em} {{{I}_{{3d}}}}}$ для частиц палладия размером в несколько нанометров должно быть больше отношения ${{I_{{MNN}}^{0}} \mathord{\left/ {\vphantom {{I_{{MNN}}^{0}} {I_{{3d}}^{0}}}} \right. \kern-0em} {I_{{3d}}^{0}}}$ для палладиевой фольги, равного 1.50, что согласуется с результатами измерений, выполненных для образца Pd/ВОПГ до взаимодействия с NO2 (${{{{I}_{{MNN}}}} \mathord{\left/ {\vphantom {{{{I}_{{MNN}}}} {{{I}_{{3d}}}}}} \right. \kern-0em} {{{I}_{{3d}}}}}$ = 1.71). Если предположить, что в ходе взаимодействия с NO2 частицы Pd увеличиваются в размере, то, в соответствии с анализом, выполненным в работе [51], отношение ${{{{I}_{{MNN}}}} \mathord{\left/ {\vphantom {{{{I}_{{MNN}}}} {{{I}_{{3d}}}}}} \right. \kern-0em} {{{I}_{{3d}}}}}$ должно уменьшаться с асимптотическим стремлением к 1.50. Значение ${{{{I}_{{MNN}}}} \mathord{\left/ {\vphantom {{{{I}_{{MNN}}}} {{{I}_{{3d}}}}}} \right. \kern-0em} {{{I}_{{3d}}}}}$, действительно, снижается, но до величины существенно более малой. Отсюда следует, что спекание частиц Pd, если оно и происходит, не может служить единственной причиной наблюдаемых изменений в интенсивностях линий палладия в РФЭ-спектре. Падение интенсивностей линий Pd3d и Pd-MNN с параллельным уменьшением отношения интенсивностей данных линий ${{{{I}_{{MNN}}}} \mathord{\left/ {\vphantom {{{{I}_{{MNN}}}} {{{I}_{{3d}}}}}} \right. \kern-0em} {{{I}_{{3d}}}}}$ до величины ниже, чем у фольги, можно связать с инкапсулированием частиц палладия за счет формирования на их поверхности пленки из фрагментов материала носителя или с внедрением частиц вглубь носителя. В этом случае экранировка внешним слоем углеродного материала будет ослаблять обе линии палладия, но в большей степени это будет касаться Оже-линии вследствие меньшего значения кинетической энергии (а, следовательно, и λ) Оже-электронов.
Структурные изменения образцов наночастиц металла, нанесенных на поверхность ВОПГ, происходящие под воздействием окислительной среды, исследованы в работах [12, 52, 53]. Методом сканирующей туннельной микроскопии (СТМ) была изучена морфология активированной поверхности ВОПГ после обработки на воздухе при температуре около 460°С в присутствии частиц нанесенного палладия [52]. Показано, что в этом случае происходило окисление графита с участием кислорода воздуха в качестве окислителя и палладия в качестве катализатора. По мере выгорания углерода на одном участке поверхности частица палладия перемещалась на соседний участок, в результате чего в поверхностном слое носителя формировался трек. В данных условиях ВОПГ в отсутствие палладия с воздухом не реагировал. Аналогичные результаты были получены в работе [53], где было исследовано окисление графеновых слоев в структуре ВОПГ, катализируемое частицами нанесенного золота. В работе [12] с помощью метода растровой электронной микроскопии (РЭМ) было обнаружено окисление поверхности ВОПГ в ходе ее взаимодействия со смесью этилена и кислорода (1 : 1) при давлении 0.25 мбар и температуре ≥250°С при участии частиц нанесенного серебра. Как и в случае палладия в работе [52] реакция сопровождалась формированием треков в местах выгоревшего углерода. Вероятно, нечто похожее наблюдается и в настоящей работе, где использование NO2 как более сильного по сравнению с кислородом окислителя позволяет окислять графит даже при комнатной температуре. Это предположение основывается на том, что графеновая структура поверхностного слоя ВОПГ разрушается (рис. 3), вследствие чего происходит погружение в него частиц металлического палладия, на которое указывает уменьшение отношения интенсивностей линий палладия ${{{{I}_{{MNN}}}} \mathord{\left/ {\vphantom {{{{I}_{{MNN}}}} {{{I}_{{3d}}}}}} \right. \kern-0em} {{{I}_{{3d}}}}}$ до аномально низкой величины.
Интересно сопоставить поведение рассматриваемой здесь системы Pd/ВОПГ и исследованной нами ранее системы Pt/ВОПГ [6, 8, 9]. Если после обработки системы Pd/ВОПГ в NO2 при комнатной температуре частицы палладия сохраняют свою металлическую природу, а графит подвергается интенсивному окислению, то в системе Pt/ВОПГ в аналогичных условиях, напротив, протекает окисление частиц платины [6, 8, 9], тогда как структура графита остается неизменной. На это указывают данные СТМ [9], а также сохранение спектром C1s своей исходной формы, характерной для графита [6, 8, 9].
По-видимому, определяющую роль в наблюдаемых отличиях в поведении двух систем играет различный характер взаимодействия атомов кислорода, образующихся при диссоциации молекул NO2, с поверхностью частиц Pt и Pd. Массивный палладий в процессе обработки кислородом или оксидами азота способен поглощать атомы кислорода [54–59]. Взаимодействие монокристаллов Pd(111), (110), (100) с O2 при температурах ≥150°С приводит к появлению состояния приповерхностного кислорода [60–63]. Показано [61, 62], что называемые приповерхностными атомы кислорода проникают в Pd(110) на глубину >1.5–2.0 нм. Для растворения кислорода в объеме металла требуются более высокие температуры (>300–350°С) [60, 64]. С ростом концентрации кислорода в объеме до некоторой критической величины происходит формирование оксида палладия PdO [64]. Необходимость использования повышенных температур обусловлена тем, что на монокристаллах процесс внедрения атомов кислорода в приповерхностную область с последующим растворением в объеме при комнатной температуре протекает слишком медленно из-за низких концентраций дефектов на поверхности [60]. Как образование приповерхностного кислорода [63], так и растворение атомов O в объеме [65] идет более эффективно на поликристаллическом палладии. Можно ожидать, что поглощение кислорода будет происходить еще легче при взаимодействии с наночастицами палладия вследствие высокой дефектности их поверхности [5]. Для успешного протекания процессов, приводящих к образованию приповерхностного кислорода, поверхностного оксида и растворению атомов O в объеме с дальнейшим их превращением в объемный оксид, важную роль играет не только дефектность поверхности палладия, необходимая для осуществления транспорта атомов O вглубь металла [63], но также концентрация адсорбированного кислорода. Если в случае с молекулярным кислородом она обусловлена проведением взаимодействия при повышенных температурах и давлениях, то при использовании NO2 в качестве источника атомов кислорода высокие концентрации O на поверхности палладия могут быть достигнуты при комнатной температуре и умеренных давлениях (таких, какие применены в настоящей работе) [55, 57].
Способность палладия хорошо растворять кислород, по-видимому, сочетается с большой подвижностью растворенных атомов в объеме частицы металла, обеспечивающей эффективный подвод к границе с носителем, в том числе расположенной под частицей металла. Можно также предположить, что растворенные атомы кислорода обладают высокой окислительной способностью, достаточной для окисления графита, по крайней мере, в местах локализации частиц палладия на дефектах, созданных ионным травлением. Эффективное расходование растворенных атомов на окисление углерода ограничивает рост их концентрации внутри частиц палладия и, как следствие, затрудняет образование оксидной фазы.
Ранее нами было показано, что на начальном этапе взаимодействия наночастиц платины, полученных напылением на поверхность оксидов (Al2O3, SiO2, TiO2, ZrO2), при комнатной температуре с NO2 [66, 67] или со смесью NO и O2 (1 : 1) [68–71] образуется состояние атомарного кислорода, которое по данным РФЭС отличается от оксидного. Атомы кислорода в этом состоянии обладают более высокой окислительной активностью по сравнению с частицами оксидов платины, что проявляется в возможности их восстановления водородом при комнатной температуре [66, 69–71]. Было высказано предположение о том, что данное состояние представляет собой атомы кислорода, растворенные в частицах платины или, по крайней мере, внедренные в приповерхностный слой, и их появление предшествует образованию частиц оксидов платины. Однако оказалось, что в случае платины, нанесенной на ВОПГ, состояние растворенного (приповерхностного) кислорода не образовывалось, а вместо этого возникали поверхностные соединения углерода с кислородом COx, и параллельно частицы металлической платины превращались в частицы оксидов Pt(II) и Pt(IV) [6, 8, 9]. На основании того, что после обработки Pt/ВОПГ в NO2 состояние углерода по данным РФЭС [6, 9] и структура графита по данным СТМ [9] практически не претерпевали изменений, следует признать, что реакция активных атомов кислорода с ВОПГ протекала лишь в незначительной степени и, по всей видимости, только по периметру частиц нанесенной платины. Вероятно, атомы кислорода в системе Pt/ВОПГ, способные вести реакцию с углеродом при комнатной температуре, не обладают такой же высокой подвижностью, как в палладии, и глубоко в объем частиц платины не проникают, а диффундируют в приповерхностной области, достигая в своем перемещении границы раздела с графитом, где они вступают в реакцию с образованием поверхностных COx-соединений. В случае проникновения атомов кислорода в объем частиц происходит образование малоактивных оксидов платины. Состояние растворенного кислорода не было нами обнаружено также при взаимодействии NO2 с массивной платиной (фольга) [72].
ЗАКЛЮЧЕНИЕ
При исследовании методом РФЭС взаимодействия NO2 с наночастицами палладия, нанесенными на поверхность высоко ориентированного пиролитического графита (ВОПГ), при комнатной температуре и давлении 10–6 и 10–5 мбар были получены следующие результаты:
1. Существенные изменения в спектральных регионах C1s, O1s и N1s свидетельствуют о протекании окисления графита, приводящего к разрушению структуры до 10–15 графеновых слоев и появлению поверхностных соединений с кислородом, содержащих группы C–OH, C–O–C, C=O, и с азотом в виде фрагментов со структурой пиррола.
2. В этих условиях палладий сохраняет металлическую природу. Частицы палладия внедряются в приповерхностный слой графита, на что указывает уменьшение величины отношения интенсивности Оже-линии Pd-MNN к интенсивности фотоэмиссионной линии Pd3d при общем ослаблении линий палладия в РФЭ-спектре.
Поведение палладия сильно отличает этот металл от платины, золота и серебра, которые в виде частиц, нанесенных на ВОПГ, были исследованных нами ранее. При взаимодействии NO2 с Ме/ВОПГ (Ме = Pt, Au, Ag) в аналогичных условиях глубокого окисления графита не наблюдается, а сами металлы переходят в окисленное состояние. Система Pd/ВОПГ требует проведения дополнительных тщательных исследований для выяснения детального механизма окисления углерода в присутствии частиц палладия. Тем не менее, полученные при изучении системы Pd/ВОПГ данные позволяют уже сейчас предложить использование палладиевых катализаторов для низкотемпературного окисления сажи молекулами NO2 в процессах нейтрализации выхлопных газов дизельных двигателей.
Список литературы
Mirkelamoglu B., Liu M., Ozkan U.S. // Catal. Today 2010. V. 151. P. 386.
Oktar N., Mitome J., Holmgreen E.M., Ozkan U.S. // J. Mol. Catal. A. 2006. V. 259 P. 171.
Lin S., Yang L., Yang X., Zhou R. // Appl. Surf. Sci. 2014. V. 305. P. 642.
Lin S., Yang X., Yang L., Zhou R. // RSC Adv. 2015. V. 5. P. 37353.
Desikusumastuti A., Happel M., Qin Z., Staudt T., Lykhach Y., Laurin M., Shaikhutdinov S., Rohr F., Libuda J. // J. Phys. Chem. C. 2009. V. 113. P. 9755.
Калинкин А.В., Сорокин А.М., Смирнов М.Ю., Бухтияров В.И. // Кинетика и катализ. 2014. Т. 55. С. 371.
Калинкин А.В., Смирнов М.Ю., Бухтияров А.В., Бухтияров В.И. // Кинетика и катализ. 2015. Т. 56. С. 785.
Smirnov M.Yu., Kalinkin A.V., Vovk E.I., Simonov P.A., Gerasimov E.Yu., Sorokin A.M., Bukhtiyarov V.I. // Appl. Surf. Sci. 2018. V. 428. P. 972.
Смирнов М.Ю., Вовк Е.И., Нартова А.В., Калинкин А.В., Бухтияров В.И. // Кинетика и катализ. 2018. Т. 59. С. 631.
Калинкин А.В., Смирнов М.Ю., Клембовский И.О., Сорокин А.М., Гладкий А.Ю., Бухтияров В.И. // ЖСХ. 2018. Т. 59. С. 1785.
Palmer R.E., Pratontep S., Boyen H.-G. // Nat. Mater. 2003. V. 2. P. 443.
Demidov D.V., Prosvirin I.P., Sorokin A.M., Bukhtiyarov V.I. // Catal. Sci. Technol. 2011. V. 1. P. 1432.
Zheng Y., Kovarik L., Engelhard M.H., Wang Y., Wang Y., Gao F., Szanyi J. // J. Phys. Chem. C. 2017. V. 121. P. 15793.
Boutikos P., Březina J., Arvajova A., Koči P. // Chem. Eng. J. 2019. V. 377. P. 119654.
Yoon B., Wai C.M. // J. Amer. Chem. Soc. 2005. V. 127. P. 17174.
Mori A., Miyakawa Y., Ohashi E., Haga T., Maegawa T., Sajiki H. // Org. Lett. 2006. V. 8. P. 3279.
Chen L., Yang K., Liu H., Wang X. // Carbon. 2008. V. 46. P. 2137.
Yuan Z., Stephan R., Hanf M.C., Becht J.M., Le Drian C., Hugentobler M., Harbich W., Wetzel P. // Eur. Phys. J. D. 2011. V. 63. P. 401.
Li F., Zhang B., Wang E., Dong S. // J. Electroanal. Chem. 1997. V. 422. P. 27.
Gao G.-Y., Guo D.-J., Li H.-L. // J. Power Sources. 2006. V. 162. P. 1094.
Mazumder V., Sun S. // J. Amer. Chem. Soc. 2009. V. 131. P. 4588.
Chen L., Hu G., Zou G., Shao S., Wang X. // Electrochem. Comm. 2009. V. 11. P. 504.
Schnyder B., Alliata D., Kotz R., Siegenthaler H. // Appl. Surf. Sci. 2001. V. 173. P. 221.
Yang D.-Q., Sacher E. // Surf. Sci. 2002. V. 504. P. 125.
Rousseau B., Estrade-Szwarckopf H., Thomann A.-L., Brault P. // Appl. Phys. A. 2003. V. 77. P. 591.
Utsumi S., Honda H., Hattori Y., Kanoh H., Takahashi K., Sakai H., Abe M., Yudasaka M., Iijima S., Kaneko K. // J. Phys.Chem. C. 2007. V. 111. P. 5572.
Paredes J.I., Martınez-Alonso A., Tascon J.M.D. // Langmuir. 2007. V. 23. P. 8932.
Demoisson F., Raes M., Terryn H., Guillot J., Migeon H.-N., Reniers F. // Surf. Interface Anal. 2008. V. 40. P. 566.
Sandhu J., Chauhan A.K.S., Govind // J. Nanopart. Res. 2011. V. 13. P. 3503.
Blume R., Rosenthal D., Tessonnier J.-P., Li H., Knop-Gericke A., Schlogl R. // ChemCatChem. 2015. V. 7. P. 2871.
http://xpspeak.software.informer.com/4.1/.
Kettner M., Stumm C., Schwarz M., Schuschke C., Libuda J. // Surf. Sci. 2019. V. 679. P. 64.
Favaro M., Agnoli S., Perini L., Durante C., Gennaro A., Granozzi G. // Phys. Chem. Chem. Phys. 2013. V. 15. P. 2923.
Nosova L.V., Stenin M.V., Nogin Yu.N., Ryndin Yu.A. // Appl. Surf. Sci. 1992. V. 55. P. 43.
Aiyer H.N., Vijayakrishnan V., Subbanna G.N., Rao C.N.R. // Surf. Sci. 1994. V. 313. P. 392.
Pan Y., Gao Y., Kong D., Wang G., Hou J., Hu S., Pan H., Zhu J. // Langmuir. 2012. V. 28. P. 6045.
Смирнов М.Ю., Вовк Е.И., Калинкин А.В., Бухтияров В.И. // Кинетика и катализ. 2016. Т. 57. С. 839.
Afanas’ev V.P., Bocharov G.S., Eletskii A.V., Ridzel O.Yu., Kaplya P.S., Koppen M. // J. Vac. Sci. Technol. B. 2017. V. 35. P. 041804.
Zhu C., Hao X., Liu Y., Wu Y., Wang J. // Appl. Surf. Sci. 2018. V. 427. P. 1137.
Susi T., Pichler T., Ayala P. // Beilstein J. Nanotechnol. 2015. V. 6. P. 177.
Figueiredo J.L., Pereira M.F.R. // Catal. Today. 2010. V. 150. P. 2.
Wang Z.-M., Kanoh H., Kaneko K., Lu G.Q., Do D. // Carbon 2002. V. 40. P. 1231.
Fu C., Zhao G., Zhang H., Li S. // Int. J. Electrochem. Sci. 2013. V. 8. P. 6269.
Saravanan M., Girisun T.C.S., Rao S.V. // J. Mater. Chem. C 2017. V. 5. P. 9929.
Haerle R., Riedo E., Pasquarello A., Baldereschi A. // Phys. Rev. B. 2001. V. 65. P. 045101.
Shinotsuka H., Tanuma S., Powell C.J., Penn D.R. // Surf. Interf. Anal. 2015. V. 47. P. 871.
Ganguly A., Sharma S., Papakonstantinou P., Hamilton J. // J. Phys. Chem. C. 2011. V. 115. P. 17009.
Oh Y.J., Yoo J.J., Kim Y.I., Yoon J.K., Yoon H.N., Kim J.-H., Park S.B. // Electrochimica Acta. 2014. V. 116. P. 118.
Stobinski L., Lesiak B., Malolepszy A., Mazurkiewicz M., Mierzwa B., Zemek J., Jiricek P., Bieloshapka I. // J. Electron Spectrosc. Related Phenom. 2014. V. 195. P. 145.
Biniak S., Szymanski G., Siedlewski J., Swiatkowski A. // Carbon. 1997. V. 35. P. 1799.
Smirnov M.Yu., Kalinkin A.V., Bukhtiyarov A.V., Prosvirin I.P., Bukhtiyarov V.I. // J. Phys. Chem. C. 2016. V. 120. P. 10419.
Yuan Z., Hanf M.C., Stephan R., Dulot F., Denys E., Florentin A., Harbich W., Wetzel P. // Surf. Interface Anal. 2015. V. 47. P. 82.
Hugentobler M., Bonanni S., Sautier A., Harbich W. // Eur. Phys. J. D. 2011. V. 63. P. 215.
Conrad H., Ertl G., Kuppers J., Latta E. // Surf. Sci. 1977. V. 65. P. 245.
Parker D.H., Koel B.E. // J. Vac. Sci. Technol. A. 1990. V. 8. P. 2585.
Banse B.A., Koel B.E. // Surf. Sci. 1990. V. 232. P. 275.
Zheng G., Altman E.I. // Surf. Sci. 2000. V. 462. P. 151.
Zemlyanov D., Azalos-Kiss B., Kleimenov E., Teschner D., Zafeiratos S., Havecker M., Knop-Gericke A., Schlogl R., Gabasch H., Unterberger W., Hayek K., Klotzer B. // Surf. Sci. 2006. V. 600. P. 983.
Gabasch H., Unterberger W., Hayek K., Klotzer B., Kleimenov E., Teschner D., Zafeiratos S., Havecker M., Knop-Gericke A., Schlogl R., Han J., Ribeiro F.H., Aszalos-Kiss B., Curtin T., Zemlyanov D. // Surf. Sci. 2006. V. 600. P. 2980.
Leisenberger F.P., Koller G., Sock M., Surnev S., Ramsey M.G., Netzer F.P., Klotzer B., Hayek K. // Surf. Sci. 2000. V. 445. P. 380.
Titkov A.I., Salanov A.N., Koscheev S.V., Boronin A.I. // React. Kinet. Catal. Lett. 2005. V. 86. P. 371.
Titkov A.I., Salanov A.N., Koscheev S.V., Boronin A.I. // Surf. Sci. 2006. V. 600. P. 4119.
Nagarajan S., Thirunavukkarasu K., Gopinath C.S. // J. Phys. Chem. C. 2009. V. 113. P. 7385.
Han J., Zemlyanov D.Y., Ribeiro F.H. // Surf. Sci. 2006. V. 600. P. 2752.
Супрун Е.А., Саланов А.Н. // Кинетика и катализ. 2017. Т. 58. С. 98.
Vovk E.I., Kalinkin A.V., Smirnov M.Yu., Klembovskii I.O., Bukhtiyarov V.I. // J. Phys. Chem. C. 2017. V. 121. P. 17297.
Смирнов М.Ю., Калинкин А.В., Назимов Д.А., Токтарев А.В., Бухтияров В.И. // Кинетика и катализ. 2015. Т. 56. С. 547.
Смирнов М.Ю., Калинкин А.В., Бухтияров В.И. // ЖСХ. 2007. Т. 48. С. 1120.
Смирнов М.Ю., Вовк Е.И., Калинкин А.В., Пашис А.В., Бухтияров В.И. // Кинетика и катализ. 2012. Т. 53. С. 120.
Смирнов М.Ю., Калинкин А.В., Вовк Е.И., Бухтияров В.И. // Кинетика и катализ. 2015. Т. 56. С. 791.
Смирнов М.Ю., Калинкин А.В., Вовк Е.И., Бухтияров В.И. // ЖСХ. 2016. Т. 57. С. 1166.
Калинкин А.В., Смирнов М.Ю., Бухтияров В.И. // Кинетика и катализ. 2016. Т. 57. С. 833.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ