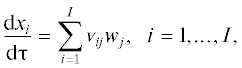Кинетика и катализ, 2020, T. 61, № 4, стр. 550-559
Кинетическая модель каталитического риформинга бензина с учетом изменения реакционного объема и термодинамических параметров
Р. З. Зайнуллин a, К. Ф. Коледина a, b, *, И. М. Губайдуллин a, b, А. Ф. Ахметов a, С. Н. Коледин a
a Уфимский государственный нефтяной технический университет
450062 Уфа, ул. Космонавтов, 1, Россия
b Институт нефтехимии и катализа УФИЦ РАН
450075 Уфа, просп. Октября, 141, Россия
* E-mail: koledinakamila@mail.ru
Поступила в редакцию 18.10.2019
После доработки 02.02.2020
Принята к публикации 28.02.2020
Аннотация
Для промышленно значимого процесса каталитического риформинга бензина одной из главных задач является повышение октанового числа бензина и выполнение ограничений на содержание ароматических углеводородов и бензола. Для решения этой задачи предлагается анализ работы реакторного блока, на основе детализированной кинетической модели процесса. В группированную кинетическую модель каталитического риформинга бензина вводится учет изменения объема реакционной смеси в ходе химических превращений. Для процесса каталитического риформинга бензина сформулирован алгоритм и определены термодинамические параметры для группированных индивидуальных углеводородов. Для разработанной математической модели поставлена обратная кинетическая задача восстановления кинетических параметров стадий. Определены функционалы невязки, учитывающие экспериментальные данные концентраций компонентов и изменение температур в ходе всего процесса. Рассчитаны концентрации групповых компонентов реакции каталитического риформинга бензина и полный температурный профиль процесса. Приведены результаты решения двухкритериальной задачи оптимизации по минимальному содержанию ароматических углеводородов при максимальном октановом числе риформата на основе разработанной кинетической модели.
ВВЕДЕНИЕ
Каталитический риформинг бензина – один из главных процессов для нефтеперерабатывающих заводов в России. Его используют для повышения октанового числа бензина путем полного превращения нафтеновых и частичного превращения парафиновых углеводородов в ароматические соединения, обладающие высокими значениями октанового числа, а также производства индивидуальных ароматических углеводородов – сырья для нефтехимии. Октановое число относиться к эксплуатационным характеристикам бензина и представляет собой главный критерий при формировании цены товарного бензина. Поэтому важной задачей является повышение октанового числа бензина с минимальными затратами. Разница октанового числа бензина в 2–3 пункта разделяет товарные бензины разных марок, продающиеся по различной цене.
Но с точки зрения экологических требований, предъявляемых к товарным бензинам, содержание ароматических углеводородов и бензола в отдельности лимитировано и не должно превышать 35 и 1 об. %. Поэтому возникает ограничение на внедрение риформата (продукта риформинга) в состав товарного бензина. Обычно излишки образовавшегося бензола либо выделяют, либо подвергают обратным химическим превращениям, что увеличивает стоимость компонента товарного бензина. Также используют предфракционирование сырья (удаление бензолобразующих компонентов), что снижает его ресурс. Как следствие, падает и производительность установки [1, 2], что неблагоприятно сказывается на себестоимости продукта.
Каталитический риформинг реализуют при высоких температурах (около 500°С), давлении от 1.5 до 3.5 МПа и избытке водорода в соотношении моль H2 : моль сырья около 8 : 1 . Процесс проводят в присутствии бифункциональных катализаторов, обуславливающих протекание огромного количества реакций, требующих наличия как кислотных, так и металлических активных центров [3–5]. Химические превращения осуществляются в каскаде трех адиабатических реакторов вытеснения переменного объема с промежуточным подогревом реакционной смеси. Объем реакторов распределяется в соотношении 1 : 2 : 4.
Потенциальная область для поиска решения вышеобозначенной проблемы – сам процесс каталитического риформинга, а именно реакторный блок [6]. И наиболее перспективным является оптимизация работы реакторного блока, для проведения которой требуется детализированная кинетическая модель процесса, описывающая основные закономерности химических превращений.
При разработке кинетической модели возникает сложность в связи с большим числом компонентов реакционной смеси (оно может достигать 300) [7], и множеством стадий химических превращений, в которые они могут вступать. Эти проблемы решают путем объединения индивидуальных углеводородов в группы по различным критериям, самые главные из которых – принадлежность к классу углеводородов и количество атомов углерода в структуре молекул.
В работах [8, 9] для оценки перепада температур в результате химической реакции были использованы термодинамические параметры. Преобразование принципов группировки и схемы реакции влечет изменение значений термодинамических параметров. Аналогичная ситуация наблюдалась и в моделях [10, 11]. В работах [12, 13] применяли термодинамически содержательную модель кинетики процесса, где скорости реакции зависят от изменения энергии Гиббса, а профиль температур определяется из термодинамических параметров химических реакций, принятых в модели. Однако в вышеуказанных работах нет подробного описания принципа выбора или методики расчета термодинамических параметров.
Ранее в [14] коллективом автором при комбинировании наиболее удачных положений о стадиях химических превращений и на основе группировки индивидуальных углеводородов была предложена новая схема процесса каталитического риформинга. На ее основе разработана предварительная группированная кинетическая модель (ГКМ) каталитического риформинга бензина, в которой учитывалось снижение температуры реакционной смеси за счет химических превращений и связанных с ней констант химических реакций. Сравнительный анализ расчетных и экспериментальных данных профилей концентраций веществ и скоростей отдельных стадий, а также динамики перепадов температуры показал зависимость погрешности от состава исходного сырья. Одной из причин таких расхождений является изменение объема реакционной смеси в ходе химических превращений.
В результате реакций дегидрирования нафтенов происходит отщепление 3 молекул водорода из структуры нафтена с образованием ароматического углеводорода, т.е. из одной молекулы нафтена образуются 4 молекулы (1 молекула ароматического углеводорода и 3 – водорода). Это влияет на мольные доли не только компонентов реакции, но и всех остальных компонентов смеси за счет увеличения общего числа молей. При этом среди реакций, протекающих при риформинге, присутствуют и те, в которых сохраняется общее число молекул. Тогда при изменении в соотношениях скоростей реакции в результате варьирования управляющих параметров или состава сырья возможны погрешности в результатах расчета ввиду отсутствия учета изменения мольных долей.
Таким образом, с целью обеспечения учета изменения числа молекул за счет химических превращений необходима модернизация математического описания процесса каталитического риформинга на основе кинетической модели, разработанной в работе [14].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве экспериментальной информации использовали показатели работы другого промышленного объекта, отличного от того, что был применен при разработке первой реализации модели [14]. Причина замены реального объекта исследования связана с полнотой данных для дальнейшего развития модели процесса и устаревшим технологическим режимом работы предыдущего. Была выбрана установка каталитического риформинга Л 35-11-300 с более современным технологическим режимом, которая имеет конструктивные отличия реакторов, обеспечивающие возможность снижения перепада давления на слое катализатора благодаря использованию радиальной схемы движения реакционной смеси через слой катализатора. Технологический режим такой установки широко распространен в России.
Реакторный блок представляет собой каскад трех последовательных, радиальных реакторов вытеснения.
Технологический режим реакторного блока представлен в табл. 1. В отличие от предыдущей установки, давление системы здесь понижено и составляет 23 против 35 кг с см–2 [14].
Таблица 1.
Технологический режим реакторного блока
| Показатель | Значения |
|---|---|
| Температура на входе в Р-1, °С | 489.0 |
| Температура на выходе в Р-1, °С | 422.0 |
| Температура на входе в Р-2, °С | 489.0 |
| Температура на выходе в Р-2, °С | 457.0 |
| Температура на входе в Р-3, °С | 489.0 |
| Температура на выходе в Р-3, °С | 474.0 |
| Давление на входе Р-1, кг с см–2 | 23.0 |
| Подача воды, л/день | 4.5 |
| Подача хлора, лДХЭ/день | 1.1 |
| Расход рециркулирующего газа, норм. м3/ч | 66 500.0 |
В табл. 2 приведен материальный баланс процесса, проверка которого показала отклонение атомарного баланса на 1.3%, следовательно, его можно использовать без дополнительных корректировок.
Таблица 2.
Материальный баланс установки
| Наименование потока | Массовый расход, т/ч |
|---|---|
| Взято | |
| Сырье риформинга (гидрогенизат) | 45.85 |
| Получено | |
| Водород с риформинга | 3.42 |
| Сухой газ (E-7) | 1.31 |
| Газ из сепаратора низкого давления (C-8) | 0.01 |
| Продукт (риформат) | 41.11 |
В табл. 3 даны составы газообразных продуктов процесса.
Таблица 3.
Составы газообразных продуктов процесса
| Компоненты | Продукты | ||
|---|---|---|---|
| водород с установки (C-10), об. % | сухой газ (E-7), мас. % | Газ из сепаратора низкого давления (C-8), мас. % | |
| Водород | 80.64 | 0.33 | 15.51 |
| Метан | 9.39 | 3.13 | 20.11 |
| Этан | 5.06 | 24.89 | 22.96 |
| Пропан | 3.28 | 58.28 | 23.18 |
| Бутаны | 1.38 | 13.37 | 13.95 |
| Пентаны | 0.25 | 0.00 | 4.29 |
Также имеются хроматографические анализы сырья (гидрогенизата) и продукта (риформата) [14]. Октановое число получаемого риформата, определенное по исследовательскому методу, равно 95.3 пункта.
ИССЛЕДОВАНИЕ КИНЕТИКИ КАТАЛИТИЧЕСКОГО РИФОРМИНГА БЕНЗИНА МЕТОДАМИ МАТЕМАТИЧЕСКОГО МОДЕЛИРОВАНИЯ
Система дифференциальных уравнений изменения мольных концентраций групповых компонент реакции каталитического риформинга бензина от времени контакта смеси с катализатором имеет вид [15–17]:
(2)
$\begin{gathered} {{w}_{j}} = k_{j}^{0}\exp \left( { - \frac{{E_{j}^{ + }}}{{RT}}} \right)\prod\limits_{j = 1}^J {{{{\left( {\frac{{{{x}_{i}}}}{F}} \right)}}^{{\left| {{{\alpha }_{{ij}}}} \right|}}}} - \\ - \,\,k_{{_{{ - j}}}}^{0}\exp \left( { - \frac{{E_{j}^{ + }}}{{RT}}} \right)\prod\limits_{j = 1}^J {{{{\left( {\frac{{{{x}_{i}}}}{F}} \right)}}^{{{{\beta }_{{ij}}}}}}} , \\ \end{gathered} $При разработке кинетической модели процесса каталитического риформинга бензина необходимо учитывать применение адиабатических реакторов для проведения реакций с сильным эндотермическим эффектом, по слою катализатора в которых наблюдается значительное снижение температуры смеси – температурный перепад в первом реакторе может достигать 80°С, что заметно сказывается на скоростях химических реакций [18]. В подобных случаях необходимо адекватное описание температурной зависимости скоростей химической реакции, и, соответственно, определение температуры смеси в различных зонах слоя катализатора.
Уравнение изменения температуры смеси от времени контакта с катализатором примет вид:
(3)
$\frac{{{\text{d}}T}}{{{\text{d}}\tau }} = \frac{{\sum\limits_{i = 1}^I {\Delta H_{{_{{Ti}}}}^{{\text{f}}}\frac{{{\text{d}}{{x}_{i}}}}{{{\text{d}}\tau }}} }}{{\sum\limits_{i = 1}^I {C_{{_{{{\text{p}}i}}}}^{T}{{x}_{i}}} }},$(4)
$\Delta H_{{{\text{Ti}}}}^{{\text{f}}} = \Delta H_{{298i}}^{{\text{f}}} + \int\limits_{298}^T {C_{{{\text{p}}i}}^{T}{\text{d}}T} ,$(5)
$C_{{{\text{p}}i}}^{T} = {{a}_{i}} + {{b}_{i}}T + {{c}_{i}}{{T}^{2}} + {{d}_{i}}{{T}^{3}} + {{e}_{i}}{{T}^{4}},$Для учета изменения количества молей в результате реакции были пересмотрены размерности основных величин. В уравнении (1) концентрация xi, выраженная в массовых долях, заменена на мольный расход компонента (кмоль/ч). Мольный расход реакционный смеси формируется из мольных расходов компонентов. Тогда дифференциальное уравнение, учитывающее изменение количества молей реакционной смеси, имеет вид (6):
(6)
$\frac{{{\text{d}}F}}{{{\text{d}}\tau }} = \sum\limits_{i = 1}^I {\frac{{{\text{d}}{{x}_{i}}}}{{{\text{d}}\tau }}} $В качестве концентраций используются мольные доли компонентов, которые представлены в уравнении (2) отношением мольного расхода компонента к мольному расходу смеси, благодаря чему система дифференциальных уравнений учитывает разбавление или концентрирование всех компонентов.
На основе математического описания (1)–(6) возможно провести оценку времени контакта за счет варьирования производительности (мольного расхода в начальный момент времени) и количества загруженного катализатора. В системе дифференциальных уравнений (1)–(6) изменение мольного расхода смеси без воздействия на состав не влияет на скорости химической реакции, поскольку концентрация остается неизменной. Так, уменьшение мольного расхода вдвое увеличивает время контакта. В соответствии с модификацией математической модели можно учитывать время контакта реакционной смеси с катализатором, являющейся функцией ее расхода и количества загруженного катализатора.
Таким образом, прямая кинетическая задача (1)–(6) представляет собой задачу Коши. При численном решении необходимо оценивать адекватность на каждой итерации. При учете неизотермического ведения процесса в качестве такой оценки может выступать выполнение теплового баланса в каждой точке. Нарушение теплового баланса связано с тем, что изменение температуры на каждом шаге влияет на энтальпию образования веществ, что суммарно сказывается на энтальпии реакции. При нарушении теплового баланса на каждом шаге интегрирования предлагается проводить итерационное уточнение температуры, исходя из теплового баланса.
При вычислительном эксперименте разработки кинетической модели каталитического риформинга бензина возникает задача определения термодинамических параметров для групповых компонент по (3)–(5).
ОПРЕДЕЛЕНИЕ ТЕРМОДИНАМИЧЕСКИХ ПАРАМЕТРОВ ГРУППОВЫХ КОМПОНЕНТОВ КАТАЛИТИЧЕСКОГО РИФОРМИНГА БЕНЗИНА
Температуру на различных слоях катализатора можно вычислить с помощью термодинамических параметров компонентов реакционной смеси (энтальпии и теплоемкости), которые можно найти в соответствующих базах и справочниках [19]. Но в случае с риформингом, когда для описания кинетики процесса используется принцип группировки индивидуальных углеводородов, возникает проблема определения вышеуказанных термодинамических параметров для сформированных групп, если не известен их углеводородный состав. Для ее решения нужно сформировать свод правил по подбору термодинамических параметров групповых компонентов каталитического риформинга.
Формулировка подобных правил требует рассмотрения возможных пределов изменения искомых величин для групп и определения степени влияния значений величин на конечный результат работы кинетической модели (концентрационные профили компонентов внутри адиабатических реакторов вытеснения).
Формирование групповых компонентов производится объединением индивидуальных углеводородов по принадлежности к классу и количеству атомов углерода в структуре молекул. Исходя из состава сырья и продуктов риформинга, верхнюю границу можно установить на 11 атомах углерода. Углеводороды с бóльшим числом атомов углерода в составе реакционной смеси присутствуют в следовом количестве, и ими можно пренебречь. В случае с классом углеводородов различные исследователи, занимающиеся моделированием кинетики риформинга, применяют разные подходы [20–25]. Но с теоретической и практической сторон наиболее предпочтительно выделение следующих классов углеводородов: н-парафины, изо-парафины, пятичленные нафтены (гомологи циклопентана), шестичленные нафтены (гомологи циклогексана) и ароматические углеводороды (арены). Потребность в разделении парафинов на соединения нормального и разветвленного строения связана большой разницей их октановых чисел. Причина разделения нафтеновых углеводородов обусловлена различной селективностью образования аренов в результате превращения пятичленных и шестичленных нафтенов [20].
Для определения влияния термодинамических параметров групповых компонентов (зависящих от состава группы) была собрана база данных компонентов бензина (220 компонентов) [26, 27], что дает возможность оценить возможные значения параметров термодинамики (энтальпии и теплоемкости), исходя из состава групп.
В полученной базе выполняли поиск индивидуальных веществ, подходящих для каждой группы, из этой выборки определяли минимальные и максимальные значения параметров компонентов групп. Таким образом, получены интервалы варьирования термодинамических параметров для каждого группового компонента.
С использованием ранее созданной ГКМ [14] каталитического риформинга и модифицированного математического описания (1)–(6), учитывающего изменение объема реакционной смеси за счет химических превращений, выполнены расчеты реакций при наибольших и наименьших параметрах для соединений одной группы. Это позволяет увеличить степень адекватности математической модели.
Исходя из условий, что для расчета реакторного блока каталитического риформинга достаточно двух термодинамических параметров – энтальпий образования компонентов и теплоемкости по (3), возникает 4 возможных набора данных с краевыми значениями. Они представляют собой комбинации минимальных и максимальных значений двух параметров, представленных в табл. 4. Данные приведены лишь для тех групповых компонентов, у которых параметры могут изменяться.
Таблица 4.
Интервалы варьирования термодинамических параметров для групповых компонентов
| Групповой компонент | Энтальпии образования при 298 К, кДж/моль | Теплоемкость при температуре 773 К, Дж моль–1 К–1 | ||
|---|---|---|---|---|
| минимум | максимум | минимум | максимум | |
| иП6 | –184.0 | –172.0 | 292.5 | 299.7 |
| иП7 | –205.8 | –186.7 | 336.9 | 347.6 |
| иП8 | –224.6 | –212.0 | 383.8 | 395.7 |
| иП9 | –242.8 | –231.5 | 426.5 | 433.2 |
| иП10 | –267.0 | –253.9 | 472.7 | 482.8 |
| иП11 | –275.7 | –270.6 | 516.7 | 524.3 |
| А8 | 17.3 | 29.9 | 273.1 | 276.6 |
| А9 | –13.8 | 7.91 | 303.5 | 321.9 |
| А10 | –41.8 | –21.0 | 361.1 | 368.6 |
| А11 | –45.9 | –22.9 | 410.7 | 415.2 |
| ЦГ8 | –180.8 | –171.6 | 367.9 | 371.3 |
| ЦГ9 | –200.0 | –179.9 | 404.4 | 410.0 |
| ЦГ10 | –213.2 | –202.3 | 461.3 | 467.1 |
| ЦГ11 | –234.4 | –210.2 | 503.1 | 506.1 |
| ЦП7 | –138.2 | –126.9 | 309.3 | 312.3 |
| ЦП8 | –188.9 | –148.1 | 354.8 | 373.6 |
| ЦП9 | –198.3 | –158.3 | 396.8 | 412.4 |
| ЦП10 | –189.1 | –171.2 | 444.3 | 452.7 |
Были проведены вычислительные эксперименты на основе созданной модели с варьированием лишь термодинамических параметров групповых компонентов.
Получены концентрационные кривые и профили температур при четырех наборах параметров, которые ограничивают область допустимых погрешностей в результате пренебрежения внутренним составом групповых компонентов.
На рис. 1 представлены температурные профили для вышеописанных наборов термодинамических данных. Небольшое расхождение наблюдается лишь в правой части графика в интервале 2°С.
Из рис. 2 видно, что кривые концентрационных профилей бензола практически полностью совпадают. Аналогичная зависимость характерна для всех групповых компонентов.
Рис. 2.
Концентрационные профили бензола при наибольших и наименьших параметрах для соединений одной группы.
Таким образом, для принятой групповой схемы можно использовать фиксированные значения термодинамических параметров: энтальпии образования и теплоемкости. Рекомендуется выбирать среднее арифметическое параметров индивидуальных веществ, входящих в группу или, с обеспечением чуть большей погрешности, принять для группы параметры любого ее представителя.
Кроме того, полученные результаты становятся дополнительным подтверждением верной группировки компонентов, так как внутренний состав групп практически не влияет на конечный результат.
В связи с заменой размерностей некоторых параметров математической модели необходимо переопределить кинетические параметры (предэкспоненциальные множители и энергии активации уравнения Аррениуса) стадий химических превращений, то есть провести постановку и решение обратной задачи химической кинетики каталитического риформинга бензина для математического описания (1)–(6).
ОБРАТНАЯ ЗАДАЧА ХИМИЧЕСКОЙ КИНЕТИКИ КАТАЛИТИЧЕСКОГО РИФОРМИНГА БЕНЗИНА
Обратная задача химической кинетики представляет собой восстановление значений кинетических параметров стадий по соответствию расчетных значений и экспериментальных (заводских) данных концентраций реагентов. Обратную задачу можно свести к оптимизации с поиском минимального значения целевой функции – функционала невязки [28, 29].
В качестве экспериментальных данных используются результаты работы промышленного объекта, но, как правило, известны только составы смеси в начальный момент и в конце реакции, и отсутствуют концентрации компонентов в промежуточные моменты времени. Возникающий перепад температур в реакторе напрямую связан с изменением состава смеси по уравнению (3). Следовательно, наряду с оценкой расчетного и промышленного состава смеси на выходе из последнего реактора, необходимо проверять соответствие температур на выходах каждого реактора, полученных в результате расчета, и промышленных данных.
Тогда функционал невязки можно разделить на две составляющие: концентрационную – сопоставление концентраций на выходе из последнего реактора, и температурную – сравнение температур на выходе из реакторов. И при необходимости для каждой составляющей можно варьировать весовые коэффициенты. Обе составляющие функционала невязки имеют различные порядки (разница 2–3 порядка). Поэтому для функционала невязки будет правомерно применение модуля относительных погрешностей между расчетными и промышленными данными.
Кроме того, у некоторых компонентов концентрации в конечный момент времени имеют очень низкие абсолютные значения (порядка 0.00001 мольных долей), т.е. относительные погрешности для них будут высокими. Для решения этой проблемы предлагается сопоставлять не конечные концентрации, а изменение концентрации по сравнению с сырьем. Противоположная картина наблюдается у температурной составляющей. Значения температур имеют значения порядка нескольких сотен (400–500°С), и разница в 10°С существенна, но будет обладать маленькой относительной погрешностью. Поэтому для температурной составляющей необходимо сравнивать динамику изменения температуры, а не абсолютные величины [29, 30].
В общем виде функционал невязки примет вид:
(7)
${{Z}_{C}} = \sum\limits_{i = 1}^I {\left| {\frac{{{{N}_{{{{{\text{э}}}_{i}}}}} - {{N}_{{{{{\text{р}}}_{i}}}}}}}{{{{N}_{{{{{\text{о}}}_{i}}}}} - {{N}_{{{{э}_{i}}}}}}}} \right|} \times 100\% ,$(8)
${{Z}_{T}} = \sum\limits_{m = 1}^M {\left| {\frac{{{{T}_{{{{{\text{э}}}_{m}}}}} - {{T}_{{{{{\text{р}}}_{m}}}}}}}{{{{T}_{{{{{\text{о}}}_{m}}}}} - {{T}_{{{{{\text{э}}}_{m}}}}}}}} \right|} \times 100\% ,$Решение обратной кинетической задачи велось на основе комбинации методов оптимизации: генетический алгоритм; метод Хука–Дживса; метод симуляции отжига [31]. В качестве начального приближения были приняты значения кинетических параметров, полученные для предыдущей реализации модели [14].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 3 приведены расчетные концентрации групповых компонентов реакции каталитического риформинга бензина: рис. 3а – укрупненные группы парафинов, нафтенов, ароматических углеводородов и газов крекинга; рис. 3б – разбиение парафинов на нормальные и изопарафины, нафтенов – на циклопентаны (пятичленные нафтены) и циклогексаны (шестичленные нафтены). Вертикальными линиями обозначены границы реакторов.
Рис. 3.
Расчетные концентрации групповых компонентов реакции каталитического риформинга бензина: а – укрупненные группы парафинов (П) и нафтенов (Н), ароматические углеводороды (А) и газы крекинга (Газ); б – нормальные (НП) и изопарафины (ИП), пятичленные (ПЧН) и шестичленные (ШЧН) нафтены, ароматические углеводороды и газы крекинга. Вертикальными линиями обозначены границы реакторов.
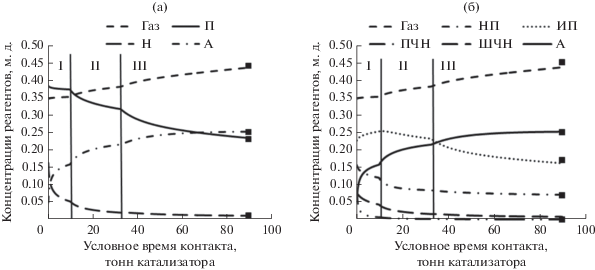
Из рис. 3а видно, что в первом реакторе преимущественно идут реакции дегидрирования нафтенов. Это подтверждается кривыми концентраций нафтенов и ароматических углеводородов. Расходования парафинов не наблюдается вследствие низких скоростей реакций дегидроциклизации и гидрокрекинга. Во втором реакторе идет накопление ароматических углеводородов за счет дегидрирования нафтенов и дегидроциклизаци парафинов. В третьем реакторе накопление нафтенов происходит при дегидроциклизации парафинов. Также парафиновые углеводороды расходуются на реакции гидрокрекинга с образованием газов.
Из рис. 3б следует, что в первом реакторе нормальные парафины и пятичленные нафтены расходуются на реакции изомеризации. Во втором реакторе циклогексанов уже нет, накопление ароматических соединений идет за счет реакций изомеризации циклопентанов с последующим дегидрированием. В третьем реакторе ароматические углеводороды накапливаются в результате превращений изопарафинов.
В табл. 5 приведено сравнение промышленных и расчетных значений (по разработанной модели) перепадов температур в каждом реакторе с соответствующей относительной погрешностью. В численных расчетах учитывался тепловой баланс в каждой точке итерации, что позволило улучшить качество описания промышленных данных.
Таблица 5.
Сравнение перепадов температур в реакторах
| Показатель | Расчетные | Промышленные | Отклонение, % |
|---|---|---|---|
| Перепад температур в Р-1, °С | 57.0 | 67.0 | 14.9 |
| Перепад температур в Р-2, °С | 27.0 | 32.0 | 15.6 |
| Перепад температур в Р-3, °С | 14.0 | 15.0 | 6.7 |
На рис. 4 представлен полный расчетный температурный профиль. На графике наблюдается резкое снижение температуры в начальный момент времени, связанное с высокими скоростями дегидрирования шестичленных нафтенов в ароматические углеводороды. В определенный момент концентрация реагирующих веществ для этой реакции резко падает, скорости реакции уменьшаются и, как результат, температура реакционной смеси снижается.
Рис. 4.
Температурный профиль каталитического риформинга бензина: кривая – расчетные значения, ◼ – промышленные данные.
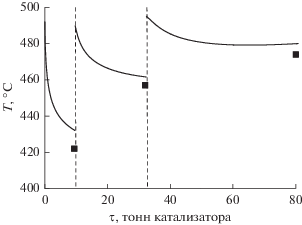
Отклонение температур, видимо, является следствием отсутствия в модели учета теплопотерь в реакторах в окружающую среду, которые происходят на реальных объектах. В пользу этого говорит тот факт, что все полученные расчетные значения температуры выше промышленных. Однако учет теплопотерь в реакторе зависит от типа и характеристик конкретного реактора.
Для промышленно значимого процесса каталитического риформинга бензина одной из главных задач является повышение октанового числа бензина и выполнение ограничений на содержание ароматических углеводородов и бензола. Для решения поставленной задачи предлагается двухкритериальная оптимизация условий проведения процесса на основе детализированной кинетической модели.
Первый критерий оптимальности – повышение октанового числа смеси (9):
где ОNi – октановое число i-го компонента, $T_{k}^{0}$ – температура k-го реактора на входе, k = 1, 2, 3.Второй критерий оптимальности – уменьшение содержания ароматических углеводородов. Для рассматриваемой модели это компоненты с индексами 6–11:
Варьируемые параметры задачи оптимизации – температуры на входе в каждый из трех реакторов $T_{k}^{0}$. Двухкритериальная задача оптимизации решалась алгоритмом Парето-аппроксимации NSGA-II (Non-dominated Sorting Genetic Algorithm II) [32, 33]. Результаты представлены в табл. 6 и на рис. 5.
Таблица 6.
Результаты оптимизации по содержанию суммы ароматических углеводородов и октановому числу
| № | $T_{1}^{0},$ °С | $T_{2}^{0},$ °С | $T_{3}^{0}$ ,°С | Октановое число смеси | Ароматические углеводороды, мас. % |
|---|---|---|---|---|---|
| 1 | 400 | 400 | 400 | 69.8 | 22.8 |
| 2 | 464 | 445 | 475 | 86.9 | 36.9 |
| 3 | 481 | 417 | 436 | 79.8 | 29.5 |
| 4 | 411 | 412 | 482 | 84.0 | 33.4 |
| 5 | 442 | 458 | 477 | 87.3 | 37.6 |
| 6 | 414 | 404 | 410 | 71.5 | 24.5 |
| 7 | 427 | 492 | 488 | 90.3 | 43.7 |
| 8 | 425 | 488 | 494 | 90.7 | 45.0 |
| 9 | 452 | 416 | 473 | 84.5 | 33.8 |
| 10 | 448 | 454 | 465 | 85.2 | 34.4 |
| 11 | 432 | 414 | 413 | 73.2 | 25.7 |
| 12 | 495 | 465 | 435 | 83.9 | 32.6 |
| 13 | 439 | 436 | 417 | 75.8 | 27.4 |
| 14 | 484 | 430 | 439 | 80.9 | 30.2 |
| 15 | 400 | 400 | 400 | 69.9 | 22.9 |
| 16 | 499 | 426 | 440 | 81.9 | 30.8 |
| 17 | 413 | 482 | 500 | 90.8 | 45.3 |
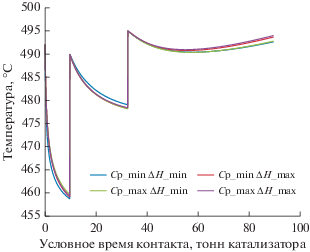
Согласно данным табл. 6 оптимальным является температурный режим 7, при котором достигается снижение содержания суммы ароматических углеводородов с 56 до 43 мас. %, при этом наблюдается уменьшение октанового числа с 92.7 до 90.3 пунктов по сравнению с исходным промышленным режимом (рис. 5).
На рис. 5 приведены неулучшаемые значения критериев оптимальности каталитического риформинга бензина. Технологические режимы входных температур в реактора на этой границе обеспечивают минимально возможное содержание ароматических углеводородов при максимальном октановом числе получаемого риформата.
ЗАКЛЮЧЕНИЕ
Таким образом, в представленной работе предлагается дополнить ранее разработанную авторами группированную кинетическую модель каталитического риформинга бензина учетом изменения объема реакционной смеси в ходе химических превращений. Для процесса каталитического риформинга бензина сформулирован алгоритм и определены термодинамические параметры для группированных индивидуальных углеводородов. Для разработанной математической модели поставлена обратная кинетическая задача восстановления кинетических параметров стадий. Определены функционалы невязки, учитывающие экспериментальные данные концентраций компонентов и изменение температур в ходе всего процесса. Рассчитаны концентрации групповых компонентов реакции каталитического риформинга бензина и полный температурный профиль процесса. Приведены результаты решения двухкритериальной задачи оптимизации по минимальному содержанию ароматических углеводородов при максимальном октановом числе риформата на основе разработанной кинетической модели.
Список литературы
Яковлев А.А., Ахметов А.Ф., Павлова И.Н. // Электрон. научн. журн. Нефтегазовое дело. 2006. № 2. С. 32.
Кондрашев Д.О., Ахметов А.Ф. // Электрон. научн. журн. Нефтегазовое дело. 2006. № 2. С. 34.
Исмагилов И.З., Матус Е.В., Нефедова Д.В., Кузнецов В.В., Яшник С.А., Керженцев М.А., Исмагилов З.Р. // Кинетика и катализ. 2015. Т. 56. № 3. С. 397.
Розовский А.Я., Кипнис М.А., Волнина Э.А., Самохин П.В., Лин Г.И. // Кинетика и катализ. 2008. Т. 49. № 1. С. 99.
Петров Р.В., Зирка А.А., Решетников С.И. // Кинетика и катализ. 2017. Т. 58. № 4. С. 410.
Зайнуллин Р.З., Коледина К.Ф., Ахметов А.Ф., Губайдуллин И.М. // Электрон. научн. журн. Нефтегазовое дело. 2018. № 6. С. 78.
Stijepovic M.Z., Ostojic A.V., Milenkovic I., Linke P. // Energy Fuels. 2009. № 23. P. 83.
Кравцов А.В., Иванчина Э.Д., Галушин C.А., Полубоярцев Д.С., Воропаева Е.Н., Мельник Д.И. // Изв. Томского политехнического университета. 2004. Т. 307. № 1. С. 119.
Гынгазова М.С., Кравцов А.В., Иванчина Э.Д., Короленко М.В., Уваркина Д.Д. // Катализ в промышленности. 2010. № 6. С. 41.
Джунусова А.А., Островский Н.М. // Динамика систем, механизмов и машин. 2002. № 3. С. 18.
Дюсембаева А.А., Вершинин В.И. // Катализ в промышленности. 2018. № 5. С. 70.
Загоруйко А.Н. / Химические технологии функциональных материалов. Материалы V Междунар. Российско-Казахстанской научно-практической конференции, посвященной 85-летию Казахского национального университета им. аль-Фараби. Новосибирск, 2019. С. 255.
Кленов О.П., Носков А.С. // Катализ в промышленности. 2003. № 2. С. 67.
Зайнуллин Р.З., Коледина К.Ф., Ахметов А.Ф., Губайдуллин И.М. // Кинетика и катализ. 2017. Т. 58. № 3. С. 292. (Zainullin R.Z., Koledina K.F., Akhmetov A.F., Gubaidullin I.M. // Kinetics and Catalysis. 2017. V. 58. №. 3. Р. 279.)
Прямые и обратные задачи в химической кинетике. Под ред. Быкова В.И. Новосибирск: Наука, 1993. 288 с.
Семиохин И.А. Физическая химия. Москва: МГУ, 2001. 272 с.
Коледина К.Ф., Губайдуллин И.М. // Журн. физ. химии. 2016. Т. 90. № 5. С. 671.
Димитров В.И. Простая кинетика. Новосибирск: Наука, 1982. 379 с.
Физико-химические свойства индивидуальных углеводородов (рекомендованные значения). Под ред. Татевского В.М. Москва: Гостоптехиздат, 1960. С. 263.
Ramage M.P., Graziani K.R., Krubeck F.J. // Chem. Eng. Sci. 1980. № 35. P. 41.
Гейтс Б., Кетцир Дж., Шуйт Г. Химия каталитических процессов. Москва: Мир, 1981. 551 c. (Bruce C. Gates, James R. Katzer, G.C.A. Schuit Chemistry of catalytic processes. New York: McGraw-Hill, 1979. 464 p.)
Smith R. // Chem. Eng. Prog. 1959. № 55. P.76.
Taskar U., Riggs J.B. // AIChE J. 1997. № 43. P. 740.
Padmavathi G., Chaudhuri K. K. // Can. J. Chem. Eng. 1997. № 75. P. 930.
Iranshahi D., Amiri H., Karimi M. // Energy Fuels. 2013. № 27. P. 4048.
Коледина К.Ф., Зайнуллин Р.З., Губайдуллин И.М., Ахметов А.Ф. Свидетельство о регистрации программы для ЭВМ RUS 2019613697 04.03.2019.
Зайнуллин Р.З., Губайдуллин И.М., Ахметов А.Ф., Коледина К.Ф. Свидетельство о регистрации программы для ЭВМ RUS 2019614867 14.02.2019.
Коледина К.Ф., Коледин С.Н., Щаднева Н.А., Губайдуллин И.М. // Журн. физической химии. 2017. Т. 91. № 3. С. 422. (Koledina K.F., Koledin S.N., Shchadneva N.A., Gubaidullin I.M. // Russ. J. Phys. Chem. A. 2017. V. 91. I. 3. Р. 444.)
Koledina K.F., Koledin S.N., Schadneva N.A., Mayakova Y.Yu., Gubaydullin I.M. // React. Kinet. Mech. Catal. 2017. T. 121. № 2. P. 425.
Nurislamova L.F., Gubaydullin I.M., Koledina K.F., Safin R.R. React. Kinet. Mech. Catal. 2016. V. 117. I. 1. P. 1.
Аттетков А.В., Галкин С.В., Зарубин В.С. Метод Хука–Дживса. Методы оптимизации. Москва: Изд-во МГТУ им. Н.Э. Баумана, 2003. 440 с.
Deb K., Mohan M. and Mishra S. Evolutionary Multi-Criterion Optimization. Springer: Faro, Portugal, April 8–11, 2003. P. 222.
Koledina K., Koledin S., Karpenko A., Gubaydullin I., Vovdenko M. // J. Math. Chem. 2019. V. 57. I. 2. P. 484.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ