Кинетика и катализ, 2020, T. 61, № 5, стр. 708-715
Влияние содержания Ag на активность катализаторов Ag/CeO2 в восстановлении 4-нитрофенола при комнатной температуре и атмосферном давлении
М. В. Черных a, *, Н. Н. Михеева a, В. И. Зайковский b, Г. В. Мамонтов a
a ФГАОУ ВО Томский государственный университет
634050 Томск, просп. Ленина, 36, Россия
b ФГБУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
* E-mail: msadlivskaya@mail.ru
Поступила в редакцию 16.12.2019
После доработки 02.03.2020
Принята к публикации 10.03.2020
Аннотация
Функционализированные ароматические амины являются важной основой для создания фармацевтических препаратов, агрохимикатов, полимеров, красителей и ряда других промышленно значимых продуктов. Каталитическое восстановление нитроаренов до ароматических аминов – один из наиболее часто используемых методов получения аминов как в промышленности, так и в лаборатории. В настоящей работе синтезированы катализаторы Ag/CeO2 с различным содержанием серебра (1, 3, 5 и 10 мас. %), исследованы физико-химические и каталитические свойства полученных систем. Показано влияние количества активного компонента (Ag) на активность катализатора в восстановлении 4-нитрофенола боргидридом натрия в воде при комнатной температуре и атмосферном давлении. С увеличением содержания серебра до 10 мас. % скорость реакции растет, однако величина абсолютной активности TOF снижается.
ВВЕДЕНИЕ
Процесс восстановления нитросоединений в соответствующие аминосоединения – важный промежуточный этап в производстве медикаментов, пластика, агрохимикатов и т.д. [1]. Перспективными катализаторами восстановления нитросоединений являются системы, которые позволяют проводить процесс в мягких условиях (при комнатной температуре, атмосферном давлении, с использованием безвредных растворителей), не содержат дорогостоящих благородных металлов (Pd, Au, Pt и др.), и характеризуются высокими показателями активности и селективности [2]. В настоящее время этим требованиям удовлетворяют серебросодержащие катализаторы, высокая активность которых достигается путем несложного регулирования размеров и форм частиц Ag на стадии синтеза [3]. Серебросодержащие системы также обладают относительно низкой стоимостью и не являются токсичными [4].
В качестве носителей серебряных катализаторов восстановления нитросоединений широкое применение находят многие оксиды металлов: Fe2O3 [5], Fe3O4 [6], SiO2 [7], CeO2 [8] и др., SBA-15 [9], углеродные нанотрубки [10], оксид графена [11], полимерные и другие композитные материалы [12]. CeO2 привлек внимание исследователей благодаря своим уникальным свойствам, позволяющим использовать его не только в качестве носителя в гетерогенном катализе, но и в топливных элементах, кислородных датчиках, механической полировке, ультрафиолетовых блоках и люминесцентных материалах [13]. Поверхностные оснóвные центры Люьиса и кислородные вакансии оксида церия могут принимать участие в переносе электронов по поверхности, что способствует перераспределению электронной плотности по поверхности активных центров [14]. Несмотря на низкую активность чистого CeO2 в реакциях восстановления нитросоединений, его использование в качестве носителя способствует диспергированию и стабилизации активного компонента (драгоценного металла), увеличению активности каталитической реакции за счет эффекта сильного взаимодействия ”металл–носитель” [15, 16].
По сравнению с другими благородными металлами, широко применяемыми в качестве активного компонента в катализаторах восстановления нитросоединений (Pt [17], Pd [18], Au [19] и др.), Ag обладает сопоставимой каталитической активностью, однако отличатся более низкой стоимостью [20], что делает его перспективным материалом для исследуемого процесса [3].
В настоящей работе были синтезированы катализаторы на основе CeO2 методом пропитки по влагоемкости при варьировании содержания серебра (1, 3, 5 и 10 мас. %), исследованы текстурные, физико-химические и каталитические свойства полученных образцов. Каталитические свойства изучали в реакции восстановления водного раствора 4-нитрофенола при помощи NaBH4 при комнатной температуре и атмосферном давлении.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез катализаторов
Носитель (CeO2) был получен термическим разложением шестиводного нитрата церия (Ce(NO3)3 · · 6H2O, х. ч., “Lanthan”, Россия). Для этого предшественник подвергали ступенчатой сушке: 120°С – 30 мин, 180°С – 30 мин, 250°С – 5 ч, и прокалке при температуре 500°С в течение 4 ч.
Серебросодержащие катализаторы готовили пропиткой по влагоемкости с использованием водного раствора нитрата серебра, варьируя расчетное содержание серебра в катализаторе: 1, 3, 5 и 10 мас. % Ag (образцы 1Ag/CeO2, 3Ag/CeO2, 5Ag/CeO2, 10Ag/CeO2 соответственно). Все образцы сушили при 80°С в течение 12 ч.
Методы исследования
Адсорбционные характеристики полученных катализаторов исследовали методом низкотемпературной адсорбции азота (–196°С) на приборе 3Flex (“Micromeritics”, USA). Перед анализом все образцы подвергли дегазации в вакууме в течение 2 ч при 200°С. Величину удельной поверхности определяли с применением многоточечного метода БЭТ по спрямлению изотермы адсорбции в диапазоне Р/Р0 от 0.05 до 0.30.
Фазовый состав и структурные параметры образцов изучали на дифрактометре XRD-6000 (“Shimadzu”, Япония) при CuKα-излучении. Анализ фазового состава проведен с использованием баз данных PDF 4+, а также программы полнопрофильного анализа POWDER CELL 2.4.
Исследование структуры образцов методом просвечивающей электронной микроскопии (ПЭМ) проводили с помощью микроскопа JEM-2200 FS (“JEOL”, Япония) с разрешением 0.1 нм при ускоряющем напряжении 200 кВ.
Особенности восстановления Ag и CeO2 изучали методом температурно-программируемого восстановления водородом (ТПВ-H2) на приборе AutoChem 2950 (“Micromeritics”, США) в токе газовой смеси 10% H2/Ar при линейном нагреве от –50 до 900°С со скоростью 10 град/мин. Для работы в области отрицательных температур использовали специальную приставку CryoCooler (“Micromeritics”, США), дозирующую жидкий азот в печь прибора. Перед ТПВ-экспериментом образцы окисляли в токе воздуха (20 мл/мин) при 500°С в течение 20 мин.
Каталитический эксперимент
Каталитические свойства полученных образцов исследовали в модельной реакции восстановления 4-нитрофенола в водном растворе боргидридом натрия при комнатной температуре и атмосферном давлении. Для этого к 50 мл 0.15 ммоль/л раствора 4-нитрофенола при постоянном перемешивании добавляли 100-кратный избыток NaBH4 и 6 мг катализатора [3]. Перед каталитическим экспериментом все образцы были предварительно обработаны в токе 10% H2/Ar 20 мин при 500°С. Кинетику расходования 4-нитрофенола изучали путем снятия УФ-спектров на приборе Solar PB 60 (“СОЛАР”, Беларусь), полоса поглощения 4-нитрофенолят-иона при длине волны 400 нм. Для расчета конверсии нитрофенола проводили калибровку в рабочем диапазоне концентраций. Дополнительно осуществляли хроматографический анализ конечной реакционной среды на приборе Кристалл 5000.2 (“ХРОМАТЭК”, Россия, колонка ZB-1) для оценки полноты превращения 4-нитрофенола и селективности. Согласно данным хроматографического анализа для всех катализаторов Ag/CeO2 и конверсия 4-нитрофенола, и селективность по 4-аминофенолу были близки к 100%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Пористую структуру синтезированных образцов исследовали методом низкотемпературной адсорбции азота. Изотермы адсорбции–десорбции азота, распределения пор по размерам и текстурные характеристики приведены на рис. 1 и в табл. 1. Для всех исследуемых образцов на изотермах адсорбции–десорбции азота характерно наличие петли гистерезиса при относительном давлении 0.6–0.95, что свидетельствует о мезопористой структуре полученных катализаторов [21]. СеО2 имеет удельную поверхность 75.6 м2/г с преобладанием пор размером 5–20 нм.
Рис. 1.
Изотермы адсорбции–десорбции азота (а) и найденное методом BJH распределение пор по размерам (б) для полученных образцов.
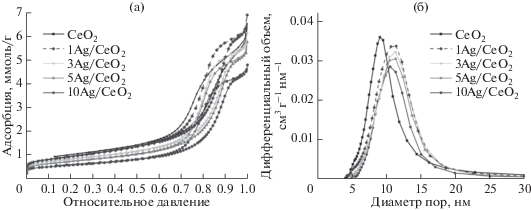
Таблица 1.
Свойства полученных образцов
| Образец | Удельная поверхность, м2/г | Объем пор, см3/г | Размер пор*, нм | ОКР $\left( {{\text{CeO}}_{{\text{2}}}^{{{\text{111}}}}} \right){\text{,}}$ нм | Поглощение Н2 в ТПВ-опытах, мкмоль/г | ||
|---|---|---|---|---|---|---|---|
| 50–130°С | 130–300°С | Σ | |||||
| CeO2 | 75.6 | 0.225 | 11.7 | 11.1 | – | – | – |
| 1Ag/CeO2 | 74.2 | 0.218 | 12.2 | 12.2 | 65 | 416 | 481 |
| 3Ag/CeO2 | 66.0 | 0.212 | 12.4 | 11.7 | 97 | 400 | 497 |
| 5Ag/CeO2 | 59.3 | 0.199 | 12.3 | 12.0 | 112 | 420 | 532 |
| 10Ag/CeO2 | 45.5 | 0.165 | 11.5 | 11.7 | 114 | 395 | 509 |
Из кривых на рис. 1б видно, что для всех серебросодержащих образцов распределение пор сходно с таковым для носителя, преобладающий диаметр пор составляет от 5 до 17 нм. По мере увеличения в образцах доли серебра уменьшаются удельная поверхность и объем пор, а также смещается максимум распределения пор в область больших размеров по сравнению с носителем CeO2.
Образцы с содержанием серебра 1, 3 и 5 мас. % обладают близкими к носителю значениями размера и объема пор, что может свидетельствовать о равномерном распределении серебра на поверхности оксида церия. Дальнейшее повышение количества серебра до 10 мас. % приводит к более значительному снижению удельной поверхности и объема пор по сравнению с исходным носителем CeO2.
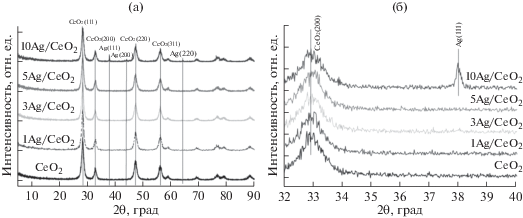
Методом рентгенофазового анализа исследован фазовый состав полученных образцов. На дифрактограммах (рис. 2) для всех образцов наблюдаются рефлексы при значениях углов 2θ = 28°, 32°, 47° и 56°, которые соответствуют фазе кубического оксида церия. Рефлексы при 2θ = 38°, 44° и 64° на дифрактограмме образца 10Ag/CeO2 свидетельствуют о формировании в нем металлических частиц Ag. Отсутствие рефлексов Ag-содержащих фаз для образцов 1Ag/CeO2, 3Ag/CeO2 и 5Ag/CeO2 указывает на их высокодисперсное состояние, т.е. на формирование частиц серебра размером менее 3–4 нм, что находится вне области детектирования методом РФА.
На рис. 3 представлены изображения ПЭМ ВР для катализаторов 1Ag/CeO2 и 10Ag/CeO2. Для образца 1Ag/CeO2 методом ПЭМ частицы серебра зафиксировать надежно не удается, однако на некоторых участках поверхности частиц СеО2 в режиме ПЭМ ВР (рис. 3а) зарегистрированы слабо окристаллизованные, размером 1–2 нм (d111 = 0.24 нм), или поликристаллические, размером до 3–4 нм, частицы серебра. Для образца 10Ag/CeO2 (рис. 3б), напротив, на поверхности оксида церия наблюдаются хорошо окристаллизованные частицы серебра размером 3–8 нм, что хорошо согласуется с данными РФА.
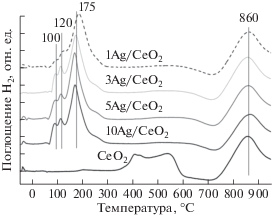
Методом температурно-программируемого восстановления водородом исследовали восстановительные особенности окисленных форм серебра и оксида церия в полученных катализаторах (рис. 4). Из представленных данных видно, что образец CeO2 имеет две области поглощения водорода: при температуре 350–600°С восстанавливается поверхность оксида церия [22], при температуре выше 700°С происходит восстановление объема частиц СеО2.
Серебросодержащие образцы характеризуются пиками поглощения водорода с максимумами около 80, 120, 180 и 860°С. При температурах ~80 и ~120°С происходит восстановление окисленных форм серебра [23]. При ~180°С восстанавливается поверхность частиц СеО2, а при ~860°С – объем частиц носителя [16]. Для образцов, в составе которых есть серебро, по сравнению с чистым СеО2 наблюдается сдвиг полосы восстановления поверхности частиц оксида церия в область более низких температур (с 350–600°С для чистого СеО2 до 120–300°С для Ag/CeO2), что говорит о наличии межфазного взаимодействия Ag–CeO2 в образцах [24, 25].
Профили ТПВ для Ag/CeO2 катализаторов имеют схожий характер, что указывает на восстановление центров схожей природы в этих образцах. С увеличением содержания серебра в катализаторах интенсивность низкотемпературных пиков возрастает (табл. 1), что говорит о повышении количества окисленных форм серебра. Однако для образцов 5Ag/CeO2 и 10Ag/CeO2 количество поглощенного в этой температурой области водорода сопоставимо (112 и 114 мкмоль/г соответственно). Полученные результаты свидетельствует о том, что для образца 10Ag/CeO2 серебро преимущественно (примерно 75%) присутствует в металлическом состоянии. Это хорошо согласуется с появлением рефлексов металлического серебра на рентгенограммах для этого образца (рис. 2). Таким образом, на основании данных ТПВ и РФА можно сделать заключение, что для образцов с содержанием серебра 1, 3 и 5 мас. % бóльшая его часть находится в высокодисперсном состоянии, преимущественно окисленном, стабилизированном на поверхности СеО2, без встраивания серебра в решетку оксида церия, что подтверждает сохранение параметра решетки СеО2. Для образца 10Ag/CeO2 серебро находится преимущественно в восстановленном состоянии, дисперсность частиц снижается.
Площадь пика поглощения водорода в профилях для катализаторов Ag/CeO2 в области 130–300°С, который относится к восстановлению поверхностного СеО2, находящегося в контакте с серебром, практически одинакова для всех образцов (395–420 мкмоль/г). Это указывает на то, что количество нанесенного серебра почти не влияет на реакционную способность поверхностного кислорода оксида церия.
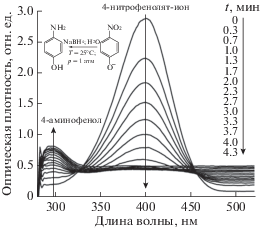
Каталитические свойства полученных образцов исследовали в реакции восстановления 4-нитрофенола в водном растворе боргидридом натрия (NaBH4) при комнатной температуре и атмосферном давлении (рис. 5). Так как полосы 4-нитрофенола и 4-аминофенола перекрываются [26], то за ходом реакции наблюдали по изменению интенсивности полосы поглощения (п. п.) при длине волны 400 нм, относящейся к 4-нитрофенолят-иону, который образуется в щелочной среде. На рис. 5 представлены спектры восстановления 4-нитрофенола в 4-аминофенол на катализаторе 1Ag/CeO2. По мере протекания реакции интенсивность п. п. 4-нитрофенолят-иона при 400 нм уменьшается, в то время как интенсивность п. п. 4-аминофенола при ~300 нм увеличивается.
На рис. 6а приведены кинетические кривые восстановления 4-нитрофенола на разных катализаторах, а также без катализатора (холостой опыт). Видно, что в отсутствие катализатора реакция не идет. CeO2 практически не катализирует данный процесс, а при добавление серебра в катализатор реакция происходит за 1–3 мин. В присутствии избытка боргидрида натрия реакция протекает по псевдопервому порядку [27], поэтому линеаризацию кинетических кривых принято проводить в рамках уравнения первого порядка (рис. 6б). По наклону кинетических кривых были определили константы скоростей восстановления 4-нитрофенола в 4-аминофенол на исследуемых катализаторах. Константы скоростей, а также сравнение их величин с таковыми для других известных из литературы катализаторов, приведены в табл. 2. Константа скорости восстановления 4-нитрофенола закономерно возрастает с увеличением содержания Ag в катализаторах от 1 до 10 мас. %.
Рис. 6.
Кинетические кривые (a) и линейные кинетические кривые (б) восстановления 4-нитрофенола в 4-аминофенол.
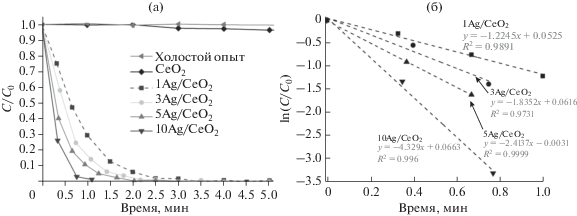
Таблица 2.
Каталитические характеристики катализаторов
| Образец | Время реакции, мин | Константа скорости реакции, мин–1 | TOF*, ч–1 | Ссылка на источник |
|---|---|---|---|---|
| 1Ag/CeO2 | 3.5 | 1.2245 | 573 | Настоящая работа |
| 3Ag/CeO2 | 2.5 | 1.8352 | 246 | |
| 5Ag/CeO2 | 2.0 | 2.4137 | 247 | |
| 10Ag/CeO2 | 1.1 | 3.7927 | 146 | |
| Pd/C | 6 | 0.77 | – | [30] |
| Pt/C | 30 | 0.058 | – | [31] |
| Pd/Fe2O3 | 5 | 0.359 | – | [31] |
| AgNPs/PAN | 70 | 0.046 | – | [31] |
| Ag@BCN | 6 | 0.196 | – | [32] |
| Ag/Fe2O3 | 30 | – | 219 | [5] |
| Ag@CeO2 | 2.2 | 0.033 | 139 | [33] |
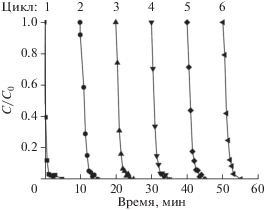
Для оценки стабильности катализатора проводили 6 последовательных экспериментов по восстановлению 4-нитрофенола в 4-аминофенол на образце 5Ag/CeO2 (рис. 7). Показано, что в первом цикле реакции полная конверсия достигается за ~2 мин, константа скорости составляет 2.4 мин–1. На втором и последующих циклах реакции полная конверсия происходит за ~3 мин, а константа скорости снижается до ~1.4 мин–1 и остается неизменной на протяжении 2–6 циклов. Таким образом, катализатор 5Ag/CeO2 является достаточно стабильным и пригоден для многократного использования. Уменьшение активности после первого цикла связано с изменением состояния активной поверхности за счет ее восстановления боргидридом натрия.
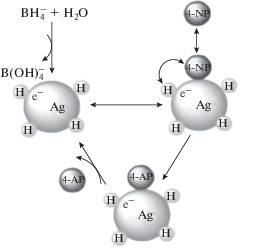
Механизм каталитической реакции восстановления нитроароматических соединений боргидридом натрия описывается в рамках теории Ленгмюра–Хиншельвуда и схематично представлен на схеме 1 [3]:
Схема 1 . Механизм восстановления 4-нитрофенола в 4-аминофенол на серебросодержащих катализаторах.
На первой стадии реакции на поверхности катализатора происходит гидролиз боргидрида натрия с образованием атомарного водорода, адсорбированного на поверхности частиц серебра. Одновременно с этим процессом сорбируются молекулы 4-нитрофенола. Затем адсорбированные молекулы нитрофенола и атомы водорода взаимодействуют друг с другом с образованием 4-нитрозофенола, который быстро восстанавливается в 4-гидроксиламинфенол, преобразующийся в конечное соединение – 4-аминофенол. Так как в растворе находится избыток NaBH4 и воды, то на поверхности частиц Ag сорбируется большое количество водорода. Вследствие этого скорость реакции зависит от количества адсорбированных молекул 4-нитрофенола и описывается реакцией псевдопервого порядка. Ключевым фактором в активности серебряных катализаторов в этой реакции считается активная поверхность серебра, поскольку именно она определяет скорость адсорбции и превращения нитрофенола [28].
При сравнении значений констант скоростей реакции и TOF (число оборотов реакции) в зависимости от содержания серебра в образцах (табл. 2) видно, что константа скорости восстановления 4-нитрофенола в 4-аминофенол повышается с увеличением количества серебра, что объясняется ростом его активной поверхности. Однако, сравнивая катализаторы по величине абсолютной активности (TOF), выраженной в количестве моль превращенного 4-нитрофенола на моль серебра в катализаторе в единицу времени, можно заметить, что с увеличением содержания серебра абсолютная активность падает. Соответственно, в образце 10Ag/CeO2 эффективность использования серебра ниже, чем в других катализаторах в этой серии. С возрастанием количества серебра от 1 до 10 мас. % происходит формирование более крупных частиц серебра, что было показано методами РФА и ПЭМ, для которых доля атомов Ag на поверхности (дисперсность) ниже.
Оценку дисперсности нанесенного серебра можно сделать по данным ТПВ-Н2. Пик при 50–130°С относится к восстановлению окисленных форм серебра, представляющих собой, предположительно, оксидную пленку AgOx, формирующуюся на поверхности высокодисперсных частиц серебра при их контакте с воздухом даже при комнатной температуре [29]. В условиях каталитического процесса под воздействием сильного восстановителя NaBH4 происходит легкое восстановление окисленных форм серебра с образованием высокодисперсных металлических кластеров/частиц Ag, количество которых и определяет активную поверхность катализатора. Из данных ТПВ-Н2 (табл. 1) видно, что с увеличением содержания серебра от 1 до 5% доля этих состояний растет, в то время как для образца 10Ag/CeO2 она сопоставима с таковой для образца 5Ag/CeO2. Таким образом, несмотря на бóльшую активность образца 10Ag/CeO2, эффективность использования серебра в этом образце значительно снижается. В связи с этим, а также с точки зрения экономической целесообразности, наиболее предпочтительно использование катализаторов с содержанием серебра 3–5 мас. %.
ЗАКЛЮЧЕНИЕ
Таким образом, катализаторы Ag/CeO2 обладают высокой каталитической активностью в реакции восстановления 4-нитрофенола в 4-аминофенол боргидридом натрия при комнатной температуре и атмосферном давлении. Приготовленные образцы сопоставимы и даже превосходят по своей активности другие известные из литературы серебросодержащие, платиновые и палладиевые катализаторы. Высокая активность серебросодержащих катализаторов в восстановлении 4-нитрофенола определяется как активной поверхностью частиц Ag, так и наличием межфазной границы Ag–CeO2, придающей катализатору уникальные свойства. Несмотря на уменьшение удельной поверхности и объема пор, внесение серебра на поверхность носителя методом пропитки приводит к формированию каталитически активных структур в реакции восстановления 4-нитрофенола. С увеличение содержания серебра в катализаторах Ag/CeO2 с 1 до 10 мас. % скорость реакции возрастает, однако эффективность использования атомов Ag падает из-за снижения дисперсности серебра.
Список литературы
Trandafir M.M., Moragues A., Amoros P., Parvulescu V.I. // Catal. Today. 2019. In Press. https://doi.org/10.1016/j.cattod.2019.02.053
Zhang K., Suh J.M., Choi J.-W., Jang H.W., Shokouhimehr M., Varma R.S. // ACS Omega. 2019. V. 4. P. 483.
Liao G., Gong Y., Zhong L., Fang J., Zhang L., Xu Z., Gao H., Fang B. // Nano Res. 2019. V. 12. P. 2407.
Goksu H., Sert H., Kilbas B., Sen F. // Curr. Org. Chem. 2017. V. 21. № 9. P. 794.
Patra A.K., Vo N.T., Kim D. // Appl. Catal. A: General. 2017. V. 538. P. 148.
Zhang R., Liu J., Li F., Wang S., Xia C., Sun W. // Chin. J. Chem. 2011. V. 29. P. 525.
Takenaka Y., Kiyosu T., Choi J.C., Sakakura T., Yasuda H. // Green Chem. 2009. V. 11. P. 1385.
Shukla A., Singha R.K., Sasaki T., Bal R. // Green Chem. 2015. V. 17. I. 2. P. 785.
Han J., Fang P., Jiang W., Li L., Guo R. // Langmuir. 2012. V. 28. P. 4768.
Wang H., Dong Z., Na C. // ACS Sustain. Chem. Eng. 2013. V. 1. P. 746.
Ye W., Yu J., Zhou Y., Gao D., Wang D., Wang C., Xue D. // Appl. Catal. B: Environ. 2016. V. 181. P. 371.
Zhang K., Suh J.M., Choi J.-W., Jang H.W., Shokouhimehr M., Varma R.S. // ACS Omega. 2019. V. 4. P. 483.
Saravanakumar K., Ramjan M.M., Suresh P., Muthuraj V. // J. Alloys Compd. 2016. V. 664. P. 149.
Trovarelli A., Llorca J. // ACS Catal. 2017. V. 7. I. 7. P. 4716.
Mitsudome T., Mikami Y., Matoba M., Mizugaki T., Jitsukawa K., Kaneda K. // Angew. Chem. 2012. V. 51. P. 136.
Grabchenko M.V., Mamontov G.V., Zaikovskii V.I., La Parola V., Liotta L.F., Vodyankina O.V. // Appl. Catal. B: Environ. 2020. V. 260. P. 118 148.
Qin G.W., Pei W., Ma X., Xu X., Ren Y., Sun W., Zuo L. // J. Phys. Chem. C. 2010. V. 114. P. 6909.
Baran N.Y., Baran T., Nasrollahzadeh M., Varma R.S. // J. Organomet. Chem. 2019. V. 900. P. 120 916.
Aswathy Aromal S., Philip D. // Spectrochim. Acta. A. 2012. V. 97. P. 1.
Budi C.S., Deka J.R., Saikia D., Kao H.M., Yang Y.C. // J. Hazard. Mater. 2020. V. 384. P. 121 270.
Thommes M., Kaneko K., Neimark A.V., Olivier J.P., Rodriguez-Reinoso F., Rouquerol J., Kenneth S.W. // Pure Appl. Chem. 2015. V. 87. P. 1051.
Mikheeva N.N., Zaikovskii V.I., Mamontov G.V. // Micropor. Mesopor. Mater. 2019. V. 277. P. 10.
Dutov V.V., Mamontov G.V., Zaikovskii V.I., Liotta L.F., Vodyankina O.V. // Appl. Catal. B: Environ. 2018. V. 221. P. 598.
Грабченко М.В., Мамонтов Г.В., Зайковский В.И., Водянкина О.В. // Кинетика и катализ, 2017. Т. 58. № 5. С. 654.
Grabchenko M.V., Mamontov G.V., Zaikovskii V.I., Parola V. La, Liotta L.F., Vodyankina O.V. // Catal. Today. 2019. V. 333. P. 2.
Schlichter S., Rocha M., Peixoto A.F., Pires J., Freire C., Alvarez M. // Polyhedron. 2018. V. 150. P. 69.
Wang Y.-Y., Shu Y., Xu J., Pang H. // CrystEngComm. 2017. V. 19. P. 684.
Liao G.F., Fang J.S., Li Q., Li S.H., Xu Z.S., Fang B.Z. // Nanoscale. 2019. V. 11. P. 7062.
Dutov V.V., Mamontov G.V., Zaikovskii V.I., Vodyankina O.V. // Catal. Today. 2016. V. 278. P. 150.
Jiang S.-F., Ling L.-L, Xu Z., Liu W.-J., Jiang H. // Ind. Eng. Chem. Res. 2018. V. 57. P. 13 055.
Liu Y., Jiang G., Li L., Chen H., Huang Q., Jiang T., Du X. // Mater. Res. Society Commun. 2016. V. 6. P. 31.
Qiu X., Liu Q., Song M. X., Huang C. // J. Colloid and Interface Sci. 2016. V. 477. P. 131.
Shi Y., Zhang X., Zhu Y., Tan H., Chen X., Lu Z.-H. // RSC Adv. 2016. V. 6. P. 47 966.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ