Кинетика и катализ, 2020, T. 61, № 6, стр. 804-811
Оценка применимости модельных и безмодельных методов кинетического анализа неизотермического пиролиза коры пихты
О. Ю. Фетисова a, *, Н. М. Микова a, О. П. Таран a
a ФИЦ КНЦ СО РАН Институт химии и химической технологии
660036 Красноярск, Академгородок 50/24, Россия
* E-mail: fetisova@icct.ru
Поступила в редакцию 04.02.2020
После доработки 05.03.2020
Принята к публикации 13.03.2020
Аннотация
На основании данных термогравиметрического анализа пиролиза коры пихты проведена оценка кинетических параметров процесса. Термохимические превращения биомассы коры проводились при скоростях нагрева 5, 10 и 20 град/мин в инертной среде (аргон). Результаты термогравиметрического (ТГ) и дифференциально-термогравиметрического (ДТГ) анализов исследованы в рамках модельных (Аррениуса, Коутса–Редферна), и безмодельных (Фридмана, Озавы–Флинна–Уолла) кинетических методов. Наиболее достоверными признаны значения энергии активации, полученные с применением безмодельных методов Озавы–Флинна–Уолла и Фридмана, которые составили, соответственно, 159 и 156 кДж/моль. Показано, что применение данных кинетических моделей позволяет установить более точные диапазоны температур разложения компонентов биомассы в условиях пиролиза.
ВВЕДЕНИЕ
Кородревесные отходы являются основными твердыми углеродсодержащими отходами современных деревообрабатывающих, целлюлозно-бумажных производств [1]. Они составляют до 21 мас. % от древесной биомассы [2], и только в Европе и Канаде образуются ежегодно в объеме 38 млн. м3 [3]. Данных о кородревесных отходах для России нам найти не удалось, однако оценки можно сделать из объема заготавливаемой древесины (300 млн м3 ежегодно) [4], т.е. объем отходов, образующихся в России, составляет 63 млн м3, что существенно превышает их количества для Канады и лесозаготавливающих стран Европы. В настоящее время более половины отходов коры сжигается или складируется, оставшаяся часть используется как дешевый источник энергии на целлюлозно-бумажных предприятиях или компостируется для применения в сельском хозяйстве. Кора характеризуется высоким содержанием золы, низкой точкой спекания и низкой теплотворной способностью по сравнению с древесиной. Следовательно, кора − плохое сырье для прямого производства энергии, а также для переработки в пеллеты и брикеты.
Перспективным методом переработки коры для получения топлив и химических веществ является пиролиз. Пиролиз – это процесс термического разложения растительной биомассы без доступа кислорода с образованием трех типов продуктов: твердых (древесный уголь), газообразных и жидких (бионефть). Этот способ превращения растительного сырья может осуществляться при значительной вариации параметров: температуры, времени обработки. Условия проведения пиролиза играют ключевую роль в соотношении выходов продуктов процесса [5]. Большинство имеющихся в литературе работ посвящено исследованию пиролиза лигноцеллюлозной биомассы (древесины, целлюлозы, лигнина, гемицеллюлоз) [6–8], а данных о процессах пиролиза коры к настоящему времени накоплено недостаточно.
Следовательно, изучение кинетики термического разложения биомассы является ключевым моментом эффективного прогнозирования термохимических процессов превращения биомассы в энергию и продукты. Установить основные кинетические параметры процесса пиролиза биомассы, в частности, энергию активации, позволяет анализ экспериментальных кривых термогравиметрического анализа (ТГ) [9].
При решении кинетических задач обычно используют два метода исследования термолиза – изотермический и динамический (неизотермический). Динамические методы термического анализа находят широкое применение для исследования кинетики реакций термического разложения, поскольку на практике химические процессы довольно часто протекают при переменных температурах. Важное преимущество динамических методов перед изотермическими состоит в их большей информативности и полноте описания кинетических реакций. Одна динамическая кривая изменения массы вещества эквивалентна большому числу соответствующих изотермических кривых [10, 11].
В свою очередь динамические методы можно разделить на два направления кинетического анализа: безмодельные (model-free) [12] и модельные (model-fitting) [13].
Широкое распространение получили модельные кинетические методы Аррениуса (А) [14] и Коутса–Редферна (КР) [15]. Применимость модельного метода расчета допускает использование одного термоаналитического измерения. В общем случае задача нахождения констант скорости реакции сводится к подбору и “подгонке” математической модели под экспериментально полученную кинетическую кривую или ее отдельные участки [16].
Безмодельные методы расчета кинетических параметров, такие как метод Фридмана (Ф) [17] или Озавы–Флинн–Уолла (ОФУ) [18], требуют построения кинетических кривых при разных скоростях нагрева. К несомненному их достоинству можно отнести возможность определения кинетических характеристик для каждого значения степени конверсии вещества, т.е. для разных этапов разложения. Кроме того, безмодельные кинетические методы не требуют предварительного знания о механизмах реакции.
Выбор математической модели, подходящей для определения кинетических характеристик пиролиза биомассы, вызывает определенные трудности из-за большого количества и разнообразия веществ, участвующих в различных параллельных и последовательных реакциях. Приведенные в литературе значения энергии активации термического разложения биомассы, рассчитанные разными методами, весьма вариабельны. Так, например, согласно расчетам по методу Бройдо и Коутса–Редферна, значения энергии активации (Еа) разложения древесины ели в аргоне весьма близки и составляют 70 [19] и 79 кДж/моль [20] соответственно. В то же время вычисления, выполненные методами Озава–Флинн–Уолла [21] и Фридмана [22] для термодеструкции сосны, дают сильно различающиеся значения Еa (96 и 146 кДж/моль соответственно).
Поэтому выработка рекомендаций для выбора и разработки адекватной кинетической модели пиролиза биомассы является важной исследовательской задачей. Понимание того, как условия процесса и характеристики исходной биомассы влияют на характеристики конечного продукта термического разложения, может существенно помочь в проектировании, эксплуатации и оптимизации технологических процессов и оборудования [23]. Достижения в области описания кинетических реакций пиролиза могут способствовать в свою очередь необходимому снижению затрат в общем процессе термохимической конверсии.
Настоящая работа посвящена термохимическому превращению коры пихты в условиях неизотермического пиролиза и изучению кинетики реакции с использованием результатов термогравиметрического (ТГ) и дифференциально-термогравиметрического (ДТГ) анализов.
Цель представленной работы состояла в сопоставлении значений энергии активации, полученных с использованием разных математических методов (модельных и безмодельных), а также в оценке их применимости к реакции термического разложения коры пихты.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектом исследования являлась кора пихты со следующим групповым составом (мас. %): целлюлоза – 18.6; лигнин – 28.8; гемицеллюлоз – 18.5; экстрактивные вещества – 30.0. Использовали фракцию частиц размером 0.05 ± 0.01 мм.
Термогравиметрическое исследование выполняли с применением прибора STA 449 F1 Jupiter (“NETZSCH”, Германия). Термодеструкцию образцов проводили в атмосфере аргона в интервале температур от 30 до 900°С, скорости потоков защитного и продувочного газов составляли 20 и 50 мл/мин соответственно. Нагрев образцов массой 10 мг осуществляли в динамическом температурном режиме при скоростях 5, 10 и 20 град/мин. Результаты измерений обрабатывали с применением пакета программ “NETZSCH. Proteus Thermal Analysis.5.1.0”, поставляемых с прибором.
Кинетические характеристики определяли, используя термогравиметрические данные, полученные при разных скоростях нагрева: 5, 10 и 20 град/мин.
Анализ кинетических зависимостей термодеструкции коры пихты проводили на основе термогравиметрических данных с использованием как модельных (Коутса–Редферна, Аррениуса), так и безмодельных методов (Фридмана, Озавы–Флинна–Уолла). Расчеты выполнены в программах Excel 2007 и OriginPro 8.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Термогравиметрическое исследование
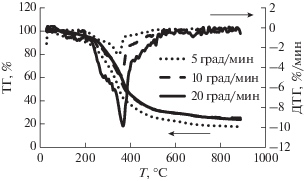
На рис. 1 представлены ТГ/ДТГ-профили термодеструкции коры пихты при скоростях нагрева 5, 10 и 20 град/мин. Как следует из приведенных термограмм, ДТГ-кривые разложения схожи между собой и имеют широкие пики в интервале от 200 до ~530°С, характеристичные для лигноцеллюлозной биомассы. В этой области температур происходит основное разложение вещества, сопровождающееся максимальной потерей массы (до 66%). “Плечо” на кривых ДТГ, относящимся к скоростям нагрева 5, 10 и 20 град/мин, имеет точки перегиба при температурах 253, 268 и 278°С соответственно, что обусловлено преимущественным разложением гемицеллюлоз и аморфной части целлюлозы [24–26].
Форма кривых ДТГ свидетельствует о том, что с увеличением скорости нагрева динамика процесса разложения остается прежней. Однако происходит расширение температурного интервала основного разложения, а пики на ДТГ-кривой термораспада коры пихты смещаются в сторону более высоких температур. При скоростях нагрева 5, 10 и 20 град/мин на профилях ДТГ биомассы наблюдаются максимумы скорости убыли массы при температурах 349, 358 и 369°С соответственно. Вероятно, при малой скорости нагрева, когда биомасса находится продолжительное время при сравнительно низких температурах, преимущественно протекают реакции, характеризующиеся незначительными энергиями активации. Процесс разложения в этом случае обусловлен последовательным разрывом лабильных связей и отщеплением нестойких функциональных групп в соответствии с энергией этих связей. При возрастании скорости нагрева процесс начинает терять селективность, в реакционной массе увеличивается количество продуктов разложения, деструкция которых требует повышенных энергетических затрат.
Характеристичный пик на кривой ДТГ в температурном интервале 350–400°С принято связывать с терморазложением кристаллической формы целлюлозы и частично лигнина [22]. В температурном интервале 400–600°С преобладающим термохимическим процессом является разложение и превращение лигнина [22]. В этом интервале наблюдаются низкие значения потери массы (15 ± 1%), что может быть связано с ароматизацией лигнина [27]. Известно [28], что терморазложение лигнина происходит постепенно в интервале температур от 220 до 500°С, что проявляется на кривой ДТГ в виде широкого пика слабой интенсивности. В связи с этим оказывается трудно установить более точные диапазоны термохимической конверсии лигнина в составе биомассы.
Полученные результаты ТГ/ДТГ-анализа были использованы для расчета энергии активации пиролиза коры пихты. Ввиду того, что пиролиз лигноцеллюлозной биомассы включает целый ряд одновременно и/или последовательно протекающих химических реакций, сопровождаемых потерей массы, основную кинетическую характеристику процесса пиролиза – энергию активации – следует рассматривать как эффективный, или кажущийся параметр.
Исследование кинетики термического разложения коры пихты проводилось исходя из предположения о первом порядке реакции пиролиза биомассы [29].
Кинетические модели
Расчет основного кинетического параметра – энергии активации, основывался на обобщенном фундаментальном выражении (1) скорости твердофазной реакции при неизотермических условиях:
(1)
$\frac{{{\text{d}}\alpha }}{{{\text{d}}T}} = \frac{A}{\beta }{{e}^{{\frac{{ - {{E}_{{\text{a}}}}}}{{RT}}}}}f(\alpha ),$Вычисления проводили с использованием двух разных методов расчета кинетических параметров: модельного (model-fitting) − Коутса–Редферна (КР), Аррениуса (А) – и безмодельного или изоконверсионного (model-free) − Озавы–Флинна−Уолла (ОФУ), Фридмана (Ф).
Модельные (model-fitting) методы
Метод Коутса–Редферна. Основное уравнение:
(2)
${\text{ln}}\left[ {\frac{{g\left( {\alpha } \right)}}{{{{T}^{2}}}}} \right] = {\text{ln}}\left( {\frac{{AR}}{{{\beta }{{E}_{{\text{a}}}}}}} \right) - \frac{{{{E}_{{\text{a}}}}}}{{RT}},$Графическая интерпретация уравнения (2) для определения кинетических параметров термогравиметрических кривых реакции первого порядка использует следующее уравнение:
(3)
${\text{ln}}\left[ { - \frac{{{\text{ln}}\left( {1 - {\alpha }} \right)}}{{{{T}^{2}}}}} \right] = {\text{ln}}\left( {\frac{{AR}}{{{\beta }{{E}_{{\text{a}}}}}}} \right) - \frac{{{{E}_{{\text{a}}}}}}{{RT}}~.$Зависимость ${\text{ln}}\left[ { - \frac{{\ln (1 - \alpha )}}{{{{T}^{2}}}}} \right]$ от 1/Т аппроксимируется линейной функцией. Применимость выбранной модели оценивается квадратом коэффициента корреляции, который характеризует степень линейной связи выбранных величин. При совпадении экспериментальных и теоретических данных, квадрат коэффициента корреляции равен 1. Энергия активации определяется, исходя из тангенса наклона полученных прямых.
Метод Аррениуса. Модель Аррениуса является широко распространенным методом кинетического анализа. Для описания твердофазных реакций первого порядка кинетическая функция в уравнении (1) принимается как:
Уравнение (4) в комбинации с уравнением (1) приводит к основному выражению этого метода:
(5)
$\frac{{{\text{d}}\alpha }}{{{\text{d}}T}} = \frac{A}{{\beta }}{{e}^{{ - \frac{{{{E}_{{\text{a}}}}}}{{RT}}}}}\left( {1 - \alpha } \right).~$Логарифмируя уравнение (5) получаем:
(6)
$\ln \left( {\frac{{\frac{{{\text{d}}\alpha }}{{{\text{d}}T}}}}{{1 - \alpha }}} \right) = {\text{ln}}\frac{A}{{\beta }} - \frac{{{{E}_{{\text{a}}}}}}{{RT}}.$Энергия активации определяется из графика зависимости ${\text{ln}}\left[ {{{\left( {\frac{{{\text{d}}\alpha }}{{{\text{d}}T}}} \right)} \mathord{\left/ {\vphantom {{\left( {\frac{{{\text{d}}\alpha }}{{{\text{d}}T}}} \right)} {\left( {1 - \alpha } \right)}}} \right. \kern-0em} {\left( {1 - \alpha } \right)}}} \right]$ от 1/Т по тангенсу наклона равному –Еа/R.
Изоконверсионные или безмодельные (model-free) методы
Метод Фридмана. Кинетическое уравнение при динамических условиях нагрева имеет следующий вид:
(7)
${\text{ln}}\left[ {{{{\beta }}_{i}}{{{\left( {\frac{{{\text{d}}\alpha }}{{{\text{d}}T}}} \right)}}_{{\alpha ,i}}}} \right] = {\text{ln}}\left[ {{{A}_{\alpha }} \cdot f\left( \alpha \right)} \right] - \frac{{{{E}_{{\text{a}}}}}}{{RT}},~$При постоянной α зависимость ${\text{ln}}\left[ {{{\beta }_{i}}{{{\left( {\frac{{{\text{d}}\alpha }}{{{\text{d}}T}}} \right)}}_{{\alpha ,i}}}} \right]$ от 1/Т выражается прямой линией, по наклону которой может быть вычислена энергия активации (изоконверсионная линия). При графическом изображении зависимости (7) для разных степеней превращения получаем соответствующие различным стадиям процесса средние значения энергии активации. Изменение значений энергии активации может служить указанием на смену механизма реакции в ходе процесса.
Метод Озавы–Флинна–Уолла. Независимо друг от друга Озава, Флинн и Уолл разработали метод расчета неизотермической кинетики, основанный на следующем уравнении:
(8)
$\ln {{\beta }_{i}} = \ln \left[ {\frac{{{{A}_{\alpha }}{{E}_{{\text{a}}}}}}{{Rg(\alpha )}}} \right] - 5.331 - 1.052\frac{{{{E}_{{\text{a}}}}}}{{R{{T}_{{\alpha ,i}}}}}.$В основе использования метода ОФУ лежит предположение о том, что скорость реакции при постоянном значении α зависит только от температуры.
Отношение логарифма скорости нагрева (lnβ) к обратной температуре (1/Т) представляет прямую линию с наклоном равным −1.052Ea/R.
Анализ кинетики пиролиза коры пихты модельными методами
Использование модельных методов подразумевает два этапа. Первый этап − определение кинетической модели. Если выбрана подходящая, то зависимости ${\text{ln}}\left[ {{{\left( {\frac{{{\text{d}}\alpha }}{{{\text{d}}T}}} \right)} \mathord{\left/ {\vphantom {{\left( {\frac{{{\text{d}}\alpha }}{{{\text{d}}T}}} \right)} {\left( {1 - \alpha } \right)}}} \right. \kern-0em} {\left( {1 - \alpha } \right)}}} \right]$ от 1/Т (Аррениус) и ${\text{ln}}\left[ { - \frac{{\ln (1 - \alpha )}}{{{{T}^{2}}}}} \right]$ от 1/Т (Коутс−Редферн) аппроксимируются линейной функцией с максимальной величиной квадрата коэффициента корреляции (R2) [30]. На втором этапе проводят вычисление главного кинетического параметра пиролиза биомассы − энергии активации.
Рисунок 2 демонстрирует кинетические зависимости пиролиза биомассы построенные на основе модельных методов: Аррениуса (а) и Коутса−Редферна (б).
Рис. 2.
Линеаризация кинетического анализа методами Аррениуса (а) и Коутса–Редферна (б). Порядок реакции n = 1.
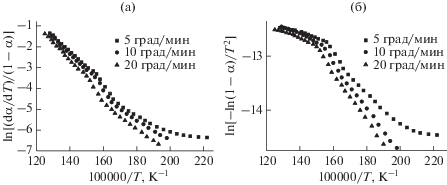
В целом, корреляция экспериментальных данных (табл. 1) не достаточно хорошая, а квадрат коэффициента корреляции не превышает 0.973 для (А) и 0.977 для (КР).
Таблица 1.
Кинетические параметры пиролиза коры пихты, полученные методами Аррениуса и Коутса–Редферна (n = 1)
| Метод | Энергия активации, кДж/моль (коэффициент корреляции R2) | ||
|---|---|---|---|
| скорость нагрева, град/мин | |||
| 5 | 10 | 20 | |
| Аррениуса | 50 (0.950) | 63 (0.970) | 69 (0.973) |
| Коутса–Редферна | 50 (0.966) | 65 (0.968) | 66 (0.977) |
Значения энергии активации пиролиза коры пихты, полученные двумя модельными методами, сопоставимы. Как видно, энергия активации конкретного вида биомассы слабо зависит от изменения скорости нагрева. Однако для обоих методов прослеживается одинаковая тенденция: с увеличением скорости нагрева энергия активации растет. Из уравнения Аррениуса
следует, что с повышением температуры скорость реакций возрастает тем быстрее, чем выше энергия активации. Поэтому ускорение нагрева должно приводить к относительному увеличению в реакционной массе продуктов реакций с высокой энергией активации, деструкция которых, в свою очередь, требует бóльших энергетических затрат.В литературе имеется ряд работ, в которых отмечены неудовлетворительные кинетические решения при применении model-fitting приемов [31, 32]. Можно предположить, что кинетический анализ с использованием модельных методов не подходит для описания всего процесса терморазложения биомассы, включающего множество реакций, протекающих одновременно и характеризующихся разными значениями Ea, очевидно заметно отличающимися от эффективной Ea.
Анализ кинетики пиролиза коры пихты безмодельными или изоконверсионными методами
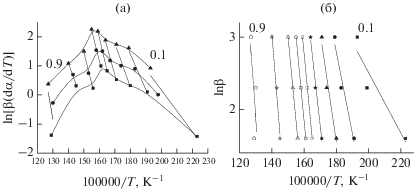
Графическая интерпретация кинетического анализа пиролиза коры пихты методами Фридмана и Озавы–Флинна–Уолла представлена на рис. 3.
Графические выражения уравнений (5) и (6) (метод Фридмана и Озавы–Флинна–Уолла соответственно)
продемонстрированы набором изоконверсионных линий (рис. 3), соединяющих точки с одинаковой степенью конверсии при разных скоростях нагрева.
Определение энергии активации проведено с помощью метода наименьших квадратов и аппроксимирования
зависимости ${\text{ln}}\left( {\frac{{{\text{d}}\alpha }}{{{\text{d}}t}}} \right)$ от 1/Т (Ф) и 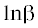 от 1/Т (ОФУ) к виду линейной функции и исходя из ее наклона. Полученные прямые показывают
высокий коэффициент корреляции (R2 ≥ 0.98) и обеспечивают хорошую сходимость с экспериментальными данными. Исключение
составляют крайние точки при степенях конверсии 0.1 и 0.9; из-за низкой корреляции
эти значения не включались в расчет средних величин. Энергию активации при степенях
конверсии 0.1 и 0.9 следует считать экстремальной, ее значения соответствуют разным
стадиям пиролиза: начальной (стадии потери влаги) и конечной (образованию коксового
остатка в конце пиролиза биомассы) [33].
от 1/Т (ОФУ) к виду линейной функции и исходя из ее наклона. Полученные прямые показывают
высокий коэффициент корреляции (R2 ≥ 0.98) и обеспечивают хорошую сходимость с экспериментальными данными. Исключение
составляют крайние точки при степенях конверсии 0.1 и 0.9; из-за низкой корреляции
эти значения не включались в расчет средних величин. Энергию активации при степенях
конверсии 0.1 и 0.9 следует считать экстремальной, ее значения соответствуют разным
стадиям пиролиза: начальной (стадии потери влаги) и конечной (образованию коксового
остатка в конце пиролиза биомассы) [33].
Графическая интерпретация метода Фридмана (рис. 3а) демонстрирует три пика в интервалах температур 176−313 (α ≤ 0.3), 337–395 (0.4 ≤ α ≤ 0.7) и 417–517°С (α ≥ 0.8). Число пиков и положение температурных интервалов соответствует обнаруженным диапазонам разложения гемицеллюлоз, целлюлозы и лигнина после ТГ/ДТГ-анализа (рис. 1). Изоконверсионные линии на графике метода Озавы–Флинна–Уолла (рис. 3б) характеризуются разными наклонами, что дает возможность объединить их в три группы аналогично результатам ТГ/ ДТГ-анализа.
Отметим, что применение данных кинетических методов позволяет установить более точные диапазоны температур разложения компонентов биомассы, тогда как на ТГ/ДТГ-кривых определить температурные границы термического превращения веществ довольно сложно из-за взаимного перекрывания сигналов.
Полученные с помощью этих методов значения энергии активации и коэффициента корреляции представлены в табл. 2.
Таблица 2.
Кинетические параметры пиролиза коры пихты, полученные методами Фридмана и Озавы–Флинна–Уолла
| α | Метод | |||
|---|---|---|---|---|
| Фридмана | Озавы–Флинна–Уолла | |||
| Еа, кДж/моль | R2 | Еа, кДж/моль | R2 | |
| 0.1 | 61 | 0.862 | 33 | 0.868 |
| 0.2 | 108 | 0.980 | 95 | 0.988 |
| 0.3 | 125 | 0.989 | 118 | 0.989 |
| 0.4 | 154 | 0.990 | 151 | 0.994 |
| 0.5 | 174 | 0.998 | 170 | 0.999 |
| 0.6 | 169 | 0.993 | 178 | 0.997 |
| 0.7 | 161 | 0.983 | 171 | 0.992 |
| 0.8 | 200 | 0.988 | 233 | 0.988 |
| 0.9 | 318 | 0.876 | 267 | 0.875 |
| Средние значения* | 156 | − | 159 | − |
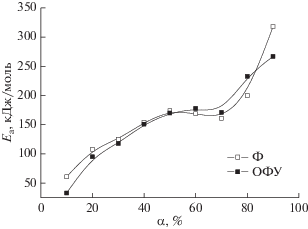
На основании данных табл. 2 была построена зависимость энергии активации от степени конверсии вещества в ходе пиролиза (рис. 4).
Значения энергии активации, рассчитанные методами Ф и ОФУ, различаются в зависимости от степени конверсии, что указывает на существование сложного механизма термической деструкции биомассы, происходящей в твердой фазе. Вместе с тем, ход кривых на рис. 4 почти идентичен, что говорит о хорошей сходимости данных, полученных разными методами.
На кривой зависимости Еа= f(α) (рис. 4) можно выделить три интервала: в первом (0.1 ≤ α ≤ 0.3) энергия активации увеличивается. В этом диапазоне температур (176–313°С) главным образом происходит разложение гемицеллюлоз и аморфной целлюлозы.
В температурной области от 337 до 395°С (0.4 ≤ ≤ α ≤ 0.7) деструкции подвергаются структуры с близкими значениями энергии активации (Еа≈ ≈ 170 кДж/моль). Можно предположить, что основной реакцией в этом диапазоне является разложение целлюлозы в составе коры. Согласно литературным сведениям энергия активации пиролиза целлюлозы лежит в диапазоне 100–200 кДж/моль [34], причем, как было показано в [35], кинетические параметры термической конверсии химически выделенной целлюлозы и целлюлозы в составе древесины (ель, эвкалипт) практически совпадают.
Кроме того, учитывая высокие значения коэффициента корреляции, можно говорить о хорошей применимости выбранных методов оценки кинетики в диапазоне степени превращения от 0.4 до 0.7.
На конечной стадии пиролиза коры пихты (α ≥ ≥ 0.8) наблюдается резкое увеличение значений энергии активации. При температурах свыше 500°С процесс деструкции лигнина включает как фрагментацию внутримолекулярных связей, так и образование мономерных продуктов распада (фенолов и их производных). Пиролитическая деградация лигнина при температурах выше 600–700°С сопровождается разложением некоторых ароматических соединений и формированием структуры угля [36].
Следует отметить, что вклад в образование высококонденсированных ароматических структур, очевидно, также вносят продукты термического превращения полифенольных веществ, содержащихся в значительных количествах (~10 мас. %) в экстрактивных веществах коры, – конденсированные таннины. В этом случае дополнительные реакции могут оказывать влияние на процесс термохимической конверсии, а значит, изменять кинетические параметры процесса. Хотя разные реакции вносят вклад в скорость образования того или иного продукта, в настоящей статье пиролиз коры рассматривается как совокупность первичных и вторичных реакций термических превращений с суммарной скоростью разложения компонентов биомассы, подчиняющейся первому порядку.
Довольно хорошая корреляция экспериментальных данных (0.980 ≤ R2 ≤ 0.999) позволяет говорить о применимости предложенных безмодельных методов оценки кинетики пиролиза коры пихты в выбранных условиях. Эти предположения находятся в хорошем соответствии с известными литературными данными [37, 38].
ЗАКЛЮЧЕНИЕ
На основе результатов термогравиметрического и дифференциально-термогравиметрического анализа получены сведения о реакционной способности коры пихты в условиях пиролиза (аргон, 30–900°С), необходимые для регулирования выходов целевых продуктов термоконверсии. Обнаружен эффект сдвига температуры начала основного разложения коры от 349 до 358 и 369°С при увеличении скорости нагрева от 5 до 10 и 20 град/мин соответственно, что позволяет корректировать время пребывания биомассы в реакторе в условиях реального процесса.
По данным ТГ/ДТГ-анализа проведена оценка основного кинетического параметра реакции пиролиза – энергии активации – с использованием методов безмодельной (Фридмана, Озавы–Флинна–Уолла) и модельной (Аррениуса и Коутса–Редферна) кинетики. Значения Еа, рассчитанные модельными методами, оказались гораздо ниже полученных безмодельными методами, а с увеличением скорости нагрева энергия активации повышалась: для метода Аррениуса – от 50 до 63 и 69 кДж/моль, а для метода Коутса–Редферна – от 50 до 65 и 66 кДж/моль при скоростях нагрева 5, 10 и 20 град/мин соответственно. Учитывая низкие значения квадрата коэффициентов корреляции (0.950 ≤ R2 ≤ 0.977), можно предположить, что кинетический анализ с использованием модельных методов не подходит для описания всего диапазона неизотермического пиролиза коры в выбранных условиях, поскольку одна кажущаяся энергия активации не может объяснить сложность реакции.
Безмодельные методы кинетического анализа показали хорошую сходимость результатов с высокой корреляцией (0.980 ≤ R2 ≤ 0.999). Средние значения Еа, рассчитанные с применением модели Фридмана, составили 156 кДж/моль, а по методу Озавы–Флинна–Уолла – 159 кДж/моль. С помощью вышеуказанных методов определены энергии активации пиролиза коры при различных степенях конверсии. Это позволяет подробно интерпретировать данные термического анализа, выделяя стадии пиролиза отдельных компонентов биомассы коры – гемицеллюлоз, целлюлозы и лигнина.
Список литературы
Производство целлюлозы, древесной массы, бумаги, картона. Информационно-технический справочник по наилучшим доступным технологиям ИТС 1-2015. М.: Бюро НДТ, 2015.
Feng S., Cheng S., Yuan Z., Leitch M., Xu C. // Renew. Sustain. Energy Rev. 2013. V. 26. P. 560.
Miranda I., Gominho J., Mirra I., Pereira H. // Ind. Crops Prod. 2012. V. 36. № 1. P. 395.
Российское государственное информационное агентство федерального уровня ТАСС. https://tass.ru/ ekonomika/6222445, режим доступа: свободный (30.01.2020).
Ding Y., Huang B, Li K., Du W., Lu K., Zhang Y. // Energy. 2020. V. 195. P. 117 010.
Lin B., Zhou J., Qin Q., Song X., Luo Z. // J. Anal. Appl. Pyrol. 2019. V. 144. P. 104 718.
Fermanelli C.S., Córdoba A., Pierella L.B., Saux C. // Waste Management. 2020. V. 102. P. 362.
Chen X., Che Q., Li S., Liu Z., Yang H., Chen Y., Wang X., Shao J., Chen H. // Fuel Proc. Technol. 2019. V. 196. P. 106 180.
Barneto A.G., Vila C., Ariza J., Vidal T. // Cellulose. 2011. V. 18. P. 17.
Doyle C.D. / Techniques and Methods of “Polymer Evaluation,” ch. 4. Eds. Slade P.E., Jenkins L.T., New York: Marsel-Dekker, 1966.
Уэндландт У. Термические методы анализа. М.: Мир, 1978. 515 с.
Opfermann J., Kaiserberger E., Flammersheim H.J. // Thermochim. Acta. 2002. V. 391. P. 119.
House J.E. Principles of Chemical Kinetics. London: Elsevier, 2007. 326 p.
Munir S., Sattar H., Nadeem A., Azam M. // Energy Sources. Part A. 2017. V. 39. P. 775.
Chen J., Fan X., Jiang B., Mu L., Yao P., Yin H., Song X. // Biores. Technol. 2015. V. 192. P. 592.
Козлов А.Н., Свищев Д.А., Худякова Г.И., Рыжков А.Ф. // Химия твердого топлива. 2017. № 4. С. 14.
Shin S., Im S.I., Nho N.S., Lee K.B. // J. Therm. Anal. Calorim. 2016. V. 126. P. 933.
Koga N. // J. Therm. Anal. Calorim. 2013. V. 113. № 3. P. 1527.
Лоскутов С.Р., Шапченкова О.А., Анискина А.А. // Сибирск. лесн. журн. 2015. № 6. С. 17.
Белый В.А., Удоратина Е.В., Кучин А.В. // Кинетика и катализ. 2015. Т. 56. № 5. С. 672.
Gu X., Zhou X., Wu M., Wang X., Chen Y., Cheng K. // Cell. Chem. Technol. 2017. V. 51. I. 5–6. P. 387.
Mishra G., Kumar J., Bhaskar T. // Biores. Technol. 2015. V. 182. P. 282.
Сафин Р.Г., Саттарова З.Г., Хабибуллин И.Г., Зиатдинов Р.Р., Степанова Т.О. // Вест. Технол. Ун-та. 2015. Т. 18. № 21. С. 90.
D’Almeida A.L.F.S., Barreto D.W., Calado V., D’Almeida J.R.M. // J. Therm. Anal. Calorim. 2008. V. 91. № 2. P. 405.
Genestar C., Pons C. // Microchim. Acta. 2008. V. 162. P. 333.
Korošec R.C., Lavrič B., Rep G., Pohleven F., Bukovec P. // J. Therm. Anal. Calorim. 2009. V. 98. № 1. P. 189.
Fisher T., Hajaligol M., Waymack B., Kellogg D. // J. Anal. Appl. Pyrol. 2003. V. 62. P. 331.
Sebio-Puñal T., Naya S., López-Beceiro J., Tarrío-Saavedra J., Artiaga R. // J. Therm. Anal. Calorim. 2012. V. 109. P. 1163.
Laidler K.J. Chemical Kinetics. McGraw-Hill Book Company, 1965.
Singh C.A.P., Singh N., Sarma A.K. // Fuel. 2013. V. 109. P. 217.
Ashraf A., Sattar H., Munir S. // Fuel. 2019. V. 240. P. 326.
Masnadi M.S., Habibi R., Kopyscinski J., Hill J.M., Bi X., Lim C.J., Ellis N., Grace J.R. // Fuel. 2014. V. 117. P. 1204.
Baroni É.G., Tannous K., Rueda-Ordóñez Y.J., Tinoco-Navarro L.K. // J. Therm. Anal. Calorim. 2016. V. 123. P. 909.
Марьяндышев П.А., Чернов А.А., Попова Е.И., Любов В.К. // Химия твердого топлива. 2016. № 3. С. 30.
Orfao J.J.M., Antunes F.J.A., Figueiredo J.L. // Fuel. 1999. V. 78. P. 349.
Tejado A., Peña C., Labidi J., Echeverria J.M., Mondragon I. // Biores. Technol. 2007. V. 98. P. 1655.
Burnham A.K. Global chemical kinetics of fossil fuels. Ch. 2. Springer International Publishing AG, 2017. 313 p.
Mureddu M., Dessì F., Orsini A., Ferrara F., Pettinau A. // Fuel. 2018. V. 212. P. 626.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ