Кинетика и катализ, 2020, T. 61, № 6, стр. 855-863
Закономерности формирования эффективных медьсодержащих катализаторов синтеза метанола
Т. П. Минюкова a, *, А. А. Хасин a, А. В. Хасин a, Т. М. Юрьева a
a ФГБУН Федеральный исследовательский центр Институт катализа им. Г.К. Борескова CO РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
* E-mail: min@catalysis.ru
Поступила в редакцию 10.02.2020
После доработки 31.03.2020
Принята к публикации 08.05.2020
Аннотация
Установлены закономерности формирования состава и структуры высокоэффективного катализатора синтеза метанола. Катализатор получают термообработкой совместного гидроксокарбоната CuZnAl(Cr) и последующей восстановительной активацией оксидного предшественника – анионно-модифицированного (а. м.) оксида цинка. Состав и структура гидроксокарбоната определяются природой и соотношением компонентов. В результате терморазложения гидроксокарбонатов при 550–650 К образуется оксидный катализатор, при более высокой температуре – неактивная смесь оксидов. Оксидный катализатор представляет собой смешанный оксид цинка, содержащий катионы Cu2+ и Al или Cr3+ и остаточные анионы (СО3)2– и ОН–, то есть анионно-модифицированный оксид.
ВВЕДЕНИЕ
Cu–Zn–Al(Cr)-катализаторы, известные своей высокой активностью и селективностью в синтезе метанола из синтез-газа с 1920-х гг., остаются предметом внимания исследователей до настоящего времени. В появившихся в последние годы публикациях активно обсуждается влияние параметров приготовления на их физико-химические свойства [1–8]. Вопрос о том, какую роль играют условия синтеза в формировании каталитических свойств катализаторов, имеет принципиальное значение, поскольку открывает путь направленного получения катализаторов с заданными свойствами. Несмотря на многочисленные проводимые в последние годы исследования, до сих пор нет единого мнения о химическом составе и структуре гидроксосоединения-предшественника, обеспечивающего получение высокоэффективного катализатора. Некоторые авторы полагают, что оптимальным является аурихальцит-гидроцинкит (CuxZny)5(OH)6(CO3)2 [9–11], другие – гидроксокарбонат Zn-малахит (CuxZny)2(OH)2CO3 [4, 12, 13]; называют также азурит Cu3(CO3)2(OH)2 и аморфный гидроксокарбонат меди–цинка – джорджеирит – (Cu,Zn)2(CO3)2(OH)2 [14–16].
Аналитическое рассмотрение технологии приготовления промышленных катализаторов синтеза метанола, проведенное в нескольких обзорах [17–19], показывает, что она включает несколько стадий, а именно: получение смешанного Cu–Zn–Al(Cr) гидроксокарбоната-предшественника методом соосаждения из водных растворов нитратов металлов раствором карбоната натрия; терморазложение гидроксокарбоната при мягких температурах с образованием смешанного оксида, восстановительную активацию катализатора водородом или реакционной смесью.
Ранее в 1995 г. [9] мы опубликовали исследование по формированию активного состояния Cu–Zn-оксидного катализатора синтеза метанола, высказав положение об особой роли низкотемпературных форм оксидов, названных анионно-модифицированными (а. м.). В работе [20] наши выводы, основанные на результатах РФА и термогравиметрии, были полностью подтверждены и уточнены несколько иным способом – по термическим эффектам в системе. Спустя еще 20 лет появилась серия тщательно выполненных с использованием современной техники работ немецких исследователей [21–24]. В них было высказано предположение об особой роли высокотемпературных карбонатов (HT-CO3) в Cu–Zn–Al-катализаторах. Мы полагаем, что наблюдаемые карбонаты представляют собой анионно-модифицированнные оксиды. Важно отметить, что возвращение к рассмотрению этих проблем спустя несколько лет оправдано, поскольку изменились возможности физико-химических методов исследования.
В настоящей работе рассмотрено влияние на свойства катализатора состава гидрооксокарбоната и температуры его термообработки. Выявлены закономерности регулирования в ходе многоступенчатого синтеза состава и структуры предшественников и обоснован выбор способа получения высокоэффективных Cu–Zn–Al(Cr)-катализаторов синтеза метанола. Поскольку известно, что промышленные Cu–Zn–Al(Cr)-катализаторы мало отличаются соотношением компонентов Cu : Zn, и в их состав обычно входит от 3 до 15 ат. % Al или Cr [25, 26], исследование было выполнено с использованием серии образцов с содержанием Al или Cr 10–15 ат. % и переменным отношением Cu : Zn.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение и характеризация гидроксокарбонатов
Образцы были получены методом соосаждения из водных растворов нитратов металлов раствором карбоната натрия при температуре 338–343 К, интенсивном перемешивании и постоянном рН 6.8 ± 0.1. Старение суспензии в условиях соосаждения продолжалось 1 ч. Время старения выбрано с учетом литературных данных [10] и результатов наших предварительных опытов, показавших, что основные изменения фазового состава осадков происходят в первые полчаса. Осадок отмывали от катионов натрия до содержания менее 0.01 вес. %, затем 12 ч высушивали на воздухе при 363 К.
В табл. 1 приведены химический и фазовый составы образцов с широким варьированием соотношения Cu : Zn и приблизительно постоянным (10–15 ат. %) содержанием Al или Cr.
Таблица 1.
Катионный и фазовый состав Cu–Zn–Al(Cr)-катализаторов
| Катионный состав | Фазовый состав | |
|---|---|---|
| 363 К, воздух | 573–753 К, N2 | |
| Cu0.10Zn0.90 | Гидроцинкит | ZnO, вюрцит |
| Cu0.20Zn0.80 | Гидроцинкит | ZnO + CuO, вюрцит + тенорит |
| Zn0.85Cr0.15 | Гидроцинкит | ZnO, вюрцит |
| Cu0.05Zn0.80Cr0.15 | Аурихальцит | ZnO, вюрцит |
| Cu0.10Zn0.80Al0.10 | Аурихальцит | ZnO, вюрцит |
| Cu0.15Zn0.70Cr0.15 | Аурихальцит | ZnO, вюрцит |
| Cu0.20Zn0.70Al0.10 | Аурихальцит | ZnO, вюрцит |
| Cu0.20Zn0.65Cr0.15 | Аурихальцит | ZnO, вюрцит |
| Cu0.25Zn0.60Cr0.15 | Аурихальцит | ZnO, вюрцит |
| Cu0.30Zn0.60Al0.10 | Аурихальцит | ZnO + сл. CuO, вюрцит + тенорит |
| Cu0.40Zn0.50Al0.10 | Аурихальцит | ZnO + сл. CuO, вюрцит + тенорит |
| Cu0.40Zn0.45Cr0.15 | Аурихальцит + сл. малахит | ZnO + сл. CuO, вюрцит + тенорит |
| Cu0.50Zn0.40Al0.10 | Аурихальцит + малахит | ZnO + CuO, вюрцит + тенорит |
| Cu0.60Zn0.30Al0.10 | Аурихальцит + малахит | ZnO + CuO, вюрцит + тенорит |
| Cu0.70Zn0.20Al0.10 | Малахит | CuO + ZnO |
| Cu0.70Zn0.15Cr0.15 | Аурихальцит + малахит | ZnO + CuO, вюрцит + тенорит |
| Cu0.80Zn0.10Al0.10 | Малахит | CuO + ZnO |
| Cu0.85Cr0.15 | Малахит | CuO, тенорит |
Дифференциальный термической анализ (ДТА) гидроксосоединений был выполнен на установке STA-409 (“Netzsch”, Германия) с параллельным масс-спектрометрическим анализом в токе аргона. Скорость повышения температуры до 1173 К составляла 10 K/мин. Навеска образца была около 15 мг.
Рентгенодифракционные исследования проводили на дифрактометре D-8 (“Bruker”, Германия) с использованием CuKα-излучения (с графитовым монохроматором на отраженном пучке). Съемки осуществляли методом сканирования по точкам с шагом 0.02°–0.05° по 2θ и временем накопления 5 с в точке. Точность измерения углов Δθ = 0.01°–0.02°, межплоскостных расстояний Δd ≈ 10–3 Å.
Исследование каталитических свойств в реакции синтеза метанола
Катализаторы испытывали в проточно-циркуляционной лабораторной установке при атмосферном давлении, 493 К, составе исходной рабочей смеси СО : СО2 : Н2 = 20 : 5 : 75. Загрузка катализаторов составляла 0.15–0.30 г, скорость подачи исходной реакционной смеси – 9–39 нл/ч. Катализаторы активировали в реакционной смеси при температурах 543 и 623 К. Состав продуктов анализировали газохроматографическим методом на приборе Цвет 500 (Россия) с пламенно-ионизационным детектором. Компоненты смеси разделяли на колонке с Porapak Q. Скорость реакции определяли по скорости образования продукта – метанола. Варьирование скорости подачи газовой смеси позволило изменять концентрацию метанола на выходе из реактора от 0.3 до 7.4 × 10–3 об. % и, таким образом, получить зависимость ее от времени контакта. Активность разных катализаторов сравнивали при постоянной концентрации метанола, равной 1 × 10–3 об. %. Точность определения концентрации метанола составляла ±10%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Разложение гидроксокарбонатов. Формирование оксидного состояния и активация
Катионный и фазовый составы наиболее представительных образцов на стадиях соосаждения и термообработки представлены в табл. 1. Можно видеть, что при содержании Al или Cr 10–15 ат. % структурный тип гидроксокарбоната зависит от соотношения Cu : Zn.
Если в состав образца входит не более 25–30 ат. % Cu, то образуются гидроксокарбонаты со структурой типа гидроцинкита-аурихальцита; с увеличением количества меди появляется фаза гидроксокарбоната со структурой типа малахита-розазита, а при содержании Cu более 60 ат. % эта фаза становится преобладающей.
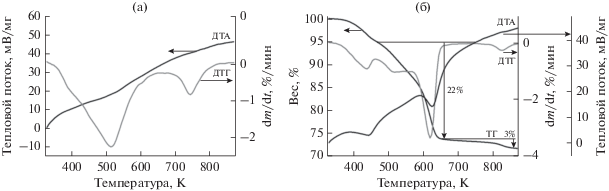
На рис. 1 приведены термические кривые образцов катионного состава Cu0.20Zn0.70Al0.10 и Cu0.20Zn0.70Cr0.10 до стадии термической обработки, а на рис. 2 – дифрактограммы этих же образцов (кривые 1 и 2 соответственно). Их сравнение показывает, что Cu–Zn–Al- и Cu–Zn–Cr-образцы имеют похожий фазовый состав. В образцах катионного состава Cu0.20Zn0.70Al0.10 и Cu0.20Zn0.70Cr0.10 при соосаждении образуются гидроксокарбонаты со структурой типа аурихальцита (Zn,Cu)5(CO3)2(OH)6 [PCPDFWIN – 00-17-0743]. Как видно из рис. 1, разложение гидроксокарбонатов происходит в области 533–673 K с потерей веса ~22%, затем в области 723–793 K с потерей веса ~3%; последний эндотермический эффект переходит в экзотермический при более высоких температурах. Данные РФА показывают, что после превращения на первом этапе образцы имеют структуру оксида цинка типа вюрцита и представляют собой твердый раствор катионов Cu2+ и Al3+ или Cu2+ и Cr3+ в ZnO, содержащем около 3 вес. % остаточных анионов. После нагрева на втором этапе, сопровождающегося разложением с экзотермическим эффектом, в образцах содержится смесь хорошо окристаллизованных стехиометрических оксидов CuO и ZnO и Cu–Zn–Al- или Cu–Zn–Cr-шпинели.
Рис. 1.
Термические кривые исходных образцов катионного состава Cu0.20Zn0.70Al0.10 и Cu0.20Zn0.70Cr0.10 со структурой типа аурихальцита, полученные в токе аргона.
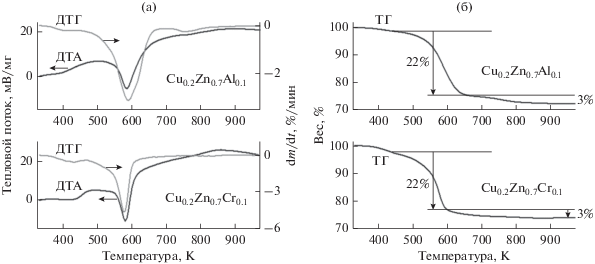
Рис. 2.
Дифрактограммы исходных образцов катионного состава: 1 – Cu0.20Zn0.70Al0.10; 2 – Cu0.20Zn0.70Cr0.10; 3 – Cu0.30Zn0.60Al0.10; 4 – Cu0.40Zn0.50Al0.10; 5 – Cu0.50Zn0.40Al0.10; 6 – Cu0.60Zn0.30Al0.10; 7 – Cu0.70Zn0.20Al0.10; 8 – Cu0.80Zn0.10Al0.10. Вертикальные линии снизу показывают положения наиболее интенсивных линий гидроксокарбоната со структурой типа гидроцинкита-аурихальцита (Zn,Cu)5(CO3)2(OH) [PCPDFWIN v.1 17-0713, 14-0256].
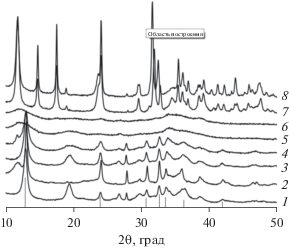
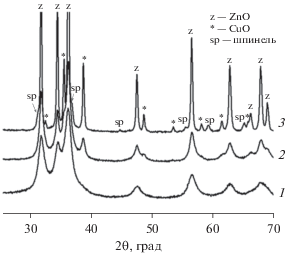
Поэтапное превращение гидроксокарбоната в оксиды демонстрирует рис. 3, на котором представлены дифрактограммы образца катионного состава Cu0.20Zn0.70Al0.10 после термообработок при 673, 873 и 1023 K. Можно видеть, что термообработка при температуре 673 K, соответствующей первому этапу превращения гидроксокарбоната, приводит к формированию однофазного образца ZnO со структурой типа вюрцита, содержащего остаточные анионы (а. м.) [PCPDFWIN – 00-36-1451]. Повышение температуры до 873 K сопровождается кристаллизацией фазы оксида меди со структурой типа тенорита, а при дальнейшем нагреве образуется смесь трех оксидных фаз – оксидов цинка и меди и шпинели (Cu,Zn)Al2O4.
Рис. 3.
Дифрактограммы образца катионного состава Cu0.20Zn0.70Al0.10 после термообработки при 673 (1), 873 (2) и 1023 K (3).
Термические кривые с результатами масс-спектрометрического анализа выделяющегося CO2 (m/z = 44) образца Cu0.30Zn0.60Al0.10 со структурой типа аурихальцита приведены на рис. 4а. Терморазложение происходит в два этапа. Как показывает анализ, на первом этапе регистрируются пары воды (не показаны на рисунке) и СО2, в то время как второй этап терморазложения сопровождается образованием в основном CO2. Практически такое же поэтапное превращение Cu-содержащих гидроксокарбонатов наблюдали в работе [27] для гидроксокарбоната катионного состава Cu0.40Zn0.60, фазовый состав которого описывается как аурихальцит M5(CO3)2(OH)6 или цинк–малахит [M2(CO3)(OH)2], где M – CuxZn(1 −x).
Рис. 4.
Термические кривые и результат масс-спектрометрического анализа выделяющегося СО2 (m/z = 44) для образцов катионного состава Cu0.30Zn0.60Al0.10 со структурой типа аурихальцита (а) и Cu0.40Zn0.50Al0.10 со структурой типа аурихальцита и розазита (б).
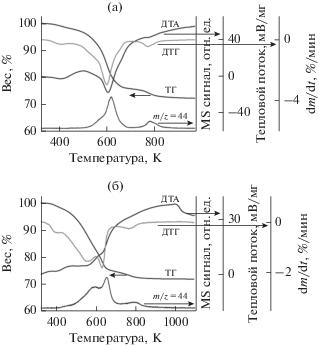
При содержании меди в образцах 40–60 ат. % образуется смесь гидроксокарбонатов со структурами типа аурихальцита и малахита-розазита [PCPDFWIN – 00-36-1475]; количество фазы со структурой типа малахита возрастает по мере увеличения доли меди (рис. 2, кривые 4–6). На рис. 4б и 5а приведены результаты термического анализа для образцов катионного состава Cu0.40Zn0.50Al0.10 и Cu0.60Zn0.30Al0.10, соответственно. Форма термических кривых отражает терморазложение гидроксокарбонатов двух типов (аурихальцита и малахита), которое происходит в две стадии: 1) эндотермические эффекты с минимумами при 558 и 633 K относятся к формированию оксидов, содержащих остаточные анионы; 2) широкий эндотермический эффект в области температур 673–803 K, сопровождающийся потерей веса 3%, указывает на удаление остаточных анионов из а. м. оксидов ZnO и CuO, имеющих структуру вюрцита и тенорита соответственно; далее наблюдается широкий экзотермический эффект в области 700–1000 K, который характеризует кристаллизацию стехиометрических CuO, ZnO и Cu–Zn–Al-шпинели. Потери массы на кривой ДТГ совпадают с максимумами скорости выделения СО2 на масс-спектрометрической кривой для образца Cu0.40Zn0.50Al0.10 (рис. 4б).
Дифрактограммы образцов с высоким содержанием меди катионного состава Cu0.70Zn0.20Al0.10 и Cu0.80Zn0.10Al0.10 приведены на рис. 2 (кривые 7 и 8). Они соответствуют дифрактограммам гидроксокарбоната Cu,Zn(CO3)(OH)2 со структурой типа розазита-малахита [28, 29]. Термические кривые первого образца представлены на рис. 5б. Положения тепловых эффектов на этих кривых отражают разложение гидроксокарбоната со структурой розазита-малахита. Кроме эффекта в области 400 K, который связан с потерей адсорбированной воды, можно выделить следующие этапы превращения гидроксокарбоната в оксид. На первом этапе наблюдается эндотермический эффект с минимумом в области 600–650 K, который сопровождается потерей ~22% веса. По данным РФА (табл. 1) после превращения на первом этапе образцы представляют собой а. м. оксиды меди и цинка со структурами типа тенорита и вюрцита соответственно, содержащие остаточные анионы. Второй этап характеризуется слабым эндотермическим эффектом с минимумом при 800–810 K, который переходит в слабый экзотермический, при этом теряется около 2% веса и происходит кристаллизация оксидов, свободных от остаточных ионов. В образце катионного состава Cu0.85Cr0.15 после высокотемпературного превращения кроме фазы оксида меди появляется фаза хромита меди со структурой шпинели [29].
Рис. 5.
Термические кривые образцов катионного состава Cu0.60Zn0.30Al0.10 (а) и Cu0.70Zn0.20Al0.10 (б).
Итак, разложение исследованных гидроксокарбонатов с образованием оксидов происходит в два этапа – в области 500–650 К и выше 723 К. Следует отметить, что в более ранних работах термообработку гидроксокарбонатов рекомендовали проводить при 700–723 К, поскольку полагали, что при этих температурах достигается довольно полное их разложение.
Полученные в настоящем исследовании данные свидетельствуют, что на первом этапе разложения анионы ((СО3)2– и ОН–) удаляются не полностью, и образуются анионно-модифицированные (а. м.) оксиды, содержащие до 5 вес. % примесных (остаточных) анионов. На втором этапе разложения при более высоких температурах происходит разложение а. м. оксидов с удалением примесных анионов, сопровождающееся последующим экзотермическим процессом кристаллизации формирующихся оксидных структур – оксидов меди и цинка или алюминиевых и хромовых шпинелей.
В регулярных позициях стехиометрического оксида цинка со структурой типа вюрцита ионы меди размещаться не могут, поскольку тетраэдрическая координация кислородом для катионов Cu2+ энергетически невыгодна. Однако структура анионно-модифицированного соединения по нескольким существенным параметрам отличается от таковой для оксидов, свободных от примесных анионов. А именно, примесные анионы обеспечивают в а. м. оксиде структурные позиции, отличающиеся от тех, что характерны для идеального оксида. По данным исследований методами РФА, ДТА, ЭМ высокого разрешения и EXAFS в структуре а. м. оксидов в результате замещения анионов О2– на анионы OH- и (CO3)2– образуются протяженные дефекты, в которых ионы меди размещаются в виде кластеров различной морфологии и размера [11, 30–35]. Из данных УФ-Vis [36] следует, что ионы меди представляют собой кластеры малого размера и имеют плоскоквадратную координацию кислородом. В анионно-модифицированных Сu–Zn-образцах в оксидной фазе растворяется вплоть до 10 ат. % меди, в анионно-модифицированных Cu–Zn–Al(Cr)-образцах – до 20 ат. % меди, поскольку введение ионов Al3+ и Cr3+ повышает содержание примесных анионов ОН– и (СО3)2–. По мере дальнейшего возрастания количества меди до 60 ат. % ее доля в твердых растворах в виде кластеров также увеличивается до 25–30% для Cu–Zn- и 40–45% для Cu–Zn–Al(Cr)-образцов. Одновременно в образцах появляется фаза а. м. CuO.
Следовательно, примесные анионы в составе оксидов нельзя рассматривать лишь как “остаточные”, но необходимо принимать во внимание как примеси, модифицирующие структуру оксидов и существенно влияющие на их свойства.
Подробное исследование стадии термообработки медьсодержащего гидроксокарбоната типа цинк-малахита в работах [24, 37] привело авторов к выводу о том, что на первой стадии образуются “высокотемпературные карбонаты” (HT-CO3) и что значительное количество HT-CO3 в катализаторе после термообработки вредит, а небольшое, наоборот, оказывает положительное влияние на кристалличность и фазовую устойчивость. Эти результаты подтверждают полученные нами ранее данные: наблюдаемые примеси (HT-CO3) являются следствием образования оксидов, модифицированных остаточными анионами, на первой стадии термообработки гидроксокарбонатов.
Активированное состояние катализатора появляется в результате взаимодействия катализатора в окисленном состоянии с реакционной средой конкретной реакции. Согласно опубликованным результатам подробных исследований активированного состояния [35, 38] в реакциях синтеза метанола в катализаторах (Cu,Zn)Oх и (Cu,Zn,Al)Oх, представляющих собой а. м. оксиды со структурой типа вюрцита, образуются наночастицы металлической меди. Размер этих частиц, согласно проведенной оценке по области когерентного рассеяния, составляет приблизительно 3.5–5.0 нм для образца катионного состава Cu0.08Zn0.92 и 3–4 нм для Cu0.20Zn0.70Al0.10 [35]. Наблюдаемые соотношения интенсивностей полос на дифрактограммах и результаты исследования ЭМ высокого разрешения позволяют заключить, что образуются частицы металлической меди несовершенной формы, эпитаксиально связанные с поверхностью оксидной матрицы, содержащей диссоциативно адсорбированный водород [39]. Стабилизация наночастиц Cu0 происходит благодаря остаточным анионам, которые способствуют формированию протяженных дефектов. Эти результаты хорошо согласуются с данными других авторов для Cu–Zn–Al(Cr)-катализаторов [40–48]. В работах [23, 49, 50] были получены экспериментальные свидетельства декорирования наночастиц меди оксидными кластерами ZnOx или атомами Zn0.
Каталитические свойства Cu–Zn–Al(Cr)-катализаторов в реакции синтеза метанола
Были исследованы Cu–Zn- и Cu–Zn–Al(Cr)-катализаторы, полученные терморазложением гидроксокарбонатов при температурах первого этапа разложения (573–623 К) и активированные в условиях реакции синтеза метанола. Результаты исследования каталитических свойств в отношении реакции синтеза метанола представлены в табл. 2. Для полноты картины приведены также характеристики других медьсодержащих оксидных фаз, формирование которых возможно в изучаемой системе: Cu–Zn–Al(Cr)-шпинели и CuO. Как видно из табл. 2, активность катализаторов драматически зависит от структуры оксидных предшественников (типа вюрцита, шпинели, тенорита), и, следовательно, от структуры исходного гидроксокарбоната-предшественника (типа гидроцинкита, аурихальцита, гидроталькита, малахита-розазита). Наибольшей активностью обладают катализаторы со структурой оксидного предшественника типа вюрцита на основе а. м. ZnO, немодифицированного и модифицированного ионами Cr3+ и Al3+, с содержанием меди от 10 до 40 ат. %. Катализаторы Cu–Zn–Cr и Cu–Zn–Al со структурой типа дефектной шпинели значительно, более чем на порядок, уступают катализаторам на основе вюрцита; катализаторы со структурой типа тенорита в условиях реакции малоустойчивы.
Таблица 2.
Каталитические свойства оксидных Cu-содержащих катализаторов в синтезе метанола*
| Катионный состав и структура гидроксокарбоната | Фазовый состав и структура образцов | W, мM г-1 ч-1 × 102 | |
|---|---|---|---|
| а. м. оксиды | активированные | ||
| Cu0.10Zn0.90, гидроцинкит | ZnO, вюрцит | Cu0/ZnO | 5.5 |
| Cu0.20Zn0.80, аурихальцит | ZnO + CuO, вюрцит + тенорит | Cu0 + Cu0/ZnO | 8.0 |
| Cu0.20Cr0.15Zn0.65, аурихальцит | ZnO, вюрцит | Cu0/ZnO | 8.0 |
| Cu0.20Al0.15Zn0.6, аурихальцит | ZnO, вюрцит | Cu0/ZnO | 8.0 |
| Cu0.30Al0.12Zn0.58, аурихальцит | ZnO, вюрцит | Cu0/ZnO | 11.5 |
| Cu0.40Cr0.15Zn0.45, аурихальцит | ZnO + СuO, вюрцит + тенлорит | Cu0 + Cu0/ZnO | 15.5 |
| Cu0.40Al0.10Zn0.50, аурихальцит | ZnO + CuO, вюрцит + тенорит | Cu0 + Cu0/ZnO | 16.5 |
| Cu0.33Cr0.67, гидроталькит | CuCr2O4, шпинель | Cu0/CuCr2O4 | 0.3 |
| Cu0.33Al0.67, гидроталькит | CuAl2O4, шпинель | Cu0/CuAl2O4 | 0.3 |
| Cu0.23Zn0.10Cr0.67, гидроталькит | (CuZn)Cr2O4, шпинель | Cu0/(CuZn)Cr2O4 | 0.4 |
| Cu0.23Zn10Al67, гидроталькит | (CuZn)Al2O4, шпинель | Cu0/(CuZn)Al2O4 | 0.3 |
| Cu0.85(Zn,Al,Cr)0.15, гидроталькит | CuO, тенорит | Cu0/(Zn–Al–Cr)Оx | ниже экспериментальной возможности |
| Стандартный коммерческий Cu–Zn–Al | – | – | 16.0 |
Для объяснения зависимости активности катализатора от соотношения компонентов в нем рассмотрим каталитические свойства Cu–Zn–Cr-образцов со структурой типа вюрцита. Результаты представлены на рис. 6 [51]. Можно видеть, что по мере увеличения количества меди в образцах от 0 до 40 ат. % наблюдается линейный рост скорости реакции, далее кривая проходит через максимум при 40–60 ат. % Cu, и при дальнейшем возрастании доли меди скорость реакции падает. В случае проведения реакции при более высокой температуре (623 К) снижение активности образцов при увеличении содержания меди свыше 60 ат. % выражено гораздо значительнее. Подобный ход зависимости активности катализаторов в синтезе метанола от соотношения Cu : Zn в образце также наблюдали в работах [3, 42, 52]. В исходных образцах на основе а. м. ZnO при содержании меди до 20 ат. % присутствует только одна фаза – фаза твердого раствора ионов меди и хрома в анионно-модифицированном ZnO. При возрастании доли меди в катализаторах наряду с фазой твердого раствора на основе а. м. ZnO регистрируется фаза оксида меди. Как видно из рис. 6, каталитическая активность при этом продолжает расти.
Рис. 6.
Скорость реакции синтеза метанола при 493 K и 1 атм в зависимости от содержания меди в катализаторах CuхZn1–0.15– xCr0.15, активированных 2 ч в реакционной смеси при 540 (1) и 623 K (2) [51].
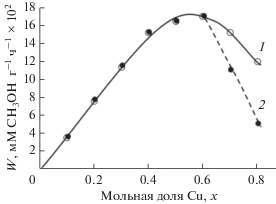
Поскольку непромотированный и промотированный ионами хрома/алюминия оксид меди малоактивен и неустойчив в условиях реакции синтеза метанола (табл. 2), наблюдающееся повышение активности с увеличением общего количества меди в образцах (рис. 6) может быть связано только с возрастанием содержания меди в твердом растворе на основе оксида цинка при одновременном образовании фазы СuО (см. обсуждение выше). Можно также отметить, что введение ионов хрома повышает не только активность, но и термостабильность катализатора. Для Cu–Zn–Al-образцов получены аналогичные зависимости.
Таким образом, каталитические свойства образцов в синтезе метанола определяются оксидами, содержащими остаточные анионы (CO3)2– и OH– (а. м. оксидами) и, следовательно, зависят от структуры исходного гидркосокарбоната.
ЗАКЛЮЧЕНИЕ
В результате проведенного в настоящей работе исследования были установлены закономерности формирования состава и структуры оксидных Cu–Zn–Al(Cr)-катализаторов, высокоэффективных в синтезе метанола
Принципиальным выводом является то, что катализатор с высокими характеристиками формируется только при активации а. м. оксида – оксида, содержащего остаточные анионы (CO3)2– и ОН–.
Cu-содержащий катализатор получают термообработкой гидроксокарбоната, структура которого определяется природой и отношением компонентов. В зависимости от состава может образовываться смесь гидроксокарбонатов различной структуры. В процессе термической обработки на воздухе и/или в инертном газе при 550–650 К разложение происходит с формированием оксидного катализатора, при более высокой температуре – неактивной смеси оксидов.
Оптимальным предшественником для катализатора синтеза метанола является гидроксокарбонат меди-цинка со структурой типа гидроцинкита-аурихальцита. Формирующийся при его термообработке твердый раствор ионов Cu2+ и Al3+ или Cr3+ в а. м. оксиде цинка после восстановительной активации обеспечивает высокую активность в синтезе метанола. Остаточные анионы создают дефекты в структуре а. м. оксида, обеспечивая взаимную растворимость оксидов.
Список литературы
Bems B., Schur M., Dassenoy A., Junkes H., Herein D., Schlögl R. // Chem. Eur. J. 2003. V. 9. P. 2039.
Sadeghinia M., Ghaziania A.N.K., Rezaei M. // Mol. Catal. 2018. V. 456. P. 38.
Jeong C., Suh Y-W. // Appl. Chem. Eng. 2016. V. 27. № 6. P. 555.
Güldenpfennig A., Distaso M., Peukert W. //Chem. Eng. J. 2019. V. 369. P. 996.
Jeong Y., Kim I., Kang J.Y., Jeong H., Park J.K., Park J.H., Jung J.C. // J. Mol. Catal. A: Chem. 2015. V. 400. P. 132.
Lee W.J., Bordoloi A., Patel J., Bhatelia T. // Catal. Today. 2020. V. 343. P. 183.
Mota N., Guil-Lopez R., Pawelec B.G., Fierro J.L.G., Navarro R.M. // RSC Adv. 2018. V. 8. P. 20619.
Sehested J. // J. Catal. 2019. V. 371. P. 368.
Плясова Л.М., Юрьева Т.М., Кригер Т.А., Макарова О.В., Зайковский В.И., Соловьёва Л.П., Шмаков А.Н. // Кинетика и катализ. 1995. Т. 36. № 3. С. 464.
Spenser M.S. // Catal. Lett. 2000. V. 66. P. 255.
Yurieva T.M. // React. Kinet. Catal. Lett. 1995. V. 55. № 2. P. 513.
Baltes C., Vukojevic S., Schűth F. // J. Catal. 2008. V. 258. P. 334.
Behrens M. // J. Catal. 2009. V. 267. P. 24.
Kondrat S.A., Smith P.J., Carter J.H., Hayward J.S., Pudge G.J., Shaw G.M., Spencer M.S., Bartley J.K., Taylor S.H., Hutchings G.J. // Faraday Discuss. 2017. V. 197. P. 287.
Smith P.J., Kondrat S.A., Chater P.A., Yeo B.R., Shaw G.M., Lu L., Bartley J.K., Taylor S.H., Spencer M.S., Kiely C.J., Kelly G.J., Park C.W., Hutchings G.J. // Chem. Sci. 2017. V. 8. P. 2436.
Pollard A.M., Spencer M.S., Thomas R.G., Williams P.A., Holt J., Jennings J.R. // Appl. Catal. A: Gen. 1992. V. 85. P. 1.
Chinchen G.C., Denny P.J., Jennings J.R., Spencer M.S., Waugh K.C. // Appl. Catal. 1988. V. 36. P. 1.
Waugh K.C. // Catal. Lett. 2012. V. 142. P. 1153.
Khassin A.A., Minyukova T.P., Yurieva T.M. // Mend. Commun. 2014. V. 24. № 2. P. 67.
Millar G.J., Holm I.H., Uwins P.J.R., Dennan J. // J. Chem. Soc. Faraday Trans. 1998. V. 94. P. 593.
Behrens M., Schlögl R. // Z. Anorg. Allg. Chem. 2013. V. 639. № 15. P. 2683.
Schumann J., Lunkenbein T., Tarasov A., Thomas N., Schlögl R., Behrens M. // ChemCatChem. 2014. V. 6. P. 2889.
Lunkenbein T., Schumann J., Behrens M., Schlögl R., Willinger M.G. // Angew. Chem. Int. Ed. 2015. V. 54. P. 4544.
Schumann J., Tarasov A., Thomas N., Schlögl R., Behrens M. // Appl. Catal. A: Gen. 2016. V. 516. P. 117.
Gogate M.R. // Petr. Sci. Technol. 2019. V. 37. № 6. P. 671.
Guil-López R., Mota N., Llorente J., Millán E., Pawelec B., García R., Fierro J.L.G., Navarro R.M. // Catal. Today.https://doi.org/10.1016/j.cattod.2019.03.034
Tarasov A., Schumann J., Girgsdies F., Thomas N., Behrens M. // Thermochim. Acta. 2014. V. 591. P. 1.
Roberts A., Jambor J., Grice J. // Powder Diffr. J. 1986. V. 1. P. 56.
Минюкова Т.П., Плясова Л.М., Юрьева Т.М., Литвак Г.С., Кетчик С.В. // Кинетика и катализ. 1989. Т. 30. С. 415.
Litvak G.S., Minyukova T.P., Demeshkina M.P., Plyasova L.M., Yurieva T.M. // React. Kinet. Catal. Lett. 1986. V. 31. P. 403.
Pelipenko V.V., Kochubey D.I., Khassin A.A., Yurieva T.M. // React. Kinet. Catal. Lett. 2005. V. 86. P. 307.
Khassin A.A., Pelipenko V.V., Minyukova T.P., Zaikovskii V.I., Kochubey D.I., Yurieva T.M. // Catal. Today. 2006. V. 112. P. 143.
Плясова Л.М., Юрьева Т.М., Кригер Т.А., Макарова О.В., Зайковский В.И., Соловьева Л.П., Шмаков А.Н. // Кинетика и катализ. 1995. Т. 36. С. 464.
Yurieva T.M., Plyasova L.M., Makarova O.V., Krieger T.A. // J. Mol. Catal. A: Chem. 1996. V. 113. P. 455.
Yurieva T.M., Plyasova L.M., Zaikovskii V.I., Minyukova T.P., Bliek A., van den Heuvel J.C., Davydova L.P., Molina I.Yu., Demeshkina M.P., Khassin A.A., Batyrev E.D. // Phys. Chem. Chem. Phys. 2004. V. 6. P. 4522.
Hadzhieva F.S., Anufrienko V.F., Yurieva T.M., Vorobiev V.N., Minyukova T.P. // React. Kinet. Catal. Lett. 1986. V. 30. P. 85.
Zwiener L., Girgsdies F., Brennecke D., Teschner D., Machoke A.G.F., Schlögl R., Frei E. // Appl. Catal. B: Env. 2019. V. 249. P. 218.
Yurieva T.M., Plyasova L.M., Krieger T.A., Zaikovskii V.I., Makarova O.V., Minyukova T.P. // React. Kinet. Catal. Lett. 1993. V. 51. P. 495.
Трунов В.А., Лебедев В.Т., Соколов А.Е., Грушко Ю.С., Торок Д., ван ден Хойвель И.К., Батырев Э., Юрьева Т.М., Плясова Л.М. // Кристаллография. 2007. Т. 52. № 3. С. 496.
Clausen B.S., Schiøts J., Gråbæk L., Ovesen C.V., Jacobsen K.W., Norskøv J.K., Topsøe H. // Top. Catal. 1994. V. 1. P. 367.
Hansen P.L., Wagner J.B., Helveg S., Rostrup-Nielsen J.R., Clausen B.S., Topsøe H. // Science. 2002. V. 295. P. 2053.
Guenter M.M., Ressler T., Berns B., Buescher C., Genger T., Hinrichsen O., Muhler M., Schlögl R. // Catal. Lett. 2001. V. 71. P. 37.
Kasatkin I., Kniep B., Ressler T. // Phys. Chem. Chem. Phys. 2007. V. 7. P. 878.
Behrens M., Studt F., Kasatkin I., Kühl S., Hävecker M., Abild-Pedersen F., Zander S., Girgsdies F., Kurr P., Kniep B.-L., Tovar M., Fischer R.W., Nørskov J.K., Schlögl R. // Science. 2012. V. 336. P. 893.
Wilkinson S.K., van de Water L.G.A., Miller B., Simmons M.J.H., Stitt E.H., Watson M.J. // J. Catal. 2016. V. 337. P. 208.
Tisseraud C., Comminges C., Belin T., Ahouari H., Soualah A., Pouilloux Y., Le Valant A. // J. Catal. 2015. V. 330. P. 533.
Le Valant A., Comminges C., Tisseraud C., Pinard C.C.L., Pouilloux Y. // J. Catal. 2015. V. 324. P. 41.
Tisseraud C., Comminges C., Pronier S., Pouilloux Y., Le Valant A. // J. Catal. 2016. V. 343. P. 106.
Kuld S., Thorhauge M., Falsig H., Elkaer C.F., Helveg S., Chorkendorff I., Sehested J. // Science. 2016. V. 352. P. 969.
Kröhnert J., Frei E., Schlögl R., Trunschke A. // Top. Catal. 2017. V. 60. P. 1735.
Минюкова Т.П., Хасин А.А., Юрьева Т.М. // Кинетика и катализ. 2018. Т. 59. № 1. С. 136.
Fujitani T., Nakamura J. // Catal. Lett. 1998. V. 56. P. 119.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


