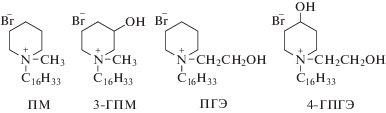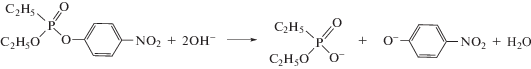Кинетика и катализ, 2020, T. 61, № 6, стр. 819-825
Каталитический эффект мицеллярных систем на основе гидроксипиперидиниевых поверхностно активных веществ в процессах гидролиза п-нитрофенилфосфоната
А. Б. Миргородская a, *, Ф. Г. Валеева a, Р. А. Кушназарова a, С. С. Лукашенко a, Л. Я. Захарова a
a Институт органической и физической химии им. А.Е. Арбузова ФИЦ Казанский научный центр РАН
420088 Татарстан, Казань, ул. Акад. Арбузова, 8, Россия
* E-mail: mirgoralla@mail.ru
Поступила в редакцию 23.03.2020
После доработки 15.04.2020
Принята к публикации 21.04.2020
Аннотация
Исследовано агрегационное поведение, солюбилизационное действие и каталитическая активность гексадецилпиперидиниевых ПАВ (в том числе функционализированных гидроксильными заместителями). Спектрофотометрическим методом изучена кинетика гидролитического расщепления необратимого ингибитора холинэстеразы этил(п-нитрофенил)этилфосфоната (армина) в мицеллярных растворах исследованных ПАВ. Показано, что мицеллярный каталитический эффект возрастает в ряду метил(гексадецил)пиперидинийбромид < метил(гексадецил)-3-гидроксипиперидинийбромид < 2-гидроксиэтил(гексадецил)пиперидинийбромид < 2-гидроксиэтил(гексадецил)-4-гидроксипиперидинийбромид) и наблюдаемое ускорение может достигать почти двух порядков.
Катионные поверхностно-активные вещества (ПАВ) находят широкое применение в современных технологиях в качестве моющих и смазочных жидкостей, ингибиторов коррозии, солюбилизаторов, переносчиков лекарственных и диагностических средств, антимикробных агентов [1–4]. Они играют важную роль в качестве мицеллярных катализаторов, влияющих на скорость и механизм практически важных химических превращений [5–8]. В частности, они значительно ускоряют процессы нуклеофильного замещения, что особенно ярко проявляется в случае ион-молекулярных реакций. Хорошо изучены в мицеллярных средах процессы с участием таких заряженных нуклеофилов, как галогенид, алкоксид, гидроксамат, иодозобензоат и др. анионы [9–11]. Особого рассмотрения заслуживают гидролитические процессы, протекающие в щелочных средах в присутствии катионных ПАВ [8, 12–16]. Концентрирование гидроксид-ионов у положительно заряженной мицеллярной поверхности увеличивает вероятность контакта между гидрофильным нуклеофилом и органическим субстратом, солюбилизированным в мицелле, что приводит к ускорению процесса. При этом в мицеллярных системах зачастую реализуется многоцентровый механизм связывания, включающий одновременное подключение электростатических, гидрофобных, а в некоторых случаях и специфических взаимодействий, что является ключевой составляющей при создании биомиметических систем, способных влиять на растворимость и реакционную способность взаимодействующих реагентов [8, 17–19]. Каталитическое действие катионных ПАВ широко используется при разложении фосфорорганических экотоксикантов и нейротоксинов [20–24]. Однако поиск новых мицеллярных систем, систематическое исследование взаимосвязей структура–активность сохраняют свою актуальность и широко представлены в современной научной литературе [25–28].
В связи с тем, что функционализация катионных ПАВ (например, введение ОН-групп) приводит к изменению их поведения и свойств в растворах [29–31], в настоящей работе значительный акцент был сделан на направленном дизайне и тестировании моно- и дигидроксипроизводных алкилпиперидиниевых амфифилов, имеющих заместители в различных положениях молекулы. Структурные формулы исследованных незамещенных и функционализированных пиперидиниевых ПАВ с одинаковым гидрофобным (гексадецильным) радикалом – метил(гексадецил)пиперидинийбромид (ПМ), метил(гексадецил)-3-гидроксипиперидинийбромид (3-ГПМ), 2-гидроксиэтил(гексадецил)пиперидинийбромид (ПГЭ) и 2-гидроксиэтил(гексадецил)-4-гидроксипиперидинийбромид (4-ГПГЭ) – приведены ниже.
Формулы исследованных гексадецилпиперидиниевых ПАВ.
Для установления зависимости структура–свойство было исследовано каталитическое влияние ПАВ на скорость гидролитического расщепления эфиров кислот фосфора. В качестве субстрата был выбран устойчивый к внешним воздействиям необратимый ингибитор холинэстеразы – этил(п-нитрофенил)этилфосфонат (армин), который часто используется в качестве модельного соединения при исследовании действия фосфорорганических экотоксикантов [32, 33].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследований применяли коммерческие образцы Твин 80, Оранж ОТ, армин (“Sigma-Aldrich”) с содержанием основного вещества 99%.
Гексадецилпиперидиниевые ПАВ синтезировали взаимодействием соответствующего производного пиперидина с гексадецилбромидом в этаноле с последующей перекристаллизацией [34].
Для приготовления растворов применяли воду, очищенную на установке Direct-Q 5 UV (“Merck Millipore”, Германия, рН 6.8–7, χ = 2–3 мкСм/см).
Удельную электропроводность образцов измеряли на кондуктометре WTW inoLab Cond 720 (“WTW”, Германия). Для определения точки Крафта использовали растворы ПАВ с концентрацией 1 мас. %. Растворы охлаждали до выпадения осадка ПАВ, затем по мере нагревания раствора измеряли электропроводность надосадочной жидкости (скорость нагревания 0.5°С/мин).
Спектры поглощения растворов записывали в термостатируемых кварцевых кюветах с толщиной поглощающего слоя 1 см на спектрофотометре Specord 250 Plus (“Analytik Jena AG”, Германия).
Солюбилизационное действие мицеллярных систем по отношению к красителю Оранж ОТ оценивали, определяя предельное содержание красителя в растворах ПАВ. Для этого готовили растворы ПАВ в интервале концентраций от 0.05 до 10 мМ, к которым добавляли фиксированное количество кристаллического Оранж ОТ. Приготовленные пробы перемешивали в течение 2 ч и оставляли на 48 ч при термостатировании (25°С) для достижения равновесия. Затем отделяли осадок, определяли значение оптического поглощения раствора (D) при 495 нм и с учетом коэффициента экстинкции красителя оценивали его содержание в пробе.
Поверхностный потенциал агрегатов определяли спектральным методом, исследуя изменение кислотно-основных свойств индикатора (п-нитрофенола) в зависимости от концентрации ПАВ в соответствии с работой [35]. Наблюдаемую величину рKап-нитрофенола (рKа,набл) вычисляли по уравнению Хендерсона–Хассельбаха.
В качестве константы диссоциации п-нитрофенола в мицеллярной фазе (Ka,m) принимали значение наблюдаемой константы диссоциации при СПАВ → ∞.
Кинетику щелочного гидролиза армина исследовали спектрофотометрическим методом. За протеканием процесса следили по изменению оптического поглощения реакционных растворов при длине волны 400 нм, отвечающей максимуму поглощения п-нитрофенолят-аниона. Начальная концентрация субстрата была (2–5) × 10–5 моль/л, степень превращения ‒ более 90%. Наблюдаемые константы скорости (kнабл) определяли из зависимости ln(D∞ – D) = –kнабл t + const, где D и D∞ ‒ оптическое поглощение реакционного раствора в момент времени t и по окончании реакции соответственно. Значения kнабл рассчитывали методом наименьших квадратов. Ошибка во всех экспериментах не превышала 4%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
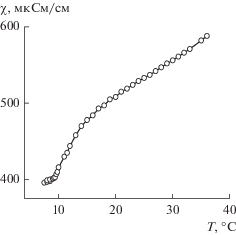
Функциональная активность растворов ПАВ проявляется при достижении определенных концентрационных и температурных порогов. В связи с этим на первом этапе работы исследовали агрегационное поведение гексадецилпиперидиниевых ПАВ. Методом кондуктометрии определяли значения критической концентрации мицеллообразования (ККМ) и температуру Крафта. Полученные данные представлены в табл. 1 и показаны на рис. 1 и 2. Видно, что, несмотря на различия в структуре, исследуемые ПАВ имеют близкие значения ККМ, однако температурные границы мицеллообразования снижаются по мере увеличения числа гидроксильных групп в молекуле. Кроме того, установлено, что наличие гидроксильной группы в пиперидиниевых ПАВ улучшает их растворимость в воде, что расширяет возможности их использования.
Таблица 1.
Агрегационные параметры гексадецилпиперидиниевых ПАВ и их солюбилизационная емкость по отношению к красителю Оранж ОТ
| ПАВ | ККМ × 10–3, моль/л | ТКр, оC | S, мольОранж/мольПАВ |
|---|---|---|---|
| ПМ | 1.2 | 26.5 | 0.030 |
| 3-ГПМ | 1.0 | 20.5 | 0.038 |
| ПГЭ | 0.85 | 19.0 | 0.042 |
| 4-ГПГЭ | 0.8 | 12.0 | 0.049 |
| ЦТАБ | 0.9 | 25.0 | 0.015 [29] |
Рис. 1.
Концентрационная зависимость удельной электропроводности гексадецилпиперидиниевых ПАВ ПМ и 4-ГПГЭ (25°С).
Сравнение способности гексадецилпиперидиниевых ПАВ повышать растворимость низко полярных органических соединений было проведено с помощью гидрофобного красителя Оранж ОТ, который широко применяется в качестве спектрального зонда для характеристики солюбилизационного действия мицеллярных растворов и определения критической концентрации мицеллообразования амфифильных соединений. В воде этот краситель практически не растворим, наблюдаемое резкое увеличение оптического поглощения при концентрации ПАВ выше ККМ отражает солюбилизацию красителя и рост его содержания в мицеллярных растворах. На рис. 3 представлены графики, характеризующие изменение оптического поглощения насыщенных растворов Оранж ОТ в зависимости от концентрации ПАВ, измеренные в максимуме поглощения при 495 нм (молекулярный коэффициент экстинкции ε = 18720 л моль–1 см–1), которые легли в основу определения солюбилизационной емкости (S). Значения этого параметра были рассчитаны по формуле S = b/ε, где b – тангенс угла наклона линейной части зависимости приведенного оптического поглощения от концентрации ПАВ.
Рис. 3.
Изменение оптического поглощения растворов Оранж ОТ в максимуме поглощения (495 нм) в зависимости от концентрации гексадецилпиперидиниевых ПАВ (25°С).
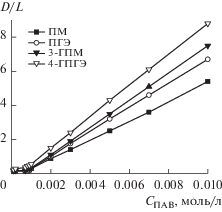
Из полученных результатов (табл. 1) следует, что солюбилизационная емкость гексадецилпиперидиниевых ПАВ увеличивается в ряду ПМ < < 3-ГПМ < ПГЭ < 4-ГПГЭ и в 2–3 раза превышает аналогичный показатель цетилтриметиламмонийбромида (ЦТАБ), который традиционно служит в коллоидной химии в качестве эталонного соединения. Вероятно, наличие гидроксильного фрагмента, способного к образованию водородной связи, наряду с гидрофобной и электростатической составляющими, дополнительно влияет на механизм солюбилизации гидрофобного красителя. Введение второй гидроксильной группы в структуру молекулы усиливает наблюдаемый эффект.
Для выяснения влияния структуры гексадецилпиперидиниевых ПАВ на скорость процесса нуклеофильного замещения в эфирах кислот фосфора была изучена кинетика щелочного гидролиза этил-4-нитрофенилового эфира этилфосфоновой кислоты (армина, схема 1 ).
Схема 1 . Щелочной гидролиз армина.
Следует отметить, что армин в водных растворах трудно гидролизуется (константа скорости второго порядка щелочного гидролиза составляет 0.155 л моль–1 с–1 [36]) и часто используется в качестве модели при разработке и тестировании систем, предназначенных для профилактики и лечения отравления фосфорорганическими соединениями [32].
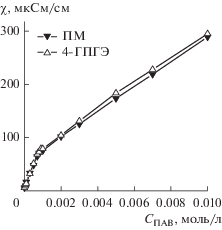
Кинетические эксперименты проводили в 0.01 М растворе гидроксида натрия при температуре 25°С. На рис. 4 представлены концентрационные зависимости наблюдаемой константы скорости гидролиза армина в мицеллярных растворах гексадецилпиперидиниевых ПАВ, из которых видно, что гидроксилсодержащие ПАВ существенно активнее незамещенного аналога, а наблюдаемый эффект выше, если ОН-группа находится не в цикле, а в заместителе у атома азота.
Рис. 4.
Концентрационные зависимости констант щелочного гидролиза армина в мицеллярных растворах гексадецилпиперидиниевых ПАВ (СNaOH = = 0.01 моль/л, 25°С).
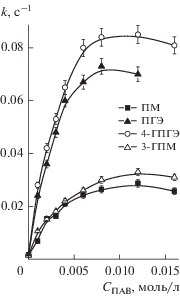
Зависимости (рис. 4) имеют типичный для мицеллярно катализируемых процессов вид: резкое увеличение наблюдаемой константы скорости при повышении концентрации ПАВ и ее последующий выход на плато, что позволяет применить для анализа кинетических данных уравнение псевдофазной модели мицеллярного катализа (уравнение (1)) [37]:
(1)
${{k}_{{набл}}} = \frac{{{{k}_{m}}{{K}_{S}}{{C}_{{ПАВ}}} + {{k}_{0}}}}{{1 + {{K}_{S}}{{C}_{{ПАВ}}}}},$Таблица 2.
Кинетические параметры щелочного гидролиза армина в присутствии гексадецилпиперидиниевых ПАВ (СNaOH = 0.01 моль/л, 25°С)
| ПАВ | km, с–1 | Ks, л/моль | ККМ*, моль/л | km/k0** |
|---|---|---|---|---|
| ПМ | 0.033 ± 0.002 | 839 ± 9 | 0.000734 ± 0.00003 | 21 |
| ПГЭ | 0.093 ± 0.004 | 465 ± 5 | 0.000687 ± 0.00002 | 60 |
| 4-ГПГЭ | 0.110 ± 0.008 | 359 ± 4 | 0.000163 ± 0.00001 | 73 |
| 3-ГПМ | 0.031 ± 0.002 | 821 ± 7 | 0.000501 ± 0.00002 | 20 |
Значения ККМ, определенные из кинетического эксперимента, оказались ниже данных кондуктометрии (табл. 1). Можно предположить, что щелочь, присутствующая в реакционной среде, выступает в роли электролитов, которые обычно облегчают процессы мицеллообразования в растворах катионных ПАВ и снижают ККМ.
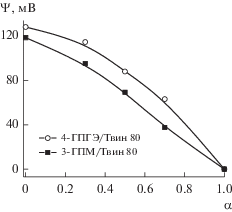
С целью поиска путей регулирования каталитического действия мицеллярных растворов гексадецилпиперидиниевых ПАВ нами была исследована скорость щелочного гидролиза армина в смешанных композициях с Твин 80. Процесс проводили в условиях варьирования соотношения катионного и неионного ПАВ, что обеспечивало изменение поверхностного потенциала мицеллы и, как следствие, влияло на ее взаимодействие с реагирующими веществами. Поверхностный потенциал (Ψ) индивидуальных и смешанных мицелл оценивали на примере систем 3-ГПМ/Твин 80 и 4-ГПГЭ/Твин 80 по методике [35] с использованием п-нитрофенола в качестве гидрофильного зонда. Суть метода состояла в том, что положение кислотно-основного равновесия п-нитрофенола сильно зависит от свойств среды и существенно сдвигается при переходе из воды в мицеллярные растворы. Наблюдаемое значение рKа этого зонда в растворах катионных ПАВ (pKa,m) зависит от электростатических взаимодействий в системе и определяется поверхностным потенциалом мицеллы. Эти параметры связаны между собой соотношением pKa,m = pKa,0 – F Ψ/2.303RT, где pKa,0 – неэлектростатическая составляющая, определяемая как рKап-нитрофенола в мицеллярных растворах на основе неионных ПАВ (Твин 80, рKа зонда = 7.6), F = 96485 Кл/моль – константа Фарадея, R = 8.314 Дж К–1 моль–1 – газовая постоянная. Таким образом, на основе значений pKaп-нитрофенола, определенных из спектрофотометрического эксперимента, выполненного в растворах ПАВ при различных рН, были рассчитаны величины поверхностного потенциала индивидуальных и смешанных мицелл (рис. 5). Значения Ψ для 3-ГПМ и 4-ГПГЭ достаточно типичны для катионных ПАВ (например, для ЦТАБ Ψ = 120–126 мВ [35]) и монотонно падают по мере увеличения мольной доли Твин 80 (α) в растворе.
Рис. 5.
Изменение поверхностного потенциала мицелл при варьировании соотношения ПАВ в бинарных системах (α – мольная доля неионного ПАВ, 25°С).
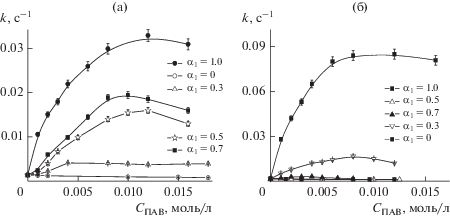
Можно было бы ожидать, что подобным образом при добавлении неионного ПАВ к гексадецилпиперидиниевым ПАВ должны меняться и константы скорости щелочного гидролиза армина. Результаты исследования кинетики этого процесса в системах 3-ГПМ/Твин 80 и 4-ГПГЭ/Твин 80 приведены на рис. 6. Видно, что по мере роста содержания неионного ПАВ в системе скорость процесса существенно замедляется. Однако для 3-ГПМ снижение скорости происходит монотонно, подобно изменению поверхностного потенциала, тогда как в смешанной системе на основе 4-ГПГЭ резкое падение каталитического эффекта наблюдается уже при мольной доле неионного ПАВ, равной 0.3. При этом соотношении сглаживается разница между двумя используемыми катионными ПАВ, которая столь очевидна в отсутствие Твин 80. Одним из вероятных объяснений этого явления может быть то, что в присутствии неионного ПАВ может снижаться доля реакционноспособной цвиттер-ионной формы 4-ГПГЭ, влияя на рKа этого соединения и тем самым уменьшая вклад в наблюдаемую константу скорости.
Рис. 6.
Зависимость наблюдаемой константы скорости щелочного гидролиза армина от общей концентрации ПАВ в смешанных системах 3-ГПМ/Твин 80 (а) и 4-ГПГЭ/Твин 80 (б) с различной долей катионного ПАВ (α1) при СNaOH = = 0.01 моль/л, 25°С.
Таким образом, на примере армина, устойчивого к гидролитическому расщеплению эфиру фосфоновой кислоты, показано, что гидроксипиперидиниевые ПАВ могут служить основой для создания эффективных каталитических систем, пригодных для концентрирования и разложения токсичных фосфорорганических соединений. В таких мицеллярных системах может быть достигнуто ускорение гидролиза вплоть до 2 порядков. Наблюдаемый эффект связан не только с солюбилизацией гидрофобного субстрата внутри мицеллы и концентрированием нуклеофильного реагента на ее положительно заряженной поверхности, но и со способностью некоторых гидроксипиперидиниевых ПАВ в щелочных средах образовывать цвиттер-ионную форму, выступающую в роли нуклеофила и дополнительно влияющую на механизм расщепления токсичных фосфорорганических соединений.
Список литературы
Tadros Th.F. Applied Surfactants: Principles and Application, Weinheim: Wiley-VCH, 2005.
Sar P., Ghosh A., Scarso A., Saha B. // Res. Chem. Intermed. 2019. T. 45. P. 6021.
Mirgorodskaya A.B., Kushnazarova R.A., Lukashenko S.S., Zakharova L.Ya. // J. Mol. Liq. 2019. V. 292. P. 111407.
Gabdrakhmanov D.R., Vasilieva E.A., Voronin M.A., Kuznetsova D.A., Valeeva F.G., Mirgorodskaya A.B., Lukashenko S.S., Zakharov V.M., Mukhitov A.R., Faizullin D.A., Salnikov V.V., Syakaev V.V., Latypov Sh.K., Zuev Yu.F., Zakharova L.Ya. // J. Phys. Chem. C. 2020. V. 124. № 3. P. 2178.
Lipshutz B.H., Ghorai S., Cortes-Clerget M. // Chem.-Eur. J. 2018. V. 24. № 26. P. 6672.
Sharma R., Gupta B., Yadav T., Sinha S., Sahu A.K., Karpichev Y., Gathergood N., Marek J., Kuca K., Ghosh K.K. // ACS Sustain. Chem. Eng. 2016. V. 4. № 12. P. 6962.
Sorella G.La., Strukul G., Scarso A. // Green Chem. 2015. V. 17. P. 644.
Zakharova L.Ya., Mirgorodskaya A.B., Zhiltsova E.P., Kudryavtseva L.A., Konovalov A.I. Molecular Encapsulation: Organic Reactions in Constrained Systems / Eds. Brinker U.H., Mieusset J.-L. Chichester: John Willey and Sons, 2010. P. 397.
Sahu Ch., Das A.K. // J. Chem. Sci. 2017. V. 129. P. 1301.
Kye Y.-S., Jeong K., Kim D. // Appl. Chem. Eng. 2019. V. 30. № 5. P. 513.
Morales-Rojas H., Moss R.A. // Chem. Rev. 2002. V. 102. № 7. P. 2497.
Orth E.S., Campos R.B. // J. Braz. Chem. Soc. 2016. V. 2. P. 285.
Xu D., Wang H., Pan Z., Zhang T. // J. Mol. Liq. 2018. V. 250. P. 223.
Al-Shamary M.N., Al-Lohedan H.A., Rafiquee M.Z.A., El-Ablack F., Issa Z.A. // J. Saudi Chem. Soc. 2017. V. 21. P. S193.
Mirgorodskaya A.B., Valeeva F.G., Lukashenko S.S., Prokopieva T.M., Zubareva T.M., Mikhailov V.A., Zakharova L.Y. // J. Mol. Liq. 2018. V. 250. P. 229
Kapitanov I.V., Mirgorodskaya A.B., Valeeva F.G., Gathergood N., Kuca K., Zakharova L.Ya., Karpichev Y. // Colloids Surf. A. 2017. V. 524. P. 143.
Wanderlind E.H., Orth E.S., Medeiros M., Santos D.M.P.O., Westphal E., Gallardo H., Fiedler H.D., Nome F. // J. Braz. Chem. Soc. 2014. V. 25. № 12. P. 2385.
Dwars T., Paetzold E., Oehme G. // Angew. Chem. Int. Ed. 2005. V. 44. P. 7174.
Fendler J.H. Membrane Mimetic Chemistry. N.Y.: Wiley, 1982.
Kumar P., Baghel M.S., Kumar A., Kumar D. // Imperial J. Interdisciplinary Research (IJIR) 2016. V. 2. № 9. P. 1776.
Um I.-H., Han J.-Y., Shin Y.-H., Dust J.M. // J. Phys. Org. Chem. 2017. V. 30. № 7. P. e3657.
Han X., Balakrishnan V.K., Buncel E. // Langmuir. 2007. V. 23. № 12. P. 6519.
Прокопьева Т.М., Капитанов И.В., Белоусова И.А., Шумейко А.Е., Кострикин М.Л., Туровская М.К., Разумова Н.Г., Попов А.Ф. // Журн. орган. химии. 2015. Т. 51. № 8. С. 1105.
Кузнецова Д.А., Габдрахманов Д.Р., Васильева Э.А., Лукашенко С.С., Ахтамянова Л.Р., Сираев И.Ш., Захарова Л.Я. // Журн. орган. химии. 2019. Т. 55. № 1. С. 22.
Steven A. // Synthesis. 2019. V. 51. № 13. P. 2632.
Abe Y., Watanabe H., Fujiwara M. // Langmuir. 2018. V. 34. № 46. P. 13979.
Acharjee A., Rakshit A., Chowdhury S., Malik S., Barman M.K., Ali M.A., Saha B. // J. Mol. Liq. 2019. V. 277. P. 360.
Chhetri N., Bhoite S. A., Singh A. K., Jain B. // Indian J. Chem. 2020. V. 59A. P. 551.
Zakharova L.Ya., Kashapov R.R., Pashirova T.N., Mirgorodskaya A.B., Sinyashin O.G. // Mendeleev Commun. 2016. V. 26. P. 457.
Rizvi S.A., Shi L., Lundberg D., Menger F.M. // Langmuir. 2008. V. 24. № 3. P. 673.
Kuznetsova D.A., Gabdrakhmanov D.R., Lukashenko S.S., Voloshina A.D., Sapunova A.S., Kulik N.V., Nizameev I.R., Kadirov M.K., Kashapov R.R., Zakharova L.Ya. // J. Mol. Liq. 2019. V. 289. P. 111058.
Прозоровский В.Б., Скопичев В.Г., Панченкова О.А. // Психофармакология и биол. наркология. 2008. Т. 8. С. 2457.
Туровская М.К., Михайлов В.А., Бураков Н.И., Капитанов И.В., Зубарева Т.М., Лобачев В.Л., Панченко Б.В., Прокопьева Т.М. // Журн. орган. химии Т. 53. № 3. С. 353.
Миргородская А.Б., Кушназарова Р.А., Лукашенко С.С., Захарова Л.Я. // Изв. АН. Сер. хим. 2019. № 2. С. 328.
Mchedlov-Petrossyan N.O. // Pure Appl. Chem. 2008. V. 80. P. 1459.
Бельский В.Е., Кудрявцева Л.А., Ильина О.М., Иванов Б.Е. // Журн. общей химии. 1979. Т. 49. № 11. С. 2470.
Березин И.В., Мартинек К., Яцимирский А.К. // Успехи химии. 1973. Т. 42. Р. 1729.
Bunton C.A., Ionescu L.G. // J. Am. Chem. Soc. 1973. V. 95. P. 2912.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ