Кинетика и катализ, 2020, T. 61, № 6, стр. 751-782
Семь современных трендов в области разработки катализаторов удаления оксидов азота
А. И. Мытарева a, *, Д. А. Бокарев a, А. Ю. Стахеев a
a ФГБУН Институт органической химии им. Н.Д. Зелинского РАН
119991 Москва, Ленинский просп., 47, Россия
* E-mail: aim@ioc.ac.ru
Поступила в редакцию 27.03.2020
После доработки 11.04.2020
Принята к публикации 14.04.2020
Аннотация
Ежегодно в результате антропогенной деятельности в атмосферу выбрасываются миллионы тонн оксидов азота (NOx = NO, NO2), представляющих серьезную угрозу для здоровья человека. Наиболее эффективным решением проблемы техногенной эмиссии NOx является каталитическая нейтрализация выхлопных газов автотранспорта и отходящих газов промышленных предприятий. На сегодняшний день существует ряд каталитических технологий удаления оксидов азота, однако в связи с низкой эффективностью при температурах 100–300°С их применение ограничено. Обзор посвящен современным тенденциям в области разработки высокоактивных катализаторов для удаления оксидов азота из выхлопных газов автотранспорта и отходящих газов химических производств при температурах ниже 300°С. Основное внимание уделено новым каталитическим системам на основе смешанных оксидов, гидротальцитов, перовскитов, узкопористы х цеолитов, металлоорганических каркасных структур (MOF), природных минералов и глин, а также гибридным катализаторам.
СОДЕРЖАНИЕ
Введение
1. Смешанные оксиды
2. Гидротальциты и слоистые двойные оксиды
3. Перовскиты
4. Узкопористые цеолиты
5. Металлоорганические каркасные структуры
6. Природные минералы и глины
7. Гибридные системы
Заключение
ВВЕДЕНИЕ
Высокие темпы развития химической и металлургической промышленности, энергетики и транспорта неизбежно ведут к загрязнению атмосферного воздуха оксидами азота (NOx – NO, NO2) – веществами, оказывающими негативное воздействие как на здоровье человека, так и на окружающую среду в целом. Превышение предельно допустимых концентраций NOx в воздухе делает человека более восприимчивым к патогенам, вызывающим заболевания дыхательных путей. Соединяясь с атмосферной влагой, NO и NO2 образуют разбавленные растворы азотистой и азотной кислот, выпадение которых в виде осадков (кислотных дождей) приводит к повышению кислотности почв, природных вод и деградации лесных массивов. Кроме того, NOx способствуют увеличению концентрации озона в приземном слое, а также участвуют в формировании фотохимического смога [1, 2].
Один из наиболее эффективных способов очистки промышленных газов и выхлопных газов автотранспорта от оксидов азота – их селективное каталитическое восстановление аммиаком (NH3-СКВ) [3, 4], суть которого заключается во взаимодействии NOx и NH3 с образованием безвредных продуктов: молекулярного азота и воды (I). Отличительной особенностью этой технологии является высокая селективность по N2 даже в присутствии большого избытка кислорода. Основной маршрут протекания восстановления NO аммиаком (так называемое “стандартное” NH3-СКВ) описывается уравнением (I):
(I)
$4{\text{NO}} + 4{\text{N}}{{{\text{H}}}_{3}} + {{{\text{O}}}_{2}} \to 4{{{\text{N}}}_{2}} + 6{{{\text{H}}}_{2}}{\text{O}}{\text{.}}$Также возможно протекание реакций NO-СКВ (II), “медленного” NH3-СКВ (III) и “быстрого” NH3-СКВ (IV) [5]:
(II)
$6{\text{NO}} + 4{\text{N}}{{{\text{H}}}_{3}} \to 5{{{\text{N}}}_{2}} + {\text{ }}6{{{\text{H}}}_{2}}{\text{O,}}$(III)
$6{\text{N}}{{{\text{O}}}_{2}} + 8{\text{N}}{{{\text{H}}}_{3}} \to 7{{{\text{N}}}_{2}} + 12{{{\text{H}}}_{2}}{\text{O,}}$(IV)
${\text{NO}} + {\text{N}}{{{\text{O}}}_{2}} + 2{\text{N}}{{{\text{H}}}_{3}} \to 2{{{\text{N}}}_{2}} + 3{{{\text{H}}}_{2}}{\text{O}}{\text{.}}$В качестве катализаторов селективного каталитического восстановления NOx аммиаком широко применяются системы на основе ванадия (V2O5–WO3/TiO2 и V2O5–MoO3/TiO2) [6, 7], обеспечивающие эффективное восстановление оксидов азота до молекулярного азота при температурах 300–400°С. Однако температура промышленных газов и выхлопных газов дизельных двигателей зачастую ниже 300°С, и в таких условиях использование V-содержащих катализаторов не обеспечивает полного удаления NOx. Кроме того, легко летучие оксиды ванадия сами являются потенциальными биотоксикантами [8]. Таким образом, разработка экологически безопасных и высокоактивных катализаторов низкотемпературного (ниже 300°С) NH3-СКВ [9, 10] является актуальной задачей.
Настоящий обзор представляет собой краткое обобщение результатов исследований в области разработки эффективных катализаторов для технологии низкотемпературного селективного восстановления оксидов азота аммиаком, опубликованных за последние 5 лет. Каталитические системы NH3-СКВ разделены на 7 основных групп: 1) оксидные системы; 2) гидротальциты; 3) перовскиты; 4) узкопористые цеолиты; 5) металлоорганические каркасы; 6) природные минералы и глины и 7) гибридные системы. В обзоре проанализированы как преимущества, так и недостатки катализаторов каждой группы.
1. СМЕШАННЫЕ ОКСИДЫ
Интерес исследователей к оксидам переходных металлов обусловлен в первую очередь их высокими окислительно-восстановительными свойствами и сравнительно небольшой себестоимостью. Наиболее перспективными для проведения реакции NH3-СКВ являются MnOx, а также FeOx и CuOx. Однако индивидуальные оксиды, как правило, имеют малую площадь поверхности, склонны к спеканию, неустойчивы по отношению к действию паров воды, а также чувствительны к отравлению соединениями серы. В связи с этим множество работ посвящено разработке и исследованию каталитических свойств бинарных и многокомпонентных оксидных катализаторов на основе марганца, железа и меди (табл. 1).
Таблица 1.
Каталитические свойства смешанных оксидов в реакции NH3-СКВ
| Катализатор (метод приготовления) | Условия | Температурный интервал максимальной конверсии (>90%), °С | Конверсия NOx, % нач./после вкл. Х/после выкл. Х (Tреакц) |
Ссылка | |||
|---|---|---|---|---|---|---|---|
| без Н2О | с Н2О | H2O | SO2 | H2O + SO2 | |||
| Нанотрубки MnOx–CeO2 (межфазная окислительно-восстановительная реакция) |
1000 м. д. NH3; 1000 м. д. NO;
5 об. % O2; N2 (100 м. д. SO2, 10 об. % H2O) GHSV = 30 000 ч–1 |
92–180 | − | 100/100/100 (180°С) |
100/84/90 (180°С) |
− | [12] |
| Наностержни MnOx–CeO2 (метод электроосаждения) |
1000 м. д. NH3; 1000 м. д. NO;
5 об. % O2; N2 GHSV = 10 000 ч–1 |
250 | − | − | − | − | [13] |
| Sm0.1MnOx (метод соосаждения) |
500 м. д. NH3; 500 м. д. NO;
5 об. % O2; Ar (100 м. д. SO2, 2 об. % H2O) GHSV = 49 000 ч –1 |
60–240 | − | 100/100/100 (100°С) |
100/96/− (100°С) |
96/91/97 (100°С) |
[14] |
| Mn0.1EuOx (метод соосаждения) |
600 м. д. NH3; 600 м. д. NO;
5 об. % O2; Ar (100 м. д. SO2, 5 об. % H2O) GHSV = 108 000 ч–1 |
115–400 | − | − | − | 100/90/94 (350°С) |
[15] |
| MnNd0.1Ox (метод соосаждения) |
600 м. д. NH3; 600 м. д. NO;
5 об. % O2; Ar (100 м. д. SO2, 5 об. % H2O) GHSV = 108 000 ч–1 |
80–270 | − | − | − | 100/85/93 (150°С) |
[16] |
| MnGd0.1Oх (метод соосаждения) |
500 м.д. NH3; 500 м.д. NO;
5 об.% O2; N2 (100 м. д. SO2, 5 об. % H2O) GHSV = 36 000 (100 000*) ч–1 |
105–345 (135–340)* |
− | 100/100/100 (200 °С) |
100/90/90 (200°С) |
100/60/87 (200°С) |
[17] |
| Mn0.1Ce0.3TiOx (золь–гель метод) |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2 (100 м. д. SO2, 6 об. % H2O) GHSV = 40 000 (80 000*) ч–1 |
165–400 (190–400)* |
− | − | − | 100/82/100 (200°С) |
[18] |
| 12.5 мол. % CeОх−FeMnOx (цитратный метод) |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2 (100 м. д. SO2, 10 об. % H2O) GHSV = 30 000 ч–1 |
85–135 | − | 100/91/98 (120°С) |
100/96/99 (120°С) |
100/76/98 (120°С) |
[19] |
| Fe0.3Mn0.5Zr0.2, прок. 500°С (метод соосаждения) |
500 м. д. NH3; 500 м. д. NO;
4 об. % O2; N2 (100 м. д. SO2, 10 об. % H2O) GHSV = 35 000 ч–1 |
125–400 | − | 100/98/100 (200°С) |
100/98/100 (200°С) |
100/95/100 (200°С) |
[20] |
| Sm0.3MnTi (метод обратного соосаждения) |
500 м. д. NH3; 500 м. д. NO;
5 об. % O2; N2 (50 м. д. SO2, 5 об. % H2O) GHSV = 36 000 (180 000*) ч–1 |
150–435 (330–400)* |
− | 100/80/100 (200 °С) | 100/60/75 (200 °С) |
75/58/73 (200 °С) |
[21] |
| MnTi0.1Eu0.3 (метод обратного соосаждения) |
500 м. д. NH3; 500 м. д. NO;
5 об. % O2; N2 (50 м. д. SO2, 5 об. % H2O) GHSV = 36 000 ч–1 |
150–450 | − | 52/45/52 (200°С) |
52/29/42 (200°С) |
100/53/77 (200°С) |
[22] |
| MnFeDy0.1 (золь–гель метод и электропрядение) |
500 м. д. NH3; 500 м. д. NO;
5 об. % O2; N2
(50 м. д. SO2, 5 об. % H2O) GHSV = 180 000 ч–1 |
150–340 | 190–310 | 85/84/85 (150°С) |
85/30/40 (150°С) |
40/32/40 (150°С) |
[23] |
| Fe0.4Nb0.1Ce0.5 (цитратный метод) |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2
(100 м. д. SO2, 12 об. % H2O) GHSV = 35 000 ч–1 |
180–410 | 200−410 | 100/90/100 (220°С) | 100/100/100 (220°С) | 100/88/100 (220°С) | [24] |
| NbSnCeOx (метод гомогенного осаждения) |
500 м. д. NH3; 500 м. д. NO; 5 об. % O2; N2 (8 об. % H2O) GHSV = 35 000 ч–1 | 225–375 | − | 91/90/91 (250°С) |
− | − | [25] |
| CeNbAlOx (гидротермальный метод) |
500 м. д. NH3; 500 м. д. NO;
5 об. % O2; N2 (100 м. д. SO2, 5 об. % H2O) GHSV = 50 000 ч–1 |
150–450 | − | 100/99/100 (250°С) |
100/96/100 (250°С) |
100/78/96 (250°С) |
[26] |
| MnCo2Nb0.5Ox (метод соосаждения) |
500 м. д. NH3; 500 м. д. NO;
5 об. % O2; N2 (10 об. % H2O) GHSV = 12 000 ч–1 |
100–250 | − | 98/62/87 (150°С) |
− | − | [27] |
| Mn0.15Nb0.02TiOx (метод соосаждения) |
500 м. д. NH3; 500 м. д. NO;
4 об. % O2; Ar (100 м. д. SO2, 5 об. % H2O) GHSV = 108 000 ч–1 |
115–350 | − | − | − | 100/90/97 (150°С) |
[28] |
| Co0.2Ce0.35Mn0.45Ti10 (золь–гель метод) |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2 (100 м. д. SO2, 6 об. % H2O) GHSV = 40 000 ч–1 |
160–400 | − | 100/98/100 (240 °С) | 100/100/100 (240 °С) | 100/96/100 (240 °С) | [29] |
| Sm0.3MnNi2Ti7Ox (метод соосаждения) |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2 (100 м. д. SO2, 5 об. % H2O) GHSV = 40 000 (120 000) ч–1 |
140–390 (202–387) |
− | 100/91/100 (240°С) |
100/96/100 (240°С) |
100/85/100 (240°С) |
[30] |
| Cu0.02Fe0.2W0.02TiOx (золь–гель метод) |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2 (100 м. д. SO2, 5 об. % H2O) GHSV = 40 000 (100 000*) ч–1 |
195–480 (220–480)* |
(235–480)* | 100/83/100 (220°С) |
− | 100/90/100 (220°С) |
[31] |
| Cu0.02Fe0.2Ce0.2Ti0.8Ox (золь–гель метод) |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2 (100 м. д. SO2, 8 об. % H2O) GHSV = 40 000 ч–1 |
150–350 | 175–360 | 100/100/100 (200°С) |
100/100/100 (200°С) |
100/100/100 (200°С) |
[32] |
Бинарные оксиды
Редкоземельные элементы активно используются в качестве второго металла в составе бинарных оксидов. Так, церий за счет способности накапливать и отдавать кислород промотирует реакцию окисления NO в NO2 и, как следствие, в значительной степени повышает каталитическую активность оксидов марганца в реакции NH3‑СКВ, в особенности в области низких температур [11]. Каталитические свойства бинарных оксидов MnOx–CeO2 хорошо изучены, поэтому в последнее время внимание исследователей сфокусировано на создании на их основе наноструктурированных катализаторов: нанотрубок и наностержней [12, 13].
В работе [12] полые нанотрубки MnOx–CeO2 были получены путем окислительно-восстановительной реакции между водным раствором KMnO4 и наностержнями Ce(OH)CO3, которые также играли роль темплата. Синтезированные каталитические системы благодаря специфической пористой структуре и доступности активных Mn- и Ce-содержащих центров, а также наличию значительного количества хемосорбированного кислорода и высокой концентрации кислотных центров Льюиса позволяют селективно удалять свыше 90% NOx в температурном интервале 100–180°C. Помимо высокой каталитической активности нанотрубки MnOx–CeO2 обладают устойчивостью к отравлению соединениями серы: конверсия NOx лишь незначительно снижается (со 100 до 84%) в присутствии 100 м. д. SO2 и 10% Н2О, а после удаления серы и паров воды снова повышается до 90%.
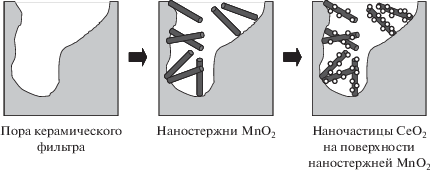
Оригинальный подход к созданию высокоактивных катализаторов для низкотемпературного NH3-СКВ изложен в [13]: предложено синтезировать в порах керамического фильтра наностержни MnOx, покрытые наночастицами СеО2 (рис. 1). Полученные таким образом наноструктурированные катализаторы MnOx–CeO2 проявляют весьма значительную каталитическую активность (максимальная конверсия составляет 90% при 250°С) благодаря высокой концентрации центров Mn4+ и поверхностного кислорода, участвующих в протекании ключевой стадии NH3-СКВ – окислении NO в NO2. Авторы полагают, что предложенный ими метод синтеза наноструктурированных катализаторов низкотемпературного NH3-СКВ может со временем заменить традиционные методы.
Рис. 1.
Схематическое изображение процедуры приготовления наноструктурированных катализаторов MnOx−CeO2.
Серьезной проблемой при разработке Mn-катализаторов является их недостаточная сероустойчивость. Улучшить каталитические свойства и повысить устойчивость к отравлению соединениями серы можно путем модификации MnOx такими редкоземельными элементами, как самарий [14], европий [15], неодим [16] и гадолиний [17]. По данным комплексного физико-химического исследования положительный эффект обусловлен тем, что добавление Sm, Eu, Nd и Gd в небольших количествах способствует увеличению удельной площади поверхности, а также возрастанию концентрации активных центров Mn4+ и хемосорбированного кислорода.
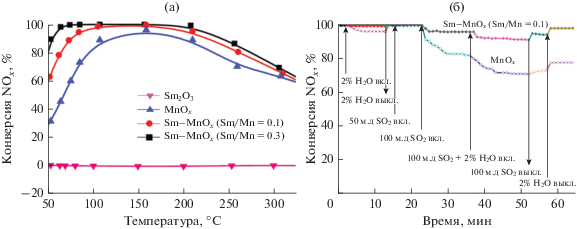
Модификация MnOx самарием дает возможность сдвинуть рабочий интервал в область существенно более низких температур [14]. Более 90% оксидов азота восстанавливается до N2 в присутствии Sm–MnOx-0.1 (Sm/Mn = 0.1) уже при 60°С (рис. 2а). Кроме того, на каталитические свойства модифицированного самарием образца практически не оказывают влияние пары воды и соединения серы (рис. 2б). При совместном присутствии в газовом потоке SO2 и Н2О наблюдается незначительное снижение конверсии NOx со 100 до 91%, однако активность катализатора полностью восстанавливается после удаления соединений серы и паров воды из газового потока.
Рис. 2.
а – Конверсия NOx на Sm2O3, MnOx, Sm–MnOx с различным соотношением Sm/Mn. б – Влияние SO2 и H2O на каталитическую активность MnOx и Sm–MnOx (Sm/Mn = 0.1). Рисунок адаптирован из работы [14] с разрешения журнала “ACS Catalysis”.
Интересные результаты были получены при исследовании каталитических свойств серии катализаторов MnXOx (где Х = Ce, Sm, Eu, Nd; X/Mn = 0.01–0.2) [15, 16]. Самым эффективным в реакции NH3-СКВ оказался образец MnEuOx (Eu/Mn = 0.1), позволяющий селективно (96–100%) восстанавливать свыше 90% NOx в интервале температур 105–400°С даже в присутствии соединений серы и паров воды [15]. Важно отметить, что в отличие от большинства других работ, посвященных изучению каталитических свойств оксидных систем в реакции NH3-СКВ, исследования MnXOx были проведены при высокой объемной скорости – 108 000 ч–1.
В работе [17] была синтезирована серия модифицированных Gd катализаторов MnOx с молярным отношением Gd/Mn = 0.05, 0.1 и 0.3. Наилучшими каталитическими свойствами в реакции NH3-СКВ обладал образец MnGdOx (Gd/Mn = 0.1). В его присутствии наблюдалась практически полная конверсия (свыше 90%) оксидов азота в N2 в широком интервале температур (105–345°С). Кроме того, катализатор MnGdOx оказался более устойчивым к воздействию SO2 и паров воды по сравнению с исходным MnOx.
Многокомпонентные оксиды
Добавление третьего металла в ряде случаев дает возможность облегчить протекание реакции NH3-СКВ на оксидных системах и сдвинуть их рабочий интервал в область более низких температур. Так, введение Ce [18, 19], Zr [20], Sm [21] и Eu [22] позволяет увеличить каталитическую активность оксидных систем Mn–Fe и Mn–Ti за счет интенсификации скоростьопределяющей стадии реакции NH3-СКВ – окисления NO в NO2. Кроме того, модифицированные редкоземельными элементами оксидные катализаторы обладают повышенной гидротермальной стабильностью и устойчивостью к отравлению серосодержащими соединениями.
Высокая конверсия NO и селективность по азоту были достигнуты при использовании MnFeDy-катализаторов, представляющих собой нанопроволоки FeMnOx, допированные диспрозием [23]. С использованием комплекса физико-химических методов (рентгенофотоэлектронная спектроскопия, температурно-программированная десорбция NO и NН3, ИК-Фурье спектроскопия) авторам удалось показать, что добавление диспрозия приводит к росту концентрации активных центров Mn4+ и хемосорбированного кислорода, принимающих активное участие в окислении NO в NO2. Увеличивается и адсорбционная емкость катализатора по NH3 и NO. При этом обе молекулы адсорбируются в виде высоко реакционноспособных поверхностных соединений (координированного NH3 и термически нестабильных нитритов соответственно), которые взаимодействуют друг с другом с образованием молекулярного азота и воды при температурах существенно ниже 300°С.
Ведутся также исследования промотирующего эффекта ниобия. В работе [24] обнаружено, что катализаторы FexNb0.5– xCe0.5 (x = 0.45, 0.4 и 0.35) по активности и селективности в реакции NH3-СКВ заметно превосходят исходные оксидные системы Nb2O5 и Fe0.5–Ce0.5. Аналогичные результаты получены для модифицированных ниобием оксидных систем Sn–Ce [25], Ce–Al [26], Mn–Co [27], Mn–Ti [28]. Введение оксида ниобия повышает общую кислотность за счет образования новых кислотных центров Бренстеда (Nb–OH) и Льюиса (Nb=O) и, как следствие, адсорбционную емкость исследуемых оксидных систем по аммиаку. Помимо этого увеличивается число кислородных вакансий, которые играют важную роль в адсорбции и активации NO и NH3.
В последние 5 лет в качестве катализаторов реакции NH3-СКВ все чаще предлагается использовать многокомпонентные оксидные системы. Такие системы помимо основного компонента (MnOx, FeOx и CuOx), выполняющего окислительно-восстановительную функцию, содержат оксиды сразу нескольких промоторов (табл. 1). В результате эффектов синергизма, возникающих между компонентами оксидных катализаторов, в ряде случаев удается значительно повысить не только их активность в области низких температур, но и устойчивость к отравлению соединениями серы и воздействию паров воды.
В работе [29] был изучен эффект промотирования Mn–Ti оксидной системы кобальтом и церием. Синтезированный золь–гель методом катализатор Co0.2Ce0.35Mn0.45Ti10 позволяет эффективно удалять NOx в широком интервале температур даже в присутствии паров воды и SO2. Анализ результатов позволил авторам заключить, что взаимодействие между Co, Ce, Mn и Ti приводит к росту общей кислотности и образованию новых центров адсорбции NOx, играющих важную роль в протекании реакции низкотемпературного NH3-СКВ.
Аналогичные данные были получены при исследовании влияния самария на низкотемпературные каталитические свойства Mn–Ti–Ni оксидной системы [30]. Авторами убедительно показано, что при введении небольшого количества Sm его взаимодействие с Mn, Ti и Ni способствует увеличению площади поверхности, концентрации хемосорбированного кислорода и активных центров Mn4+. Так, синтезированный методом соосаждения катализатор Sm0.3MnNi2Ti7Ox позволяет удалять свыше 90% NOx и практически не теряет свою активность в присутствии паров воды и SO2.
Промотирование оксидных систем Cu–Fe–Ti церием или вольфрамом оказывает положительный эффект на их каталитические свойства [31, 32]. Катализаторы Cu0.02Fe0.2Ce0.2Ti0.8Ox и Cu0.02Fe0.2W0.02TiOx проявляют высокую активность при наличии паров воды и соединений серы даже при больших объемных скоростях (100 000 ч–1). Авторы полагают, что добавление Ce и W в незначительных количествах приводит к увеличению числа кислотных центров и концентрации хемосорбированного кислорода, а также позволяет стабилизировать Cu- и Fe-содержащие активные центры оксидных систем.
Анализ литературы показывает, что смешанные оксиды, состоящие из двух и более компонентов, позволяют эффективно удалять NOx в интервале 140–350°С, а также обладают высокой селективностью по N2 и сероустойчивостью. Однако следует отметить, что в подавляющем большинстве работ каталитические тесты проводили в отсутствие паров воды и при низких объемных скоростях (≤30 000 ч–1). Такие условия эксперимента являются модельными и слишком далеки от реальных условий эксплуатации катализаторов NH3-СКВ. Кроме того, при расчете конверсии, как правило, не исключалась вероятность адсорбции NOx на поверхности катализатора в виде термически стойкого нитрата аммония, что тоже может завышать показатели в области низких температур. Таким образом, вопрос о возможности практического применения смешанных оксидов все еще остается открытым и требует проведения более детального исследования их каталитических характеристик.
2. ГИДРОТАЛЬЦИТЫ И СЛОИСТЫЕ ДВОЙНЫЕ ОКСИДЫ
Традиционные способы получения (гидротермальный синтез, соосаждение и золь–гель метод) многокомпонентных оксидных катализаторов включают в себя несколько стадий: 1) приготовление суспензий предшественника; 2) удаление растворителя (например, воды) из суспензии; 3) сушку; 4) прокаливание высушенного предшественника для получения металлоксидного катализатора. Неверно подобранные условия каждой из этих стадий могут привести к неоднородному распределению активных компонентов по поверхности катализатора, агломерации и спеканию частиц, что, в свою очередь, негативно скажется на каталитических свойствах оксидной системы.
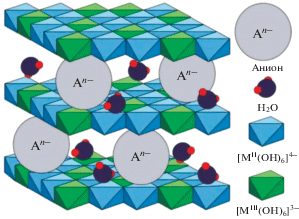
Альтернативным методом является использование в качестве предшественников оксидных катализаторов гидротальцитоподобных соединений (гидротальцитов или слоистых двойных гидроксидов, СДГ). Это соединения с общей формулой
Характерной особенностью СДГ является их уникальная слоистая двумерная наноструктура, которая сохраняется даже после прокаливания (рис. 3). Благодаря простоте и воспроизводимости синтеза, широкому спектру возможных составов, невысокой стоимости гидротальциты служат предшественниками для получения слоистых двойных оксидов (СДО). В свою очередь, СДО могут быть использованы в качестве катализаторов в таких процессах, как альдольная конденсация, алкилирование [34], углекислотный (“сухой”) риформинг метана [35], удаление летучих органических соединений [36], получение метанола из углекислого газа [37], селективное окисление аммиака [38], разложение N2O [39, 40] и др.
Исследования каталитических свойств слоистых двойных оксидов в реакции NH3-СКВ активно ведутся с конца 1990-х гг. [39]. На сегодняшний день наиболее перспективными являются Cu- и Mn-содержащие оксидные композиции (табл. 2). Каталитическая активность таких композиций во многом определяется соотношениями M2+/M3+ и Mn3+/M3+ (где M2+ = Cu2+, М3+ = Mn3+, Al3+, Ti3+ и др.) [41–43]. Так, для образцов Cu–Mn–Al по мере возрастания соотношения Cu2+/(Mn3+ + Al3+) от 1 до 4 конверсия NOx при 150°С меняется и составляет 74.3, 91.2, 87.5 и 76.9% соответственно (рис. 4). Зависимость активности от Mn3+/Al3+ также проходит через максимум, наилучшие результаты достигаются при соотношении 1 : 1. Полученная в результате оптимизации композиция Cu2Mn0.5Al0.5Ox превосходит оксидные системы Cu2AlOx, Cu‑Mn/γ-Al2O3 и Mn/γ-Al2O3 по своим каталитическим свойствам и устойчивости к отравлению соединениями серы.
Таблица 2.
Каталитические свойства гидротальцитов в реакции NH3-СКВ
| Катализатор (метод приготовления) | Условия | Температурный интервал максимальной конверсии (>90%), °С | Конверсия NOx, % нач./после вкл. Х/ после выкл. Х (Tреакц) |
Ссылка | |||
|---|---|---|---|---|---|---|---|
| без Н2О | с Н2О | H2O | SO2 | H2O + SO2 | |||
| CuMn0.5Ti0.5 (метод соосаждения, прок. 400°С) |
500 м. д. NH3; 500 м. д. NO; 5 об. % O2; Ar (100 м. д. SO2, 5 об. % H2O) GHSV = 60 000 ч–1 |
100–250 | − | 90/78/– (200°С) |
90/70/– (200°С) |
78/65/73 (200°С) |
[41] |
| Cu2Mn0.5Al0.5 (метод соосаждения, прок. 400°С) |
500 м. д. NH3; 500 м. д. NO; 5 об. % O2; Ar (100 м. д. SO2, 5 об. % H2O) GHSV = 60 000 ч–1 |
150 | − | 91/78/90 (150°С) |
− | 91/62/81 (150°С) |
[42] |
| Cu0.5Mg1.5Mn0.5Al0.5 (метод соосаждения, прок. 400°С) |
500 м. д. NH3; 500 м. д. NO; 5 об.% O2; Ar (100 м. д. SO2, 5 об. % H2O) GHSV = 60 000 (105 000*) ч–1 |
100–225 (100–200)* |
− | 97/78/91 (150°С) |
97/69/– (150°С) |
97/68/87 (150°С) |
[43] |
| Ni–Fe (метод соосаждения в присутствии мочевины, прок. 500°С) |
600 м. д. NH3; 600 м. д. NO; 5 об. % O2; N2 (100 м. д. SO2, 10 об. % H2O) GHSV = 45 000 ч–1 |
220–350 | − | − | 99/98/99 (300°С) |
99/97/99 (300°С) |
[44] |
| Cо3MnAl (гидротермальный метод, прок. 500°С) |
600 м. д. NH3; 600 м. д. NO; 5 об. % O2; N2 (100 м. д. SO2, 10 об. % H2O) GHSV = 45 000 ч–1 |
125–275 | − | − | 99/88/– (240°С) |
88/75/84 (240°С) |
[45] |
| Mn/Co–Al (гидротермальный метод, прок. 500°С) |
600 м. д. NH3; 600 м. д. NO; 5 об. % O2; N2 (100 м. д. SO2, 10 об. % H2O) GHSV = 45 000 ч–1 |
90–300 | – | 99/92/– (240°С) |
− | 92/81/91 (240°С) |
[46] |
| 0.25% Mn/Co–Al (метод соосаждения в присутствии мочевины, прок. 500°С) |
500 м. д. NH3; 500 м. д. NO; 5 об. % O2; N2 (100 м. д. SO2, 10 об. % H2O) GHSV = 40 000 ч–1 |
130–350 | − | 100/98/100 (200°С) |
100/93/100 (200°С) |
100/77/92 (200°С) |
[47] |
| 2% Ce/Cu–Al (метод соосаждения, прок. 400°С) |
500 м. д. NH3; 500 м.д. NO; 5 об.% O2; Ar (100 м. д. SO2, 5 об. % H2O) GHSV = 60 000 ч–1 |
170–225 | 200 (83%) |
− | − | 83/79/− (150°С) |
[48] |
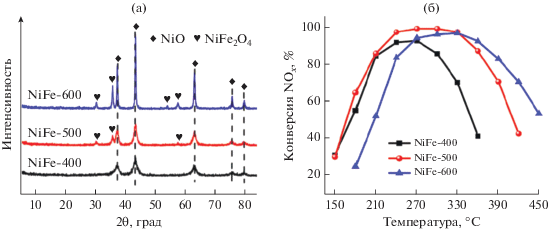
Рис. 4.
а – Дифрактограммы Ni–Fe-оксидов, полученных прокаливанием исходного слоистого двойного гидроксида при температурах 400–600°C. б – Влияние температуры прокаливания исходного слоистого двойного гидроксида на активность Ni–Fe-оксидов [44] (оpen access).
Работа [43] посвящена оптимизации состава оксидной системы Cu‑Mg‑Mn‑Al с целью получения максимальной конверсии NOx в области низких температур. Для этого соотношение (Cu2+ + Mg2+)/(Mn3+ + Al3+) в исходном Cu‑Mg‑Mn‑Al‑CO3 слоистом двойном гидроксиде сохраняли равным 2, а соотношение Cu2+/Mg2+ варьировали в пределах от 0 до 3. Наибольшей активностью в интервале 100–225°С обладает оксидная система Cu0.5Mg1.5Mn0.5Al0.5Ox. Важно отметить, что даже при увеличении объемной скорости с 60 000 до 105 000 ч–1 эта система сохраняет свою эффективность и позволяет удалять свыше 90% NOx в интервале 100–200°С. Согласно результатам физико-химического анализа высокая активность Cu0.5Mg1.5Mn0.5Al0.5Ox по сравнению с остальными образцами обусловлена повышенной концентрацией Mn4+ и Cu2+, активных в NH3-СКВ, а также бóльшим количеством кислотных центров и наличием на его поверхности кислородных вакансий.
Улучшить каталитические свойства СДО можно не только путем оптимизации состава исходного гидротальцита, но также подбором наиболее подходящих условий прокаливания исходного слоистого двойного гидроксида. Влияние температуры прокаливания на активность СДО в реакции NH3-СКВ было исследовано в [44, 45]. Для серии оксидных систем Ni‑Fe, приготовленных прокаливанием Ni‑Fe-СДГ при 400, 500 и 600°C, установлено, что при высоких температурах формируются две активные фазы: 1) NiO, отвечающая за протекание реакции низкотемпературного NH3-СКВ, и 2) NiFe2O4, вносящая свой вклад в высокотемпературное восстановление NOx [44]. Оптимального соотношения между NiO и NiFe2O4 и, как следствие, максимального эффекта синергизма между ними удается достичь путем прокаливания исходного Ni‑Fe-CДГ при 500°С (рис. 4).
Схожие результаты были получены в работе [45], посвященной изучению каталитических свойств Co‑Mn‑Al оксидных систем. Оксиды были синтезированы путем прокаливания исходного слоистого двойного гидроксида при 500, 600 и 700°С. Показано, что наибольшей активностью в реакции NH3-СКВ обладает образец Co‑Mn‑Al, приготовленный прокаливанием СДГ при 500°С: конверсия NOx на нем при 90–200°С заметно выше, чем на двух других образцах. Согласно результатам комплексного физико-химического исследования повышение температуры прокаливания приводит к уменьшению количества кислотных центров, снижению концентрации центров Mn4+ и хемособированного кислорода, отвечающих за протекание реакции низкотемпературного NH3-СКВ.
Промотирование слоистых двойных оксидов металлами, например, Mn [46, 47] и Ce [48], также способствует увеличению их каталитической активности (табл. 2). В [46] было проведено сравнительное исследование каталитических и физико-химических свойств Co-Mn-Al и Mn/Co-Al оксидных систем. В случае Co–Mn–Al конверсия NOx выше 90% наблюдается при 125–275°С, в то время как на Mn/Co‑Al такое же количество оксидов азота конвертируется в более широком интервале температур 90–300°С. Авторы полагают, что повышенная активность нанесенного катализатора связана с несколькими причинами, одной из которых является бóльшая концентрация активных и кислотных центров.
Влияние содержания активного металла на каталитические свойства слоистого двойного оксида было изучено в [47, 48]. В работе [47] исследовали каталитические свойства образцов Mn/Co-Al, приготовленных пропиткой слоистого двойного оксида водным раствором нитрата марганца, при этом концентрацию Mn варьировали от 0.05 до 0.5 мас. %. В качестве образцов сравнения использовали Co‑Al и MnOx. Введение даже небольшого количества марганца (0.05 мас. %) приводит к резкому увеличению каталитической активности по сравнению с СДО и оксидом марганца во всем исследуемом интервале температур, что указывает на возникновение эффекта синергизма между носителем и нанесенным металлом. Сопоставление полученных результатов для всех катализаторов Mn/Co‑Al показывает, что наибольшей эффективностью в реакции NH3-СКВ обладает образец с содержанием марганца 0.25 мас. %: конверсия NOx на нем составляет 74% при 100°С и более 95% при 150–300°С.
Важно отметить, что слоистые двойные оксиды и нанесенные каталитические системы на их основе сохраняют высокую активность в реакции NH3-СКВ даже в присутствии соединений серы и паров воды. Практически для всех рассмотренных выше катализаторов наблюдается незначительная потеря активности при введении в газовый поток Н2О: конверсия оксидов азота снижается лишь на 2–7% (табл. 2). Одновременная подача воды и оксида серы в ряде случаев приводит к более заметным изменениям, например, на Cu2Mn0.5Al0.5Ox и Cu0.5Mg1.5Mn0.5Al0.5Ox конверсия NOx снижается на 29% (с 91 до 62% и с 97 до 68% соответственно). Однако этот эффект обратим, и сразу же после удаления SO2 и Н2О из газового потока наблюдается практически полное восстановление начальной каталитической активности.
В целом слоистые двойные оксиды доказали свою эффективность в реакции селективного каталитического восстановления оксидов азота аммиаком. Одной из основных проблем, которую все еще необходимо решить, является их узкий рабочий интервал (как правило, 100–300°С). Между тем катализаторы NH3-СКВ должны обеспечивать эффективное удаление NOx и при бóльших температурах (до 600°С), что связано с особенностями работы дизельных двигателей. Кроме того, лишь ограниченное число исследований проведено при высоких объемных скоростях и с использованием газовых смесей, моделирующих состав реальных выхлопных газов. В значительной части работ также отсутствует информация о стабильности катализаторов в условиях реакции, а также о влиянии гидротермальной обработки на каталитические свойства СДО.
3. ПЕРОВСКИТЫ
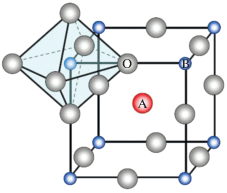
К перовскитам относятся сложные оксиды с общей химической формулой ABО3, где A – крупный катион (лантаноиды, щелочные или щелочноземельные металлы), В – катионы меньшего размера (переходные металлы). Элементарная ячейка перовскита образована правильными октаэдрами, в центре которых находится катион В, окруженный шестью анионами О (рис. 5). Октаэдры ВО6 соединены между собой вершинами и образуют трехмерный каркас. В пустотах этого каркаса располагаются правильные кубооктаэдры, состоящие из катионов А, окруженных двенадцатью атомами О [49]. Интересной особенностью перовскитов является возможность частичной замены как катионов A, так и катионов B, что приводит к образованию кислородных вакансий или изменению степени окисления A и B. Это, в свою очередь, позволяет направленно регулировать каталитические свойства систем на основе перовскитов [50].
Высокая адсорбционная емкость, кислотно-оснóвные и окислительно-восстановительные свойства, подвижность кислорода, устойчивость к отравлению соединениями серы, термическая стабильность и низкая стоимость делают перовскиты перспективными для решения задач экологического катализа. Так, ABO3 хорошо зарекомендовали себя в качестве компонентов систем накопления–восстановления NOx (англ. NOx storage reduction catalyst или NSR) и их комбинаций с катализаторами NH3-СКВ (англ. NSR-SCR combined system) [49, 51]. Кроме того, они проявляют активность в реакциях разложения закиси азота [52], селективного каталитического восстановления NOx углеводородами (УВ-СКВ) и водородом (Н2-СКВ) [51].
В последние 5 лет все чаще стали появляться работы, посвященные исследованию каталитических свойств перовскитов в реакции NH3-СКВ (табл. 3). В работах [53–55] продемонстрирована высокая эффективность LaMnO3 в удалении оксидов азота при низких температурах (170–300°С): максимального значения конверсия NO (70–80%) достигала уже при 200–250°С. Кроме того, показано, что перовскиты позволяют одновременно удалять как оксиды азота, так и ртуть [53, 54]. Полученные данные указывают на то, что LaMnO3 и подобные ему соединения ABO3 могут рассматриваться как весьма перспективные и недорогие каталитические системы для очистки отходящих газов угольных электростанций.
Таблица 3.
Каталитические свойства перовскитов в реакции NH3-СКВ
| Катализатор (метод приготовления) | Условия | Температурный интервал максимальной конверсии, °С | Конверсия NOx, % нач./после вкл. Х/ после выкл. Х (Tреакц.) |
Ссылка | |||
|---|---|---|---|---|---|---|---|
| без Н2О | с Н2О | H2O | SO2 | H2O + SO2 | |||
| LaMnO3 (золь–гель метод) |
500 м. д. NH3; 500 м. д. NO; 4 об. % O2; N2 GHSV не указана |
175–300 (>60%) |
− | − | − | − | [53] |
| LaMnO3 (золь–гель метод) |
500 м. д. NH3; 500 м. д. NO; 4 об. % O2; N2 GHSV = 30 000 ч–1 |
170–265 (>70%) |
− | − | − | − | [54] |
| LaMnO3 (цитратный метод) |
1000 м. д. NH3; 1000 м. д. NO; 6 об. % O2; Ar GHSV = 30 000 ч–1 |
200–340 (>70%) |
− | − | − | − | [55] |
| La0.8Ce0.2MnO3 (золь–гель метод) |
500 м. д. NH3; 500 м. д. NO; 4 об. % O2; N2 GHSV = 30 000 ч–1 |
150–300 (>60%) |
− | − | − | − | [54] |
| La0.9Ce0.1MnO3 (цитратный метод) |
1000 м. д. NH3; 1000 м. д. NO; 6 об. % O2; Ar GHSV = 30 000 ч–1 |
190–325 (>80%) | − | − | − | − | [55] |
| LaMn0.95Fe0.05O3 (цитратный метод) |
1000 м. д. NH3; 1000 м. д. NO; 6 об. % O2; Ar GHSV = 30 000 ч–1 |
225–360 (>90%) |
− | − | − | − | [55] |
Влияние частичного замещения катионов La и Mn на каталитические свойства LaMnО3 было детально исследовано в [54] на примере синтезированных золь–гель методом перовскитов с общей формулой La1 – xAxMn1– yByО3 (где А = Ca, Sr, Ce; В = Cu, Co, Fe; x = 0 и 0.2; y = 0 и 0.2). Авторы продемонстрировали, что замещение части катионов La в бóльшей степени влияет на каталитические свойства La1– xAxMn1– yByО3, чем замещение катионов Mn. Так, введение Ca, Sr и Ce способствует повышению концентрации поверхностного кислорода и поверхностных Mn4+-центров, обладающих активностью в реакциях NH3-СКВ и окисления ртути. Показано, что наилучшими каталитическими свойствами при 200°С обладает образец La0.8Ce0.2MnO3: конверсия NO на нем составляет 90%, а конверсия Hg – 98%.
Аналогичное исследование проведено в [55]. Перовскиты состава La0.9A0.1MnO3 (где A = Sr, Ce) и LaMn0.95B0.05O3 (где B = Fe, V), а также образец сравнения LaMnO3 были приготовлены цитратным методом и протестированы в реакции NH3-СКВ. Показано, что частичное замещение как катионов А, так и катионов В может способствовать увеличению каталитической активности перовскита. Так, для образцов La0.9Ce0.1MnO3 и LaMn0.95Fe0.05O3 получены более высокие значения максимальной конверсии NO (~90 и 100% соответственно) по сравнению с исходным LaMnO3 (~80%). Однако селективность перовскитов по молекулярному азоту все еще недостаточна из-за возможного протекания реакций окисления аммиака и монооксида азота с образованием N2O, NO и NO2: выход N2 увеличивается с ~30% для исходного LaMnO3 до ~45 и ~42% для Се-, Fe-замещенных образцов соответственно.
Очевидно, что перовскиты обладают довольно высокой каталитической активностью в реакции NH3-СКВ при температурах 180–300°С. Однако их потенциал раскрыт не полностью. В частности, пока трудно оценить, при каких максимальных объемных скоростях и температурах можно проводить реакцию без заметной потери активности, а также какова сероустойчивость, термическая и гидротермальная стабильность этих соединений. Кроме того, на данный момент отсутствуют работы, посвященные исследованию влияния метода синтеза перовскитов на их каталитические свойства в реакции NH3-СКВ. Однако уже сейчас понятно, что благодаря своим уникальным физико-химическим свойствам перовскиты могут использоваться в качестве одного из компонентов в составе композитных каталитических систем, что будет более подробно обсуждено в главе “Гибридные системы”.
4. УЗКОПОРИСТЫЕ ЦЕОЛИТЫ
Наряду с оксидными системами перспективными катализаторами являются системы на основе цеолитов. Их высокая активность в реакции NH3-СКВ обусловлена: 1) наличием двух типов активных центров, позволяющих осуществлять окислительно-восстановительные (катионы металлов) и кислотно-оснóвные (группы ‒OH) взаимодействия, и 2) развитой трехмерной системой каналов и пор, облегчающей перенос реагентов и продуктов. Среди коммерчески доступных цеолитов, модифицированных Cu, Fe, Mn и другими металлами, наилучшими каталитическими свойствами в области температур ниже 350°С обладают Cu-содержащие широкопористые цеолиты со структурой типа BEA (Beta) и MFI (ZSM-5), а также узкопористые CHA (SSZ-13, SAPO-34 и др.), AEI (SAPO-18 и SSZ-39), AFX (SSZ-16), KFI (ZK-5), LTA и др. (табл. 4) [56–59].
Таблица 4.
Основные группы синтетических цеолитов, используемых при разработке катализаторов NH3-СКВ [63]
| Тип структуры цеолита | Пористая структура | Размер колец (число Т-атомов) |
Размер пор, Å |
|---|---|---|---|
| *BEA | 3D | 12 6 5 4 | 5.95 |
| FAU | 3D | 12 6 4 | 7.35 |
| MOR | 2D | 12 8 5 4 | 6.45 |
| MFI | 3D | 10 6 5 4 | 4.46 |
| FER | 2D | 10 8 6 5 | 4.69 |
| LTA | 3D | 8 6 4 | 4.21 |
| KFI | 3D | 8 6 4 | 4.04 |
| AEI | 3D | 8 6 4 | 3.84 |
| AFX | 3D | 8 6 4 | 3.73 |
| CHA | 3D | 8 6 4 | 3.72 |
Однако практическое применение цеолитов Beta и ZSM-5 затруднено по ряду причин. В частности, длительное воздействие высоких температур в присутствии паров воды приводит к “вымыванию” алюминия из кристаллической решетки цеолитов (деалюминированию). Cu-содержащие Beta и ZSM-5 подвержены этому процессу в большей степени, поскольку медь образует термически стабильные шпинели CuAl2O4, что, в свою очередь, ускоряет разрушение структуры цеолитов [60]. Cu–Beta и Cu–ZSM-5 также обладают высокой чувствительностью к отравлению углеводородами, которые адсорбируются на их поверхности при низких температурах, блокируя активные центры, а затем по мере повышения температуры окисляются с выделением большого количества тепла. Это, в свою очередь, приводит к термическому разрушению кристаллической решетки цеолита. Еще одним существенным недостатком Cu-содержащих широкопористых цеолитов является их активность в образовании N2O.
Узкопористые цеолиты по сравнению с широкопористыми Beta и ZSM-5 обладают более высокой гидротермальной стабильностью и устойчивостью к отравлению углеводородами. Кроме того, они позволяют восстанавливать оксиды азота практически без образования побочных продуктов: концентрация N2O, как правило, не превышает 5 м. д. [58, 60]. Из всего многообразия имеющихся на сегодняшний день узкопористых цеолитов (CHA, AEI, AFX, KFI, LTA и др.) наиболее перспективными и потому активно изучаемыми являются Cu–CHA: Cu-содержащие SSZ-13 и SAPO-34 [57–59, 61].
Поскольку особенности синтеза Cu–CHA, их каталитические свойства, термическая и гидротермальная стабильность, а также строение активных центров и механизм реакции NH3-СКВ были подробно описаны в обзорах [57–59, 61, 62], в настоящей работе основное внимание сфокусировано на влиянии промотирования на активность и гидротермальную стабильность Cu-содержащих цеолитов. В частности, рассмотрены примеры наиболее удачных каталитических композиций, полученных дополнительной модификацией Cu‑SSZ-13 различными элементами и их комбинациями: Fe, Mn, Ce, La, Y, Yb, Sm и Mn–Ce (табл. 5).
Таблица 5.
Каталитические свойства узкопористых цеолитов в реакции NH3-СКВ
| Катализатор (метод приготовления) | Условия | Температурный интервал максимальной конверсии (>90%), °С | Конверсия NOx, % нач./после вкл. Х/ после выкл. Х (Tреакц) |
Ссылка | |||
|---|---|---|---|---|---|---|---|
| свежий | после ГТО | H2O | SO2 | H2O + SO2 | |||
| 2.19% Cu–0.51% Fe/SSZ-13 (метод совместного ионного обмена) |
360 м. д. NH3; 360 м. д. NO;
14 об. % O2; 2.5 об. % H2O; N2 GHSV = 200 000 ч–1 ГТО: 750°С, 10 об. % H2O, 16 ч |
175–500 (с Н2О) |
225–350 (с Н2О) |
– | – | – | [66] |
| 0.09% Fe/0.14% Cu–SSZ-13 (метод ионного обмена) |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2 GHSV = 50 000 ч–1 ГТО: 750°С, 10 об. % H2O, 16 ч |
215–625 | 250–475 | – | – | – | [67] |
| 3.0% Fe/3.3% Cu–SSZ-13 (метод ионного обмена) |
500 м. д. NH3; 500 м. д. NO;
5 об. % O2; N2 (100 м. д. SO2) GHSV = 400 000 ч–1 ГТО: 750°С, 10 об. % H2O, 16 ч |
225–475 | 350 (45%) |
– | 96/86/– (300 °С) |
96/75/– (300 °С) |
[68] |
| Cu(0.2)–Mn(0.1)/SSZ-13 (метод совместного ионного обмена) |
500 м. д. NH3; 500 м. д. NO;
5 об. % O2; 2.5 об. % H2O; N2 GHSV = 30 000 ч–1 ГТО: 800°С, 10 об. % H2O |
175–550 (с Н2О) |
180–475 (с Н2О) |
– | – | – | [69] |
| 2.79% Ce/2.18% Cu–SSZ-13 (метод ионного обмена) |
500 м. д. NH3; 500 м. д. NO;
7 об. % O2; Ar GHSV = 40 000 ч–1 ГТО: 800°С, 10 об. % H2O, 20 ч |
225–580 | 225–525 | – | – | – | [70] |
| 0.5% Ce/2.4% Cu–SSZ-13 (метод ионного обмена) |
500 м. д. NH3; 500 м. д. NO;
5 об. % O2; 2.8 об. % H2O; N2 GHSV = 800 000 ч–1 Предварительная обработка: 650°С,10 об. % Н2О, 4 ч ГТО: 800°С, 10 об. % H2O, 8 ч |
250–550 (>80%) (с Н2О) |
350 (85%) (с Н2О) |
– | – | – | [71] |
| 0.3% Ce/3.6% Cu–SSZ-13 (метод ионного обмена) |
200 м. д. NH3; 200 м. д. NO;
8 об. % O2; 10 об. % H2O; N2 GHSV = 60 000 ч–1 ГТО: 850°С, 10 об. % H2O, 5 ч |
200–500 (с Н2О) |
300 (80%) (с Н2О) |
– | – | – | [72] |
| 2.40% Ce/5.81% Cu–SSZ-13 (метод ионного обмена) |
500 м. д. NH3; 500 м. д. NO; 5 об. % O2; N2 (100 м. д. SO2, 5 об. % H2O) GHSV = 100 000 ч–1 |
145–525 | – | 100/100/100 (300°С) |
100/94/98 (300°С) |
100/70/80 (300°С) |
[73] |
| 2.2% Cu/1.6% Ce /SSZ-13 (метод ионного обмена) |
500 м. д. NH3; 500 м. д. NO;
10 об. % O2; 5 об. % H2O; N2 GHSV = 80 000 ч–1 ГТО: 800°С, 10 об. % H2O, 16 ч |
160–570 (с Н2О) |
165–460 (с Н2О) |
– | – | – | [74] |
| 2.8% Cu/1.3% Y /SSZ-13 (метод ионного обмена) |
500 м. д. NH3; 500 м. д. NO; 10 об. % O2; 5 об. % H2O; N2 GHSV = 80 000 ч–1 ГТО: 800°С, 10 об. % H2O, 16 ч |
165–565 (с Н2О) |
160–550 (с Н2О) |
– | – | – | [74] |
| 3.0% Cu/2.7% Yb/SSZ-13 (метод ионного обмена) |
500 м. д. NH3; 500 м. д. NO; 10 об. % O2; 5 об. % H2O; N2 GHSV = 80 000 ч–1 ГТО: 800°С, 10 об. % H2O, 16 ч |
165–610 (с Н2О) |
175–520 (с Н2О) |
– | – | – | [74] |
| 3.4% Cu/1.8% La/SSZ-13 (метод ионного обмена) |
500 м. д. NH3; 500 м. д. NO; 10 об.% O2; 5 об.% H2O; N2 GHSV = 80 000 ч–1 ГТО: 800°С, 10 об.% H2O, 16 ч |
165–565 (с Н2О) |
175–480 (с Н2О) |
– | – | – | [74] |
| 3,4% Cu/2,3% Sm/SSZ-13 (метод ионного обмена) |
500 м.д. NH3; 500 м.д. NO; 10 об.% O2; 5 об.% H2O; N2 GHSV = 80 000 ч–1 ГТО: 800°С, 10 об. % H2O, 16 ч |
165–600 (с Н2О) |
175–480 (с Н2О) |
– | – | – | [74] |
Одной из самых сложных проблем, возникающих при разработке высокоэффективных Cu-содержащих цеолитных катализаторов для реакции NH3-СКВ, является одновременное увеличение их низкотемпературной активности и гидротермальной стабильности. Так, для достижения максимально возможной эффективности удаления NOx при 100–200°С разработаны однореакторные методы синтеза Cu‑SSZ-13 с высоким содержанием меди (>3 мас. %). Однако большое количество меди негативно сказывается на каталитической активности цеолитов при 450–600°С, а также на их стабильности в условиях высокотемпературных гидротермальных обработок [64]. Возможный путь решения этой проблемы – введение второго металла. Наиболее подходит для этой цели железо, поскольку реакция NH3-СКВ на Fe-содержащих активных центрах в цеолитах протекает при температурах выше 300°С и, кроме того, присутствие Fe способствует стабилизации меди в структуре цеолита [65].
Влияние железа на каталитические свойства и гидротермальную стабильность Сu-содержащего цеолита SSZ-13 было исследовано в работах [66–68]. Так, в [66] убедительно продемонстрировано преимущество Cu–Fe/SSZ-13 перед Cu/SSZ-13 и Fe/SSZ-13. Катализаторы были получены путем введения металлов или их смеси в исходный NH4/SSZ-13 методом ионного обмена в жидкой фазе. Модифицированный Fe/SSZ-13 позволяет эффективно удалять оксиды азота только в области повышенных температур (400–500°С), в то время как Cu-содержащие цеолиты проявляют высокую активность в более широком температурном интервале 180–500°С. Дополнительная модификация железом (Cu–Fe/SSZ-13) приводит к заметному увеличению конверсии NOx при 300–500°С.
В [67] катионы железа вводили в синтезированный однореакторным способом Cu-SSZ-13 путем ионного обмена в растворе Fe(NO3)3. Часть полученного таким образом катализатора Fe/Cu-SSZ-13 была подвержена гидротермальной обработке (ГТО) при 750°С в токе воздуха, содержащего 10 об. % воды, в течение 16 ч. Свежий и обработанный образцы цеолита тестировали в реакции NH3-СКВ в интервале температур 100–700°С. Показано, что введение железа способствует расширению рабочего интервала Cu-цеолита. Так, Cu-SSZ-13 со значительным содержанием меди (8.27 мас. % Cu) позволяет удалять более 90% NOx при 150–450°С. На Fe/Cu-SSZ-13 (0.14 мас. % Cu; 0.0089 мас. % Fe) тех же результатов удается достичь при 215–625°С. Высокая активность модифицированного железом образца сохраняется и после ГТО (табл. 5), в то время как Cu-SSZ-13 практически полностью дезактивируется.
Влияние способа введения железа в Cu-SSZ-13 было детально изучено в работе [68]. Образцы Fe/Cu-SSZ-13 приготовлены путем: 1) ионного обмена в жидкой фазе (ИО); 2) твердофазного ионного обмена (ТИО); 3) гомогенного осаждения (ГО). Каталитические свойства модифицированных железом цеолитов исследованы в реакции NH3-СКВ до и после гидротермальной обработки (750°С, 10% Н2О, 16 ч). Установлено, что самой высокой активностью и приемлемой гидротермальной стабильностью по сравнению с другими образцами (Fe/Cu-SSZ-13ТИО и Fe/Cu-SSZ-13ГО) обладает Fe/Cu-SSZ-13ИО. Согласно результатам комплексного физико-химического анализа использование ионного обмена в жидкой фазе позволяет получать более равномерное распределение катионов железа в структуре цеолита, что, в свою очередь, положительно влияет на его каталитические свойства и стабильность.
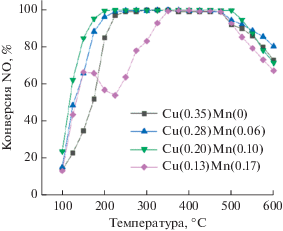
Расширить температурный интервал и увеличить гидротермальную стабильность Cu‑SSZ-13 можно путем его модификации марганцем. В работе [69] методом ионного обмена была синтезирована серия цеолитов Cu–Mn/SSZ-13 с различным соотношением Mn/Cu: 0/10, 2/10, 4/10 и 6/10. Наиболее высокой каталитической активностью в реакции NH3-СКВ обладает образец Cu(0.20)-Mn(0.10)/SSZ-13 (Mn/Cu = 4/10): конверсия NO на нем превышает 90% в интервале 175–550°С, что почти на 50°С шире, чем в случае Cu(0.35)-Mn(0)/SSZ-13 (Mn/Cu = 0/10), не содержащем марганец (рис. 6). Даже после гидротермальной обработки (800°С, 10% Н2О, продолжительность не указана) Cu(0.20)-Mn(0.10)/SSZ-13 позволяет эффективно удалять NO при 180–475°С. Таким образом, марганец не только повышает низкотемпературную активность Cu-содержащего цеолита, но также способствует стабилизации меди, препятствуя ее агломерации в результате воздействия высоких температур и паров воды.
Активно исследуется влияние Ce на каталитические свойства Cu-SSZ-13. Установлено, что добавление церия позволяет расширить рабочий интервал температур Cu-содержащих цеолитов [70], а также дает возможность увеличить их гидротермальную стабильность [70–72]. Кроме того, модификация Ce повышает устойчивость Cu-SSZ-13 к отравлению соединениями серы и парами воды [73]. Так, каталитические свойства образца Ce/Cu-SSZ-13 не меняются при добавлении в газовый поток Н2О (табл. 5). В присутствии SO2 или Н2О + SO2 конверсия NOx на модифицированном церием цеолите заметно снижается, но в меньшей степени, чем на Cu-SSZ-13: от 100 до 94% (до 90% на Cu-SSZ-13) и от 100 до 70% (до 40% на Cu-SSZ-13) соответственно.
В работе [74] в качестве модификаторов для обогащенного алюминием Cu/SSZ-13 использовали церий, лантан, самарий, иттербий и иттрий. Обнаружено, что добавки редкоземельных элементов не оказывают влияния на каталитические свойства исходного Cu-цеолита, однако способствуют улучшению его гидротермальной стабильности. Так, цеолиты М–Cu/SSZ-13 (где М = Ce, La, Sm, Yb и Y) после ГТО (800°С, 10% H2O, 16 ч) обладали большей активностью по сравнению с Cu/SSZ-13 при температурах ниже 250°С. Наилучший результат был получен для образца Y‒Cu/SSZ-13. Исследование цеолитов с различным содержанием иттрия (0.8–2.9 мас. %) показало, что положительный эффект достигается лишь при относительно небольших количествах редкоземельного элемента (0.8 и 1.3 мас. %).
Модифицированные различными металлами Cu-содержащие цеолиты имеют хороший потенциал применения в качестве катализаторов для удаления NOx благодаря высокой каталитической активности и селективности по N2 в широком диапазоне температур (200–550°С), а также термической и гидротермальной стабильности. Однако необходимо отметить, что некоторые вопросы остаются малоизученными. Так, лишь в нескольких работах уделяется внимание устойчивости модифицированных Cu-SSZ-13 по отношению к сере. Следует учитывать, что введение второго металла может интенсифицировать образование термически устойчивых сульфатов. Кроме того, в ряде случаев тестирование цеолитных систем в реакции NH3‑СКВ проводили в отсутствие паров воды и при объемных скоростях ниже 50 000 ч–1.
5. МЕТАЛЛООРГАНИЧЕСКИЕ КАРКАСНЫЕ СТРУКТУРЫ
Металлоорганические каркасные структуры (англ. Metal-organic framework или MOF) представляют собой гибридные пористые материалы, в которых неорганические узлы (ионы металлов, металлсодержащие кластеры) связаны друг с другом органическими мостиками (лигандами) [75]. От неорганических пористых носителей (цеолитов или мезопористых силикатов), широко используемых на практике, MOF выгодно отличаются разнообразием химического состава и топологии каркаса, большой удельной площадью поверхности, достигающей в ряде случаев 5900 м2/г, более однородным распределением пор по размерам и форме, высоким содержанием активного металла и его доступностью для реагентов [76]. Еще одним привлекательным свойством MOF является их термическая стабильность [77]. Благодаря этим характеристикам, MOF могут найти применение в таких областях, как гетерогенный катализ, хранение и селективная сорбция газов [78], направленный транспорт лекарственных средств [79, 80], химическая сенсорика [81], нелинейная оптика [82], создание люминофоров [83, 84].
Перспективность использования MOF в качестве катализатора для процесса низкотемпературного селективного восстановления оксидов азота аммиаком впервые была продемонстрирована в патентной литературе. Так, уже в 2010 г. китайской компанией “Zhonghuan (China) Engineering Co., Ltd.” был запатентован метод, позволяющий эффективно удалять свыше 80% NOx при температурах 80–200°С в присутствии монометаллических М/MIL-101 (где М = Mn, Fe, Cu, V, Ce) [85], однако стоит отметить, что тестирование проводили при крайне низкой объемной скорости (3000 ч–1). Исследователи Даляньского технологического университета предложили использовать в качестве катализатора для NH3-СКВ системы MIL-100(Fe), MIL-53(Fe), ZIF-100(Co) [86]. Утверждается, что они проявляют высокую активность в NH3-СКВ в интервале температур 250–350°С при объемной скорости 40 000 ч–1 даже в присутствии SO2.
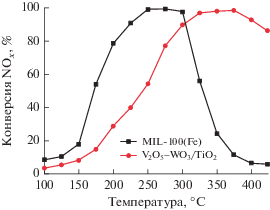
В научной литературе исследования каталитических свойств MOF в NH3-СКВ появились лишь в 2014 г. Наиболее интересные результаты приведены в табл. 6. В одной из первых работ в этой области [76] авторы показали, что катализатор MIL-100(Fe), активированный в токе N2 при 250°С, обладает повышенной каталитической активностью при низких температурах по сравнению с традиционной системой V2O5–WO3/TiO2: более 90% NOx восстанавливается до N2 в присутствии MOF в интервале 225–300°С (рис. 7). Согласно расчетам, проведенным в рамках теории функционала плотности (ТФП, англ. Density Functional Theory или DFT), столь высокие показатели эффективности обусловлены тем, что NH3-СКВ протекает на MIL-100(Fe) по механизму, включающему две стадии: 1) окисление NO на льюисовских кислотных центрах, 2) взаимодействие NO и NO2 с аммиаком в соответствии с реакцией (IV) “быстрого” NH3-СКВ [87].
Таблица 6.
Каталитические свойства металлоорганических каркасных структур в реакции NH3-СКВ
| Катализатор (метод приготовления) | Условия | Температурный интервал максимальной конверсии (>90%), °С | Конверсия NOx, % нач./после вкл. Х/ после выкл. Х (Tреакц) |
Ссылка | |||
|---|---|---|---|---|---|---|---|
| без Н2О | с Н2О | H2O | SO2 | H2O + SO2 | |||
| MIL-100(Fe), актив. в N2 при 250°С (гидротермальный метод) | 500 м. д. NH3; 500 м. д. NO;
4 об. % O2; N2; (500 м. д. SO2, 5 об. % H2O) GHSV = 30 000 ч–1 |
225–300 | ‒ | ‒ | ‒ | 98/88/96 (250°C) |
[76] |
| 23.87% Mn‒MOF-74, актив. в N2 при 300°С (гидротермальный метод) | 1000 м. д. NH3; 1000 м. д. NO;
2 об. % O2; Ar; GHSV = 50 000 ч–1 |
195–260 | ‒ | ‒ | ‒ | ‒ | [88] |
| 26.33% Co‒MOF-74, актив. в N2
при 300°С (гидротермальный метод) |
1000 м. д. NH3; 1000 м. д. NO;
2 об. % O2; Ar; GHSV = 50 000 ч–1 |
210 (70%) |
‒ | ‒ | ‒ | ‒ | [88] |
| MIL-100(Fe), актив. в вакууме при 200°С (гидротермальный метод) | 500 м. д. NH3; 500 м. д. NO;
5 об. % O2; N2; GHSV = 15 000 ч–1 |
240–320 | ‒ | ‒ | ‒ | ‒ | [89] |
| Cu‒BTC, актив. в N2 при 230°С (гидротермальный метод) |
500 м. д. NH3; 500 м. д. NO;
5 об. % O2; N2; GHSV = 30 000 ч–1 |
205–305 | ‒ | ‒ | ‒ | ‒ | [91] |
| Ni‒MOF, актив. в N2 при 220°С (сольвотермальный метод) | 500 м. д. NH3; 500 м. д. NO;
5 об. % O2; N2; GHSV = 15 000 ч–1 |
225–400 | ‒ | ‒ | ‒ | ‒ | [92] |
| 29.4% Cu‒MOF-74-iso, актив. в N2 при 230°С (сольвотермальный метод с использованием сорастворителя) | 1000 м. д. NH3; 1000 м. д. NO;
2 об. % O2; Ar; (100 м. д. SO2, 5 об. % H2O) GHSV = 50 000 ч–1 |
205–240 | ‒ | 98/54/97 (230°C) |
95/85/95 (230°C) |
‒ | [93] |
| MIL-100(Fe‒Mn), актив. в вакууме при 100°С (гидротермальный метод) | 500 м. д. NH3; 500 м. д. NO;
4 об. % O2; N2; (250 м. д. SO2, 5 об. % H2O) GHSV = 15 000 ч–1 |
260–330 | ‒ | ‒ | ‒ | 96/90/90 (280°C) |
[94] |
| Mn0.66Co0.34‒MOF-74, актив. в N2 при 250°С (гидротермальный метод) | 500 м. д. NH3; 500 м. д. NO;
5 об. % O2; Ar; (100 м. д. SO2, 5 об. % H2O) GHSV = 50 000 ч–1 |
175–250 | ‒ | 98/67/97 (200°C) |
98/98/98 (200°C) |
98/74/98 (200°C) |
[95] |
| 0.08IM‒CeO2/MIL-100(Fe), актив. в N2 при 250°С (гидротермальный метод) | 500 м. д. NH3; 500 м. д. NO;
4 об. % O2; N2; (500 м. д. SO2, 5 об. % H2O) GHSV = 30 000 ч–1 |
196–300 | ‒ | 99/95/99 (250°C) |
99/90/95 (250°C) |
98/92/95 (250°C) |
[96] |
| 4.92% Mn‒5.50% Ce@UiO-67 (метод пропитки) |
500 м. д. NH3; 500 м. д. NO;
5 об. % O2; N2; (200 м. д. SO2, 3 об. % H2O) GHSV = 4 000 ч–1 |
170–325 | ‒ | 97/91/‒ (200°C) |
97/90/‒ (200°C) |
‒ | [97] |
| 8.5% MnOx/UiO-66, актив. в вакууме
при 200°С (in-situ нанесение) |
500 м. д. NH3; 500 м. д. NO;
5 об. % O2; N2; (100 м. д. SO2, 5 об. % H2O) GHSV = 5 000 ч–1 |
100–290 | ‒ | 99/95/97 (200°C) |
99/98/99 (200°C) |
99/92/98 (200°C) |
[98] |
| 2.11% MnOx@MIL-125(Ti), актив. в N2 при 50°С (метод пропитки) | 500 м. д. NH3; 500 м. д. NO;
3 об. % O2; N2; (200 м. д. SO2, 5 об. % H2O) GHSV = 30 000 ч–1 |
175–425 | ‒ | 100/96/98 (200°C) |
100/57/60 (200°C) | ‒ | [99] |
| 3% Mn@6.8% CuBTC, актив. в Не при 230°С (гидротермальный метод) | 500 м. д. NH3; 500 м. д. NO;
5 об. % O2; N2; GHSV = 30 000 ч–1 |
200–265 | ‒ | ‒ | ‒ | ‒ | [100] |
| CuO@Cu3(BTC)2 ядро-оболочка (метод роста in-situ) | 600 м. д. NH3; 600 м. д. NO;
4 об. % O2; N2; (150 м. д. SO2, 4 об. % H2O) GHSV = 60 000 ч–1 |
200–240 | ‒ | 95/74/95 (200°C) | 95/80/88 (200°C) | 95/60/80 (200°C) | [101] |
| MnOx (термолиз Mn‒MOF-74 при 300°С в токе воздуха) |
1000 м. д. NH3; 1000 м. д. NO;
2 об. % O2; Ar; GHSV = 50 000 ч–1 |
220–260 | ‒ | ‒ | ‒ | ‒ | [102] |
| α-Fe2O3 (термолиз MIL-100(Fe) при 400°С в токе N2 и при 350°С в токе воздуха) |
1000 м. д. NH3; 1000 м. д. NO;
4 об. % O2; N2; (500 м. д. SO2, 8 об. % H2O) GHSV = 30 000 ч–1 |
210–350 | ‒ | 100/81/‒ (275°C) | ‒ | 81/82/95 (275°C) | [104] |
Рис. 7.
Конверсия NOx в присутствии MIL-100(Fe) и V2O5–WO3/TiO2. Рисунок адаптирован из работы [76] с разрешения журнала “RSC Аdvances”.
Существенное влияние на каталитические свойства MOF оказывают условия проведения активации [88, 89]. Так, в работе [88] образцы М‑MOF-74 (где М = Mn, Co) были активированы перед проведением каталитических тестов MOF двумя различными способами: 1) вакуумированием при 180°С в течение 14 ч и 2) термической обработкой в среде N2 при 300°С в течение 7 ч. Mn‑MOF-74 и Co‑MOF-74 после вакуумирования практически не проявляли каталитической активности в реакции NH3-СКВ, что, по мнению авторов, связано с недостаточно полным удалением растворителей (метанол, вода, диметилформамид), адсорбированных на координационно ненасыщенных центрах. Положительного эффекта удалось достичь при использовании термической обработки в среде N2: максимальная конверсия NOx, полученная в присутствии Mn‑MOF-74 и Co‑MOF-74, составляла 99% (при 220°С) и 70% (при 210°С) соответственно.
В работе [89] был детально исследован эффект температуры активации в вакууме. Образцы MIL-100(Fe) вакуумировали в течение 12 ч при температурах 100, 150, 180 и 200°С. Наилучшими каталитическими свойствами в NH3-СКВ обладает MIL-100(Fe), активированный при температуре 200°С: максимальная конверсия NOx на нем достигает 100%, в то время как на неактивированном образце не превышает 80%. Авторы полагают, что вакуумирование способствует увеличению числа координационно ненасыщенных центров (ионов Fe2+/Fe3+), на которых и протекает реакция восстановления NOx.
Ли и др. (Li et al.) выявили зависимость каталитических свойств Сu‑BTC (или HKUST-1) от температуры предварительной термической обработки в N2 [90, 91]. Так, конверсия оксидов азота на образце Сu‑BTC, выдержанном в токе N2 в течение 3 ч при 230°С, превышала 90% при 200–300°С, в то время как на образцах, обработанных при 180, 210 и 250°С, тех же результатов удалось достичь в более узком интервале – 215–280°С. Аналогичные результаты были получены для системы Ni‑MOF [92]. Установлено, что термическая обработка в N2 приводит к образованию активных Ni-центров и увеличению их дисперсности.
Изменение условий синтеза также может повлиять на физико-химические свойства MOF. В работе [93] был изучен эффект от использования различных сорастворителей (изопропанол и этанол) в сольвотермальном синтезе Cu‑MOF-74 (Cu‑MOF-74-iso и Cu‑MOF-74-eth соответственно). Авторы показали, что применение изопропанола в качестве сорастворителя способствует увеличению удельной поверхности MOF и его адсорбционной емкости по NH3. Как следствие, по своим каталитическим свойствам в реакции NH3-СКВ образец Cu‑MOF-74-iso превосходит Cu‑MOF-74-eth, в особенности в области низких температур. Следует отметить, что в отличие от Cu-содержащих цеолитов и оксидных систем, Cu‑MOF-74, полученные с использованием сорастворителей, дают возможность проводить реакцию восстановления NOx со 100% селективностью по N2 без образования N2O.
Перспективными каталитическими свойствами обладают гетерометаллические MOF, содержащие два или более ионов металлов в узлах решетки [94, 95]. Так, синтезированный в работе [94] гидротермальным методом биметаллический MOF MIL-100(Fe‑Mn) значительно превосходит по активности монометаллические образцы MIL-100(Fe) и MIL-100(Mn). Максимальная конверсия NOx в присутствии MIL-100(Fe‑Mn) составляет 99%, в то время как на MIL-100(Fe) и MIL-100(Mn) она не превышает 78 и 53% соответственно. Бóльшая эффективность биметаллического MOF в реакции NH3-СКВ связана, по мнению авторов, с возникновением эффекта синергизма между Fe и Mn.
Еще одним способом улучшения каталитических свойств MOF в реакции NH3-СКВ является инкапсулирование в их поры наноразмерных частиц металлов или их оксидов. Полученные таким образом композитные MOF обладают повышенной каталитической активностью, гидротермальной стабильностью и устойчивостью к отравлению серой. Так, модифицированный оксидом церия CeO2/MIL-100(Fe) позволяет удалять оксиды азота в области более низких температур (Т50 = 150°С) по сравнению с исходным MIL-100(Fe) (Т50 = 178°С) [96]. Исследование механизма реакции дало авторам возможность предположить, что рост низкотемпературной активности композитного каркаса CeO2/MIL-100(Fe) обусловлен интенсификацией образования NO2 благодаря высокой концентрации на поверхности MOF хемосорбированного кислорода и центров Ce3+, что, в свою очередь, способствует протеканию реакции между NOx и NH3 по “быстрому” маршруту (IV).
Каталитической активностью в реакции NH3-СКВ обладают системы, в которых металлы или их оксиды нанесены непосредственно на поверхность MOF [97–101]. При этом, как было показано в работе [97], образцы, приготовленные методом пропитки (MnCe@MOF), более активны по сравнению с образцами, полученными in situ допированием металлоорганического каркаса Mn и Ce (MnCeMOF). По мнению авторов, преимущество нанесенных систем в реакции NH3-СКВ обсуловлено доступностью металлов, поскольку они расположены на поверхности носителя, а не встроены в каркас, и, как следствие, их окислительно-восстановительные свойства выражены сильнее.
Интересным подходом к созданию эффективных катализаторов низкотемпературного NH3-СКВ является использование MOF в качестве темплатов для синтеза оксидных систем [97, 102–104]. В результате термолиза металлоорганических каркасов удается получать пористые наночастицы оксидов металлов, кристаллическую структуру и физико-химические свойства которых можно легко варьировать путем изменения условий синтеза (температуры, природы сорастворителя, атмосферы и т.д.) [102]. В ряде работ было показано, что синтезированные таким образом оксиды превосходят по своим низкотемпературным каталитическим свойствам исходные металлоорганические каркасы и оксидные системы, приготовленные традиционными способами (например, соосаждением). Установлено, что подобные каталитические системы также более активны по сравнению с широко используемым на практике катализатором V2O5–WO3/TiO2 [103, 104].
Благодаря высокой каталитической активности и селективности катализаторы на основе металлоорганических каркасов могут рассматриваться как перспективные каталитические системы для NH3-СКВ при 200–300°С. Однако пока их применение на практике ограничено. Одной из причин является недостаточная термическая стабильность MOF: лишь немногие виды металлоорганических каркасов сохраняют свою структуру при температурах выше 300°С. Кроме того, каталитическая активность MOF, как правило, заметно снижается в присутствии паров воды ввиду возникающей между молекулами Н2О и NH3 конкуренции за центры адсорбции [93, 95, 101]. К счастью, этот эффект обратим, и после удаления паров Н2О из газового потока первоначальные значения конверсии NOx восстанавливаются. Иначе дела обстоят при введении в газовый поток соединений серы. Обработка MOF в токе SO2 может приводить к необратимой потере каталитической активности [99, 101].
6. ПРИРОДНЫЕ МИНЕРАЛЫ И ГЛИНЫ
Катализаторы природного происхождения, в частности, различные глины (монтмориллонит, каолинит, бентонит, аттапульгит и др.), находят широкое применение в нефтеперерабатывающей промышленности для очистки и каталитического крекинга нефти. Их значительная адсорбционная емкость и каталитическая активность обусловлены большой площадью поверхности, высокой кислотностью, наличием центров, отвечающих за окислительно-восстановительные взаимодействия. К числу неоспоримых преимуществ природных катализаторов перед синтетическими относятся: 1) низкая стоимость, 2) доступность, 3) простая технология подготовки (размол, формовка гранул, активация растворами кислот), 4) широкий выбор химических составов.
За последние 5 лет в литературе появилось множество статей, посвященных изучению активности и селективности катализаторов природного происхождения в реакции NH3-СКВ. Результаты наиболее интересных из них приведены в табл. 7. Особое внимание уделяется низкотемпературным (100–300°С) каталитическим свойствам минералов и глин, модифицированных переходными металлами: гидроксиапатита [105, 106], аттапульгита [107–109], доломитовой палыгорскитовой глины [110], монтмориллонита [111–113]. В ряде работ также рассматривается вопрос стабильности природных катализаторов и их устойчивости по отношению к соединениям серы и парам воды.
Таблица 7.
Каталитические свойства природных минералов и глин в реакции NH3-СКВ
| Катализатор (метод приготовления) | Условия | Температурный интервал максимальной конверсии (>90%), °С | Конверсия NOx, % нач./после вкл. Х/ после выкл. Х (Tреакц) |
Ссылка | |||
|---|---|---|---|---|---|---|---|
| без Н2О | с Н2О | H2O | SO2 | H2O + SO2 | |||
| 6% Cu/гидроксиапатит (метод ионного обмена) |
500 м. д. NH3; 500 м. д. NO;
1 об. % O2 GHSV = 30 000 ч–1 |
255–310 | − | − | − | − | [105] |
| 5% Fe/гидроксиапатит (метод ионного обмена) |
500 м. д. NH3; 500 м. д. NO;
1 об. % O2 GHSV = 30 000 ч–1 |
375 (60%) |
− | − | − | − | [106] |
| 1% Cu/АТП (метод пропитки) |
50 м. д. NH3; 50 м. д. NO;
4 об. % O2; N2 (500 м. д. SO2, 8 об. % H2O) GHSV = 15 000 ч–1 |
350 | − | 93/85/− (350°С) |
93/67/− (350°С) |
− | [107] |
| 7% Mn/АТП (метод пропитки) |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2 GHSV = 25 000 ч–1 |
250–300 (85%) | − | − | − | − | [108] |
| Γ-Fe2O3/нц-MnO2/АТП (гидротермальный метод |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2 (200 м. д. SO2; 10 об. % Н2О) GHSV = 45 000 ч–1 |
150–300 | − | − | 98/89/94 (200°С) |
98/86/90 (200°С) |
[109] |
| 10% Mn/ДПГ (метод осаждения) |
500 м. д. NH3; 500 м. д. NO;
3 об. % O2; N2 (3 об. % H2O) GHSV = 10 000 ч–1 |
140–300 | 210–300 | − | − | − | [110] |
| 6% γ-MnO2/Се–ММТ (метод осаждения) |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2 (200 м. д. SO2, 3 об. % H2O) GHSV = 25 000 ч–1 |
230–325 | − | − | − | 97/87/95 (250°С) |
[111] |
| 12% Mn–6% Ce/AlСr(2 : 2)-PILC (метод пропитки) |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2 GHSV = 100 000 ч–1 |
180–300 | − | − | − | − | [112] |
| 1% Mo/12% Mn–6% Ce/AlZr(1 : 1)-PILC (ионный обмен) |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2 (100 м. д. SO2, 12 об. % H2O) GHSV = 100 000 ч–1 |
190–300 | − | 98/97/98 (240°С) |
98/96/98 (240°С) |
98/94/98 (240°С) |
[113] |
Работа [105] посвящена детальному исследованию каталитических свойств двух серий образцов Cu/гидроксиапататит (2–11 мас. % Cu), приготовленных различными методами: 1) ионным обменом и 2) пропиткой по влагоемкости. Авторам удалось убедительно показать, что концентрация меди, метод ее нанесения и выбор соли-предшественника существенным образом влияют на активность полученных катализаторов в реакции NH3-СКВ. Многообещающий результат получен для образца с содержанием Cu 6 мас. %, введенной методом ионного обмена с использованием нитрата меди в качестве предшественника: максимальная конверсия NOx на нем составляет 90% в области температур 255–310°С.
В [106] предпринята попытка улучшить каталитические свойства гидроксиапатита путем его модификации железом. Серия катализаторов Fe/гидроксиапатит с различной концентрацией активного металла (2–7 мас. % Fe) была синтезирована методом ионного обмена в растворе нитрата железа. В качестве образца сравнения использовали Cu/гидроксиапатит (6 мас. % Cu) из [105]. Показано, что активность Fe-катализатора заметно ниже: максимальная конверсия NOx на Fe/гидроксиапатит (5 мас. % Fe) не превышает 60%, в то время как на Cu/гидроксиапатит (6 мас. % Cu) она достигает 90%. Кроме того рабочий интервал Fe-содержащих образцов смещен в область бóльших температур (300–500°С).
В работах [107, 108] предложено использовать в качестве носителей для катализаторов NH3-СКВ глинистый минерал аттапульгит (АТП), который по химическому составу представляет собой природную смесь кристаллогидратов силиката магния и алюминия. Аттапульгит обладает высокими показателями удельной площади поверхности, пористости и адсорбционной способности. Кроме того, на поверхности его кристаллов, имеющих форму наностержней с диаметром 40–50 нм и длиной от сотен нанометров до нескольких микрометров, имеются дефекты, которые могут служить центрами зародышеобразования и роста наночастиц металлов.
Индивидуальная активность аттапульгита низкая (конверсия NOx на нем не превышает 30%), однако она может быть в значительной степени увеличена путем нанесения на поверхность наностержней минерала наночастиц переходных металлов, например, Cu или Mn. Так, Cu/АТП с содержанием металла всего 1 мас. % позволяет удалять свыше 90% оксидов азота при 350°С, при этом даже в присутствии SO2 и паров воды конверсия NOx составляет 67% [107]. Введение Mn также положительно влияет на каталитическую активность аттапульгита [108]: с ростом содержания марганца от 0 до 7 мас. % значение максимальной конверсии повышается от 27 до 85%, при этом рабочий интервал катализатора сдвигается в область более низких температур почти на 100°С.
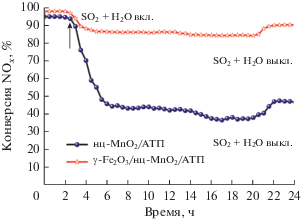
Простой и весьма эффективный метод синтеза высокоактивных катализаторов на основе аттапульгита предложен в работе [109]. На первой стадии для удаления примесей исходный минерал обрабатывали смесью серной и азотной кислот (H2SO4/HNO3 = 3/1). Затем на поверхности наностержней аттапульгита формировали подобные “наноцветам” кристаллы MnO2 (нц-MnO2), для чего в суспензии минерала растворяли KMnO4 (pH ~ 3) и выдерживали при 78°С в течение 4 ч. Наночастицы γ-Fe2O3 на поверхность нц-MnO2/АТП наносили из раствора солей FeSO4 и FeCl3 (pH ~10). Уровень pH регулировали добавлением ледяной уксусной кислоты или гидрата аммиака. Приготовленный таким образом катализатор γ-Fe2O3/нц-MnO2/АТП отличается высокой каталитической активностью при 150–300°С и устойчивостью к соединениям серы и парам воды (рис. 8).
Рис. 8.
Конверсия NOx на нц-MnO2/АТП и γ‑Fe2O3/нц-MnO2/АТП в присутствии SO2 и H2O. Рисунок адаптирован из работы [109] с разрешения журнала “New Journal of Chemistry”.
Перспективные катализаторы получены в [110] путем модификации марганцем доломитовой палыгорскитовой глины (ДПГ). Активный металл (10 мас. % Mn) наносили на предварительно прокаленный при 300°С природный носитель тремя различными способами: 1) пропиткой, 2) осаждением и 3) цитратным методом. Каталитические свойства образцов Mn/ДПГ исследованы в реакции NH3-СКВ как в отсутствие, так и в присутствии паров воды. Все исследуемые Mn/ДПГ катализаторы проявляют высокую активность в области низких температур: в отсутствие паров воды полная конверсия NOx при селективности 94% по N2 наблюдается при 180–300°С. Наличие в газовом потоке паров воды негативно сказывается на каталитических свойствах Mn-содержащих образцов, и их рабочий интервал смещается в сторону бóльших температур на 60°С.
Метод приготовления катализаторов оказывает заметное влияние на их активность и устойчивость по отношению к парам воды при температурах ниже 180°С. Так, при 120°С на Mn/ДПГ, полученном осаждением, удалось конвертировать 83% (62% с Н2О) оксидов азота, в то время как на системах, синтезированных пропиткой и цитратным методом – только 55% (35% с Н2О) и 68% (39% с Н2О) соответственно. Согласно результатам физико-химического исследования использование метода осаждения позволило создать катализатор с более высокой концентрацией решеточного кислорода и центров Mn4+, проявляющих активность в реакции NH3-СКВ.
Еще одним перспективным носителем, имеющим природное происхождение, является столбчатый монтмориллонит PILC (от англ. Pillared Interlayered Clay – столбчатая слоистая глина). Природный минерал монтмориллонит (ММТ) обладает очень низкой удельной площадью поверхности, из-за чего его применение для решения каталитических задач затруднено. Однако из него можно получить термически стабильный PILC с развитой удельной поверхностью и регулярным распределением макро- и мезопор. Для этого осуществляют ионный обмен (интеркаляцию) катионов Na+, находящихся в межслоевом пространстве кристаллической структуры исходного минерала, на крупные поликатионы Al, Zr, Ti, Fe, Cr или Се с последующим их превращением в оксиды соответствующих металлов в результате прокаливания [111]. Внедренные оксиды удерживают на себе слои монтмориллонита подобно опорам (англ. Pillar – колонна, столб).
В [111] было показано, что интеркалированный катионами церия монтмориллонит (Се‑ММТ) превосходит по каталитической активности исходный минерал: он позволяет удалять до 90% NOx при температуре 400°С (против 10%). Дополнительная модификация Се-ММТ γ-MnO2 (2–8 мас. %) оказывает воздействие на его низкотемпературные характеристики. Увеличение концентрации оксида марганца до определенного предела способствует росту активности в NH3-СКВ: максимальная конверсия NOx (97%) получена на образце 6% γ-MnO2/Ce-ММТ при 250°С. Следует отметить, что столь высокая эффективность удаления оксидов азота сохраняется даже в присутствии паров воды и SO2.
Вопросы о влиянии выбора поликатионов и их соотношения на каталитические свойства модифицированного Mn и Ce столбчатого монтмориллонита подробно рассмотрены в работе [112]. PILC были синтезированы путем интеркаляции исходного монтмориллонита поликатионами алюминия, хрома и их смесями с молярным соотношением Al : Cr, варьируемым в пределах от 0 : 4 до 4 : 0. Mn (12 мас. %) и Ce (6 мас. %) наносили методом пропитки. Установлено, что соотношение Al : Cr влияет не только на формирование межслоевого пространства, текстуру и окислительно-восстановительные свойства модифицированных активными компонентами столбчатых глин, но и на их каталитические характеристики. Так, активность и селективность систем Mn–Ce/AlСr(2 : 2)‑PILC была намного выше, чем у образцов, полученных на основе Al‑PILC, Сr-PILC и AlСr-PILC с молярными соотношениями Al : Cr равными 3 : 1 и 1 : 3. Сопоставление результатов каталитических тестов с данными физико-химического анализа позволило авторам заключить, что между носителем и Mn–Ce в результате их сильного взаимодействия возникает эффект синергизма.
В работе [113], которая послужила продолжением [112], исследовали влияние переходных металлов (V, W, Co и Mo; 1 мас. %) на каталитические свойства 12% Mn‑6% Ce/AlZr‑PILC с молярным соотношением Al : Zr = 1 : 1. Показано, что самыми многообещающими каталитическими свойствами в реакции NH3-СКВ обладает образец Mo/Mn‑Ce/AlZr‑PILC. Конверсия NOx на нем превышает 90% в интервале 190–300°С, при этом селективность по молекулярному азоту составляет более 85%. Кроме того, Мо-содержащий образец не теряет свою активность как в присутствии паров воды или SO2, так и при их совместной подаче.
Катализаторы на основе природных минералов и глин представляют собой достойную альтернативу традиционным V2O5–WO3/TiO2. Их характерной особенностью является возможность варьировать каталитические свойства путем несложных физико-химических обработок, например, растворами кислот или воздействием высоких температур, интеркалированием или модификацией поверхности различными металлами. Кроме того, благодаря высокой активности и сероустойчивости при температурах ниже 300°С, а также наличию слоистой кристаллической структуры минералы и глины могут быть использованы в качестве компонентов нанокомпозитных систем (см. главу “Гибридные системы”). Однако требуется проведение дополнительных исследований по установлению влияния паров воды и высоких температур, а также изучение возможности регенерации катализаторов, имеющих природное происхождение, в случае их отравления серосодержащими соединениями.
7. ГИБРИДНЫЕ СИСТЕМЫ
В последнее время активно ведутся работы по созданию гибридных (композитных, нанокомпозитных и мультизонных) каталитических систем, обеспечивающих высокую эффективность удаления NOx (или сразу нескольких компонентов выхлопных газов) в широком диапазоне температур, а также обладающих устойчивостью к действию паров воды, отравлению серосодержащими соединениями и углеводородами. Идея заключается в объединении в одном блоке двух или более компонентов, выполняющих разные каталитические функции. На сегодняшний день существует три вида подобных катализаторов: 1) композитные системы, полученные механическим смешением; 2) нанесенные нанокомпозитные системы; 3) мультизонные системы (рис. 9). Ниже каждый из этих видов будет рассмотрен подробнее (табл. 8).
Рис. 9.
Схематическое изображение композитных (а), нанокомпозитных (б) и мультизонных (в) гибридных каталитических систем.
Таблица 8.
Каталитические свойства гибридных систем в реакции NH3-СКВ
| Катализатор (метод приготовления) | Условия | Температурный интервал максимальной конверсии (>90%), °С | Конверсия NOx, % нач./после вкл. Х/ после выкл. Х (Tреакц) |
Ссылка | |||
|---|---|---|---|---|---|---|---|
| без Н2О | с Н2О | H2O | SO2 | H2O + SO2 | |||
| 1.5% Cu–SAPO-34 + 7.4% Fe‑MOR (1 : 1) (механическое смешение) |
150 м. д. NH3; 75 м. д. NO; 75 м. д. NO2;
10 об. % O2; 50 м. д. С3Н6/С3Н8;
5 об. % CO2; 667 м. д. CO; 2 об. % H2O GHSV ≈ 143 000 ч–1 |
– | 250–450 | – | – | – | [114] |
| Ce0.75Zr0.25O2 + H-Beta (3 : 1) (механическое смешение) |
580 м. д. NH3; 500 м. д. NO; 10 об. % O2;
6 об. % Н2О; N2 GHSV = 270 000 ч–1 |
– | 375–500 | – | – | – | [116] |
| 8% Mn/TiO2 + 0.9% FeBeta 8% Mn/Al2O3 + 0.9% FeBeta (3 : 1) (механическое смешение) |
580 м. д. NH3; 500 м. д. NO; 10 об. % O2;
6 об. % Н2О; N2 GHSV = 270 000 ч–1 |
– | 300–575 (>80%) | – | – | – | [117] |
| 8% Mn–8% Ce/Ce0.75Zr0.25O2 + + 0.9% Fe–Beta (3 : 1) (механическое смешение) |
600 м. д. NH3; 500 м. д. NO;
10 об. % O2; 5 об. % CO2; 6 об. % Н2О; N2 GHSV = 270 000 ч–1 |
– | 200–300 (>80%) | – | – | – | [118] |
| CuMnOx + 0.4%
Fe–ZSM-5 (1 : 1) (механическое смешение) |
1000 м. д. NH3; 1000 м. д. NO;
2 об. % O2; He GHSV = 300 000 ч–1 |
240–330 (>80%) |
– | – | – | – | [119] |
| CuMnOx + 0.2% Fe– ZSM-5 (1 : 1) (механическое смешение) |
1000 м. д. NH3; 1000 м. д. NO;
2 об. % O2; He GHSV = 300 000 ч–1 |
200–400 (>80%) | – | – | – | – | [120] |
| CeZrOx + 0.4% Fe–ZSM-5 (1 : 1) (механическое смешение) |
1000 м. д. NH3; 1000 м. д. NO;
2 об. % O2; He GHSV = 300 000 ч–1 |
380–550 | – | – | – | – | [121] |
| 1.6% Fe–SSZ-13 + + Fe0.2Mn0.4TiZr0.03Ох (7 : 1) (механическое смешение) |
500 м. д. NH3; 500 м. д. NO;
10 об. % O2; 5 об. % Н2О; N2 GHSV = 80 000 ч–1 |
– | 220–550 | – | – | – | [122] |
| 2% Fe–Beta + 50% MnOx/CeO2
(1 : 1) (механическое смешение) |
500 м. д. NH3; 500 м. д. NO;
10 об. % O2; 10 об. % СO2;
5 об. % Н2О; N2 (500 м. д. С3Н6) GHSV = 80 000 ч–1 |
− | 190–390 (+ C3H6) |
− | − | − | [123] |
| Mn–Ce/Cu/SSZ-13 (метод совместной пропитки) |
500 м. д. NH3; 500 м. д. NO;
3 об. % O2; N2 (100 м. д. SO2, 3 об. % H2O) GHSV = 50 000 ч–1 |
125–450 | − | − | 100/90/100 (300°С) |
100/70/95 (300°С) |
[125] |
| ZnTi10Ox/Cu/SSZ-13 (1 : 5) (золь-дисперсионный метод) |
500 м. д. NH3; 500 м. д. NO;
10 об. % O2; 5 об. % Н2О;
10 об. % СО2; N2 (50 м. д. SO2) GHSV = 80 000 ч–1 |
− | 160–500 | − | − | 100/73/73 (250°С) |
[126] |
| Ce(1)–Mn(0.25)/АТП (метод пропитки) |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2 (100 м. д. SO2) GHSV = 25 000 ч–1 |
240–350 | − | − | − | 96/61/83 (250°С) |
[127] |
| MnFeTiOx/АТП (метод соосаждения) |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2 (200 м. д. SO2) GHSV = 45 000 ч–1 |
150–300 | − | − | 97/80/93 (300°С) |
− | [128] |
| MnCrOx/АТП (гидротермальный метод) |
1000 м. д. NH3; 1000 м. д. NO;
5 об. % O2; N2 GHSV = 35 000 ч–1 |
165–350 | − | − | − | − | [129] |
| MnCrOx/ММТ (гидротермальный метод) |
1000 м. д. NH3; 1000 м. д. NO;
5 об. % O2; N2 GHSV = 35 000 ч–1 |
180–330 | − | − | − | − | [129] |
| MnCrOx/сепиолит (гидротермальный метод) |
1000 м. д. NH3; 1000 м. д. NO;
5 об. % O2; N2 (200 м. д. SO2) GHSV = 35 000 ч–1 |
115–350 | − | − | − | 98/85/90 (220°С) |
[129] |
| CeMo0.15Ox/ОГ (метод пропитки) |
850 м. д. NH3; 850 м. д. NO;
10 об. % O2 (200 м. д. SO2; 5 об. % Н2О) GHSV = 5000 ч–1 |
200–430 | − | 100/99/100 (330°С) |
100/92/100 (330°С) |
100/68/100 (330°С) |
[130] |
| LaMnO3/CeO2 (цитратный метод) |
1000 м. д. NH3; 1000 м. д. NO;
6 об. % O2; Ar GHSV = 30 000 ч–1 |
175–340 | − | − | − | − | [131] |
| LaMnO3/АТП (золь–гель метод) |
1000 м.д. NH3; 1000 м.д. NO;
3 об. % O2; N2 GHSV = 25 000 ч–1 |
200–300 (>70%) | − | − | − | − | [132] |
| La0.9Ce0.1MnO3/ АТП (золь–гель метод) |
1000 м. д. NH3; 1000 м. д. NO;
3 об. % O2; N2 GHSV = 25 000 ч–1 |
200–340 (>70%) |
− | − | − | − | [133] |
| FeBeta||[Mn−Ce/CeO2−ZrO2 + + FeBeta] (зонирование) |
600 м. д. NH3; 500 м. д. NO;
10 об. % O2; 5 об. % CO2; 200 м. д. СО; 500 м. д. n–С4Н10; 6 об. % Н2О; N2 GHSV = 270 000 ч–1 |
− | 250–500 (+ n-C4H10) |
− | − | − | [118] |
| 0.9% FeBeta||12% Mn−12% Ce/0.9% FeBeta на монолите (зонирование) |
380 м. д. NH3; 330 м. д. NO;
10 об. % O2; 6 об. % Н2О; N2 GHSV = 36 000 ч–1 |
− | 250–475 | − | − | − | [134] |
Композитные системы, полученные механическим смешением
Механическое смешение двух или более компонентов – один из самых эффективных способов получения композитных катализаторов. Их высокая активность может быть обусловлена несколькими причинами. Первая причина заключается в аддитивности действия входящих в состав механической смеси компонентов. Так, в [114] предлагается объединить каталитические свойства Cu-цеолита при температурах ниже 300°С и Fe-цеолита при температурах выше 300°С. Показано, что механическая смесь 1.5% Cu‑SAPO-34 и 7.4% Fe‑MOR, взятых в массовом соотношении 1 : 1, действительно позволяет эффективно удалять оксиды азота в более широком температурном интервале по сравнению с индивидуальными компонентами.
Другой причиной является возникновение синергических эффектов между компонентами механической смеси. Перспективность использования этих эффектов при разработке катализаторов для реакции NH3-СКВ впервые была продемонстрирована в [115]. Показано, что смешение оксидного (Ce0.67Zr0.33O2 или Mn/Ce0.67Zr0.33O2) и цеолитного (0.7% Fe‑Beta) компонентов приводит к сверхаддитивному увеличению каталитической активности. Авторы полагают, что возникновение синергического эффекта обусловлено высокой скоростью образования на оксидном компоненте NO2 (V), который инициирует протекание реакции NH3-СКВ по “быстрому” маршруту на цеолитном компоненте (VI):
(V)
$\begin{gathered} ~{\text{NO}} + {{{\text{O}}}_{2}}~~ \rightleftarrows ~~ \\ \to 2{\text{N}}{{{\text{O}}}_{2}}--{\text{на оксидном компоненте,}} \\ \end{gathered} $(VI)
$\begin{gathered} {\text{NO}} + {\text{N}}{{{\text{O}}}_{2}} + 2{\text{N}}{{{\text{H}}}_{3}} \to \\ \to 2{{{\text{N}}}_{2}} + 3{{{\text{H}}}_{2}}{\text{O}}--{\text{на цеолитном компоненте}}. \\ \end{gathered} $Более детально природа эффекта синергизма в композитных катализаторах, полученных механическим смешением оксидного и цеолитного компонентов, изучалась в [116]. Для этой цели была специально разработана модельная каталитическая система, состоящая из каталитически малоактивных в условиях реакции “стандартного” NH3-СКВ (I) компонентов Ce0.75Zr0.25O2 и H-Beta. Конверсия NOx на них не превышала 5% (рис. 10). Сопоставление имеющихся в литературе данных и результатов серии экспериментов с послойной загрузкой компонентов, изменением степени контакта между ними и массового соотношения оксид/цеолит позволило авторам заключить, что увеличение каталитической активности (конверсия NOx > 90%) при наличии плотного контакта между оксидом и цеолитом действительно обусловлено вовлечением NO2, образующегося на Ce0.75Zr0.25O2 (V), в реакцию восстановления (VI), протекающую на H-Beta.
Рис. 10.
Каталитическая активность индивидуальных компонентов (Ce0.75Zr0.25O2 и H-Beta) и композитного катализатора на их основе. Рисунок адаптирован из работы [116] с разрешения журнала “Topics in Catalysis”.
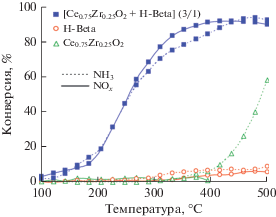
На основе полученных данных о природе эффекта синергизма был разработан оригинальный подход к созданию высокоактивных композитных катализаторов низкотемпературного NH3-СКВ. Основная его идея заключается в комбинировании двух компонентов, один из которых должен обладать высокой активностью в реакции окисления NO (например, Mn- и Ce-содержащие оксидные композиции), а другой – в реакции восстановления эквимолярной смеси NO + NO2 (Fe-содержащие цеолиты). Так, весьма перспективными являются композитные системы [Mn/MO2 + FeBeta] (где М = Ti или Al) [117] и [Mn‑Ce/CeO2‑ZrO2 + FeBeta] [118], полученные механическим смешением оксида и цеолита в массовом соотношении 3 : 1, позволяющие удалять более 80% NOx при температурах 300–575 и 200–300°С соответственно.
Исследованию причины возникновения эффекта синергизма также посвящен цикл работ [119–121]. На примере композитных систем, приготовленных смешением CuMnOx, CeZrOx или Mn2O3 (оксидный компонент) и Fe‑ZSM-5 (цеолитный компонент), удалось показать, что увеличение каталитической активности в области низких температур не связано напрямую с образованием NO2. Сопоставительный анализ литературных данных и полученных в ходе работы результатов позволил предложить иное объяснение природы синергического эффекта. По мнению авторов NO окисляется на оксидном компоненте с образованием реакционноспособного газообразного промежуточного соединения HNO2, которое диффундирует к поверхности цеолитного компонента. На активных центрах цеолита HNO2 восстанавливается аммиаком до H2O и N2.
Свой взгляд на природу эффекта синергизма, возникающего между компонентами композитных катализаторов, представили авторы работы [122], посвященной изучению каталитических свойств систем [1.6% Fe‑SSZ-13 + Fe0.2Mn0.4TiZr0.03Ох] с различным массовым соотношением компонентов. Неаддитивное увеличение каталитической активности, по их мнению, возникает в результате разделения между компонентами функций активации молекул реагентов во времени и пространстве. Так, Fe0.2Mn0.4TiZr0.03Ох отвечает за окисление NO в газообразный HNO2 или поверхностные ‒NO2/‒NO3. Роль 1.6% Fe‑SSZ-13 заключается в адсорбции NH3 и его активации в виде ‒NH4+. Кроме того, на поверхности цеолита накапливаются ‒NO2/‒NO3, которые наряду с HNO2 вступают в реакцию с различными формами аммиака (газообразной или активированной) с образованием нестабильного промежуточного комплекса NH4NO2. Этот комплекс легко разрушается при температурах ниже 300°С с выделением воды и молекулярного азота.
Еще одним проявлением синергизма в композитных катализаторах является повышение устойчивости к отравлению углеводородами. Известно, что низкотемпературная каталитическая активность цеолитов в реакции NH3-СКВ заметно снижается в присутствии углеводородов вследствие их адсорбции на активных центрах, отвечающих за активацию NO. Эффективное решение данной проблемы было найдено в работе [123]. Предлагается смешивать FeBeta с оксидным катализатором MnOx/CeO2. Обнаружено, что каталитические свойства полученной таким образом композитной системы не зависят от присутствия в газовом потоке С3Н6. Авторы предполагают, что молекулы углеводорода окисляются на активных центрах оксидного катализатора с образованием оксигенированных промежуточных комплексов, которые затем выступают в роли восстановителей оксидов азота.
Нанесенные нанокомпозитные системы
Большая часть работ в области разработки нанокомпозитных каталитических систем для реакции NH3-СКВ посвящена исследованию активности наночастиц многокомпонентных оксидов, нанесенных на цеолиты [124–126] или на носители, имеющие природное происхождение, например, аттапульгит [127–129], монтмориллонит [129, 130] и сепиолит [129]. Важно отметить, что такие нанесенные катализаторы, как правило, превосходят по своим свойствам каталитические системы аналогичного состава, полученные механическим смешением. Плотный контакт между компонентами способствует быстрому переносу промежуточных соединений от одного компонента к другому, облегчая тем самым протекание реакции NH3-СКВ [117].
В работе [125] Cu/SSZ-13 модифицировали марганцем и церием, используя метод совместной пропитки растворами нитратов Mn и Ce. Молярное соотношение MnOx : CeO2 : Cu/SSZ-13 составляло 6 : 4 : 90. Установлено, что добавка марганца и церия позволяет сместить рабочий интервал цеолита в низкотемпературную область. Так, для эффективной работы (конверсия NOx выше 90%) Cu/SSZ-13 температура должна быть не менее 175°С, в то время как для Mn‑Ce/Cu/SSZ-13 – всего 125°С. Помимо активности в реакции NH3-СКВ модифицированный марганцем и церием Cu-содержащий цеолит обладает устойчивостью к соединениям серы и парам воды.
Высокие каталитические свойства и сероустойчивость продемонстрировал нанокомпозитный катализатор ZnTiOx/Cu/SSZ-13, полученный золь-дисперсионным методом в [126]: даже в присутствии SO2 и Н2О конверсия NOx на нем превышала 73%, в то время как на Cu/SSZ-13 и механической смеси ZnTiO2 + Cu/SSZ-13 она составляла только 66%. Предполагается, что ZnTiOx за счет тесного контакта с цеолитом выполняет роль своеобразного “щита”, защищающего Cu-содержащие активные центры от отравления серой. На это указывают результаты экспериментов по регенерации, а также данные термогравиметрического анализа и температурно-программированной десорбции SO2, согласно которым в случае нанокомпозитного катализатора ZnTiOx/Cu/SSZ-13 образуется заметно меньше сульфата меди и больше сульфатов цинка.
Перспективными катализаторами для проведения реакции NH3-СКВ при температурах ниже 350°С являются нанокомпозиты, представляющие собой двух- и трехкомпонентные оксиды Mn‑X и Mn‑X‑Ti (где Х = Ce, Fe, Cr, Ti), нанесенные на аттапульгит. Так, в работе [127] исследованы каталитические свойства серии образцов Mn‑Ce/АТП. Показано, что такие системы превосходят по своей низкотемпературной активности широко применяемый на практике катализатор V2O5‑WO3/TiO2. При этом существенное влияние на эффективность удаления NOx оказывает молярное соотношение металлов в составе оксидной композиции нанокомпозита: оптимальными каталитическими характеристиками обладает образец с молярным соотношением Се/Mn = 1/0.25.
Серия эффективных нанокомпозитных катализаторов была получена в [128] осаждением MnFeOx, MnCrOx, MnTiOx и MnFeTiOx на поверхность аттапульгита. Самым активным и селективным в реакции NH3-СКВ был образец MnFeTiOx/АТП за счет более высокой концентрации активных центров Mn4+ и поверхностного кислорода. Он позволяет превращать свыше 90% оксидов азота в N2 (селективность 90–100%) в интервале 150–300°С. Кроме того, MnFeTiOx/АТП обладает большей стабильностью в условиях реакции и устойчивостью к отравлению соединениями серы по сравнению с традиционным катализатором V2O5–WO3/TiO2.
Выбор носителя природного происхождения оказывает существенное влияние на каталитические свойства нанесенного оксидного катализатора. Так, в работе [129] показано, что низкотемпературная активность (ниже 200°С) MnCrOx при его нанесении на различные глины и минералы падает в следующем ряду: сепиолит > аттапульгит > > монтмориллонит. Согласно результатам физико-химического исследования высокая каталитическая активность MnCrOx/сепиолит обусловлена сильным взаимодействием между носителем и Mn‑Cr-композицией, приводящим к возрастанию концентрации хемосорбированного кислорода, увеличению кислотности и образованию большого количества активных центров Mn4+ и Cr6+.
Оригинальный подход к созданию нанокомпозитных катализаторов на основе оксидного компонента и монтмориллонита был предложен в [130]. Исходный минерал подвергали полному ионному обмену с раствором, содержащим крупные поверхностно-активные катионы (октадецилтриметиламмония и цетилтриметиламмония). Это способствовало расширению межслоевого пространства монтмориллонита, увеличению его удельной площади поверхности, а также снижению содержания щелочных металлов, которые являются каталитическими ядами. Полученная “органическая глина” (ОГ) была модифицирована молибденом и церием, из которых на стадии прокаливания в межслоевом пространстве образуются высокодисперсные наночастицы CeMoOx. Катализатор CeMoOx/ОГ обладает высокой эффективность в реакции NH3-СКВ и устойчивостью к отравлению серой.
В литературе имеются примеры успешного создания нанокомпозитных катализаторов, представляющих собой наночастицы перовскитов, нанесенные на различные оксидные материалы (TiO2, CeO2) или природные минералы (например, аттапульгит). Такие системы проявляют значительно бóльшую активность в низкотемпературной области по сравнению с ненанесенными перовскитами. Носитель в данном случае может выполнять различные функции. Так, высокая эффективность нанокомпозитного катализатора LaMnO3/CeO2 при температурах ниже 300°С обусловлена активностью оксидного носителя в реакции окисления NO в NO2 [131]. Использование в качестве носителя аттапульгита, обладающего значительной удельной площадью поверхности, способствует интенсификации адсорбции молекул аммиака в виде поверхностных форм $ - {\text{NH}}_{4}^{ + }$ и накоплению активированных молекул монооксида азота (‒NO2). Взаимодействие $ - {\text{NH}}_{4}^{ + }$ и ‒NO2 приводит к образованию H2O и N2 даже при температурах ниже 300°С [132, 133].
Мультизонные системы
Особый интерес представляет разработка мультизонных гибридных каталитических систем, обеспечивающих эффективное удаление не только NOx, но и СО, несгоревших углеводородов и остаточного аммиака. Перспективность подобных систем для комплексной очистки выхлопных газов автотранспорта и отходящих газов химических предприятий была впервые продемонстрирована в [118]. За счет пространственного разделения каталитических функций (зон) удается обеспечить независимое протекание нескольких реакций, отличающихся по своей химической природе (зона восстановления и зона окисления).
Полифункциональность действия двухзонной системы, состоящей из цеолита FeBeta (фронтальная зона) и нанокомпозитного катализатора [Mn–Ce/CeO2–ZrO2 + FeBeta] (задняя зона), была исследована в реакциях NH3-СКВ, полного окисления несгоревших углеводородов, монооксида углерода и остаточного аммиака. Показано, что FeBeta || [Mn–Ce/CeO2–ZrO2 + FeBeta] позволяет одновременно удалять свыше 90% NOx, NH3 и СО при 250–500°С, а также n-C4H10 при 350–500°С в присутствии паров воды и при высокой объемной скорости (180 000 ч–1). Установлено, что FeBeta отвечает за протекание реакции NH3-СКВ при 300–500°С. Роль [Mn–Ce/CeO2–ZrO2 + + FeBeta] заключается в удалении NOx и NH3 при температурах ниже 300°С, а также в окислении углеводорода и монооксида углерода. Двухзонные системы могут быть легко нанесены на монолит путем пропитки одной из его половин катализатором восстановления, а другой – катализатором окисления [134].
Анализ литературы показывает, что на сегодняшний день гибридные системы являются наиболее перспективными катализаторами реакции NH3-СКВ. Они эффективно удаляют NOx в широком интервале температур, обладают высокой устойчивостью к парам воды, серосодержащим соединениям и углеводородам. Преимущество подобных систем перед остальными рассмотренными выше катализаторами заключается в возможности их использования для нейтрализации не только оксидов азота, но и СО, летучих органических соединений, остаточного аммиака. В перспективе необходимо более детально исследовать их каталитические свойства в условиях, максимально приближенных к реальным условиям эксплуатации систем каталитической очистки отходящих газов предприятий и выхлопных газов автотранспорта, а также оценить их термическую и гидротермальную стабильность.
ЗАКЛЮЧЕНИЕ
Разработка высокоэффективных экологически безопасных катализаторов для реакции селективного каталитического восстановления NOx аммиаком остается актуальной задачей. За последние 5 лет предложено множество каталитических систем, из которых наиболее перспективными свойствами обладают многокомпонентные смешанные оксиды, гидротальциты, перовскиты, узкопористые цеолиты, MOF, природные минералы и глины, а также гибридные катализаторы (рис. 11). Смешанные оксиды и гидротальциты являются бесспорными лидерами с точки зрения низкотемпературных характеристик. Их рабочий интервал температур, как правило, лежит в области 140–350°С.
Рис. 11.
Максимальная конверсия NOx и рабочие интервалы температур для различных групп катализаторов.
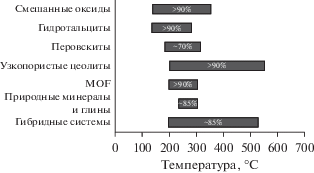
Интерес исследователей к перовскитам, природным минералам и глинам обусловлен не только их высокими каталитическими характеристиками при температурах ниже 300°С и термической стабильностью, но также дешевизной и доступностью, что особенно важно при разработке катализаторов для нейтрализации отходящих газов промышленных предприятий. Активно исследуются всевозможные металлоорганические каркасные структуры. Благодаря большой удельной площади поверхности, а также равномерному распределению активных центров и их доступности для реакции на основе MOF удается создавать системы, превосходящие по своим характеристикам традиционные V-содержащие катализаторы.
Следует, однако, отметить, что существенным недостатком многих из перечисленных систем является относительно узкий интервал рабочих температур (см. рис. 11), а также недостаточная устойчивость каталитических характеристик в присутствии паров воды и серосодержащих соединений.
Наибольший потенциал практического применения имеют модифицированные различными металлами узкопористые Cu-содержащие цеолиты и гибридные каталитические системы, состоящие из двух и более компонентов. Они способны работать в широком диапазоне температур (200–550°С), сохраняя высокую активность даже в присутствии паров воды и соединений серы. Преимуществом гибридных систем является потенциальная возможность их использования для одновременного проведения сразу нескольких каталитических процессов: восстановления NOx и окисления СО, углеводородов, остаточного NH3.
В перспективе предстоит изучить стабильность рассмотренных катализаторов в условиях реакции NH3-СКВ, расширить рабочий интервал в область температур ниже 200°С, обеспечить высокую устойчивость к отравлению серой, углеводородами, парами воды, а также оценить возможность их регенерации. Кроме того, в контексте введения все более строгих нормативов на выбросы выхлопных газов необходимо исследовать эффективность их применения для удаления других ныне нерегулируемых, однако оказывающих негативное воздействие на окружающую среду и здоровье человека, экотоксикантов: N2O, NH3, муравьиной и изоциановой кислот и др.
Список литературы
Boningari T., Smirniotis P.G. // Curr. Opin. Chem. Eng. 2016. V. 13. P. 133
Nguyen H.P., Matsuoka M., Kim T.H., Lee S.W. // J. Photochem. Photobiol. A. 2018. V. 367. P. 429.
Villamaina R., Nova I., Tronconi E., Maunula T., Keenan M. // Emission Contr. Sci. Technol. 2019. V. 5. № 4. P. 290.
Li J., Chang H., Ma L., Hao J., Yang R.T. // Catal. Today. 2011. V. 175. № 1. P. 147.
Nova I., Tronconi E. Urea-SCR technology for DeNOx after treatment of diesel exhausts. New York: Springer. 2014. P. 716.
Liu Z., Yu F., Ma C., Dan J., Luo J., Dai B. // Catalysts. 2019. V. 9. № 9. 771.
Damma D., Ettireddy P.R., Reddy B.M., Smirniotis P.G. // Catalysts. V. 9. № 4. 349.
Wang H., Huang B., Yu C., Lu M., Huang H., Zhou Y. // Appl. Catal. A: Gen. 2019. V. 588. 117207.
Zhang M., Huang B., Jiang H., Chen Y. // Front. Chem. Sci. Eng. 2017. V. 11. № 4. P. 594.
Li X., Shi H., Wang T., Zhang Y., Lu X., Zuo S., Li Z., Yao C. // J. Taiwan Inst. Chem. Eng. 2018. V. 89. P. 119.
Liu C., Shi J.-W., Gao C., Niu C. // Appl. Catal. A: Gen. 2016. V. 522. P. 54.
Li C., Tang X., Yi H., Wang L., Cui X., Chu C., Li J., Zhang R., Yu Q. // Appl. Surf. Sci. 2018. V. 428. P. 924.
Kim S.H., Park B.C., Jeon Y.S., Kim Y.K. // ACS Appl. Mater. Interfaces. 2018. V. 10. № 38. P. 32112.
Meng D., Zhan W., Guo Y., Guo Y., Wang L., Lu G. // ASC Catal. 2015. V. 5. № 10. P. 5973.
Sun P., Guo R.-T., Liu S.-M., Wang S.-X., Pan W.-G., Li M.-Y. // Appl. Catal. A: Gen. 2017. V. 531. P. 129.
Guo R.-T., Sun P., Pan W.-G., Li M.-Y., Liu S.-M., Sun X., Liu S.-W., Liu J. // Ind. Eng. Chem. Res. 2017. V. 56. № 44. P. 12566.
Fan Z., Shi J.-W., Gao C., Gao G., Wang B., Wang Y., He C., Niu C. // Chem. Eng. J. 2018. V. 348. P. 820.
Leng X., Zhang Z., Li Y., Zhang T., Ma S., Yuan F., Niu X., Zhu Y. // Fuel. Process. Technol. 2018. V. 181. P. 33.
France L.J., Yang Q., Li W., Chen Z., Guang J., Guo D., Wang L., Li X. // Appl. Catal. B: Env. 2017. V. 206. P. 203.
Fang N., Guo J., Shu S., Luo H., Li J., Chu Y. // J. Taiwan Inst. Chem. E. 2018. V. 93. P. 277.
Gao C., Shi J.-W., Fan Z., Wang B., Wang Y., He C., Wang X., Li J., Niu C. // Appl. Catal. A: Gen. 2018. V. 564. P. 102.
Gao C., Shi J.-W., Fan Z., Yu Y., Chen J., Li Z., Niu C. // Fuel. Proc. Technol. 2017. V. 167. P. 322.
Gao C., Xiao B., Shi J.-W., He C., Wang B., Ma D., Cheng Y., Niu C. // J. Catal. 2019. V. 380. P. 55.
Ali S., Li Y., Zhang T., Hasnain Bakhtiar S.U., Leng X., Li Z., Yuan F., Niu X., Zhu Y. // Mol. Catal. 2018. V. 461. P. 97.
Yan L., Liu Y., Zha K., Li H., Shi L., Zhang D. // Catal. Sci. Technol. 2017. V. 7. № 2. P. 502.
Shi R., Zhang Y., Yuan B., Zheng Z., Ni L., Feng R., Lin X., Dai L. // Kinet. Catal. 2019. V. 60. № 2. P. 205.
Xu T., Wang C., Wu X., Zhao B., Chen Z., Weng D. // RSC Adv. 2016. V. 6. № 99. P. 97004.
Liu J., Guo R.-T., Guan Z.-Z., Sun X., Pan W.-G., Liu X.-Y., Wang Z.-Y., Shi X., Qin H., Qiu Z.-Z., Liu S.-W. // Int. J. Hydrogen Energy. 2019. V. 44. № 2. P. 835.
Chen L., Yuan F., Li Z., Niu X., Zhu Y. // Chem. Eng. J. 2018. V. 354. P. 393.
Tong Y., Li Y., Li Z., Wang P., Zhang Z., Zhao X., Yuan F., Zhu Y. // Appl. Catal. A: Gen. 2020. V. 590. 117333.
Ma S., Zhao X., Li Y., Zhang T., Yuan F., Niu X., Zhu Y. // Appl. Catal. B: Env. 2019. V. 248. P. 226.
Ma S., Tan H., Li Y., Wang P., Zhao C., Niu X., Zhu Y. // Chemosphere. 2020. V. 243. 125309.
Wijitwongwan R., Intasa-ard S., Ogawa M. // ChemEng. 2019. V. 3. № 3. P. 68.
Бельская О.Б., Степанова Л.Н., Гуляева Т.И., Леонтьева Н.Н., Зайковский В.И., Саланов А.Н., Лихолобов В.А. // Кинетика и катализ. 2016. Т. 57. 554.
Dębek R., Motak M., Grzybek T., Galvez M.E., Da Costa P. // Catalysts. 2017. V. 7. № 1. P. 32.
Jabłońska M., Chmielarz L., Węgrzyn A., Góra-Marek K., Piwowarska Z., Witkowski S., Bidzińska E., Kuśtrowski P., Wach A., Majda // Appl. Clay Sci. 2015. V. 114. P. 273.
Frusteri L., Cannilla C., Todaro S., Frusteri F., Bonura G. // Catalysts. 2019. V. 9. № 12. P. 1058.
Basąg S., Kocoł K., Piwowarska Z., Rutkowska M., Baran R., Chmielarz L. // React. Kinet. Mech. Catal. 2017. V. 121. P. 225.
Jabłońska M., Palkovits R. // Catal. Sci. Technol. 2016. V. 6. № 1. P. 49.
Klyushina A., Pacultová K., Karásková K., Jirátová K., Ritz M., Fridrichová D., Volodarskaja A., Obalová L. // J. Mol. Catal. A: Chem. 2016. V. 425. P. 237.
Yan Q., Chen S., Zhang C., Wang Q., Louis B. // Appl. Catal. B: Env. 2018. V. 238 P. 236.
Yan Q., Chen S., Qiu L., Gao Y., O’Hare D., Wang Q. // Dalton Trans. 2018. V. 47. № 9. P. 2992.
Yan Q., Chen S., Zhang C, O’Hare D., Wang Q. // J. Colloid Interf. Sci. 2018. V. 526. P. 63.
Wang R., Wu X., Zou C., Li X., Du Y. // Catalysts. 2018. V. 8. № 9. P. 384.
Wu X., Feng Y., Liu X., Liu L., Du Y., Li Z. // Appl. Surf. Sci. 2019. V. 495. P. 143513.
Wu X., Feng Y., Du Y., Liu X., Zou C., Li Z. // Appl. Surf. Sci. 2019. V. 467–468. P. 802.
Wang R., Hao Z., Li Y., Liu G., Zhang H., Wang H., Xia Y., Zhan X. // Appl. Catal. B; Env. 2019. V. 258. P. 117983.
Yan Q., Gao Y., Li Y., Vasiliades M.A., Chen S., Zhang C., Gui R., Wang Q., Zhu T., Efstathiou A.M. // Appl. Catal. B: Env. 2019. V. 255. P. 117749.
Onrubia-Calvo J.A., Pereda-Ayo B., De-La-Torre U., González-Velasco J.R. / In book: Perovskite Materials, Devices and Integration. Ed. Tian H. London: IntechOpen, 2019.
Русских О.В., Иванов Д.В., Исупова Л.А., Чезганов Д.С., Остроушко А.А. // Кинетика и катализ. 2016. Т. 57. P. 719.
Jabłońska M., Palkovits R. // Catal. Sci. Technol. 2019. V. 9. № 9. P. 2057.
Исупова Л.А., Куликовская Н.А., Сапутина Н.Ф., Герасимов Е.Ю., Цыбуля С.В. // Кинетика и катализ. 2015. Т. 56. P. 770.
Xu H., Qu Z., Zong C., Quan F., Mei J., Yan N. // Appl. Catal. B: Env. 2016. V. 186. P. 30.
Yang J., Zhang M., Li H., Qu W., Zhao Y., Zhang J. // Ind. Eng. Chem. Res. 2018. V. 57. № 29. P. 9374.
Zhang R., Yang W., Luo N., Li P., Lei Z., Chen B. // Appl. Catal. B: Env. 2019. V. 146. P. 94.
Яшник С.А., Исмагилов З.Р. // Кинетика и катализ. 2016. Т. 57. P. 777.
Dusselier M., Davis M.E. // Chem. Rev. 2018. V. 118. № 11. P. 5265.
Wang J., Zhao H., Haller G., Li Y. // Appl. Catal. B: Env. 2017. V. 202. P. 346.
Xin Y., Li Q., Zhang Z. // ChemCatChem. 2017. V. 10. № 1. P. 29.
Blakeman P.G., Burkholder E.M., Chen H.-Y., Collier J.E., Fedeyko J.M., Jobson H., Rajaram R.R. // Catal. Today. 2014. V. 231. P. 56.
Mohan S., Dinesha P., Kumar S. // Chem. Eng. J. 2020. V. 384. P. 123253.
Paolucci C., Di Iorio J.R., Ribeiro F.H., Gounder R., Schneider W.F. // Adv. Catal. 2016. V. 59. P. 1.
Database of Zeolite Structures, http://www.iza-structure.org/databases/.
Song J., Wang Y., Walter E.D., Washton N.M., Mei D., Kovarik L., Engelhard M.H., Prodinger S., Wang Y., Peden C.H.F., Gao F. // ACS Catal. 2017. V. 7. № 12. P. 8214.
Gao F., Wang Y., Kollár M., Washton N.M., Szanyi J., Peden C.H.F. // Catal. Today. 2015. V. 258. Part 2. P. 347.
Wang A., Wang Y., Walter E.D., Washton N.M., Guo Y., Lu G., Peden C.H.F., Gao F. // Catal. Today. 2019. V. 320. P. 91.
Zhang T., Li J., Liu J., Wang D., Zhao Z., Cheng K., Li J. // AIChE. 2015. V. 61. № 11. P. 3825.
Wang Y., Xie L., Liu F., Ruan W. // J. Environ. Sci. 2019. V. 81. P. 195.
Song C., Zhang L., Li Z., Lu Y., Li K. // Catalysts. 2019. V. 9. № 5. P. 455.
Wang J., Peng Z., Qiao H., Yu H., Hu Y., Chang L., Bao W. // Ind. Eng. Chem. Res. 2016. V. 55. № 5. P. 1174.
Wang Y., Shi X., Shan Y., Du J., Liu K., He H. // Ind. Eng. Chem. Res. 2020. V. 59. № 14. P. 6416.
Usui T., Liu Z., Ibe S., Zhu J., Anand C., Igarashi H., Onaya N., Sasaki Y., Shiramata Y., Kusamoto T., Wakihara T. // ACS Catal. 2018. V. 8. № 10. P. 9165.
Li X., Feng J., Xu Z., Wang J., Wang Y., Zhao W. // React. Kinet. Mech. Cat. 2019. V. 128. № 1. P. 163.
Zhao Z., Yu R., Shi C., Gies H., Xiao F.-S., De Vos D., Yokoi T., Bao X., Kolb U., McGuire R., Parvulescu A.-N., Maurer S., Müller U., Zhang W. // Catal. Sci. Technol. 2019. V. 9. № 1. P. 241.
Исаева В.И., Кустов Л.М. // Нефтехимия. 2010. Т. 50. № 3. С. 179.
Wang P., Zhao H., Sun H., Yu H., Chen S., Quan X. // RSC Adv. 2014. V. 4. № 90. P. 48912.
Tafipolsky M., Amirjalayer S., Schmid R. // Micropor. Mesopor. Mater. 2010. V. 129. № 3. P. 304.
Li H., Wang K., Sun Y., Lollar C.T., Li J., Zhou H.-C. // Mater. Today. 2018. V. 21. № 2. P. 108.
Wu M.-X., Yang Y.-W. // Adv. Mater. 2017. V. 29. № 23. P. 1606134.
Liu Y., Zhao Y., Chen X. // Theranostics. 2019. V. 9. № 11. P. 3122.
Kreno L.E., Leong K., Farha O.K., Allendorf M., Van Duyne R.P., Hupp J.T. // Chem. Rev. 2012. V. 112. № 2. P. 1105.
Mingabudinova L.R., Vinogradov V.V., Milichko V.A., Hey-Hawkins E., Vinogradov A.V. // Chem. Soc. Rev. 2016. V. 45. № 19. P. 5408.
Cui Y., Yue Y., Qian G., Chen B. // Chem. Rev. 2012. V. 112. № 2. P. 1126.
Liu Y., Xie X.-Y., Cheng C., Shao Z.-S., Wang H.-S. // J. Mater. Chem. C. 2019. V. 7. № 35. P. 10743.
Пaтeнт CN101920213A.
Пaтeнт CN103418239A.
Zhang M., Wang W., Chen Y. // Phys. Chem. Chem. Phys. 2018. V. 20. № 4. P. 2211.
Jiang H., Wang Q., Wang H., Chen Y., Zhang M. // ACS Appl. Mater. Interfaces. 2016. V. 8. № 40. P. 26817.
Shi Y., Li C., Liu X., Zhang H., Zhao Q., Li X. // Integr. Ferroelectr. 2017. V. 181. № 1. P. 14.
Пaтeнт CN103752169A.
Li C., Shi Y., Zhang H., Zhao Q., Xue F., Li X. // Integr. Ferroelectr. 2016. V. 172. № 1. P. 169.
Sun X., Shi Y., Zhang W., Li C., Zhao Q., Gao J., Li X. // Catal. Commun. 2018. V. 114. P. 104.
Jiang H., Zhou J., Wang C., Li Y., Chen Y., Zhang M. // Ind. Eng. Chem. Res. 2017. V. 56. № 13. P. 3542.
Zhang W., Shi Y., Li C., Zhao Q., Li X. // Catal. Lett. 2016. V. 146. № 10. P. 1956.
Jiang H., Niu Y., Wang Q., Chen Y., Zhang M. // Catal. Commun. 2018. V. 113. P. 46.
Wang P., Sun H., Quan X., Chen S. // J. Hazard. Mater. 2016. V. 301. P. 512.
Zhang X., Shen B., Zhang X., Wang F., Chi G., Si M. // RSC Adv. 2017. V. 7. № 10. P. 5928.
Zhang M., Huang B., Jiang H., Chen Y. // Front. Chem. Sci. Eng. 2017. V. 11. № 4. P. 594.
Sun H., Liu Z., Wang Y., Quan X., Zhao G. // J. Hazard. Mater. 2019. V. 380. P. 120800.
Yao Z., Qu D., Guo Y., Yang Y., Huang H. // Adv. Mater. Sci. Eng. 2019. V. 2019. P. 2935942.
Yu Y., Chen C., He C., Miao J., Chen J. // ChemCatChem. 2019. V. 11. № 3. P. 979.
Jiang H., Wang C., Wang H., Zhang M. // Mater. Lett. 2016. V. 168. P. 17.
Peng B., Feng C., Liu S., Zhang R. // Catal. Today. 2018. V. 314. P. 122.
Gong Z., Niu S.-L., Zhang Y.-J., Lu C.-M. // Mater. Res. Bull. 2020. V. 123. P. 110693.
Schiavonia M., Campisia S., Carnitia P., Gervasinia A., Delplanche T. // Appl. Catal. A : Gen. 2018. V. 563. P. 43.
Campisi S., Galloni M.G., Bossola F., Gervasini A. // Catal. Commun. 2019. V. 123. P. 79.
Chen C., Cao Y., Liu S., Chen J., Jia W. // Appl. Surf. Sci. 2019. V. 480. P. 537.
Xie A., Zhou X., Huang X., Ji L., Zhou W., Luo S., Yao C. // J. Ind. Eng. Chem. 2017. V. 49. P. 230.
Xie A., Tao Y., Jin X., Gu P., Huang X., Zhou X., Luo S., Yao C., Li X. // New J. Chem. 2019. V. 43. № 6. P. 2490.
Zuo H., Xu D., Liu W., Dan H., Liu X., Lin S., Hou P. // Appl. Clay Sci. 2018. V. 152. P. 276.
Huang X., Xie A., Zhou X., Xia J., Luo S., Yao C., Li X. // J. Mater. Res. 2018. V. 33. № 21. P. 3559.
Chen D., Cen C., Feng J., Yao C., Li W., Tiana S., Xiong Y. // J. Chem. Technol. Biotechnol. 2016. V. 91. № 11. P. 2842.
Chen D., Feng J., Sun J., Cen C., Tian S., Yang J., Xiong Y. // J. Chem. Techol. Biotechnol. 2020. V. 95. № 5. P. 1441.
Hamoud H.I., Valtchev V., Daturi M. // Appl. Catal. B: Env. 2019. V. 250. P. 419.
Stakheev A.Yu., Baeva G.N., Bragina G.O., Teleguina N.S., Kustov A.L., Grill M., Thøgersen J.R. // Top. Catal. 2013. V. 56. P. 427.
Mytareva A.I., Stakheev A.Yu., Baeva G.N., Bokarev D.A., Kustov A.L., Thøgersen J.R. // Top. Catal. 2016. V. 59. № 10–12. P. 919.
Мытарева А.И., Бокарев Д.А., Баева Г.Н., Криворученко Д.С., Белянкин А.Ю., Стахеев А.Ю. // Нефтехимия. 2016. Т. 56. № 3. С. 228.
Mytareva A.I., Bokarev D.A., Baeva G.N., Belyankin A.Yu., Stakheev A.Yu. // Top. Catal. 2019. V. 62. P. 192.
Salazar M., Hoffmann S., Tkachenko O.P., Becker R., Grünert W. // Appl. Catal. B: Env. 2016. V. 182. P. 213.
Salazar M., Hoffmann S., Singer V., Becker R., Grünert W. // Appl. Catal. B: Env. 2016. V. 199. P. 433.
Salazar M., Hoffmann S., Tillmann L., Singer V., Becker R., Grünert W. // Appl. Catal. B: Env. 2017. V. 218. P. 793.
Yu R., Zhao Z., Shi C., Zhang W. // J. Phys. Chem. C. 2019. V. 123. № 4. P. 2216.
Zhao Q., Chen B., Bai Z., Yu L., Crocker M., Shi C. // Appl. Catal. B: Env. 2019. V. 242. P. 161.
Криворученко Д.С., Телегина Н.С., Бокарев Д.А., Стахеев А.Ю. // Кинетика и катализ. 2015. Т. 56. P. 729.
Liu Q., Fu Z., Ma L., Niu H., Liu C., Li J., Zhang Z. // Appl. Catal. A: Gen. 2017. V. 547. P. 146.
Yu R., Zhao Q., Chen B., Bai Z., Yu L., Crocker M., Shi C. // Appl. Catal. B: Env. 2020. V. 269. P. 118825
Xie A., Zhou X., Huang X., Ji L., Zhou W., Luo S., Yao C. // J. Ind. Eng. Chem. 2017. V. 49. P. 230.
Tang Y., Tao Y., Wu J., Xu L., Huang X., Zhou X., Xie A., Luo S., Yao C., Li X. // J. Mater. Res. 2019. V. 34. № 7. P. 1188.
Xie A., Tang Y., Huang X., Jin X., Gu P., Luo S., Yao C., Li X. // Chem. Eng. J. 2019. V. 370. P. 897.
Xu B., Liu Y., Shen Y., Zhu S. // RSC Adv. 2018. V. 8. № 5. P. 2586.
Zhang R., Yang W., Luo N., Li P., Lei Z., Chen B. // Appl. Catal. B: Env. 2019. V. 146. P. 94.
Shi H., Li X., Xia J., Lu X., Zuo S., Luo S., Yao C. // J. Inorg. Organomet. Polym. 2017. V. 27. № 1S. P. 166.
Li X., Yin Yu., Yao C., Zuo S., Lu X., Luo S., Ni C. // Particuology. 2016. V. 26. P. 66.
Mytareva A.I., Bokarev D.A., Krivoruchenko D.S., Baeva G.N., Belyankin A.Yu., Stakheev A.Yu. // Top. Catal. 2019. V. 62. P. 86.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ