Кинетика и катализ, 2020, T. 61, № 6, стр. 797-803
Константа скорости взаимодействия 2-тио-6-аминоурацила с пероксильными радикалами
Л. Р. Якупова a, *, Р. Л. Сафиуллин a
a Уфимский Институт химии – обособленное структурное подразделение ФГБНУ Уфимского федерального исследовательского центра РАН
450054 Башкортостан, Уфа, просп. Октября, 69, Россия
* E-mail: stargar@inbox.ru
Поступила в редакцию 13.03.2020
После доработки 08.05.2020
Принята к публикации 20.05.2020
Аннотация
Показано, что 2-тио-6-аминоурацила (ТАУ) является ингибитором радикально-цепного окисления этилбензола и метилового эфира олеиновой кислоты. Сопоставлена реакционная способность пероксильных радикалов различного строения по отношению к ТАУ. Установлено, что константа скорости реакции пероксильных радикалов с 2-тио-6-аминоурацилом уменьшается в ряду пероксильный радикал 1,4-диоксана: этилбензола: метилолеата (fk7 × 104, л моль–1 с–1, 333 К) = 30 : 5.2 : 2.0. Предположена причина снижения реакционной способности пероксильных радикалов этилбензола и метилового эфира олеиновой кислоты.
В ходе изучения антирадикальной активности производных урацила было показано, что они являются ингибиторами радикально-цепного окисления органических соединений. Также было установлено, что 5-амино-6-метилурацил является эффективным ингибитором окисления 1,4-диоксана, этилбензола, спиртов в водных растворах и метилолеата (табл. 1). В различных системах (1,4-диоксан, этилбензол, стирол, изопропиловый спирт, метилолеат) была обнаружена антиоксидантная активность 5-гидрокси-6-метилурацила. Из табл. 1 следует, что антиоксидантная активность урацильного производного зависит как от его природы, так и от строения атакующего его пероксильного радикала. Анализ литературных данных показывает, что наименьшее внимание было уделено производным тиоурацила, хотя именно они представляют интерес, поскольку находят применение в медицине [1, 2].
Таблица 1.
Антиоксидантная активность производных урацила
| Соединение | Субстрат | fk7, л моль–1 с–1 |
Т, К | Лит. ссылка |
|---|---|---|---|---|
| 5-Амино-6-метилурацил | 1,4-Диоксан | 2.1 × 104 | 348 | [3, 4] |
| 1.4 × 105 | 333 | [5] | ||
| Метилолеат | 1.7 × 104 | 333 | [6] | |
| 5-Гидрокси-6-метилурацил | 1,4-Диоксан | 1.7 × 104 | 348 | [3, 4, 7] |
| 5.2 × 104 | 333 | [8] | ||
| Метилолеат | 2.5 × 104 | 333 | [9] | |
| Метилолеат в водоэмульсионной среде | 1.3 × 104 | 333 | [9] | |
| Изопропиловый спирт | 1.5 × 105 | 348 | [10] | |
| 6.4 × 104 | 348 | [11] | ||
| 1.0 × 105 | 323 | [12] | ||
| Стирол | 1.5 × 104 | 303 | [13] | |
| Этилбензол | 2.6 × 104 | 323 | [14] | |
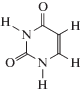
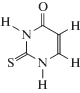
| 2-Тиоурацил | Этилбензол | 1.3 × 105 | * | [15] |
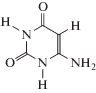
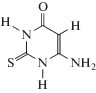
| 2-Тио-6-аминоурацил | Этилбензол | 1.3 × 105 | * | [15] |
| 1,4-Диоксан | 3.0 × 105 | 333 | [16] | |
| 1,4-Диоксан/вода | 8.9 × 104 | 333 | [17] | |
| 2-Тио-6-метилурацил | Этилбензол | 9.1 × 104 | * | [15] |
| 1,4-Диоксан | 1.4 × 104 * | 333 | [16] | |
| 5-Аминоурацил | 1,4-Диоксан | 2.1 × 104 | 333 | [5] |
| Этилбензол | 2.0 × 104 | * | [15] | |
| 6-Аминоурацил | Изопропиловый спирт | 1.8 × 104 | 348 | [11] |
* В работе [15] температура не указана.
В настоящей работе рассмотрена реакционная способность пероксильных радикалов различного строения по отношению к 2-тио-6-аминоурацилу в системах радикально-цепного окисления этилбензола и метилового эфира олеиновой кислоты.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1,4-Диоксан, этилбензол, метиловый эфир олеиновой кислоты, 2,2'-азо-бис(изобутиронитрил) (АИБН) и хлорбензол очищали согласно методикам [8, 9, 18]. Критерием чистоты субстрата служил параметр его окисляемости. 2-Тиоурацил произведен фирмой “Sigma” (чистота 99%). Синтез и физико-химические характеристики монокристаллогидрата 2-тио-6-аминоурацила приведены в работе [16].
Окисление 1,4-диоксана, этилбензола и метилолеата кислородом воздуха проводили по методике, описанной в работах [9, 18, 19]. Кинетические опыты проводили в стеклянном реакторе, в который загружали субстрат (5 мл 1,4-диоксана, 5.6 мл этилбензола или 2.3 мл метилового эфира олеиновой кислоты) и раствор инициатора АИБН в хлорбензоле (1 мл – при окислении в 1,4-диоксане, 0.5 мл – в этилбензоле или 0.4 мл – в метиловом эфире олеиновой кислоты). Объем газовой фазы составлял ~25 мл. Реактор термостатировали при 333 К в течение 20 мин, затем микрошприцем вводили раствор ингибитора.
Скорость инициирования рассчитывали по уравнению wi = ki[АИБН] = 2ekр[АИБН]. При расчете использовали следующие значения константы скорости распада АИБН: в 1,4-диоксане lgkр = = 15.8 – 132.9/θ [с–1], θ = 2.303RT × 10–3 кДж/моль [20], 2е = 1 [21]; в этилбензоле lgkр = 15.4 – 130.5/θ [с–1], θ = 2.303RT × 10–3 кДж/моль, 2е = 1.2 [22]; в метилолеате lgkр = 15 – 127.5/θ [с–1], θ = 2.303RT × 10–3 кДж/моль, 2е = 0.65 [23].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Константа скорости реакции пероксильного радикала этилбензола с 2-тио-6-аминоурацилом
Кинетику ингибированного 2-тио-6-аминоурацилом окисления этилбензола изучали при температуре 333 К. Инициирование осуществляли АИБН со скоростью wi = 4.1 × 10–8 моль л–1 с–1, концентрация субстрата составляла 5.7 моль/л. В этих условиях процесс протекает согласно схеме 1 [18].
Схема 1 .
Здесь АИБН – инициатор 2,2'-азо-бис(изобутиронитрил), RH – окисляемый субстрат этилбензол, ${\text{RO}}_{2}^{\centerdot }$ – пероксильный радикал, образующийся из этилбензола, Р6 и Р7 – продукты, неактивные в реакции продолжения цепи, InH – ингибитор (2-тио-6-аминоурацил).
Окисление этилбензола в присутствии 2-тио-6-аминоурацила протекает с индукционным периодом (рис. 1). Индукционный период определяли, обрабатывая кинетические кривые интегральным методом по уравнению (1) [24]:
(1)
${\tau инд} = \int\limits_0^\infty {\left( {1 - {{{\left( {\frac{w}{{{{w}_{0}}}}} \right)}}^{2}}} \right)} {\text{d}}t,$Рис. 1.
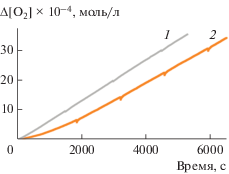
Типичные кинетические кривые расходования кислорода, полученные при инициированном окислении этилбензола: 1 – без ингибитора, 2 – в присутствии 2-тио-6-аминоурацила (1.8 × 10–4 моль/л). Условия реакции: [этилбензол] = 5.7 моль/л, wi = 4= .1 × 10–8 моль л–1 с–1, 333 К.
Экспериментальные значения индукционного периода приведены в табл. 2. Для расчета константы скорости k7 использовали уравнение (2) [25, 26]:
(2)
$\Delta \left[ {{{{\text{O}}}_{2}}} \right] = - {{k}_{2}}{{({{k}_{7}})}^{{ - 1}}}[{\text{RH}}]{\kern 1pt} {\text{ln(}}1--{t \mathord{\left/ {\vphantom {t \tau }} \right. \kern-0em} \tau }),$Таблица 2.
Зависимость начальной скорости окисления этилбензола и длины индукционного периода от концентрации 2-тио-6-аминоурацила*
| [2-Тио-6-аминоурацил] × 10–4, моль/л | w× 10–7, моль л–1 с–1 | τ, с | k7 × 104, л моль1 с–1 |
|---|---|---|---|
| 0 | 6.5 | 0 | – |
| 0.3 | 5.3 | 263 | 8.2 |
| 0.5 | 4.7 | 528 | – |
| 0.6 | 4.4 | 532 | 7.7 |
| 0.8 | 3.8 | 990 | 6.8 |
| 0.9 | 3.4 | 943 | 8.7 |
| 1.2 | 2.9 | 1255 | 6.6 |
| 1.3 | 2.6 | – | – |
| 1.6 | 2.2 | 1634 | 6.1 |
| 2.0 | 1.5 | 2437 | 4.8 |
| 2.4 | 1.1 | 2508 | 7.5 |
| 2.5 | 1.3 | 2340 | 4.9 |
| 2.6 | 0.9 | 2603 | 8.7 |
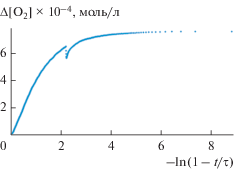
В рамках этого уравнения были обработаны кинетики, полученные в условиях, когда длина цепи в процессе ингибированного окисления составляет не менее 3 звеньев [25]. На рис. 1 представлена типичная кинетика поглощения кислорода в ходе ингибированного 2-тио-6-аминоурацилом окисления этилбензола, а на рис. 2 – ее преобразование в координатах уравнения (2). При расчете константы скорости k7 использовали значение k2 = 2.5 л моль–1 с–1, измеренное в этилбензоле [29]. Среднее значение константы скорости ингибирования для 2-тио-6-аминоурацила составляет k7 = (7.0 ± 1.2) × 104 л моль–1 с–1 (табл. 2).
Рис. 2.
Преобразование зависимости 2 (см. рис. 1) в координатах уравнения (2). Условия реакции: [этилбензол] = 5.7 моль/л, wi = 4.1 × 10–8 моль л–1 с–1, 333 К.
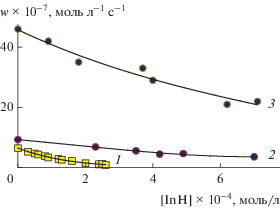
Для количественной оценки эффективности ингибирования (F) изучали зависимость начальной скорости окисления этилбензола от концентрации 2-тио-6-аминоурацила (рис. 3) и обрабатывали ее в координатах уравнения (3) [26]:
(3)
$F = {{w}_{0}}{{\left( w \right)}^{{ - 1}}}--w{{\left( {{{w}_{0}}} \right)}^{{ - 1}}} = f{{k}_{7}}\left[ {{\text{InH}}} \right]{{\left( {2{{k}_{6}}{{w}_{i}}} \right)}^{ - }}^{{0.5}},$Рис. 3.
Зависимость начальной скорости окисления субстрата от концентрации ингибитора при 333 К: 1 – [1,4-диоксан] = 9.75 моль/л, wi = 1.0 × 10–7 моль л–1 с–1, ингибитор – 2-тиоурацил; 2 – [этилбензол] = = 5.6 моль/л, wi = 4.1 × 10–8 моль л–1 с–1, ингибитор – 2-тио-6-аминоурацил; 3 – [метилолеат] = 2.5 моль/л, wi = 6.2 × 10–8 моль л–1 с–1, ингибитор – 2-тио-6-аминоурацил.
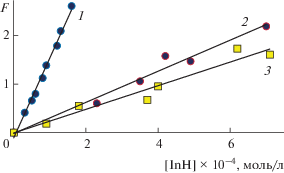
Удовлетворительная линеаризация зависимости параметра F от [InH] (рис. 4) позволяет рассчитать эффективную константу скорости реакции 2-тио-6-аминоурацила с пероксильным радикалом этилбензола. В результате получено, что fk7 = (2.1 ± 0.1) × 104 л моль–1 с–1 (при расчете принимали 2k6 = 3.8 × 107 л моль–1 с–1 [29]).
Рис. 4.
Преобразование зависимости начальной скорости окисления субстрата от концентрации ингибитора при 333 К в координатах уравнения (3): 1 – [1,4-диоксан] = 9.75 моль/л, wi = 1.0 × 10–7 моль л–1 с–1, ингибитор – 2-тиоурацил; 2 – [этилбензол] = = 5.6 моль/л, wi = 4.1 × 10–8 моль л–1 с–1, ингибитор – 2-тио-6-аминоурацил; 3 – [метилолеат] = 2.5 моль/л, wi = 6.2 × 10–8 моль л–1 с–1, ингибитор – 2-тио-6-аминоурацил.
Стехиометрический коэффициент ингибирования (f) рассчитывали, опираясь на значение индукционного периода, из соотношения (4).
(4)
$\tau {\text{ }} = f{{\left[ {{\text{InH}}} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{InH}}} \right]} {{{w}_{i}}}}} \right. \kern-0em} {{{w}_{i}}}}.$Найдено, что f = 0.4 ± 0.1.
Заниженное значение f свидетельствует о том, что ингибитор расходуется в побочных реакциях [28]. Предполагаемая причина снижения параметра может быть выражена следующей схемой 2 :
Схема 2 .
Здесь ${\text{I}}{{{\text{n}}}^{{'{\kern 1pt} \centerdot }}}$ – углерод-центрированная форма радикала In•.
Определение константы скорости реакции пероксильных радикалов 1,4-диоксана с 2-тиоурацилом
Жидкофазное ингибированное окисление 1,4-диоксана в условиях нашего эксперимента (333 К, wi = 1.0 × 10–7 моль л–1 с–1, концентрация субстрата 9.8 моль/л) протекает согласно схеме 1 [19].
Для определения эффективной константы скорости fk7 зависимость начальной скорости окисления 1,4-диоксана от концентрации 2-тиоурацила (рис. 3) преобразовывали в координатах уравнения (3) (табл. 3, рис. 4). В данном случае 2k6 = 109 л моль–1 с–1 [19, 30 ] . Получено fk7 = (2.9 ± ± 0.1) × 104 л моль–1 с–1.
Таблица 3.
Зависимость начальной скорости окисления 1,4-диоксана и длины индукционного периода от начальной концентрации 2-тиоурацила*
| [2-Тиоурацил] × 10–4, моль/л | w × 10–7, моль л–1 с–1 |
τ, с |
|---|---|---|
| 0 | 9.3 | 0 |
| 2.3 | 6.9 | – |
| 3.5 | 5.6 | – |
| 4.2 | 4.5 | 4174 |
| 4.9 | 4.7 | 3650 |
| 7.0 | 3.6 | 6000 |
| 8.9 | 3.3 | 6097 |
| 11.7 | 3.0 | 8000 |
| 11.7 | 3.4 | – |
Стехиометрический коэффициент ингибирования (f) рассчитывали, опираясь на значение индукционного периода из соотношения (4). Найдено, что параметр f равен 0.8 ± 0.1.
Антиоксидантная активность 2-тио-6-аминоурацила в системе радикально-цепного окисления метилолеата
Жидкофазное окисление метилолеата проводили при температуре 333 К со скоростью инициирования wi= 6.2 × 10–8 моль л–1 с–1 при концентрации метилолеата, равной 2.5 моль/л. Зависимость начальной скорости окисления 1,4-диоксана от концентрации 2-тиоурацила (рис. 3) преобразовывали в координатах уравнения (3) (табл. 4, рис. 4). В данном случае для расчета эффективной константы скорости fk7 использовали константу скорости взаимодействия пероксильных радикалов метилолеата 2k6 = 106 л моль–1 с–1 [31]. Получено fk7 = = (6.0 ± 0.5) × 102 л моль–1 с–1. Обработка кинетических кривых в координатах уравнения (2) привела к значению k7 = (2.1 ± 0.3) × 104 л моль–1 с–1. Стехиометрический коэффициент ингибирования f равен 0.03 ± 0.1.
Таблица 4.
Зависимость начальной скорости окисления метилолеата и длины индукционного периода от начальной концентрации 2-тио-6-аминоурацила*
| [2-Тио-6-аминоурацил]× × 10–4, моль/л | w× 10–6, моль л–1 с–1 |
τ, с | k7 × 104, л моль1 с–1 |
|---|---|---|---|
| 0 | 4.6 | 0 | – |
| 0.9 | 4.2 | – | – |
| 1.8 | 3.5 | – | – |
| 3.7 | 3.3 | – | – |
| 4.0 | 2.9 | – | – |
| 6.2 | 2.1 | 365 | 1.9 |
| 7.1 | 2.2 | 380 | 1.1 |
| 10.1 | 1.2 | 900 | 1.7 |
| 10.1 | 0.8 | 1000 | 2.2 |
В табл. 5 приведены измеренные нами ранее эффективные константы скорости реакции пероксильных радикалов с производными урацила (fk7). Из представленных данных следует, что введение метильной и аминной групп в положение 6 урацилового цикла слабо влияет на антиоксидантные свойства соединения. Существенные изменения происходят, когда эти же заместители присутствуют в 2-тиопроизводном урацила. Наиболее активным ингибитором является 2-тио-6-аминоурацил. Поэтому его антиоксидантная активность и была измерена по отношению к пероксильным радикалам этилбензола и метилолеата.
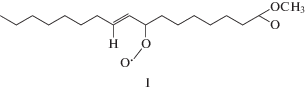
В табл. 6 приведены полученные в данной работе эффективные константы скорости (fk7) реакции пероксильных радикалов с производными 2-тиоурацила. Здесь же представлены значения константы скорости k7, полученной из отношения fk7/f. Видно, что введение аминогруппы на порядок увеличивает реакционную способность 2-тиоурацила по отношению к пероксильному радикалу 1,4-диоксана – для 2-тио-6-аминоурацила k7 = 3.0 × 105 л моль–1 с–1. Пероксильный радикал этилбензола проявляет умеренную реакционную способность по отношению к 2-тио-6-аминоурацилу – k7 = 4.5 × 104 л моль–1 с–1 (табл. 6). Одной из причин этого может быть снижение прочности О–H-связи в гидропероксиде этилбензола: прочность О–Н-связи составляет 357.6 кДж/моль, тогда как прочность О–Н-связи в гидропероксиде 1,4-диоксана выше (370.0 кДж/моль) [6]. В соединении CH3(CH2)2CH=CHCH(OOH)CH2CH3, которое является аналогом гидропероксида метилолеата, прочность О–Н-связи D(O–H) = 356.6 кДж/моль [6]. Предположим, что и в гидропероксиде метилолеата D(O–H) будет такой же. Тогда по своей реакционной способности пероксильный радикал метилолеата будет сравним с пероксильным радикалом этилбензола. По-видимому, это предположение справедливо: снижение прочности связи на 1 кДж приводит к снижению константы скорости k7 примерно в 2.6 раза (табл. 5). Однако эффективная константа скорости ингибирования fk7, измеренная для пероксильного радикала метилолеата, заметно ниже. Возможно, это связано со стабильностью образующегося из метилолеата радикала вследствие превращения во внутримолекулярный комплекс [6]. Известно, что пероксильные радикалы олефинов склонны к образованию внутреннего комплекса [32, 33], например, такого:
Таблица 6.
Константа скорости реакции k7 взаимодействия 2-тиоурацила и 2-тио-6-аминоурацила с пероксильными радикалами и стехиометрический коэффициент ингибирования f (333 К)
| InH | Среда (источник радикала ${\text{RO}}_{2}^{\centerdot }$) |
fk7, л моль1 с–1 | f | k7, л моль1 с–1 |
|---|---|---|---|---|
| 2-Тиоурацил | 1,4-Диоксан | (2.9 ± 0.1) × 104 | 0.8 ± 0.1 | 3.6 × 104 |
| 1,4-Диоксан | 3.3 × 105 [16] | 1.1 [16] | 3.0 × 105 | |
| 2-Тио-6-аминоурацил | Этилбензол | (2.1 ± 0.1) × 104 | 0.4 ± 0.1 | 5.2 × 104 |
| Метилолеат | (6.0 ± 0.5) × 102 | 0.03 ± 0.01 | 2.0 × 104 |
По всей вероятности, некоторая стабилизация радикала I вследствие возникновения водородной связи приводит к тому, что реакция ${\text{RO}}_{2}^{\centerdot }$ + + In• не идет. В то же время радикал In• как мезомерная структура может продолжать цепь окисления, предварительно вступив в реакцию с кислородом [34]. Образующийся из ингибитора пероксильный радикал не может вступать в реакцию с RH, но с InH реакция протекает согласно схеме 2 . Ранее нами было показано, что образующийся из 5-амино-6-метилурацила радикал In• может находится в мезомерной форме, крайним проявлением которой является углерод-центрированная частица [35, 36], которая может прореагировать с кислородом, а затем с молекулой InH [28, 37]. Известно, что продолжение цепи с участием “вторичных” радикалов в значительной большей степени приводит к снижению антиокислительного действия ингибиторов [38].
Список литературы
Moustafa H., Shibl M. F., Hilal R. // Phosphorus, Sulfur, Silicon, Relat. Elem. 2005. V. 180. № 2. P. 459.
Prasanthkumar K.P., Suresh C.H., Aravindakumar C.T. // J. Phys. Chem. A. 2012. V. 116. № 44. P. 10712.
Ахатова Г.Р., Сафарова И.В., Герчиков А.Я. // Кинетика и катализ. 2011. V. 52. № 1. С. 3.
Герчиков А.Я., Ахатова Г.Р., Сафарова И.В. // Бутлеров. сообщ. 2011. Т. 25. № 6. С. 22.
Якупова Л.Р., Сахаутдинова Р.А., Панкратьев Е.Ю., Сафиуллин Р.Л. // Кинетика и катализ. 2012. Т. 53. № 6. С. 708.
Сахаутдинова Р.А., Гимадиева А.Р., Якупова Р.Л., Борисов И.М., Сафиуллин Р.Л. // Кинетика и катализ. 2015. Т. 56. № 2. С. 139.
Ахатова Г.Р., Сафарова И.В., Герчиков А.Я. // Бутлеров. сообщ. 2010. Т. 20. № 5. С. 11.
Якупова Л.Р., Иванова А.В., Сафиуллин Р.Л., Гимадиева А.Р., Чернышенко Ю.Н., Мустафин А.Г., Абдрахманов И.Б. // Изв. АН. Сер. хим. 2010. № 3. С. 507.
Якупова Л.Р., Сафиуллин Р.Л. // Кинетика и катализ. 2011. Т. 52. № 6. С. 806.
Герчиков А.Я., Гарифуллина Г.Г., Султанаева И.В., Кривоногов В.П., Мустафин А.Г., Абдрахманов И.Б. // Хим.-фарм. журн. 2000. Т. 34. № 10. С. 28.
Даутова И.Ф., Ахатова Г.Р., Сафарова И.В., Герчиков А.Я., Хурсан С.Л. // Докл. АН. 2010. Т. 431. № 4. С. 487.
Grabovskiy S.A., Konkina I.G., Murinov Y.I., Kabal’nova N.N. // Curr. Org. Chem. 2012. V. 16. № 11. P. 1447.
Amorati R., Valgimigli L., Pedulli G.F., Grabovskiy S.A., Kabal’nova N.N.,Chatgilialoglu C. // Org. Lett. 2010. V. 12. № 18. P. 4130.
Мышкин В.А., Бакиров А.Б. Оксиметилурацил. Очерки эксперим. фармакологии. Уфа: ДАР, 2001. 218 с.
Толстиков Г.А., Мышкин В.А., Балтина Л.А., Муринов Ю.И., Срубилин Д.В., Вакарица А.Ф., Алехин Е.К. // Хим.-фарм. журн. 1996. Т. 30. № 5. P. 36.
Насибуллина Р.А., Гимадиева А.Р., Якупова Л.Р., Сафиуллин Р.Л. // Кинетика и катализ. 2016. Т. 57. № 2. С. 159.
Якупова Л.Р., Сафарова Д.И., Мурзагулова Э.И., Сафиуллин Р.Л. // Бутлеров. сообщ. 2018. Т. 54. № 5. С. 68.
Якупова Л.Р., Сахаутдинова Р.А., Фаттахов А.Х., Гимадиева А.Р., Сафиуллин Р.Л. // Кинетика и катализ. 2013. Т. 54. № 3. С. 291.
Якупова Л.Р., Хайруллина В.Р., Сафиуллин Р.Л., Герчиков А.Я., Баймуратова Г.Р. // Кинетика и катализ. 2008. Т. 49. № 3. С. 387.
Moroni A.F. // Makromol. Chem. 1967. V. 105. № 6. P. 43.
Денисов Е.Т. Константы скорости гомолитических жидкофазных реакций. М.: Наука, 1971. 712 с.
Кулицки З.И., Терман Л.М., Цепалов В.Ф., Шляпинтох В.Я. // Изв. АН СССР. Сер. хим. 1963. № 2. С. 253.
Письменский А.В., Психа Б.Л., Харитонов В.В. // Нефтехимия. 2000. Т. 40. № 2. С. 112.
Loshadkin D., Roginsky V., Pliss E. // Int. J. Chem. Kinet. 2002. V. 34. № 3. P. 162.
Цепалов В.Ф. Исследование синтетических и природных антиоксидантов in vitro и in vivo. Сб. науч. ст. М.: Наука, 1992. С. 16.
Денисов Е.Т., Азатян В.В. Ингибирование цепных реакций. Черноголовка: Изд-во РАН, 1997. 266 с.
Якупова Л.Р., Сахаутдинова Р.А., Панкратьев Е.Ю., Сафиуллин Р.Л. // Кинетика и катализ. 2012. Т. 53. С. 708.
Насибуллина Р.А., Якупова Л.Р., Сафиуллин Р.Л. // Кинетика и катализ. 2016. Т. 57. № 6. С. 767.
Цепалов В.Ф., Шляпинтох В.Я. // Кинетика и катализ. 1962. Т. 3. № 6. С. 870.
Сафиуллин Р.Л., Запольских В.В., Якупова Л.Р., Зарипов Р.Н., Терегулова А.Н. // Хим. физика. 2001. Т. 20. № 5. С. 110.
Howard J.A., Ingold K.U. // Can. J. Chem. 1967. V. 45. № 8. P. 793.
Эмануэль Н.М., Заиков Г.Е., Майзус З.К. Роль среды в радикально-цепных реакциях окисления органических соединений. М.: Наука, 1973. 279 с.
Рубайло В.Л., Маслов С.А. Жидкофазное окисление непредельных соединений. М.: Химия, 1989. 224 с.
Amorati R., Pedulli G.F. Valgimigli L. // Org. Biomol. Chem. 2011. T. 9. № 10. P. 3792.
Mori M., Teshima S.-I., Yoshimoto H., Fujita S.-I., Taniguchi R., Hatta H., Nishimoto S.-I. // J. Phys. Chem. B. 2001. V. 105. № 10. P. 2070.
Neta P. // J. Phys. Chem. 1972. V. 76. № 17. P. 2399.
Valgimigli L., Amorati R., Fumo M.G., DiLabio G.A., Pedulli G.F., Ingold K.U., Pratt D.A. // J. Org. Chem. 2008. V. 73. № 5. P. 1830.
Эмануэль Н.М. Химическая и биологическая кинетика. Избран. тр. М.: Наука, 2005. Т. 1. 668 с.
Байбуртли А.В., Якупова Л.Р. Материалы Междунар. молодеж. науч. форума “ЛОМОНОСОВ-201” / Под ред. Алешковского И.А., Андриянова А.В., Антипова Е.А. М.: МАКС Пресс, 2016. https://lomonosov-msu.ru/archive/Lomonosov_2016/data/section_11_8611.htm
Байбуртли А.В., Насибуллина Р.А., Якупова Л.Р., Сафиуллин Р.Л. Сб. тез. докл. II Всеросс. молодеж. конф. “Достижения молодых ученых: химические науки”. Уфа: БашГУ, 2016. С. 222.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ