Кинетика и катализ, 2021, T. 62, № 1, стр. 87-93
Синтез и активность нанодисперсных катализаторов SnO2–CeO2 в реакции окисления СО и метана
Е. Ю. Либерман a, *, Е. А. Симакина a, И. А. Моисеев b, А. О. Изотова a, Т. В. Конькова a, В. Н. Грунский a
a ФГБОУ ВО Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
b Сколковский институт науки и технологий, Территория Инновационного Центра “Сколково”
121205 Москва, Большой бульвар, 30, стр. 1, Россия
* E-mail: el-liberman@mail.ru
Поступила в редакцию 30.03.2020
После доработки 27.04.2020
Принята к публикации 22.05.2020
Аннотация
Синтезированы высокодисперсные нанодисперсные катализаторы SnO2–CeO2 для процессов окисления СО и СН4 путем соосаждения в водно-изопропанольной среде с последующей термической обработкой. Показано, что твердые растворы SnхCe1– хO2 на основе кристаллической решетки диоксида церия формируются при x ≤ 0.15. Образцы охарактеризованы методами ЭДС, РФА, ПЭМ, адсорбции–десорбции азота, газовой хроматографии. Материалы обладают мезопористой структурой: удельная поверхность составляет 52.3–69.7 м2/г, общий объем пор 0.073–0.108 см3/г. При содержании SnO2 более 30 мол. % наряду с частицами твердого раствора с близкой к сферической формой и размером 8–10 нм происходит образование частиц SnO2 пластинчатой формы размером более 100 нм. Синтезированные твердые растворы проявляют высокую активность в реакции окисления СО и метана и могут быть использованы в качестве катализаторов и носителей.
ВВЕДЕНИЕ
Диоксид церия является уникальным материалом, который широко применяется в самых разных областях промышленности: микро- и наноэлектроника, полирующие материалы, производство защитных покрытий, сенсорные устройства и т.д. [1]. Церийсодержащие твердые растворы и композиты на его основе входят в состав трехмаршрутных катализаторов, твердых электролитов топливных элементов [1–4], носителей и катализаторов в реакциях детоксикации угарного газа, парциального и полного окисления органических соединений [1, 5–8]. Для получения твердых растворов кристаллическую решетку диоксида церия допируют ионами d- и f-элементов [5, 7], что приводит к улучшению эксплуатационных свойств: увеличению кислородонакопительной способности, повышению каталитической активности (Mn, Cu), термостойкости (Zr). Одной из перспективных допирующих добавок является диоксид олова, поверхность которого обладает высокой адсорбционной и реакционной способностью вследствие наличия большого количества поверхностных и объемных дефектов, анион-радикалов O2- и О–, образующихся в результате захвата электронов из зоны проводимости хемосорбированными молекулами кислорода. Кроме того ионы Sn способны к редокс-переходу Sn2+$ \rightleftarrows $ Sn4+, что является интересным с точки зрения применения в окислительных процессах [9–11]. Авторами [12, 13] было показано, что оловосодержащие катализаторы сероустойчивы, что актуально для процессов окислительной конверсии метана вследствие присутствия примесей меркаптанов и для очистки выхлопных газов автотранспорта, также содержащих следовые количества сернистых соединений.
Введение в кристаллическую решетку диоксида церия ионов Sn4+ (до 50 мол. %) приводит к формированию высокодефектных твердых растворов на основе кристаллической решетки диоксида церия, при этом увеличиваются кислородонакопительная способность и повышается мобильность кислорода, что способствует росту каталитической активности [14, 15].
Для получения бикомпонентных систем SnO2–CeO2 применялись методы, основанные на термическом разложении солей в присутствии восстановителей [16, 17], соосаждение гидроксидов церия и олова с последующей термической обработкой [18, 19], темплатный синтез [20]. Одним из привлекательных вариантов приготовления твердых растворов является метод соосаждения гидроксидов Ce(III) и Sn(II) с последующим термолизом при температуре 650°С в течение 4 ч [18]. К его преимуществу следует отнести применение в качестве предшественника олова SnCl2, из которого образуется легкофильтруемый осадок гидроксида олова(II), что позволяет упростить технологию получения твердого раствора. Однако в вышеупомянутой работе отсутствуют сведения о параметре кристаллической решетки синтезированных твердых растворов, а также не рассмотрены их морфологические особенности, что затрудняет характеризацию материалов для их дальнейшего использования. Представляется целесообразным проведение процесса осаждения в водно-изопропанольной среде, что дает возможность синтезировать не только менее агрегированные системы, но и снизить температуру и продолжительность прокаливания [1, 21, 22].
Целью настоящей работы было получение бикомпонентных материалов SnO2–СеО2 на основе кристаллической решетки диоксида церия в водно-изопропанольной среде, исследование дисперсных, текстурных характеристик и каталитической активности синтезированных соединений в реакциях окисления СО и полной конверсии CH4.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализаторов
Синтез бикомпонентных материалов SnO2–CeO2 проводили методом соосаждения гидроксидов церия и олова(II) в водно-изопропанольной среде с последующим термолизом. Предварительно взвешенные навески нитрата церия и хлорида олова(II) в пересчете на концентрацию 0.2 моль/л растворяли в изопропиловом спирте и смешивали в заданном стехиометрическом соотношении в соответствии с условиями эксперимента. Затем к полученному раствору солей церия и олова добавляли концентрированный раствор гидроксида аммония (9.5 моль/л) до величины рН 9–10. Образовавшийся осадок выдерживали под слоем маточного раствора в течение 30 мин. Отделение осадка от маточного раствора проводили путем вакуумного фильтрования. Промывку осадка осуществляли дистиллированной водой до отрицательной реакции на хлорид-ионы, затем сушили при 80°С в течение 6–8 ч и прокаливали при 550°С в течение 2 ч (скорость подъема температуры составляла 5°С/мин).
Физико-химические исследования
Содержание элементов (мас. %) в образцах определяли методом энергодисперсионной спектроскопии (ЭДС) с помощью прибора X-MAXINCA ENERGY (“Oxford Instruments”, Великобритания) в Центре коллективного пользования им. Д.И. Менделеева. Измерения проводили в 3–4 произвольно выбранных точках пробы и затем вычисляли среднее значение.
Рентгеновскую дифракцию регистрировали на дифрактометре D8 Advanced (“Bruker”, Германия) в геометрии Брегга–Брентано на медном источнике рентгеновского излучения с дуплетом длин волн (λKα1 = 1.54051 Å, λKα2 = 1.54433 Å). Съемку осуществляли в диапазоне 2θ = 20°–80° с шагом 0.088° и выдержкой в точке в течение 0.4 с. Во время съемки держатель с нанесенным порошком вращался с постоянной угловой скоростью равной 20°/мин. Щель Соллера на детекторе была выставлена на значение 0.8 мм. Для анализа фазового состава образцов использовали программное обеспечение EVA Software дифрактометра D8 Advanced с базой данных PDF2 (2016). Параметры элементарных ячеек определяли путем обсчета профиля рентгенограммы методом Ле Бейля с помощью программного обеспечения Jana 2006.
Морфологию образцов изучали с помощью просвечивающей электронной микроскопии (ПЭМ) на электронном микроскопе высокого разрешения JEM-2100 (“JEOL”, Япония), разрешение – 0.18 нм, напряжение – 200 кВ. С целью устранения агломерации частиц проводили предварительное ультразвуковое диспергирование в изопропиловом спирте в течение 10 мин, затем 10 мкл полученной суспензии наносили на специальную сетку с аморфной углеродной пленкой.
Пористую структуру образцов – удельную поверхность (Sуд) и общий объем пор (VΣ) – исследовали методом низкотемпературной адсорбции азота на приборе NOVA 1200e (“Quantachrome”, США). Непосредственно перед измерением образцы массой 0.2–0.3 г дегазировали в вакууме при остаточном давлении P < 10 мм рт. ст. при температуре 200°С в течение 4 ч. Удельную поверхность образцов рассчитывали по уравнению БЭТ, суммарный объем пор определяли при P/PS = 0.95.
Каталитические свойства образцов изучали в реакции окисления СО и СН4 проточным методом. Для этого в U-образный кварцевый реактор загружали навеску катализатора, смешанную с кварцем для предотвращения его перегрева. Затем производили нагрев до необходимой температуры и пропускали через реактор газовую смесь. Исследование каталитической активности в реакции окисления СО проводили на модельной смеси: СО – 1 об. %; О2 – 8 об. %; N2 – баланс (ОАО “Линде Газ Рус”), при этом масса катализатора составляла 0.3 г. Активность в реакции полной конверсии метана изучали на модельной смеси: СН4 – 1 об. %; О2 – 8 об. %; N2 – баланс (ОАО “Линде Газ Рус”), масса навески – 1 г.
Эксперименты проводили при скорости подачи реагентов 60 мл/мин в интервале температур от 20 до 700°С. Концентрацию компонентов газовой смеси (О2, N2, CO, CH4, CO2 и Н2О) измеряли методом газовой хроматографии на приборе CHROM-5 (“CHROM”, Чехия). Разделение проводили на колонках с молекулярными ситами NaХ (l = 2.5 м, d = 3 мм) и Порапак Q (l = 5 м, d = 2 мм). Для регистрации сигнала использовали детектор по теплопроводности. Расчет хроматограмм осуществляли с помощью пакета программ “Экохром”.
Конверсию CO (αСО) и СН4 (αСН) рассчитывали по уравнению:
Активность катализаторов оценивали по температурам 50%-ной и 90%-ной конверсии CO и метана.
Для проведения сопоставительных исследований диоксид церия синтезировали по методике, изложенной в [22].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Согласно результатам элементного анализа методом ЭДС соотношение Sn : Ce в синтезированных материалах соответствует заданному условиями эксперимента.
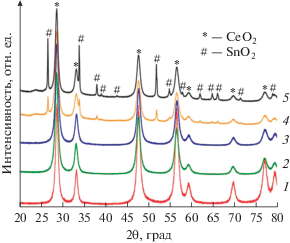
Исследования, проведенные методом рентгеновской дифракции, показали следующее. При содержании Sn не более 15 мол. % на дифрактограммах (рис. 1, кривые 1–3) наблюдаются рефлексы (2θ = 28.6°, 33.3°, 47.9° и 56.8°), соответствующие диоксиду церия, что позволяет предположить формирование твердого раствора на основе кристаллической решетки диоксида церия. Согласно результатам расчетов параметр решетки а составляет 5.4039–5.4060 Å. При допировании ионами Sn значение этого параметра снижается относительно чистого диоксида церия (a = 5.411 Å). Это обусловлено вхождением иона меньшего размера, в данном случае Sn4+ (0.67 Å по Белову–Бокию), в состав кристаллической решетки диоксида церия, ионный радиус которого составляет 0.88 Å. Однако величина, на которую происходит уменьшение, незначительна, что связано с образованием при допировании ионами Sn2+ диоксида церия ионов Се3+, имеющего больший размер (1.02 Å) [8]. При содержании диоксида олова более 20 мол. % наблюдается появление ярко выраженных рефлексов (2θ = 26.5°, 33.8°, 37.9° и 51.7°), которые относятся к диоксиду олова, имеющего кристаллическую структуру рутила, что свидетельствует о формировании бифазной системы.
Рис. 1.
Дифрактограммы синтезированных образцов SnO2–CeO2, содержащих 5 (1), 10 (2), 15 (3), 20 (4) и 30 (5) мол. % SnО2.
Данные проведенных электронно-микроскопических исследований подтверждают вышесказанное. Как видно из рис. 2, образцы обладают агломерированной структурой мозаичного типа. Для образцов, содержание олова в которых не превышает 20 мол. %, наблюдается присутствие частиц с формой близкой к сферической (рис. 2). Средний размер частиц составляет 8–10 нм. К сожалению, в рассмотренных литературных источниках информация о размерах частиц твердых растворов, полученных методом соосаждения, приведена недостаточно подробно, что не позволяет произвести сопоставительный анализ размеров частиц твердого раствора SnхCe1– хO2, синтезированных путем соосаждения в водно-изопропанольной среде. В то же время известно, что частицы Sn0.2Ce0.8O2, приготовленные цитратным методом, имеют размер 15–20 нм [15], а полученные путем термического разложения с глицином – 10–20 нм [16]. Поскольку размер частиц является одним из ключевых факторов регулирования каталитической активности, это, несомненно, подчеркивает преимущество выбранного нами метода синтеза твердых растворов SnхCe1– хO2. При содержании олова выше 30 мол. % наряду со сферическими частицами отмечается появление пластинок диоксида олова размером более 100 нм (рис. 2).
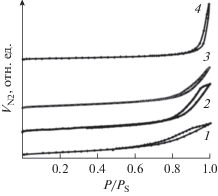
Результаты исследований текстурных характеристик приведены на рис. 3. Изотермы адсорции–десорбции азота исследованных материалов согласно классификации IUPAC соответствуют IV типу изотерм, которые характеризуются наличием капиллярно-конденсационного гистерезиса, что является типичным для мезопористых материалов. Форму петли гистерезиса образцов SnО2–CeO2, содержащих не более 20 мол. % SnО2 (рис. 3, кривые 1–3), можно отнести по классификации Де Бура к типу А, для которого свойственно наличие цилиндрических пор. Для образца SnO2–CeO2, содержащего диоксид олова в количестве 30 мол. %, наблюдается изотерма типа В (рис. 3, кривая 4), соответствующая материалам, имеющим щелевидные поры, в том числе образованные в результате агломерации нанодисперсных частиц в неупорядоченные структуры.
Рис. 3.
Изотермы сорбции–десорбции азота для образцов SnO2–CeO2, cодержащих 5 (1), 10 (2), 20 (3) и 30 (4) мол. % SnO2.
Данные по величинам удельной поверхности Sуд и суммарного объема пор VΣ синтезированных материалов приведены в табл. 1. Зависимости этих показателей от количества SnO2 в образцах носят экстремальный характер с максимумами при содержании SnO2 10 мол. %. Так, Sуд образца Sn0.1Ce0.90O2 составляет 69.3 м2/г, а VΣ – 0.108 см3/г. Для образца Sn0.15Ce0.85O2 удельная поверхность немного меньше – 67.9 м2/г. Наблюдаемое увеличение удельной поверхности и развитие пористости для образцов SnxCe1– xO2, где x ≤ 0.15, обусловлено образованием дефектной структуры в результате инкорпорирования ионов Sn в кристаллическую решетку CeO2. Величина удельной поверхности образца SnO2–CeO2 с содержанием SnO2 20 мол. % практически совпадает с таковой для Sn0.15Ce0.85O2, что можно объяснить формированием наночастиц диоксида олова (которые не входят в состав твердых растворов и образуют самостоятельную фазу), имеющим согласно данным ПЭМ размер 8–10 нм. Снижение удельной поверхности для SnO2–CeO2, содержащего 30 мол. % SnO2, связано с образованием крупных частиц.
Таблица 1.
Дисперсные, текстурные характеристики и каталитическая активность синтезированных материалов
| Образец | Соотношение Sn : Ce |
Размер частиц СеО2 (l), нм | Размер частиц SnО2 (l), нм | Sуд, м2/г | VΣ, см3/г | Окисление СО | Окисление СН4 | ||
|---|---|---|---|---|---|---|---|---|---|
| Т50% | Т90% | Т50% | Т90% | ||||||
| СеО2 | 100 : 0 | 9–10 | – | 56.2 | 0.060 | 170 | 328 | 529 | 578 |
| Sn0.05Ce0.95O2 | 5 : 95 | 9–10 | – | 65.3 | 0.095 | 118 | 258 | 518 | 564 |
| Sn0.10Ce0.90O2 | 10 : 90 | 9–10 | – | 69.3 | 0.108 | 100 | 236 | 508 | 552 |
| Sn0.15Ce0.85O2 | 15 : 85 | 8–10 | – | 67.9 | 0.073 | 126 | 280 | 524 | 572 |
| Sn0.20Ce0.80O2 | 20 : 80 | 8–10 | – | 62.5 | 0.065 | 152 | 308 | 536 | 572 |
| Sn0.30Ce0.70O2 | 30 : 70 | 8–10 | 90–100 | 53.2 | 0.052 | 206 | 411 | 542 | 600 |
Синтезированные образцы проявляют высокую активность в реакции окисления СО и полной конверсии СН4 (рис. 4 и 5). Согласно полученным результатам (данные табл. 1) активность катализаторов SnO2–CeO2 в обоих процессах изменяется в следующей последовательности: Sn0.30Ce0.70O2 < Sn0.20Ce0.80O2 < Sn0.15Ce0.85O2 < < Sn0.05Ce0.95O2 < Sn0.10Ce0.90O2.
Рис. 4.
Зависимость конверсии СО от температуры в присутствии образцов SnO2–CeO2, cодержащих 30 (1), 0 (2), 20 (3), 15 (4), 5 (5) и 10 (6) мол. % SnO2.
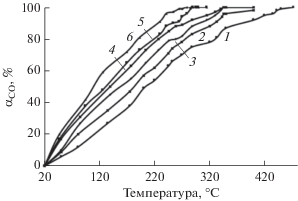
Рис. 5.
Зависимость конверсии СН4 от температуры в присутствии образцов SnO2–CeO2, cодержащих 30 (1), 0 (2), 20 (3), 15 (4), 5 (5) и 10 (6) мол. % SnO2.
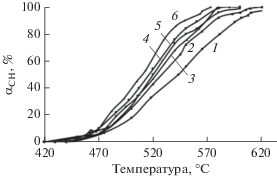
Температуры 50%-ного и 90%-ного превращения в реакции окисления СО в присутствии наиболее активного образца Sn0.10Ce0.90O2 составляют 100 и 238°С соответственно, в процессе полной конверсии СН4 – 510 и 552°С соответственно. Сравнительный анализ зависимостей удельной поверхности образцов, температуры 50%-ной и 90%-ной конверсии СО и СН4 от содержания SnO2 (табл. 1), показал, что максимальным значениям удельной поверхности образцов соответствуют минимальные значения Т50%. Как уже было отмечено выше, наблюдаемое увеличение удельной поверхности обусловлено формированием твердых растворов SnxCe1– xO2, где x ≤ 0.15, в результате инкорпорирования ионов Sn в кристаллическую решетку диоксида церия. При этом появляются анионные вакансии, ионы Ce3+, что и способствует росту каталитической активности [1, 8, 19]. При дальнейшем увеличении содержания SnO2 до 30 мол. % происходит снижение активности вследствие формирования в процессе синтеза крупных пластинчатых частиц SnO2, не обладающих высокой каталитической активностью.
ЗАКЛЮЧЕНИЕ
Таким образом, формирование твердых растворов SnxCe1– xO2 на основе кристаллической решетки диоксида церия в водно-изопропанольной среде возможно, если количество SnO2 не превышает 15 мол. %. Методом ПЭМ показано, что при содержании SnO2 более 30 мол. % наряду с частицами твердого раствора сферической формы происходит формирование частиц SnO2 пластинчатой формы размером 100 нм. Полученные образцы SnxCe1– xO2, где x ≤ 0.15, являются мезопористыми материалами: их удельная поверхность составляет 52.3–69.7 м2/г, общий объем пор равен 0.073–0.108 см3/г. Синтезированные твердые растворы проявляют высокую активность в реакции окисления СО и метана и могут быть использованы в качестве катализаторов и носителей.
Список литературы
Иванов В.К., Щербаков А.Б., Баранчиков А.Е., Козик В.В. Нанокристаллический диоксид церия: свойства, получение, применение. Томск: Изд-во Томск. университета, 2013. 284 с.
Dusastre V., Kilner J.A. // Solid State Ionics. 1999. V. 126. P. 163.
Kharton V.V., Kovalevsky A.V., Biskup A.P. Shaula A.L., Figueiredo F.M., Naumovich E.N., Marques F.M.B. // Solid State Ionics. 2003. V. 160. P. 247.
Nigge U., Wiemhöfer H.-D., Römer E.W.J., Bouwmeester H.J.M., Schulte T.R. // Solid State Ionics. 2002. V. 146. P. 163.
Catalysis by Ceria and Related Materials (Catalytic Science Series, V. 12.). Eds. A. Trovarelli, P. Fornasiero. Imperial College Press, 2013. P. 486.
Попова Н.М. Катализаторы очистки газовых выбросов промышленных производств. М.: Химия, 1991. 174 с.
Крылов О.В., Миначев Х.М., Панчишный В.И. // Успехи химии. 1991. Т. 60. Вып. 3. С. 634.
Иванова А.И. // Кинетика и катализ. 2009. Т. 50. № 6. С. 831.
Ayastuy J.L., González-Marcos M.P., Gutiérrez-Ortiz M.A. // Catal. Comm. 2011. V. 12. P. 895.
Sasikala R., Gupta N.M., Kulshreshtha S.K. // Catal. Lett. 2001. V. 71. P. 69.
Yao X., Xiong Y., Zou W., Zhang L., Wu S., Dong X., Gao F., Deng Y., Tang C., Chen Z., Dong L., Chen Y. // Appl. Catal. B: Environ. 2014. V. 144. P. 152.
Халипова О.С., Кузнецова С.А., Галанов С.И. // Неорганические материалы. 2016. Т. 52. № 4. С. 417.
Вишняков А.В., Родина К.В., Чащин В.А. // Кинетика и катализ. 2013. Т. 54. № 3. С. 384.
Gupta A., Kumar A., Hedge M.S., Waghmare U.V. // J. Chem. Phys. 2010. V. 132. P. 194702.
Nguyen T.B., Deloume J.P., Perrichon V. // Appl. Catal. A: General. 2003. V. 249. P. 273.
Vasilechenko D.B., Gulyaev R.V., Slavinskaya E.M., Stonkus O.A., Shubin Yu.V., Boronin A.I. // Catal. Commun. 2015. V. 73. P. 34.
Cao J.-L., Wang Y., Sun G., Zhang Z.-Y. // Transit. Met. Chem. 2011. V. 36. P. 107.
Chen Y.-Z., Liaw B.-J., Huang C.-W. // Appl. Catal. A: General. 2006. V. 302. P. 168.
Ayastuy J.I., Iglesias-Gonzalez A., Gutierrez-Ortiz M.A. // Chem. Eng. J. 2014. V. 244. P. 372.
Халипова О.С., Кузнецова С.А. Галанов С.И., Козик В.В. // Неорганические материалы. 2013. Т. 49. № 7. С. 729.
Пaтeнт 2688945C1 PФ, 2019.
Либерман Е.Ю., Николаев С.А., Наумкин А.В., Цодиков М.В., Эзжеленко Д.И., Конькова Т.В., Михайличенко А.И. // Кинетика и катализ. 2018. Т. 59. № 6. С. 728.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ



