Кинетика и катализ, 2021, T. 62, № 1, стр. 120-128
Исследование поверхностных слоев никеля, формирующихся в процессе окисления метана в автоколебательном режиме
В. Ю. Бычков a, *, Ю. П. Тюленин a, А. Я. Горенберг a, В. Н. Корчак a
a ФГБУН Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН
119991 Москва, ул. Косыгина, 4, Россия
* E-mail: bychkov@chph.ras.ru
Поступила в редакцию 15.06.2020
После доработки 02.09.2020
Принята к публикации 09.09.2020
Аннотация
В результате протекания реакции окисления метана на Ni-фольге при 750°С в автоколебательном режиме в течение 1 ч на поверхности фольги образуется пористый слой глубиной 10–12 мкм. Показано, что глубина этого слоя не растет при увеличении продолжительности автоколебательного режима до 2–3 ч. В окислительной газовой среде пористый слой состоит из кристаллов оксида никеля размером 100–200 нм, а в восстановительной – из кристаллитов металлического Ni (кристаллы без четкой формы) таких же размеров. Образование слоя приводит к многократному повышению каталитической активности никеля в реакции углекислотной конверсии метана (УКМ). Непосредственно после автоколебательной реакции кристаллы пористой поверхности находятся в окисленном состоянии. В таком состоянии они могут сохраняться при температуре 750°С в потоке инертного газа или СО2 без потери каталитической активности. Напротив, в восстановительной среде (Н2, СН4) кристаллы оксида восстанавливаются до металла и постепенно “сливаются”, образуя губчатую структуру, площадь поверхности которой существенно меньше, чем в исходном окисленном состоянии. Об этом свидетельствует снижение каталитической активности никеля после предварительной восстановительной обработки, а также в ходе каталитической реакции УКМ, где катализатор также находится в восстановленном состоянии. По каталитическим и реакционным свойствам пористый слой на поверхности Ni-фольги близок к образцу пеноникеля с размером пор ~1 мкм (металлическая мембрана), однако отличается от него ограниченной глубиной на поверхности массивного металла.
ВВЕДЕНИЕ
Никель является известным катализатором самых разных процессов, включая реакцию сдвига водяного газа [1], глубокое или парциальное окисление углеводородов [2–4], паровую или углекислотную конверсию органических соединений [5–9], метанирование двуокиси углерода [10], гидрирование и дегидрирование [11, 12], гидродехлорирование хлорорганики [13] и др. Приготовление образцов металлического никеля с увеличенной удельной поверхностью может представлять интерес с точки зрения получения катализаторов на основе фольги или проволоки, сочетающих в себе такие свойства, как высокая каталитическая активность, относительно быстрый теплообмен через металлическую основу массивных систем и низкое сопротивление газовому потоку образцов.
Известно, что каталитическое окисление низших углеводородов [14–18] и СО [19] на металлическом никеле в форме фольги, проволоки или пены может протекать в автоколебательном режиме. Также было установлено, что поверхность никеля существенно разрыхляется в результате таких реакций [16, 20–22]. Ранее в работе [23] мы изучили влияние автоколебательного режима процесса окисления метана на Ni-фольге на формирование пористого поверхностного слоя и его каталитическую активность в реакциях углекислотной конверсии метана (УКМ) и гидрирования этилена. Методом сканирующей электронной микроскопии (СЭМ) было показано, что такая обработка Ni-фольги в условиях автоколебательного режима окисления метана (далее, для краткости, автоколебательная обработка) действительно приводит к формированию рыхлого поверхностного слоя, каталитическая активность которого на порядок превышает активность исходной Ni-фольги.
В настоящей работе была поставлена задача более детального изучения свойств пористого поверхностного слоя, получаемого при автоколебательной обработке никеля, в том числе исследование влияние времени автоколебательной обработки на глубину и структуру образуемого слоя, а также изменений, возникающих в структуре этого слоя при высокотемпературном воздействии инертных и реакционных газов. Для оценки степени увеличения удельной поверхности применяли два метода: 1) измерение каталитической активности никеля в реакции УКМ и 2) непосредственное наблюдение изменений морфологии поверхности с помощью СЭМ. Реакция УКМ была выбрана по следующим соображениям: i) данная реакция относится к перспективным и в настоящее время активно изучается; ii) реакция УКМ протекает при той же температуре, что и окисление метана в автоколебательном режиме. Это упрощает проведение экспериментов с переходом от одной реакции к другой. Кроме того, была поставлена задача сопоставить реакционные свойства рыхлого поверхностного слоя с аналогичными свойствами известных микропористых образцов никеля (пеноникель).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Изучали образцы фольги Ni размером 6 × 6 × × 0.1 мм (масса 33 мг), а также образцы “двойной фольги”, изготовленные путем сплющивания отрезков никелевого капилляра диаметром 2 мм, длиной 6 мм и с толщиной стенки 0.1 мм (масса 52 мг). Во втором случае перед сжатием внутрь капилляра помещали концы проволок из хромеля и алюмеля. Таким образом, полученный образец содержал внутри хромель-алюмелевую термопару, поверхность которой практически не имела контакта с газовой фазой во время каталитических испытаний. Известно, что термопара, поверхность которой контактирует с газовой фазой, проявляет автоколебательную активность [24]. Отсутствие такого контакта позволяло исключить автоколебательное окисление метана на поверхности термопары. Сплющенный капилляр был жестко фиксирован к торцу керамической трубки для термопары, которую размещали внутри кварцевого реактора со стороны подачи газовой смеси так, что катализатор находился в центре реактора и обтекался газовой смесью.
Дополнительно были изучены три микропористых образца никеля (пенометаллы), имеющие поры разного размера. Для таких образцов температуру реактора измеряли снаружи с помощью термопары.
Каталитические эксперименты проводили при атмосферном давлении в проточном кварцевом реакторе с внутренним диаметром 6 мм. Автоколебательные режимы каталитической реакции получали при пуске на образцы смеси 80% СН4 и 20% О2 (20 мл/мин) при температуре 750°С. Автоколебания скорости реакции фиксировали по колебаниям состава газовой смеси на выходе из реактора с помощью масс-спектрометра OmniStar GSD 301 (“Preiffer”, Австрия) или по колебаниям температуры катализатора с помощью внутренней термопары. Период колебаний в наших условиях составлял ~40 с.
Реакцию УКМ тестировали в потоке смеси 50% СН4–50% СО2 (15 мл/мин) также при 750°С. Концентрации газовых реагентов и продуктов измеряли с помощью газового хроматографа Кристалл 2000м (“Хроматэк”, Россия). Для сопоставления каталитической активности до и после автоколебательной обработки проводили испытания в следующей последовательности. Свежий образец Ni-фольги нагревали в потоке инертного газа до 750°С. Затем пускали поток смеси 50% СН4–50% СО2 (15 мл/мин) и фиксировали изменение каталитической активности в течение 1 ч. Потом на образец при той же температуре подавали смесь 80% СН4–20% О2 (20 мл/мин) в течение 1 ч или более, наблюдая автоколебательный режим реакции окисления метана. После этого опять пускали смесь 50% СН4–50% СО2 в течение 1 ч, измеряя изменившуюся активность катализатора. В ряде опытов после этапа автоколебательной обработки образец сначала выдерживали при 750°С в потоке Не, Н2, СО2 или СН4 в течение 1 ч и только потом повторно пускали смесь 50% СН4–50% СО2.
Морфологию исходной Ni-фольги и образцов фольги после различной обработки изучали с помощью сканирующего электронного микроскопа JSM-7001F (“JEOL”, Япония).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Влияние автоколебательной обработки на трансформацию поверхности Ni-фольги
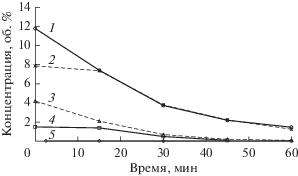
На рис. 1 показано, как меняются концентрации СО и Н2 в реакционной смеси в ходе реакции УКМ при 750°С на исходном образце Ni-фольги, а также образцах фольги после автоколебательной обработки в потоке смеси 80% СН4–20% О2 в течение 1 или 2.5 ч. При протекании реакции УКМ на исходной фольге концентрация СО составляет 0.3–0.4%, и эта величина сохраняет практически постоянное значение в течение 1 ч. После автоколебательной обработки в течение 1 ч содержание СО в продуктах УКМ возрастает до ~12%. Такая высокая каталитическая активность не остается постоянной и постепенно снижается со временем в течение 1 ч, но, тем не менее, она существенно выше, чем до автоколебательной обработки. Увеличение времени автоколебательной обработки до 2.5 ч не приводит дальнейшему росту каталитической активности Ni-фольги.
Рис. 1.
Концентрация СО (1, 2, 5) и Н2 (3, 4) в реакционной смеси в ходе реакции УКМ на Ni-фольге при 750°С до автоколебательной обработки (5) и после автоколебательной обработки в течение 1 ч (1, 3) или 2.5 ч (2, 4).
Были проведены микроскопические исследования трех катализаторов: образца, участвовавшего в реакции УКМ, но не подвергнутого автоколебательной обработке (рис. 2а); образца, демонстрирующего высокую каталитическую активность УКМ сразу после автоколебательной обработки (рис. 2б); образца после автоколебательной обработки и продолжительной реакции УКМ (1 ч) (рис. 2в). У исходного образца Ni-фольги после стационарной каталитической реакции поверхность относительно гладкая (рис. 2а). Напротив, образец, участвовавший в автоколебаниях, имеет пористую поверхность, состоящую из множества нанокристаллитов (кристаллы с нечеткой формой) размером ~1 мкм (рис. 2б). Нанокристаллиты образуют губчатую структуру, содержащую каналы, уходящие в глубину металлического образца. В процессе реакции УКМ при 750°С эти каналы постепенно “смыкаются” (рис. 2в). Полученные микроснимки позволяют понять, как меняется каталитическая активность никеля в реакции УКМ до и после автоколебательной обработки. Очевидно, такая обработка способствует быстрому формированию пористой поверхности металла, что приводит к пропорциональному росту каталитической активности никеля. В ходе каталитической реакции поры этой поверхности частично смыкаются, что вызывает постепенное снижение каталитической активности.
Рис. 2.
СЭМ-изображения поверхности образцов фольги Ni: а – исходный образец после реакции УКМ при 750°С в течение 1 ч; б – образец после автоколебательной обработки при 750°С и последующего кратковременного пуска реакционной смеси 50% СН4–50% СО2; в – образец после автоколебательной обработки при 750°С и последующей реакции УКМ при 750°С в течение 1 ч.

В отдельном эксперименте было показано, что каталитическое окисление метана на Ni-фольге в стационарном режиме не вызывает аналогичного образования пористой поверхности. В этом опыте образец Ni-фольги катализировал окисление метана при 750°С в потоке смеси 2.7% СН4–43.3% О2–Не в течение 1 ч. При этом протекало стационарное окисление метана с конверсией ~8%. Затем на образец пускали смесь 50% СН4–50% СО2 при 750°С в течение 1 ч и наблюдали почти постоянную скорость УКМ с образованием всего 0.06% СО. Таким образом, можно заключить, что процесс стационарного окисления метана не приводит к такому же быстрому увеличению поверхности никеля, как проведение этой реакции в автоколебательном режиме.
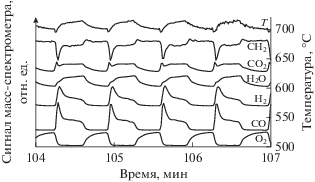
Причиной интенсивного образования пористой поверхности Ni является стадийный механизм автоколебаний реакции окисления метана на никеле [17, 25]. В ходе автоколебаний (рис. 3) периодически чередуются фазы с высокой и низкой каталитической активностью. В фазе с высокой активностью никель находится в восстановленном металлическом состоянии, катализирующем в основном парциальное окисление метана в СО и Н2. В фазе с низкой активностью поверхность металла окисляется до гораздо менее активного оксида никеля NiO, который катализирует только глубокое окисление метана до СО2 и Н2О. Образование NiO или металлического никеля было доказано, например, в работе [25] методом рентгеновской дифракции и в работе [20] методом РФЭС. Было показано [17, 25], что глубина окисленного слоя может составлять десятки слоев кристаллической решетки никеля. Период смены состояний меняется от десятков секунд до минут в зависимости от температуры реакции и других условий. Очевидно, настолько быстрые и частые фазовые изменения поверхности (окисление и восстановление никеля) приводят к дроблению и разрыхлению кристаллитов никеля и формированию из них микропористой структуры.
Рис. 3.
Автоколебания скорости окисления метана на Ni-фольге при 750°С в потоке смеси 80% СН4–20% О2.
Хотя состояние окисленности поверхности Ni периодически меняется в ходе автоколебаний, при прерывании автоколебательного режима окисления метана мы всегда получали окисленную поверхность, что хорошо заметно по изменению цвета никелевой фольги в реакторе. Таким образом, для дальнейшего тестирования каталитической активности не имеет значения прерывание реакции в той или иной стадии автоколебаний.
Выше упоминалось, что увеличение продолжительности автоколебательной обработки от 1 до 2.5 ч не приводит к дополнительному росту каталитической активности фольги Ni. Чтобы более детально понять природу такого ограничения, мы изучили влияние времени автокаталитической обработки никеля на толщину образуемого пористого слоя. Для решения этой задачи образцы Ni-фольги выдерживали при 750°С в потоке смеси 20% О2–80% СН4 в условиях автоколебательного протекания реакции в течение 1, 2.5 или 3.5 ч. Затем поперечное сечение образцов изучали с помощью СЭМ. Для получения поперечного сечения фольги без повреждения поверхностного слоя образцы охлаждали в жидком азоте до хрупкого состояния и затем разламывали на две половины. В камеру микроскопа образцы помещали под углом к плоскости поверхности фольги так, чтобы была видна поверхность излома. Типичный снимок поперечного сечения Ni-фольги после автоколебательной обработки в течение 1 ч показан на рис. 4а. Хорошо виден пористый поверхностный слой, ниже которого находится сплошной массив металлического никеля. Средняя толщина пористого поверхностного слоя составляет 12 мкм. Состав поверхностного слоя неоднороден: можно различить относительно крупные кристаллиты размером ~1 мкм и гораздо более мелкие размером ~0.1 мкм. Аналогичные изображения, полученные для образцов, находившихся в автоколебательных условиях в течение 2.5 и 3.5 ч, свидетельствуют о присутствии пористого поверхностного слоя примерно такой же толщины ~12 мкм (рис. 4б и 4в). Это означает, что автоколебательная обработка никеля продолжительностью более 1 ч не приводит к дополнительному увеличению глубины пористого слоя.
Рис. 4.
СЭМ-изображения поперечного излома образца Ni-фольги после автоколебательной обработки при 750°С в течение 1 (а), 2.5 (б) и 3.5 ч (в). Место излома расположено под углом к наблюдателю, так что в самой верней части изображения видна уходящая вдаль поверхность. Поперечный излом состоит из пористого слоя толщиной ~12 мкм и сплошного металла под ним (нижняя половина изображения).

Влияние различных газовых сред на свойства поверхностного слоя
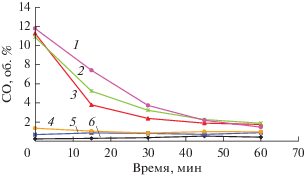
Выше было упомянуто, что пористая поверхность, полученная после автоколебательной обработки, не остается неизменной в условиях реакции УКМ. Чтобы понять, какие газовые компоненты реакционной смеси вызывают этот эффект, было изучено влияние различных газовых сред (инертный газ (Не), СО2, СН4, Н2) на каталитические свойства пористого слоя и его морфологию. Для этого образцы Ni-фольги сначала выдерживали при 750°С в потоке смеси 20% О2–80% СН4 в условиях автоколебательного протекания реакции в течение 1 ч, а затем после образования пористой поверхности – при 750°С в течение 1 ч в потоке гелия, СО2, водорода или метана. Изменение свойств поверхности после такой обработки тестировали 1) путем измерения каталитической активности в реакции УКМ при 750°С или 2) с помощью СЭМ. Результаты каталитического тестирования показали, что свойства образцов в реакции УКМ после нахождения в потоке гелия или СО2 практически не изменялись (рис. 5), т.е. они также демонстрировали высокую каталитическую активность в начальный период (~11–12% СО) и постепенное снижение скорости реакции в течение 1 ч. Напротив, образцы после обработки в потоках водорода или метана даже в начальный период имели низкую активность (0.5–1% СО), которая практически не менялась со временем.
Рис. 5.
Концентрация СО в реакционной смеси в ходе каталитической реакции УКМ при 750°С на Ni-фольге: исходной (6); после автоколебательной обработки при 750°С (1); после автоколебательной обработки и выдерживании при 750°С в потоке СО2 (2), Не (3), СН4 (4) и Н2 (5).
Данные о морфологии поверхности, полученные с помощью СЭМ, позволяют понять причину таких изменений каталитической активности. Поверхность образца Ni-фольги после автоколебательной обработки покрыта кристаллами размерами 100–200 нм, которые можно отнести к оксиду никеля NiO (рис. 6а). Поверхностный слой рыхлый и содержит поры диаметром 100–200 нм, уходящие на глубину до 10–12 мкм. После выдерживания при 750°С в потоке инертного газа структура поверхности практически не меняется (рис. 6б). После обработки в потоке СО2 образуются кристаллы оксида с более четко выраженными гранями, но размер их остается фактически таким же (рис. 6в). Поверхность выглядит менее пористой по сравнению с тем, что мы видим на рис. 6а и 6б, но активность этого образца в реакции УКМ такая же высокая, как и для двух вышеуказанных. Вероятно, в восстановительных условиях (условия УКМ) при 750°С данные кристаллы быстро восстанавливаются, и формируется высокопористая металлическая поверхность. Повторим, что такое состояние нестабильно в ходе реакции УКМ, и каталитическая активность снижается со временем.
Рис. 6.
СЭМ-изображения поверхности Ni-фольги непосредственно после автоколебательной обработки при 750°С (а) и после дальнейшего ее выдерживания в потоке Не (б), СО2 (в), Н2 (г) и СН4 (д) при 750°С в течение 1 ч.

На рис. 6г показано строение поверхности образца, который после автоколебательной обработки выдерживали в потоке водорода при 750°С. На снимке видна губчатая структура из сцепленных кристаллитов размером 1–3 мкм, которые можно отнести к металлическому никелю, похожая на ту, что наблюдается на рис. 2б, однако заметно, что кристаллиты Ni более крупные. По-видимому, удельная поверхность образца на рис. 6г существенно ниже, чем образца на рис. 2б. Вероятно, это и объясняет их разные каталитические свойства: образец с рис. 2б обладает высокой активностью, а с рис. 6г – низкой.
На рис. 6д приведен снимок поверхности образца, который после автоколебательной обработки выдерживали в потоке метана при 750°С в течение 1 ч и который также имеет низкую каталитическую активность. Видно, что размер кристаллитов не превышает 1 мкм, но поры между ними “заплавились”, напоминая поверхность образца после реакции УКМ в течение 1 ч при 750°С (рис. 2в). Вероятно, именно присутствие Н2 и СН4 в газовой фазе в процессе УКМ приводит к постепенному снижению активности никеля вследствие сокращения пористости поверхностного слоя.
Сравнение свойств пористого слоя Ni, полученного при автоколебательной обработке, с известными микропористыми образцами Ni
Чтобы сопоставить свойства пористых слоев на поверхности Ni, полученных в ходе автоколебательной обработки, со свойствами известных микропористых образцов (пенометаллов), мы изучили каталитические свойства ряда микропористых образцов Ni, содержащих поры разного размера. По данным СЭМ для первого образца характерны крупные поры размером 100–500 мкм (далее Ni-100-мкм), размер пор второго составляет 10–20 мкм (далее Ni-10-мкм), а третьего – 1–3 мкм (далее Ni-1-мкм). Каталитическую активность в реакции УКМ при 750°С измеряли на свежих образцах, сопоставимых по размеру с изученными образцами Ni-фольги, и на образцах после часовой обработки в потоке смеси 20% О2–80% СН4 в условиях автоколебательного протекания реакции. Исходный образец Ni-100-мкм имеет практически нулевую каталитическую активность, которая резко повышается после автоколебательной обработки (0.9% СО). Похожая картина наблюдается для образца Ni-10-мкм: низкая скорость образования СО (~0.2%) на свежем образце возрастает до ~11% после обработки. Напротив, исходный образец Ni-1-мкм обладает высокой каталитической активностью (20–22% СО в продуктах), но после автоколебательной обработки она уменьшается на ~25% от исходной. Данные СЭМ свидетельствуют, что это связано с ростом размера кристаллитов Ni от 1–3 мкм для исходного Ni-1-мкм до 2–10 мкм после автоколебательной обработки. Можно заключить, что морфология образца Ni-1-мкм близка к морфологии пористого слоя, получаемого на Ni-фольге при автоколебательной обработке, поэтому подобная обработка не вызывает дополнительного увеличения его удельной поверхности. Кристаллиты Ni, содержащиеся в образцах Ni-100-мкм и Ni-10-мкм, имеют размеры от 10 мкм и выше. Такие кристаллиты уменьшаются в размерах в процессе автоколебательного окисления метана на никеле.
ЗАКЛЮЧЕНИЕ
В результате проведения реакции окисления метана в автоколебательном режиме при 750°С на поверхности никеля образуется пористый слой, содержащий кристаллы размером 100–200 нм. Глубина этого слоя составляет 10–12 мкм и не растет при кратном увеличении длительности автоколебательной обработки. Непосредственно после автоколебательной обработки кристаллы пористой поверхности находятся в окисленном состоянии. В таком состоянии они могут сохраняться при температуре 750°С в потоке инертного газа или СО2. В восстановительной среде (Н2, СН4) кристаллы оксида никеля восстанавливаются до металла и постепенно “сливаются”, образуя губчатую структуру, площадь поверхности которой существенно меньше, чем таковая в исходном окисленном состоянии, о чем свидетельствует снижение каталитической активности никеля после предварительной восстановительной обработки, а также в ходе каталитической реакции УКМ, где катализатор также находится в восстановленном состоянии. Установлено, что относительно быстрое формирование вышеуказанного пористого слоя характерно именно для автоколебательного режима протекания каталитической реакции, т.к. проведение реакций в стационарном режиме (углекислотная конверсия метана, глубокое окисление метана) не вызывает такого быстрого преобразования поверхности никеля. По каталитическим и реакционным свойствам формирующийся пористый слой близок к известным микропористым образцам с размером пор ~1 мкм (металлические мембраны), однако отличается от них ограниченной глубиной на поверхности массивного металла.
Список литературы
Ashok J., Wai M.H., Kawi S. // ChemCatChem. 2018. V. 10. P. 3927.
Bkour Q., Marin-Flores O.G., Graham T.R., Ziaei P., Saunders S.R., Norton M.G., Ha S. // Appl. Catal. A: General. 2017. V. 546. P. 126.
Li J., Lu G. // Appl. Catal. A: General. 2004. V. 273. P. 163.
Yao Y.-F.Y., Kummer J.T. // J. Catal. 1973. V. 28. P. 124.
Seo H.O. // Catalysts. 2018. V. 8. P. 110.
Бычков В.Ю., Крылов О.В., Корчак В.Н. // Кинетика и катализ. 2002. Т. 43. № 1. С. 94. (Bychkov V.Yu., Krylov O.V., Korchak V.N. // Kinet. Catal. 2002. V. 43. № 1. Р. 86.)
Simonov M.N., Rogov V.A., Smirnova M.Yu., Sadykov V.A. // Catalysts. 2017. V. 7. P. 268.
Матус E.В., Нефедова Д.В., Сухова O.Б., Исмагилов И.З., Ушаков В.A., Яшник С.A., Никитин A.П., Керженцев M.A., Исмагилов З.Р. // Кинетика и катализ. 2019. Т. 60. № 4. С. 532. (Matus E.V., Sukhova O.B., Ismagilov I.Z., Ushakov V.A., Yashnik S.A., Kerzhentsev M.A., Ismagilov Z.R., Nefedova D.V., Nikitin A.P. // Kinet. Catal. 2019. V. 60. № 4. Р. 496.)
Матус E.В., Шляхтина A.С., Сухова O.Б., Исмагилов И.З., Ушаков В.A., Яшник С.A., Никитин A.П., Bharali P., Керженцев M.A., Исмагилов З.Р. // Кинетика и катализ. 2019. Т. 60. № 2. С. 245. (Matus E.V., Shlyakhtina A.S., Sukhova O.B., Ismagilov I.Z., Ushakov V.A., Yashnik S.A., Kerzhentsev M.A., Ismagilov Z.R., Nikitin A.P., Bharali P. // Kinet. Catal. 2019. V. 60. № 2. Р. 221.)
Jalama K. // Catal. Rev. 2017. V. 59. № 2. P. 95.
Попов Ю.В., Мохов В.M., Небыков Д.Н., Латышова С.E., Щербакова K.В., Панов A.O. // Кинетика и катализ. 2018. Т. 59. № 4. С. 435. (Popov Y.V., Mokhov V.M., Nebykov D.N., Latyshova S.E., Shcherbakova K.V., Panov A.O. // Kinet. Catal. 2018. V. 59. № 4. Р. 444.)
Чесноков В.В., Чичкань A.С., Паукштис E.A., Чесалов Ю.A., Краснов A.В. // Кинетика и катализ. 2019. Т. 60. № 4. С. 471. (Chesnokov V.V., Chichkan A.S., Paukshtis E.A., Chesalov Y.A., Krasnov A.V. // Kinet. Catal. 2019. V. 60. № 4. Р. 439.)
Голубина E.В., Локтева E.С., Кавалерская Н.E., Маслаков K.И. // Кинетика и катализ. 2020. Т. 61. № 3. С. 410. (Golubina E.V., Lokteva E.S., Kavalerskaya N.E., Maslakov K.I. // Kinet. Catal. 2020. V. 61. № 3. Р. 444.)
Zhang X.L., Hayward D.O., Mingos D.M.P. // Catal. Lett. 2002. V. 83. P. 149.
Tulenin Yu.P., Sinev M.Yu., Savkin V.V., Korchak V.N. // Catal. Today. 2004. V. 91–92. P. 155.
Гладкий A.Ю., Каичев В.В., Ермолаев В.К., Бухтияров В.И., Пармон В.Н. // Кинетика и катализ. 2005. Т. 46. № 2. С. 269. (Gladky A.Yu., Kaichev V.V., Ermolaev V.K., Bukhtiyarov V.I., Parmon V.N. // Kinet. Catal. 2005. V. 46. P. 251.)
Bychkov V.Yu., Tyulenin Yu.P., Korchak V.N., Aptekar E.L. // Appl. Catal. A: General. 2006. V. 30. P. 21.
Сараев A.A., Винокуров З.С., Шмаков A.Н., Каичев В.В., Бухтияров В.И. // Кинетика и катализ. 2018. Т. 59. № 6. С. 776. (Saraev A.A., Vinokurov Z.S., Shmakov A.N., Kaichev V.V., Bukhtiyarov V.I. // Kinet. Catal. 2018. V. 59. № 6. Р. 810.)
Bychkov V.Yu., Tulenin Yu.P., Slinko M.M., Gordienko Yu.A., Korchak V.N. // Catal. Lett. 2018. V. 148. P. 653.
Kaichev V.V., Teschner D., Saraev A.A., Kosolobov S.S., Gladky A.Yu., Prosvirin I.P., Rudina N.A., Ayupov A.B., Blume R., Hövecker M., Knop-Gericke A., Schlögl R., Latyshev A.V., Bukhtiyarov V.I. // J. Catal. 2016. V. 334. P. 23.
Сараев A.A., Косолобов С.С., Каичев В.В., Бухтияров В.И. // Кинетика и катализ. 2015. Т. 56. № 5. С. 606. (Saraev A.A., Kaichev V.V., Bukhtiyarov V.I., Kosolobov S.S. // Kinet. Catal. 2015. V. 56. № 5. Р. 598.)
Kaichev V.V., Gladky A.Yu., Saraev A.A., Kosolobov S.S., Sherstyuk O.V., Bukhtiyarov V.I. // Top. Catal. 2020. V. 63. P. 24.
Bychkov V.Yu., Tulenin Yu.P., M.M. Slinko M.M., Sokolov S., V.N. Korchak V.N. // Catal. Lett. 2017. V. 147. P. 1019.
Bychkov V.Yu., Tyulenin Yu.P., Slinko M.M., Korchak V.N. // Appl. Catal. A: General. 2007. V. 321. P. 180.
Saraev A.A., Vinokurov Z.S., Kaichev V.V., Shmakov A.N., Bukhtiyarov V.I. // Catal. Sci. Technol. 2017. V. 7. P. 1646.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


