Кинетика и катализ, 2021, T. 62, № 1, стр. 14-20
Ингибирующее действие 4-гидрокси-2,5-диметилфуран-3-она на радикально-цепное окисление стирола
С. А. Грабовский a, *, Ю. С. Грабовская a, А. В. Антипин a, Н. Н. Кабальнова a
a Уфимский институт химии УФИЦ РАН
450054 Уфа, просп. Октября, 69, Россия
* E-mail: stas_g@anrb.ru
Поступила в редакцию 14.05.2020
После доработки 21.07.2020
Принята к публикации 15.08.2020
Аннотация
Расчеты прочности O–H-связи, выполненные методами G4 и M06-2X/MG3S для 2-гидрокси-3-метилциклопент-2-ен-1-она (кленовый лактон), 4-гидрокси-2,3-диметил-2H-фуран-5-она (сотолон), 4-гидрокси-5-метилфуран-3-она, 4-гидрокси-2,5-диметилфуран-3-она (клубничный фуранон), (2R)-2-[(1S)-1,2-дигидроксиэтил]-3,4-дигидрокси-2H-фуран-5-она (аскорбиновая кислота), 5-гидрокси-2-(гидроксиметил)пиран-4-она (койевая кислота), 3-гидрокси-2-метилпиран-4-она (мальтол), 3-гидрокси-2-этилпиран-4-она (этилмальтол), 4-гидрокси-6-метилпиран-2-она и 5-гидрокси-6-метил-3,4-дигидро-2H-пиран-4-она (дигидромальтол), свидетельствуют о наличии слабой O–H-связи, менее 82.0 ккал/моль, в производных 4-гидроксифуран-3-она. Экспериментально измеренная константа скорости реакции соединения с наиболее низкой прочностью O–H-связи – 4-гидрокси-2,5-диметилфуран-3-она – с пероксильными радикалами в хлорбензоле и ацетонитриле сравнима с данными для ионола, однако стехиометрический коэффициент ингибирования равен 0.17 (PhCl) и 0.66 (MeCN), что значительно меньше, чем для ионола. Рассчитанное методом SMD(PhCl)-M05/MG3S значение энтальпии активации для отрыва атома водорода от 4-гидрокси-2,5-диметилфуран-3-она пероксильными радикалами хорошо коррелирует с данными для производных 5-гидрокси и 5-аминоурацила, что свидетельствует об общем механизме взаимодействия этих соединений с пероксильными радикалами.
ВВЕДЕНИЕ
Среди веществ, обнаруженных в натуральных пищевых продуктах, антиоксиданты наиболее интенсивно исследовались в качестве соединений, предотвращающих заболевания, связанные с окислительным стрессом. Активные формы кислорода могут приводить к нежелательным последствиям для живых организмов, включая канцерогенез, мутагенез, старение и атеросклероз [1–3]. Например, накопление сложных эфиров холестерина вызвано окислением липидов плазмы крови [4] и тесно связано с атеросклерозом и эндотелиальной дисфункцией [5, 6].
В литературе обсуждается наличие антиоксидантной активности у вкусоароматических добавок, в частности, производных фуран-3-она, пиранона и родственных соединений. Так, было обнаружено, что 4-гидрокси-5-метилфуран-3-он, 4-гидрокси-2,5-диметилфуран-3-он, 4-гидрокси-2-этил-5-метилфуран-3-он и 4-гидрокси-5-этил-2-метилфуран-3-он проявляют антиоксидантные свойства, однако константы скорости реакции с пероксильными радикалами определены не были [7, 8]. Соединение 4-гидрокси-5-метилфуран-3-он ингибирует окисление метил линолеата и линолевой кислоты в водной среде. При этом его эффективность ниже, чем у (2R)-2-[(1S)-1,2-дигидроксиэтил]-3,4-дигидрокси-2H-фуран-5-она [9, 10], и оба соединения ингибируют окисление липидов в плазме крови [11, 12]. В работе [13] было установлено, что 2-гидрокси-3-метилциклопент-2-ен-1-он, выделенный из кофе, селективно ингибирует реакции с участием пероксинитрита и незначительно – c супероксид анион-радикалом. Антиоксидантные свойства проявляют и производные пиранона. Так, 3-гидрокси-2-метилпиран-4-он ингибирует накопление пероксидов при окислении липидов в присутствии ионов железа, в то время как 2,6-диметилпиран-4-он не оказывает на процесс окисления никакого влияния [14]. Обнаружено, что экстракты корейского красного женьшеня ингибируют перекисное окисление липидов в печени крыс, и основным компонентом, ответственным за антиоксидантное действие, является 3-гидрокси-2-метилпиран-4-он [15]. Это соединение показало хороший защитный эффект как антиоксидант при легочной форме отравления кислородом [16]. Близкое по строению соединение 5-гидрокси-2-(гидроксиметил)пиран-4-он проявляет антиоксидантные свойства при проведении тестов в биологических системах [17] и ингибирует накопление пероксидов при окислении соевого масла [8]. Исследования, описанные в литературе, выполнены различными методами, при этом сравнимые количественные данные отсутствуют.
В настоящей работе рассчитаны прочности O–H-связей производных фуран-3-она, пиранона, а также некоторых родственных соединений, и изучено ингибирующее действие 2-гидрокси-3-метилциклопент-2-ен-1-она, 4-гидрокси-2,5-диметилфуран-3-она, 4-гидрокси-2,3-диметил-2H-фуран-5-она и 3-гидрокси-2-этилпиран-4-она на радикально-цепное окисление стирола, инициированное 2,2'-азо-бис-изобутиронитрилом в хлорбензоле и ацетонитриле.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
2,2'-Азо-бис-изобутиронитрил (AIBN) очищали двукратной перекристаллизацией из 96%-ного этилового спирта. Стирол (St) очищали от ингибитора на колонке с окисью алюминия с последующей вакуумной перегонкой при 40°С/15 мм рт. ст. Растворители хлорбензол (≥98%) и ацетонитрил (≥99%) перегоняли непосредственно перед использованием. Коммерчески доступные соединения 2-гидрокси-3-метилциклопент-2-ен-1-он, 4-гидрокси-2,5-диметил-фуран-3-он, 4-гидрокси-2,3-диметил-2H-фуран-5-он, 3-гидрокси-2-этилпиран-4-он и α-токоферол с чистотой ≥ 98% использовали без дополнительной очистки.
Инициированное окисление стирола
Антиоксидантную активность изучали в модельной системе инициированного AIBN окисления стирола в хлорбензоле и ацетонитриле при 310 K в атмосфере воздуха (P0 = 1 атм) [18]. В предварительных экспериментах с использованием УФ-спектрофотометрии и ВЭЖХ было установлено, что соединения не расходуются в насыщенных кислородом растворах в отсутствие и в присутствии AIBN без кислорода. Количество поглощенного кислорода определяли с помощью манометрической дифференциальной установки с датчиком перепада давления в кинетическом режиме, коэффициент Генри при 310 K (Сжидк/Сгаз) составлял 0.198 и 0.19 для смеси хлорбензол–стирол и ацетонитрил–стирол соответственно [19, 20]. Скорость инициирования (wi) предварительно находили по формуле, приведенной ниже, в серии экспериментов из периода индукции (tind), используя α-токоферол (α-TP) в качестве эталонного антиоксиданта [18]:
Период индукции определяли численным интегрированием согласно уравнению [21]:
Квантово-химические расчеты
Квантово-химические расчеты проводили с помощью программного пакета Gaussian-09, Revision C1 [23]. Для визуализации полученных результатов использовали программу ChemCraft [24]. Для вычисления энтальпии диссоциации связей применяли композитный метод G4 [25] и гибридный мета-GGA функционал M06-2X [26] с базисным набором MG3S [27]. Для поиска переходного состояния использовали метод M05/MG3S [28]. Расчеты геометрии и энергии проведены для газовой фазы и принимая во внимание влияние растворителя в рамках сольватационной модели SMD [29], как с учетом специфического влияния растворителя, так и без него. Для включения в модель специфической сольватации рассчитывали комплекс ацетонитрила с 4-гидрокси-2,5-диметилфуран-3-оном по –OH-группе, принимая во внимание неспецифическую сольватацию ацетонитрилом. Все геометрические параметры молекул оптимизированы без ограничения по симметрии. Соответствие найденных структур минимумам или максимумам на поверхности потенциальной энергии устанавливали по отсутствию отрицательных частот в матрице Гессе или наличию единственной отрицательной частоты соответственно. Энергии для найденных структур корректировали с учетом энергии нулевых колебаний, используя фактор 0.977 и 0.981 для M05/MG3S и M06-2X/ MG3S соответственно [30]. Энтальпию активации вычисляли как разность между переходным состоянием и предреакционным комплексом. Все квантово-химические расчеты проведены на суперкомпьютерном кластере центра коллективного пользования Уфимского института химии УФИЦ РАН.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Реакционная способность пероксильных радикалов по отношению к ингибиторам в большинстве случаев зависит от прочности разрываемой X–H-связи (где X – O, N, S, Se) [31, 32]. Нами были рассчитаны прочности наиболее слабых O–H-связей в некоторых производных фуранона и пирона – 2-гидрокси-3-метилциклопент-2-ен-1-он (1, кленовый лактон), 4-гидрокси-2,3-диметил-2H-фуран-5-он (2, сотолон), 4-гидрокси-5-метилфуран-3-он (3), 4-гидрокси-2,5-диметилфуран-3-он (4, клубничный фуранон), (2R)-2-[(1S)-1,2-дигидроксиэтил]-3,4-дигидрокси-2H-фуран-5-она (5, аскорбиновая кислота), 5‑гидрокси-2-(гидроксиметил)пиран-4-она (6, койевая кислота), 3-гидрокси-2-метилпиран-4-она (7, мальтол), 3-гидрокси-2-этилпиран-4-она (8, этилмальтол), 4-гидрокси-6-метилпиран-2-она (9) и 5-гидрокси-6-метил-3,4-дигидро-2H-пиран-4-она (10, дигидромальтол). Расчеты были выполнены с использованием композитного метода G4 и гибридного мета-GGA функционала M06-2X с базисным набором MG3S, которые позволяют получать данные близкие к экспериментальным [33, 34]. Результаты приведены на рис. 1.
Рис. 1.
Энтальпия диссоциации O–H-связей (при 298 К) в некоторых производных фуранона и пирона, рассчитанная методами G4 и M06-2X/MG3S (приведена в скобках).
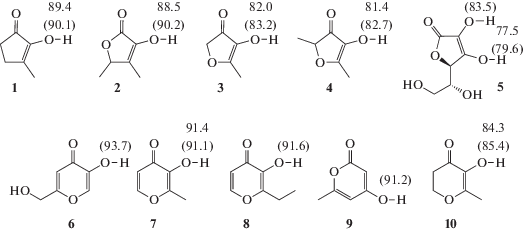
Согласно расчетам, выполненным методом G4, самой низкой прочностью O–Н-связи обладает соединение 5 – 77.5 ккал/моль (рис. 1), что хорошо согласуется с экспериментальным значением 78.0 ± 0.5 ккал/моль [35]. Замена гидроксильной группы на метильную (соединения 2 и 5) приводит к увеличению прочности связи в оставшейся на 5 ккал/моль. При этом отличающиеся наличием гетероатома в кольце соединения 2 и 1 имеют сравнимые прочности O–H-связи. Наиболее близкими по прочности связи к 5 среди изученных соединений с пятичленным циклом являются 3 и 4. Из производных пирона самая низкая прочность O–H-связи у соединения 10, остальные имеют прочность связи более 88 ккал/моль, в связи с чем их ингибирующее действие на радикально-цепное окисление пренебрежимо мало [31, 32]. Таким образом, среди соединений 1–10 наиболее перспективным для исследования ингибирующего действия на процесс радикально-цепного окисления, за исключением 5, является соединение 4 (рис. 1), обладающее наименьшей прочностью O–H-связи. Прочность связи в соединении 4 сравнима с таковой для известного фенольного ингибитора 2,6-дитретбутил-4-метилфенола (81.7 ккал/моль) [35]. Необходимо помнить, что эта характеристика может быть использована лишь для предварительной оценки реакционной способности [32]. Так, для близких по прочности связи соединений α-токоферола и 5 (78.5 и 78.0 ккал/моль соответственно [35]) константы скорости реакции с пероксильными радикалами отличаются более чем на порядок (в хлорбензоле 32 × 105 и 1.4 × 105 моль–1 л с–1 соответственно) [18, 36, 37].
Ранее была исследована реакционная способность производных соединения 5 в неводных средах, где ключевая реакция ингибирования – отрыв атома водорода пероксильным радикалом [36, 37]. Показано, что в ацетонитриле и хлорбензоле аскорбиновая кислота является ингибитором средней силы, константы скорости реакции с пероксильными радикалами составляют 0.84 × 105 и 1.4 × 105 моль–1 л с–1 соответственно. Ожидаемое значение константы скорости реакции для 4 должно быть сравнимым или ниже. Для экспериментального изучения была выбрана система инициированного окисления стирола в хлорбензоле или ацетонитриле, позволяющая определять константы скорости в пределах от 0.31 × 104 до 6.0 × 106 моль–1 л с–1 [18]. Выбор растворителей связан с большим набором данных по реакционной способности ингибиторов различного строения [31, 32] в этих растворителях, что позволит сопоставить характеристики исследованного соединения с уже имеющимися в литературе сведениями. Кроме того, использованная система хорошо зарекомендовала себя, и получаемые с ее помощью результаты сравнимы с данными метода импульсного радиолиза [18–21, 32].
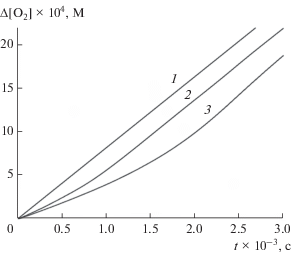
При окислении стирола в присутствии 4 в концентрации 3 × 10–5 моль/л и выше скорость поглощения кислорода снижается, и наблюдается индукционный период (рис. 2). В этих же условиях соединения 1, 2 и 8 не влияют на скорость поглощения кислорода в диапазоне концентраций (3–20) × 10–5 моль/л. После завершения индукционного периода скорость поглощения кислорода равна скорости окисления без добавок 4 (рис. 2), т.е. продукты цепного окисления не ингибируют окисление.
Расчет кинетических параметров проводили в рамках механизма цепного окисления:
По кинетическим кривым поглощения кислорода рассчитана начальная скорость окисления w и период индукции tind. Длина цепи окисления ν = = w/wi (wi – скорость инициирования) без ингибитора составляет 67 (PhCl) и 77 (MeCN). При добавлении 4 длина цепи снижается, и при концентрации 17 × 10–5 моль/л этот показатель в обоих растворителях составляет 19. Таким образом, в изученном диапазоне концентраций ингибитора (3–17) × 10–5 моль/л окисление протекает по цепному механизму.
Из кинетических кривых поглощения кислорода были рассчитаны значения степени торможения F = w0/w – w/w0, и из концентрационных зависимостей F = fk7 [4]0 × (wi × 2k6)−1/2, где [4]0 – начальная концентрация 4, вычислены константы ингибирования fk7. Стехиометрический коэффициент ингибирования рассчитан из концентрационной зависимости wi × tind = f × [4]0. Полученные значения констант скорости и коэффициента ингибирования приведены в табл. 1. Константы скорости реакции для 4 ниже, чем для производных аскорбиновой кислоты [36], и близки к таковым для ионола (k7 = 1.4 × 104 моль–1 л с–1 [18]). Стехиометрические коэффициенты ингибирования для 4 и производных 5 близки (0.15 и 1.0 в PhCl и MeCN соответственно [36, 37]), но для 2,6-дитретбутил-4-метилфенола f больше (2.0 в обоих растворителях [18]). Низкое значение f для 4 связано, по-видимому, как и в случае с производными аскорбиновой кислоты, с наличием канала генерации активных радикалов из радикала ингибитора [32, 36, 37].
В дополнение к экспериментальным исследованиям проведено квантово-химическое моделирование реакции отрыва атома водорода от O–H-группы 4-гидрокси-2,5-диметилфуран-3-она t-BuOO•-радикалом в газовой фазе, хлорбензоле и ацетонитриле. Расчеты были выполнены с использованием метода (SMD)-M05/MG3S, позволяющего получать результаты, сопоставимые с данными такого ресурсоемкого метода, как RMP2/aug-cc-pVTZ//MRMP2/MG3S [38]. Результаты расчетов представлены в табл. 2 и на рис. 3.
Таблица 2.
Ключевые геометрические параметры и энтальпия активации отрыва атома водорода от 4-гидрокси-2,5-диметилфуран-3-она t-BuOO• радикалом вычисленные методом (SMD)-M05/MG3S
| Среда | r(O–H), Å | r(H–OO), Å | r(OO), Å | ∠(OHO) | ∠(CCOH) | $\Delta H_{{298}}^{ \ne },$ ккал/моль |
|---|---|---|---|---|---|---|
| Газовая фаза | 1.199 | 1.183 | 1.344 | 177.3 | 2.3 | 11.6 |
| PhCl | 1.120 | 1.255 | 1.333 | 169.9 | 62.3 | 8.8 |
| MeCN | 1.110 | 1.270 | 1.331 | 172.5 | 66.4 | 7.6 (8.5*) |
Рис. 3.
Геометрии: а – комплекс 4-гидрокси-2,5-диметилфуран-3-она с ацетонитрилом, рассчитанный методом SMD(MeCN)-M05/MG3S; б – переходное состояние отрыва H-атома от 4-гидрокси-2,5-диметилфуран-3-она радикалом t-BuOO•, рассчитанное на уровне теории SMD(Ph-Cl)-M05/MG3S.
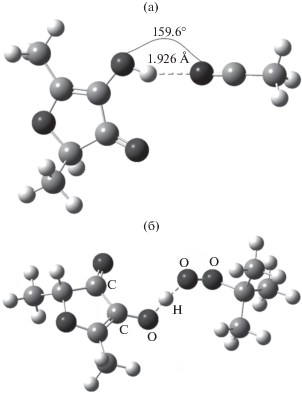
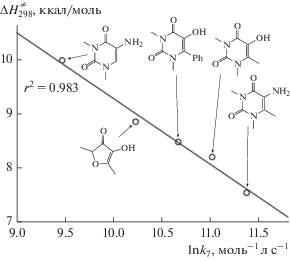
Геометрии переходного состояния в газовой фазе и растворе отличаются диадеральным углом ∠(CCOH), т.е. в растворителе в переходном состоянии разрушается водородная связь между кислородом карбонильной группы и водородом гидроксильной группы, что связано с уменьшением прочности этой связи с 6.2 ккал/моль в газовой фазе до 3.0 ккал/моль (SMD-M05/MG3S) в растворе хлорбензола. Аналогичное явление описано для производных 5-гидрокси-1,3-диметилурацила [19]. Полученное значение энтальпии активации в хлорбензоле хорошо коррелирует с данными для производных 5-гидрокси и 5-амино-1,3-диметилурацила [19] (рис. 4), что может свидетельствовать о близком механизме реакций этих неароматических соединений с пероксильными радикалами.
Рис. 4.
Корреляционная зависимость между ln k7 в хлорбензоле и рассчитанными методом SMD(хлорбензол)-M05/MG3S значениями $\Delta H_{{298}}^{ \ne }$ для отрыва атома водорода от 4-гидрокси-2,5-диметилфуран-3-она и некоторых производных 1,3-диметилурацила.
В случае расчета энтальпии активации в ацетонитриле с учетом неспецифической сольватации получаемое значение 7.6 ккал/моль явно занижено, принимая во внимание близкие константы скорости реакции в MeCN и Ph-Cl. Однако при дополнении модели специфической сольватацией гидроксильной группы, одной молекулой ацетонитрила, энтальпия активации становится близкой к рассчитанной для хлорбензола (табл. 2). Наличие специфической сольватации гидроксильных групп антиоксидантов в ацетонитриле отмечали и авторы [39 ] , основываясь на снижении их реакционной способности в MeCN по сравнению с другими растворителями.
ЗАКЛЮЧЕНИЕ
По данным расчетов прочности O–H-связи производных фуран-3-она и пиранона (соединения 1–10), выполненных на уровне теории G4 и M06-2X/MG3S, низкой прочностью связи обладают производные 4-гидроксифуран-3-она. Экспериментально измеренная константа скорости реакции с пероксильными радикалами для соединения с наиболее низкой прочностью O–H-связи – 4-гидрокси-2,5-диметилфуран-3-она – сравнима с таковой для известного ингибитора 2,6-дитретбутил-4-метилфенола в хлорбензоле и ацетонитриле. Однако стехиометрический коэффициент ингибирования в 11 (PhCl) и 3 раза (MeCN) меньше, чем для 2,6-дитретбутил-4-метилфенола. Полученные кинетические данные свидетельствуют, что 4-гидрокси-2,5-диметилфуран-3-он является неэффективным ингибитором, особенно в неполярном растворителе – хлорбензоле. В полярном растворителе – ацетонитриле – его эффективность возрастает. Рассчитанное методом SMD(хлорбензол)-M05/MG3S значение энтальпии активации для отрыва атома водорода от 4-гидрокси-2,5-диметилфуран-3-она пероксильными радикалами хорошо коррелирует с данными для производных 5-гидрокси и 5-амино-1,3-диметилурацила, что указывает на общий механизм взаимодействия этих соединений с пероксильными радикалами. На основании сравнения расчетных значений энтальпии активации отрыва атома водорода пероксильным радикалом в рамках неспецифической и специфической сольватации с экспериментальным значением lnk7 можно утверждать, что при моделировании реакционной способности O–H-групп производных 4-гидроксифуран-3-она в ацетонитриле необходимо пользоваться моделью специфической сольватации.
Список литературы
Birben E., Sahiner U.M., Sackesen C., Erzurum S., Kalayci O. // WAO Journal. 2012. V. 5. № 1. P. 9.
Halliwell B., Gutteridge J.M.C. Free Radicals in Biology and Medicine, New York: Oxford University Press, 2015. 944 p.
Зинатуллина К.М., Касаикина О.Т., Кузьмин В.А., Храмеева Н.П. // Кинетика и катализ. 2019. Т. 60. № 3. С. 281. (Zinatullina K.M., Kasaikina O.T., Kuz’min V.A., Khrameeva N.P. // Kinet. Catal. 2019. V. 60. P. 266.)
Retsky K.L., Freeman M.W., Frei B. // J. Biol. Chem. 1993. V. 268. P. 1304.
Schmidt A.M., Hori O., Brett J., Yan D.D., Wauitier J.L., Stern D. // Arterioscler. Thrombosis. 1994. V. 14. P. 1521.
Tesfamariam B. // Free Radic. Biol. Med. 1994. V. 16. P. 383.
Slaughter J.C. // Biol. Rev. 1999. V. 74. № 3. P. 259.
Yoon H.S., Kwon J.H., Choi J.C. // Korean J. Food Sci. Technol. 1984. V. 14. № 3. P. 265.
Koga T., Moro K., Matsudo T. // J. Agric. Food Chem. 1998. V. 46. № 3. P. 946.
Liégeois C., Lermusieau G., Collin S. // J. Agric. Food Chem. 2000. V. 48. № 4. P. 1129.
Miyake T., Shibamoto T. // J. Agric. Food Chem. 1998. V. 46. № 9. P. 3694.
Mi H., Hiramoto T., Kujirai K., Ando K., Ikarashi Y., Kikugawa K. // J. Agric. Food Chem. 2001. V. 49. № 10. P. 4950.
Kim A.R., Zou Y., Kim H.S., Choi J.S., Chang, G.Y., Kim Y.J., Chung H.Y. // J. Pharm. Pharmacol. 2002. V. 54. № 10. P. 1385.
Murakami K., Ito M., Tanemura Y., Yoshino M. // Biomed. Res. 2001. V. 22. № 4. P. 183.
Lee D., Ghafoor K., Moon S., Kim S.H., Kim S., Chun H., Park J. // Qual. Assur. Saf. Crop. 2015. V. 7. № 4. P. 493.
Hwang S.J., Cho S.H., Yon D.R. // Korean J. Prev. Med. 1993. V. 26. № 4. P. 551.
Gupta A.K., Gover M.D., Nouri K., Taylor S. // J. Am. Acad. Dermatol. 2006. V. 55. № 6. P. 1048.
Burton G.W., Doba T., Gabe E.J., Hughes L., Lee F.L., Prasad L., Ingold K.U. // J. Am. Chem. Soc. 1985. V. 107. № 24. P. 7053.
Grabovskiy S.A., Antipin A.V., Grabovskaya Y.S., Andriayshina N.M., Akchurina O.V., Kabal’nova N.N. // Lett. Org. Chem. 2017. V. 14. № 1. P. 24.
Антипин В.А., Грабовский С.А., Грабовская Ю.С., Кабальнова Н.Н. // Кинетика и катализ. 2020. Т. 61. № 3. С. 343. (Antipin A.V., Grabovskii S.A., Grabovskaya Y.S., Kabal’nova N.N. // Kinet. Catal. 2020. V. 61. P. 369.)
Loshadkin D., Roginsky V., Pliss E. // Int. J. Chem. Kin. 2002. V. 34. No. 3. P. 162.
Howard J.A., Ingold K.U. // Can. J. Chem. 1965. V. 43. P. 2729.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E., Robb M.A., Cheeseman J.R., Scalmani G., Barone V., Mennucci B., Petersson G.A., Nakatsuji H., Caricato M., Li X., Hratchian H.P., Izmaylov A.F. et al. Gaussian 09, Revision C.01. Wallingford CT: Gaussian Inc., 2010.
Zhurko G.A. ChemCraft, Version 1.6 (build 332). http://www.chemcraftprog.com
Curtiss L.A., Redfern P.C., Raghavachari K. // J. Chem. Phys. 2007. V. 126. № 8. P. 084108.
Zhao Y., Truhlar D.G. // Theor. Chem. Acc. 2008. V. 120. № 1–3. P. 215.
Lynch B.J., Zhao Y., Truhlar D.G. // J. Phys. Chem. A. 2003. V. 107. № 9. P. 1384.
Zhao Y., Schultz N.E., Truhlar D.G. // J. Chem. Phys. 2005. V. 123. P. 161 103.
Marenich A.V., Cramer C.J., Truhlar D.G. // J. Phys. Chem. B. 2009. V. 113. № 18. P. 6378.
Alecu I.M., Zheng J., Zhao Y., Truhlar D.G. // J. Chem. Theory Comput. 2010. V. 6. P. 2872.
Denisov E.T., Khudyakov I.V. // Chem. Rev. 1987. V. 87. № 6. P. 1313.
Ingold K.U., Pratt D.A. // Chem. Rev. 2014. V. 114. № 18. P. 9022.
Somers K.P., Simmie J.M. // J. Phys. Chem. A. 2015. V. 119. № 33. P. 8922.
Grabovskii S.A., Andriyashina N.M., Grabovskaya Y.S., Antipin A.V., Kabal’nova N.N. // J. Phys. Org. Chem. 2020. V. 33. № 8. P. e4065.
Warren J.J., Tronic T.A., Mayer J.M. // Chem. Rev. 2010. V. 110. № 12. P. 6961.
Amorati R., Pedulli G.F., Valgimigli L. // Org. Biomol. Chem. 2011. V. 9. № 10. P. 3792.
Грабовский С.А., Грабовская Ю.С., Антипин А.В., Кабальнова Н.Н. // Вест. Башкирск. Ун-та. 2019. Т. 24. № 4. С. 830. (Grabovskii S.A., Grabovskaja Y.S., Antipin A.V., Kabal’nova N.N. // Vestn. Bashkir. Univ. 2019. V. 24. № 4. Р. 830.)
Tishchenko O., Truhlar D.G. // J. Phys. Chem. Lett. 2012. V. 3. № 19. P. 2834.
Tikhonov I., Roginsky V., Pliss E. // Int. J. Chem. Kinet. 2009. V. 41. № 2. P. 92.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ