Кинетика и катализ, 2021, T. 62, № 1, стр. 77-86
Перовскиты LaMn1 – xFexO3 (x = 0–1) в реакциях окисления метана и СО
Л. А. Исупова a, *, Е. Ю. Герасимов a, И. П. Просвирин a
a ФГБУН Институт катализа СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
* E-mail: isupova@catalysis.ru
Поступила в редакцию 24.03.2020
После доработки 31.08.2020
Принята к публикации 07.09.2020
Аннотация
Методом Pechini приготовлены перовскиты серии LaMn1 –xFexO3 (х = 0–1) и исследованы их физико-химические свойства методами РФА, ПЭМВР, РФЭС, БЭТ, а также определена каталитическая активность образцов в реакциях окисления метана и СО. Показано, что образцы состава х < 0.4 являются орторомбическими перовскитами, а образцы с х > 0.4 – ромбоэдрическими. В образце со степенью замещения х = 0.4 присутствуют обе модификации, что свидетельствует о наличии морфотропного фазового перехода в области значений х = 0.4. Показано, что все промежуточные образцы серии (0 < x < 1) в реакциях окисления СО и метана менее активны, чем крайние члены ряда, несмотря на их более высокую удельную поверхность, что коррелирует с обогащением поверхности этих оксидов соединениями лантана. Образцы с х = 0.6 и 0.8 с максимальным содержанием лантана на поверхности характеризуются наименьшей активностью, а также стабильностью в каталитическом процессе окисления метана, что может быть обусловлено накоплением на поверхности в процессе окисления метана карбонатов и углерода. Не исключено также, что этому способствует и формирование на поверхности этих оксидов в процессе окисления метана локально упорядоченных областей.
ВВЕДЕНИЕ
Оксиды со структурой перовскита LaBO3 благодаря высокой термической и химической стабильности являются перспективными материалами для использования в ряде высокотемпературных процессов, например, в качестве высокотемпературных катодных материалов или катализаторов окислительных процессов [1, 2]. Среди наиболее активных в окислительных процессах рассматриваются перовскиты, содержащие в B-подрешетке катионы Mn и Fe [3, 4]. Известно, что их каталитическая активность существенно зависит от наличия замещающих иновалентных катионов в подрешетке лантана, которые определяют образование вакансий, изменение заряда на 3d-катионах или даже структурную модификацию оксидов. Это, в свою очередь, оказывает влияние на прочность связи или появление новых форм кислорода, и, следовательно, на активность оксидов в окислительных процессах [5–8].
Наличие замещающих катионов в подрешетке B также влияет на каталитические свойства перовскитов.
Так, в работе [9] было показано, что каталитическая активность в реакции окисления СО перовскитов LaMn1 –xFexO3 (0 < x < 1), приготовленных осаждением и цитратным методами и прокаленных при 800оС, изменяется через максимум при содержании железа х = 0.6. Авторы отмечали, что при введении железа увеличивается удельная поверхность и уменьшается параметр решетки структуры перовскита от 3.931 Å для манганита лантана до 3.8743 Å для феррита лантана. Кроме того, способ получения оксидов влияет на их каталитические свойства: наиболее активны образцы, синтезированные цитратным методом.
В работе [10] однофазные перовскиты LaMn1 –xFexO3 (0 < x < 1) были получены золь–гель-методом после прокаливания предшественников при 700°С и исследованы в реакции каталитического восстановления NO + CO при температурах 150–500°С. Показано, что введение железа приводит к снижению удельной поверхности образцов, повышению доли катионов Me+4 на поверхности и облегчению восстановления перовскитов. Максимальную активность в данной реакции при 350°С продемонстрировал образец состава LaMn0.3Fe0.7O3.
В работе [11] однофазные перовскиты LaMn1 –xFexO3 (0 < x < 1) были приготовлены методом полимерно-солевых композиций после термообработки предшественников при 800°С. При увеличении содержания железа наблюдался рост параметра решетки перовскита (в кубическом приближении) от 3.885 до 3.944 Å, в то время как удельная поверхность образцов изменялась несущественно и варьировалась в интервале 11–15 м2/г. Основываясь на данных ТПВ, авторы отмечали более легкую восстанавливаемость катионов марганца и, напротив, повышение стабильности катионов железа в смешанных оксидах перовскитов, при этом каталитическая активность в разложении перекиси водорода при возрастании содержания железа снижалась.
В работе [12] была также продемонстрирована высокая каталитическая активность перовскитов LaMn1 –xFexO3 (0 < x < 1) в реакции окисления сажи.
Авторы [13] исследовали электронные, структурные и магнитные свойства перовскитов LaMn1 –xFexO3 (0 < x < 1), приготовленных глицин-нитратным способом, после термообработки образующихся предшественников при 1000°С на воздухе. Было установлено, что образцы с х < 0.5, как и LaMnO3, – это ромбоэдрические перовскиты, в них присутствует избыточный кислород, а образцы с х ≥ 0.5 представляют собой орторомбические перовскиты, не содержат избыточного кислорода и являются антиферромагнетиками, в которых доминирует обменное взаимодействие Fe–O–Fe.
Данные, представленные в литературе, свидетельствуют о возможности формирования в системе LaMn1 –xFexO3 (0 < x < 1) непрерывного ряда однофазных растворов уже после термообработки при 700°С, чему способствует обеспечение гомогенного распределения катионов на стадии приготовления предшественника (методы Pechini, цитратный, золь–гель), а также о существовании в системе морфотропного фазового перехода в области х = 0.5. Продемонстрирована высокая каталитическая активность перовскитов в некоторых реакциях, при этом можно отметить противоречия в данных о закономерностях изменения каталитической активности оксидов с увеличением содержания катионов железа, что, возможно, обусловлено различными методами получения образцов или разными каталитическими реакциями.
Метод Pechini характеризуется отсутствием жидких стоков и часто используется для приготовления катализаторов, поскольку обеспечивает возможность синтеза сложных однофазных оксидов при умеренных температурах прокаливания, а также более однородное распределение оксидов на поверхности носителя при получении нанесенных катализаторов. Модельные реакции окисления СО и метана позволяют оценить каталитическую активность оксидов в окислительных процессах.
Целью настоящей работы было изучение каталитических свойств перовскитов LaMn1 –xFexO3 (0 < x < 1), синтезированных методом Pechini, в реакциях окисления СО и метана.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез образцов LaMn1 –xFexO3 с шагом по x = = 0.2 был выполнен путем растворения в воде кристаллогидратов соответствующих азотнокислых солей, смешения растворов в необходимом по катионам соотношении, добавления лимонной кислоты и этиленгликоля с последующим упариванием при 70–80°С до образования резиноподобного полимера (полимерно-солевой композиции). После окислительной деструкции полимера при 110°С образующиеся предшественники прокаливали при 900°С в течение 4 ч.
Рентгенограммы исследуемых образцов снимали на дифрактометре HZG 4-C (“Freiberger Präzisionsmechanik”, Germany) с использованием монохроматезированного (плоский графитовый монохроматор на дифрагированном пучке) CuKα-излучения в интервале углов 2θ = 10°–75° методом сканирования по точкам. Шаг сканирования – 0.05°, время накопления в точке – 3 с. Параметры элементарной ячейки были рассчитаны с помощью ПО Поликристалл [14]. Расчет размеров области когерентного рассеяния (ОКР) и величины микроискажений (∆d/d) был произведен по формуле Селякова–Шеррера в приближении кубической элементарной ячейки:
Данные просвечивающей электронной микроскопии высокого разрешения (ПЭМВР) были получены на приборе JEM-2010 (“JEOL”, Япония) с разрешением 1.4 Å. Рентгеновский микроанализ (EDX) элементного состава образцов осуществляли с использованием энерго-дисперсионного спектрометра EDX с Si(Li) детектором с разрешением по энергиям 130 эВ. Для проведения исследований на электронных микроскопах частицы образцов наносили на дырчатые углеродные подложки, закрепленные на медных или молибденовых сетках, с применением ультразвукового диспергатора УЗД-1УЧ2 (Россия), что позволяло добиться равномерного распределения частиц по поверхности подложки.
Химический состав поверхности катализаторов исследовали с помощью фотоэлектронного спектрометра фирмы SPECS Surface Nano Analysis GmbH (Германия). Спектрометр был оснащен полусферическим анализатором PHOIBOS-150-MCD-9, рентгеновским монохроматором FOCUS-500 и источником рентгеновского характеристического излучения XR-50M с двойным Al/Ag-анодом. Для записи спектров использовали монохроматизированное излучение AlKα (hν = = 1486.74 эВ).
Удельную поверхность (Sуд, м2/г) находили методом БЭТ по тепловой десорбции аргона.
Каталитическую активность в реакции окисления метана определяли для фракции катализатора 0.25–0.5 мм при температурах 350–600°С в установке проточного типа, оборудованной хроматографом ЦВЕТ-500 (Россия), оснащенным капиллярами с Porapack Q (диаметром 3 мм и длиной 3 м) и СаХ (диаметром 3 мм и длиной 2 м) и детектором по теплопроводности для анализа газов (газ-носитель – гелий). Перед каждым измерением образец выдерживали в реакционной смеси (0.9% СН4 + + 9% О2 + 90.1% N2, расход – 2.4 л/ч, время контакта – 1.5 с) в течение ~30 мин, после чего определяли конверсию метана как среднее трех измерений, различающихся не более чем на 10%. Продуктами окисления метана были только углекислый газ и вода. Скорость реакции (w, ${\text{молеку}}{{{\text{л}}}_{{{\text{С}}{{{\text{Н}}}_{4}}}}}$ м–2 с–1) рассчитывали в предположении ее протекания в режиме идеального вытеснения, пользуясь формулой:
где k – константа скорости реакции (м–2 с–1), k = = –ln(1 – ${{X}_{{{\text{C}}{{{\text{H}}}_{{\text{4}}}}}}}$)/τ Sудm (XCH4 – доля превращенного метана; τ − время контакта (с); m – масса навески (г); Sуд − удельная поверхность образца (м2/г)), а С0 – начальная концентрация метана (%). После испытаний при Т = 300–600°С с шагом 50°С образец охлаждали в токе реакционной смеси до 500°С и еще раз определяли его активность при этой температуре.Каталитическую активность в реакции окисления СО изучали в проточно-циркуляционной установке в условиях отсутствия внешнедиффузионнго торможения, а использование фракции катализатора 0.25−0.5 мкм предотвращало внутридиффузионное торможение реакции. В кварцевый трубчатый реактор диаметром 15 мм загружали смесь 1 г катализатора и 1 см3 кварца. Скорость подачи реакционной смеси 1% СО + 1% О2 (остальное N2) составляла 10 л/ч, скорость циркуляции − 1000 л/ч. Перед проведением опыта образец сначала прогревали в токе искусственного воздуха состава 20% О2 + 80% N2 (5 л/ч) при 400°С в течение 1 ч, а затем охлаждали. Перед каждым измерением катализатор выдерживали в реакционной смеси при заданной температуре в течение 30 мин. Константу скорости K (м–2 с–1) определяли в предположении протекания реакции в режиме идеального перемешивания по формуле:
После испытаний при Т = 300–500°С с шагом 50°С образец охлаждали в токе реакционной смеси до 350°С и повторно определяли его активность при этой температуре. Тот факт, что активность не изменялась, свидетельствует о быстром достижении катализатором стационарного состояния в условиях реакционной среды.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Данные рентгеновского анализа
На рис. 1 приведены рентгенограммы приготовленных образцов. По результатам рентгеновского анализа все образцы серии LaMn1 –xFexO3 являются однофазными твердыми растворами со структурой перовскита. Параметры элементарных ячеек оксидов представлены в табл. 1.
Рис. 1.
Рентгенограммы перовскитов LaMn1 – xFexO3 до каталитических испытаний. Значения х указаны рядом с ренгенограммами.
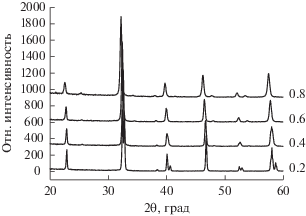
Таблица 1.
Данные рентгеновского анализа для приготовленных оксидов перовскитов
| Образец | Sуд, м2/г | Пространственная группа | Параметры элементарной ячейки | Объем элементарной ячейки V/Z (Å3) | Размер ОКР D, Å | Микроискажения Δd/d |
|---|---|---|---|---|---|---|
| LaMnO3 | 3.2 | Pnmb | а = 5.491(8) b =7.774(4) c = 5.489(9) |
58.58 | 660 | 3.9 × 10–4 |
| LaMn0.8Fe0.2O3 | 4.3 | R-3c | а = b = 5.514(1) c = 13.310(1) |
58.41 | – | – |
| LaMn0.6Fe0.4O3 | 6.0 | R-3c | а = b = 5.521(1) c = 13.352(4) |
58.74 | – | – |
| Pnma | а = 5.486(1) b = 7.769(1) c = 5.524(1) |
58.86 | 950 | 1.8 × 10–4 | ||
| LaMn0.4Fe0.6O3 | 8.4 | Pnma | а = 5.512(1) b = 7.805(1) c = 5.536(1) |
59.54 | 920 | 7.4 × 10–4 |
| LaMn0.2Fe0.8O3 | 10.0 | Pnma | а = 5.543(1) b = 7.832(1) c = 5.556(1) |
60.30 | 750 | 1.1 × 10–3 |
| LaFeO3 | 6.1 | Pnma | а = 5.563(1) b = 7.860(1) c = 5.560(1) |
60.78 | 900 | 1 × 10–3 |
Полученные данные (табл. 1) свидетельствуют о формировании хорошо окристаллизованных оксидов перовскитов с размером ОКР ~66−95 нм и об увеличении объема элементарной ячейки оксидов при повышении содержания железа, что согласуется с данными работы [11]. Принимая во внимание близость ионных радиусов катионов Fe+3 и Mn+3, можно сделать предположение о том, что отмеченный рост параметра решетки обусловлен возрастанием количества кислородных вакансий в структуре перовскитов при увеличении содержания железа. Возможно, что восстановительные условия, реализующиеся во время приготовления оксидов методом Pechini, способствуют формированию в оксидах вакансий по кислороду. Наблюдаемые структурные отличия способны оказывать влияние на каталитические свойства, определяемые прочностью связи кислорода, оксидов-перовскитов в реакциях окисления, следствием чего могут быть различающиеся ряды активности таких оксидов в вышеуказанных реакциях.
Важно также отметить наличие морфотропного фазового перехода из ромбоэдрической модификации в орторомбическую при х ≈ 0.4, обусловленного увеличением содержания в оксидах катионов железа. Образцы с х < 0.4 являются ромбоэдрическими перовскитами, а образцы с х > 0.4 – орторомбическими. Для образца со степенью замещения х = 0.4 – LaMn0.6Fe0.4O3 – характерно сосуществование двух фаз со структурой перовскита (и орторомбической, и ромбоэдрической). Из анализа микроискажений (табл. 1) видно, что их количество в структуре оксидов возрастает с повышением содержания катионов Fe, по-видимому, вследствие увеличения количества кислородных вакансий в объеме оксида.
После каталитических испытаний в реакции окисления метана фазовый состав образцов остается прежним (рис. 2). Наблюдаемое изменение структурной модификации манганита лантана и рост объема элементарной ячейки могут быть обусловлены снижением содержания в образце избыточного кислорода [15]. Для образца LaMn0.6Fe0.4O3 сохраняется наличие двух модификаций (орторомбической и ромбоэдрической). Отмечаются незначительные изменения размеров областей когерентного рассеяния (ОКР), уменьшение объемов элементарной ячейки и, напротив, возрастание количества микроискажений в структуре железосодержащих перовскитов после испытаний (табл. 2). Сокращение объемов элементарной ячейки и увеличение микроискажений может быть обусловлено сокращением количества кислородных вакансий в структуре этих оксидов.
Рис. 2.
Рентгенограммы перовскитов LaMn1 – xFexO3 после участия в реакции окисления CH4. Значения х указаны рядом с ренгенограммами.
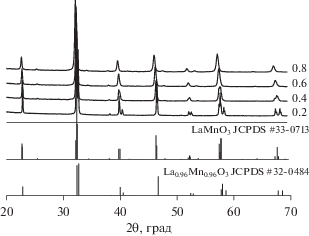
Таблица 2.
Данные рентгеновского анализа для образцов серии LaMn1 –xFexO3 после каталитических испытаний в реакции окисления метана
| Образец | Пространственная группа | Параметры элементарной ячейки | Объем элементарной ячейки V/Z, Å3 | Размер ОКР D, Å | Микроискажения Δd/d |
|---|---|---|---|---|---|
| LaMnO3 | R-3c/2 | а = b = 5.526(3) c = 13.324(8) |
58.73 | 660 | 4.5 × 10–4 |
| LaMn0.8Fe0.2O3 | R-3c | а = b = 5.513(1) c = 13.307(1) |
58.37 | >1000 | – |
| LaMn0.6Fe0.4O3 | R-3c | а = b = 5.517(1) c = 13.310(2) |
58.47 | – | – |
| Pnma | а = 5.486(1) b = 7.771(1) c = 5.525(1) |
58.88 | 860 | 5.9 × 10–4 | |
| LaMn0.4Fe0.6O3 | Pnma | а = 5.502(1) b = 7.812(1) c = 5.530(1) |
59.42 | 920 | 1.1 × 10–3 |
| LaMn0.2Fe0.8O3 | Pnma | а = 5.540(1) b = 7.829(1) c = 5.554(1) |
60.22 | 650 | 1.1 × 10–3 |
| LaFeO3 | Pnma | а = 5.555(2) b = 7.852(2) c = 5.549(1) |
60.51 | 1000 | 2 × 10–3 |
Данные электронной микроскопии
Данные ПЭМВР (рис. 3) также подтверждают, что образцы представляют собой однофазные твердые растворы со структурой перовскита. Особенностью этой серии образцов является наличие пор на поверхности, сформировавшихся в ходе удаления функциональных групп с поверхности материала. Частицы перовскита размером от 100 нм до 1 мкм имеют округло-пластинчатую форму и образуют дендритоподобные агломераты размером порядка нескольких микрон.
Рис. 3.
Снимки ПЭМВР частиц перовскита LaMn0.6Fe0.4O3 и LaMn0.8Fe0.2O3, иллюстрирующие наличие микропор (а) и кристаллическую решетку (б) оксида.

После каталитических испытаний в реакции окисления метана образцы также состоят из дендритоподобных агломератов пластинчато-округлых частиц с размерами от 100 нм до 1 мкм. На поверхности этих хорошо окристаллизованных частиц фиксируются поры с широким диапазоном размеров (от 1 до 100 нм), а также аморфный углерод (рис. 4). На некоторых частицах зафиксировано наличие локальных упорядочений (рис. 5): наблюдается удвоении периода элементарной ячейки в направлениях плоскостей (100) и (101), по-видимому, возникающих в результате локального упорядочения катионов Fe и Mn (рис. 5). Локальные упорядочения имеют размеры порядка 10 нм. Возможно, их формирование связано с перераспределением/упорядочением катионов Mn, приводящим к увеличению микроискажений в структуре оксида, прежде всего на поверхности перовскита, поскольку на рентгенограммах не зафиксированы соответствующие рефлексы. Других видимых изменений структуры и наличия примесей, кроме вышеописанных, методом ПЭМВР не зафиксировано.
Рис. 4.
Снимки ПЭМВР: морфология (а) и микроструктура (б) образца LaMn0.4Fe0.6O3 после реакции окисления метана.

Рис. 5.
Снимки ПЭМВР микроструктуры образца LaMn0.2Fe0.8O3 (а, б) и Фурье-обработка изображения 2а (в), иллюстрирующая наличие удвоения периода в направлениях плоскостей (100) и (101).

Таким образом, можно заключить, что структура оксидов стабильна в условиях реакционной среды процесса окисления метана. Наблюдается уменьшение количества вакансий в железосодержащих перовскитах и увеличение микроискажений. На поверхности появляются локальные области с упорядоченной структурой, а также углерод.
Данные РФЭС
Методом РФЭС был исследован состав поверхности серии образцов LaMn1 –xFexO3. Относительные концентрации (атомные соотношения) элементов в приповерхностном слое катализаторов, определенные на основании данных РФЭС, представлены в табл. 3. Значения энергий связи Mn2p3/2, Fe2p3/2, La3d5/2 и O1s приведены в табл. 4.
Таблица 3.
Атомные отношения элементов в приповерхностном слое оксидов LaMn1 –xFexO3: расчетные и по данным XPS
| х | [Fe]/[La] | [Mn]/[La] | [Fe]/[Mn] | [O]/[La] | [C]/[La] | [Fe + Mn]/[La] | |||
|---|---|---|---|---|---|---|---|---|---|
| расчет | XPS | расчет | XPS | расчет | XPS | ||||
| 0.2 | 0.2 | 0.06 | 0.8 | 0.51 | 0.25 | 0.13 | 3.11 | 1.53 | 0.57 |
| 0.4 | 0.4 | 0.14 | 0.6 | 0.39 | 0.67 | 0.35 | 2.92 | 1.33 | 0.53 |
| 0.6 | 0.6 | 0.17 | 0.4 | 0.28 | 1.5 | 0.62 | 3.14 | 3.13 | 0.45 |
| 0.8 | 0.8 | 0.23 | 0.2 | 0.15 | 4 | 1.51 | 3.20 | 3.12 | 0.38 |
Таблица 4.
Значения энергий связи Mn2p3/2, Fe2p3/2, La3d5/2 и O1s (эВ)
| х | Mn2p3/2 | Fe2p3/2 | La3d5/2 | O1s |
|---|---|---|---|---|
| 0.2 | 642.29 | 710.95 | 834.26 | 529.51 531.27 533.33 |
| 0.4 | 642.30 | 710.91 | 834.29 | 529.57 531.56 533.62 |
| 0.6 | 642.31 | 710.85 | 834.48 | 529.96 532.15 533.92 |
| 0.8 | 642.35 | 710.79 | 834.37 | 529.85 532.07 533.75 |
Поверхность изученных катализаторов обогащена катионами лантана, поскольку атомные соотношения [Fe]/[La] и [Mn]/[La] в приповерхностном слое ниже их стехиометрических соотношений в объеме оксидов. С возрастанием в образцах доли железа содержание катионов марганца на поверхности монотонно снижается, а катионов железа – повышается, однако, их атомное соотношение [Fe]/[Mn] почти в 2 раза ниже стехиометрического, что свидетельствует об обеднении поверхности замещенных перовскитов катионами железа. Кроме того, с увеличением количества железа в замещенных образцах содержание лантана на поверхности растет, поскольку отношение [Fe + Mn]/[La] уменьшается. Можно отметить также заметное повышение количества углерода на поверхности образцов состава х = 0.6 и х = 0.8, что может указывать на большее содержание остаточного углерода в перовскитах с высокой долей железа.
По данным РФЭС в исследованных катализаторах лантан находится в состоянии La3+ в составе перовскита и, частично, в составе карбоната лантана La2(CO3)3. Катионы железа присутствуют в состоянии Fe3+ в октаэдрическом кислородном окружении, а катионы марганца – в состоянии Mn3+. Поскольку значения энергии связи для катионов Mn3+ и Mn4+ близки, нельзя исключить наличие на поверхности катионов марганца в состоянии Mn4+.
Таким образом, замещение катионов марганца на железо приводит к обеднению поверхности замещенных оксидов LaMn1 –xFexO3 катионами 3d, более выраженному для катионов железа, и обогащению поверхности катионами лантана, вероятно, в виде La2(CO3)3.
Удельная поверхность образцов
Как следует из данных, представленных в табл. 1, наименьшей удельной поверхностью (3.2 м2/г) характеризуется незамещенный образец манганита лантана. Замещение катионов марганца на железо в структуре перовскита способствует увеличению Sуд до 10 м2/г. Феррит лантана имеет поверхность 6.1 м2/г. Таким образом, все замещенные образцы имеют удельную поверхность более высокую, чем незамещенные.
Каталитическая активность в реакции окисления СО
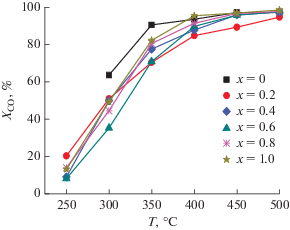
На рис. 6 представлены зависимости конверсии СО от температуры для изученных катализаторов, а на рис. 7 – зависимости константы скорости от состава образцов при различных температурах испытаний. Конверсия СО и константы скорости реакции его окисления закономерно увеличиваются с повышением температуры испытаний. Константы скорости для крайних членов ряда выше, чем для промежуточных. Это свидетельствует о том, что все замещенные перовскиты характеризуются меньшей активностью (рис. 7), чем незамещенные LaMnO3 и LaFeO3.
Каталитическая активность в реакции окисления метана
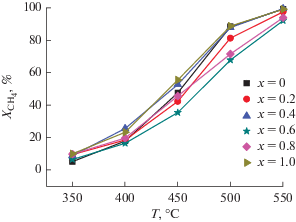
На рис. 8 показаны зависимости степени конверсии метана от температуры для образцов серии LaMn1 –xFexO3. С повышением температуры испытаний конверсия увеличивается, и для всех образцов уже при 600°С достигается полное превращение метана. Продуктами окисления являются только СО2 и H2O.
Рис. 7.
Зависимость константы скорости окисления СО от состава образцов LaMn1 – xFexO3 при температурах 300–500°С.
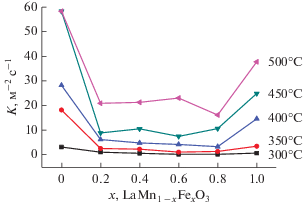
Самой высокой активностью при всех температурах испытаний обладают незамещенный феррит лантана (x = 1), а также замещенный манганит лантана с х = 0.4. Полученные данные свидетельствуют о том, что конверсия не является простой функцией от степени замещения, а также от величины удельной поверхности образцов. Так, образец со степенью замещения х = 0.8 с наибольшей удельной поверхностью не является самым активным.
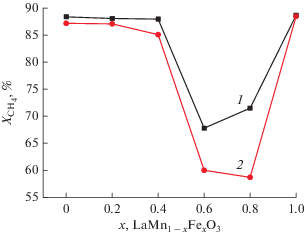
На рис. 9 представлены зависимости скорости реакции окисления метана от температуры для исследуемых образцов. Видно, что скорость этой реакции (активность, нормированная на единицу поверхности), как и в случае реакции окисления СО, для всех замещенных перовскитов ниже, чем для незамещенных. При этом наиболее резкое снижение удельной каталитической активности наблюдается для образцов со степенью замещения х = 0.6 и 0.8. Кроме того, эти образцы характеризуются и наименьшей стабильностью в реакционной среде. На рис. 10 представлены данные по конверсии метана при 500°С, полученные для образцов во время испытаний с подъемом Т от 300 до 600°С (кривая 1) и при повторном измерении их активности после понижения температуры от 600 до 500°С (кривая 2). Результаты говорят о стабильной активности образцов со степенью замещения 0, 0.2 и 1. Активность же образцов с х = 0.6 и 0.8 снижается, что, по-видимому, связано с особенностями поверхностных свойств этих оксидов. Вероятно, наблюдаемое повышенное содержание лантана на поверхности и обеднение ее 3d-катионами является причиной как более низкой активности образцов с высокой степенью замещения, так и их дезактивации из-за склонности оксида лантана не только образовывать карбонаты, но и зауглероживаться. Не исключено также и возможное влияние на активность образцов формирующихся под действием реакционной среды на поверхности перовскитов структурно-упорядоченных областей, обусловленных упорядочением катионов марганца и железа.
Рис. 9.
Зависимость скорости реакции окисления метана от состава образцов LaMn1 – xFexO3 при температурах 350–550°C. На вставке показано, что при низких температурах зависимость имеет такой же вид, как и при высоких.
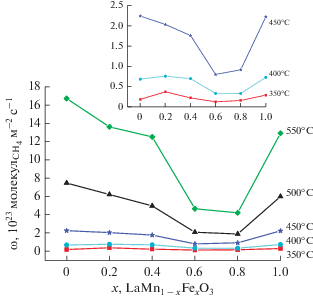
Рис. 10.
Конверсия метана при 500°С в присутствии образцов LaMn1 – xFexO3 во время испытаний с подъемом Т от 300 до 600°С (1) и при повторном измерении их активности после понижения температуры от 600 до 500°С (2).
Полученные данные свидетельствуют о том, что каталитическая активность в реакциях окисления СО и метана, приготовленных методом Pechini, замещенных перовскитов ниже активности незамещенных, несмотря на их более высокую удельную поверхность. Возможно, прежде всего это связано с обогащением поверхности замещенных перовскитов соединениями лантана, способными взаимодействовать с образующимся в реакции CO2 и формировать поверхностные карбонаты, блокирующие поверхность, а также зауглероживаться. Так, для образцов с х = 0.6 и 0.8, продемонстрировавших наименьшую активность и стабильность в процессе окисления метана, отмечается максимальное в серии содержание лантана на поверхности и минимальное – 3d-катионов. Сделанные выводы согласуются с заключением авторов [9], которые объяснили более низкую активность в реакции окисления СО образцов, приготовленных осаждением, обогащением поверхности соединениями лантана. Отличие найденной в настоящей работе зависимости активности катализаторов от их состава в реакции окисления СО от аналогичной зависимости для образцов, синтезированных по цитратной методике в [9], возможно, обусловлено большим количеством органических соединений, используемых в методе Pechini (лимонная кислота и этилпенгликоль в отличие от цитратного метода, в котором этиленгликоль не применяется). Это может приводить к появлению на поверхности карбонатов, блокирующих активные центры поверхности [16].
ЗАКЛЮЧЕНИЕ
Методом Pechini приготовлены образцы перовскитов серии LaMn1 –xFexO3 (х = 0–1) и выполнены исследования их физико-химических свойств, а также каталитической активности в реакциях окисления метана и СО.
Показано, что образцы состава х < 0.4 являются орторомбическими перовскитами, а образцы с х > 0.4 – ромбоэдрическими. В образце со степенью замещения 0.4 присутствуют обе модификации, что свидетельствует о наличии в системе морфотропного фазового перехода в области х = 0.4.
Установлено, что все промежуточные образцы серии в реакциях окисления СО и метана менее активны, чем крайние члены ряда, несмотря на более высокую удельную поверхность. Это может быть связано с обогащением поверхности замещенных перовскитов соединениями лантана. Образцы с х = 0.6 и 0.8 характеризуются наименьшей активностью и стабильностью в каталитическом процессе окисления метана, что, возможно, обусловлено не только высоким содержанием лантана на их поверхности, но также и накоплением углерода в процессе окисления метана. Не исключено, что падению активности способствует и формирование на поверхности этих оксидов локально упорядоченных областей, снижающих концентрацию вакансий.
Список литературы
Yamazoe N., Teraoka J. // Catal. Today. 1990. V. 8. P. 175.
Tejuca L.J., Fierro J.L.G., Tascon J.M.D. // Adv. Catal. 1989. V. 36. P. 237.
Arakava T., Yoshida A., Shiokawa J. // Mat. Res. Bull. 1980. V. 15. P. 269.
Zhong Z., Chen K., Ji Y., Yan Q. // Appl. Catal. A: General. 1997. V. 156. 29.
Поповский В.В. // Кинетика и катализ. 1972. Т. 13. С. 1190. (Popovskii V.V. // Kinetika i kataliz. 1972. V. 13. P. 1190.)
Яковлева И.С., Исупова Л.А., Рогов В.А., Садыков В.А. // Кинетика и катализ. 2008. Т. 49. № 2. С. 274. (Yakovleva I.S., Isupova L.A., Rogov V.A., Sadykov V.A. // Kinet. Catal. 2008. Т. 49. № 2. P. 261.)
Marchetti L., Forni L. // Appl. Catal. B: Environ. 1998. V. 15. P. 179.
Иванов Д.В., Пинаева Л.Г., Садовская Е.М, Исупова Л.А. // Кинетика и катализ. 2011. Т. 52. № 3. С. 410. (Ivanov D.V., Pinaeva L.G., Sadovskaya E.M., Isupova L.A.. // Kinet. Catal. 2011. V. 52. №. 3. Р. 401.)
Zheng S., Hua Q., Gu W., Liu B. // J. Mol. Catal. A: Chem. 2014. V. 391. P. 7.
Tarjomannejad A., Farzi A., Gomez M.J.I., Niaei A., Salari D., Albaladejo-Fuentes V. // Catal. Lett. 2016. V. 146. P. 2330.
Magalhaes F., Moura F.C.C., Ardisson J.D., Lago R.M. // Mater. Res. 2008. V. 11. № 3. P. 307.
Zheng J., Lou J., Zhao Z., Xu J., Jiang G. // Catal. Today. 2012. V. 191. P. 146.
Zhou Z., Pederson L.R., Cai Q., Jang J., Scarfino B.J., Kim M., Yelon W.B., James, W.J., Anderson H.U., Wang C. // J. Appl. Phys. 2006. V. 99. 08M918.
Цыбуля С.В., Черепанова С.В., Соловьева Л.П. // Журн. структ. химии. 1996. Т. 37. № 2. С. 379. (Tsybulya S.V., Cherepanova S.V., Soloviyova L.P. // J. Struct. Chem. 1996. V. 37 № 2. P. 332).
Исупова Л.А., Герасимов Е.Ю., Зайковский В.И., Цыбуля С.В. // Кинетика и катализ. 2011. Т. 52. № 1. С. 106. (Isupova L.A., Gerasimov E.Yu., Zaikovskii V.I., Tsybulya S.V. // Kinet. Catal. 2011. V. 52. № 1. P. 104.)
Белышева Д.Н., Синельщикова О.Ю., Тюрнина Н.Г., Тюрнина З.Г., Свиридов С.И., Тумаркин А.В., Злыгостов М.В., Уголков В.Л. // Физика твердого тела. 2019. Т. 61. Вып. 12. С. 2364.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ