Кинетика и катализ, 2021, T. 62, № 1, стр. 21-28
Реакционная способность пероксильных радикалов по отношению к 5-метил-4-[(пропилсульфанил)метил]-2,4-дигидро-3н-пиразол-3-ону
Л. Р. Якупова a, *, Л. А. Баева a, Р. Л. Сафиуллин a
a Уфимский Институт химии – обособленное структурное подразделение ФГБНУ Уфимского федерального исследовательского центра РАН
450054 Башкортостан, Уфа, просп. Октября, 69, Россия
* E-mail: stargar@inbox.ru
Поступила в редакцию 10.07.2020
После доработки 22.08.2020
Принята к публикации 26.08.2020
Аннотация
Показано, что 5-метил-4-[(пропилсульфанил)метил]-2,4-дигидро-3Н-пиразол-3-он является ингибитором радикально-цепного окисления 1,4-диоксана, этилбензола и метилолеата. Найдено, что на одной молекуле (пропилсульфанилметил)замещенного 2,4-дигидро-3Н-пиразол-3-она гибнет один пероксильный радикал. Константа скорости реакции изученного соединения с пероксильным радикалом зависит от строения последнего и уменьшается в ряду: пероксильный радикал 1,4-диоксана, этилбензола, метилолеата (k7 × 104, л моль–1 с–1, 333 К: 5.7, 4.1, 1.1). Обсуждается причина наблюдаемой зависимости.
ВВЕДЕНИЕ
Производные пиразолона обладают широким спектром биологической активности, включая противовоспалительную [1–3], анальгетическую [1, 2], противотуберкулезную [3–5], противоопухолевую [3], антибактериальную [5], противомикробную, антивирусную [3], антидепрессантную, противосудорожную [1, 3] и фунгицидную [2]. На основе приразол-3(5)-онов получены болеутоляющие и жаропонижающие препараты − антипирин (феназон), пропифеназон, аминофеназон, метамизол (анальгин), седативное средство со снотворным эффектом − дихлоралфеназон, агонист тромбопоэтиновых рецепторов − элтромбопаг, а также эдаравон, проявляющий нейропротекторные свойства [2–4]. В последние годы активно изучаются антиоксидантные свойства замещенных пиразолонов [2, 3, 6–8]. Методом хемилюминесценции показана высокая антирадикальная активность 3-метил- и 4-амино-2,3-диметил-1-фенилпиразол-5-онов при окислении этилбензола кислородом воздуха в гомогенной системе – константа скорости реакции пероксильного радикала этилбензола с этими соединениями лежит в диапазоне (1.8–3.7) × 105 л моль–1 с–1 [8]. В системе инициированного окисления подсолнечного масла в присутствии 1-фенил-3-метилпиразол-5-она измерен стехиометрический коэффициент ингибирования (f = 1.5–1.7) и предположено, что на обрыв цепи влияет кето-енольная таутомеризация ингибитора [9]. В качестве субстрата использовано свежее подсолнечное масло. Следовательно, результат может отражать совместное действие 1-фенил-3-метилпиразол-5-она и эндогенных ингибиторов, присутствующих в продукте. В работе [10] предположено, что один из механизмов лечебного действия эдаравона (3-метил-1-фенил-2-пиразолин-5-она) основан на способности связывать свободные радикалы.
Целью настоящей работы было изучение антиоксидантной активности нового 5-метил-4-[(пропилсульфанил)метил]-2,4-дигидро-3Н-пиразол-3-она, в молекуле которого сочетаются пиразолоновый цикл и алкилсульфанилметильная группа. Известно, что соединения серы способствуют разрушению гидропероксидов [11], поэтому поиск перспективных эффективных антиоксидантов среди соединений с несколькими функциональными группами, способных к комбинированному действию, является актуальным.
Антиоксидантную активность изучали в модельной системе радикально-цепного окисления индивидуальных субстратов, регистрируя кинетику поглощения кислорода манометрическим методом. Такое проведение исследования является одним из наиболее надежных методов количественной оценки антиоксидантной активности [12–14].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
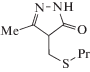
1,4-Диоксан, этилбензол, метилолеат (метиловый эфир олеиновой кислоты), 2,2'-азо-бис(изобутиронитрил) (АИБН) и хлорбензол очищали согласно [15–17]. Критерием чистоты субстрата служил параметр его окисляемости. 5-Метил-4-[(пропилсульфанил)метил]-2,4-дигидро-3Н-пиразол-3-он (3Н-пиразол-3-он) получали методом гетероциклизации этил 2-[(пропилсульфанил)метил]-3-оксобутаноата с помощью гидразина в среде этанола при комнатной температуре [18], он представляет собой белые кристаллы с Тпл. = 140–142°С.
5-Метил-4-[(пропилсульфанил)метил]-2,4-дигидро-3Н-пиразол-3-он (3Н-пиразол-3-он)
Индивидуальность соединения подтверждали методами элементного анализа, ИК- и ЯМР 1H и 13С спектроскопии. Элементный анализ выполнен на CHNS-анализаторе EA 3000 (“HEKAtech”, Германия). ИК-спектр зарегистрирован на спектрометре Prestige-21 (“Shimadzu”, Япония). Спектры ЯМР 13С и 1Н записаны на спектрометре AM-300 (“Bruker”, Германия, 75 и 300 МГц соответственно) в ДМСO-d6 относительно ТМС. Анализ методом газо-жидкостной хроматографии проводили на хроматографе Chrom 5 (Чехия), колонка 2.4 м × 3 мм, неподвижная фаза SE-30 (5%) на хроматоне N-AW-DMCS (0.16–0.20 мм), рабочая температура 50–300°С, детектор пламенно-ионизационный, газ-носитель – гелий. Спектральные характеристики реагента соответствовали данным [18], его чистота по данным газо-жидкостной хроматографии и спектроскопии ЯМР была не менее 95%.
Окисление 1,4-диоксана, этилбензола и метилолеата кислородом воздуха осуществляли по методике, описанной в работах [16, 17, 19]. Кинетические опыты проводили в стеклянном реакторе, в который загружали субстрат (4.9 мл 1,4-диоксана, 2.7 мл этилбензола, 2 мл метилолеата) и раствор инициатора АИБН в хлорбензоле (1 мл – при окислении в 1,4-диоксане, 0.2 мл – в этилбензоле, 0.4 мл – в метилолеате). Объем газовой фазы составлял 25 мл. Реактор термостатировали при температуре 333 К в течение 20 мин, затем микрошприцем вводили 0.1 мл раствора ингибитора в 1,4-диоксане.
Скорость инициирования рассчитывали по уравнению: wi = ki[АИБН] = 2ekр[АИБН]. При расчете использовали следующие значения константы скорости распада АИБН: в 1,4-диоксане lg kр = 15.8 – – 132.9/θ [с–1], θ = 2.303RT × 10–3 кДж/моль [20], 2е = = 1 [21]; в этилбензоле lg kр = 15.4 – 130.5/θ [с–1], θ = 2.303RT × 10–3 кДж/моль, 2е = 1.2 [22]; в метилолеате lg kр = 15 – 127.5/θ [с–1], θ = 2.303RT × × 10–3 кДж/моль, 2е = 0.65 [23].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Константа скорости реакции пероксильных радикалов 1,4-диоксана с 5-метил-4-[(пропилсульфанил)метил]- 2,4-дигидро-3Н-пиразол-3-оном
Жидкофазное ингибированное окисление 1,4-диоксана в условиях нашего эксперимента ([1,4-диоксан] = 9.8 моль/л, wi = 1.0 × 10–7 моль л–1 с–1, 333 К) протекает согласно схеме 1 [19]:
Схема 1 .
Здесь АИБН – инициатор, RH – 1,4-диоксан (окисляемый субстрат), ${\text{RO}}_{2}^{\centerdot }$ – пероксильный радикал, образующийся из 1,4-диоксана, Р6 и Р7 – продукты, неактивные в радикальных реакциях, приводящих к продолжению цепи, InH – 5-метил-4-[(пропилсульфанил)метил]-2,4-дигидро-3Н-пиразол-3-он (ингибитор).
Окисление 1,4-диоксана в присутствии 3Н-пиразол-3-она протекает с индукционным периодом (рис. 1), длительность которого определяли, обрабатывая кинетические кривые интегральным методом по уравнению (1) [24]:
(1)
$\tau = \int\limits_0^\infty {\left( {1 - {{{\left( {\frac{w}{{{{w}_{0}}}}} \right)}}^{2}}} \right)} {\text{d}}t,$Рис. 1.
Типичные кинетические кривые расходования кислорода, полученные при инициированном окислении 1,4-диоксана: без ингибитора (1); в присутствии 3Н-пиразол-3-она в концентрации 0.9 × 10–4 (2) и 3.9 × × 10–4 моль/л (3). Условия реакции: [1,4-диоксан] = = 9.8 моль/л, wi = 1.0 × 10–7 моль л–1 с–1, 333 К.
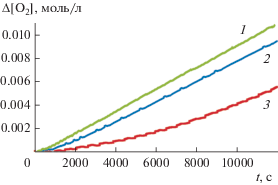
Полученные значения длины индукционного периода приведены в табл. 1.
Таблица 1.
Зависимость скорости окисления 1,4-диоксана и длины индукционного периода от начальной концентрации 3Н-пиразол-3-она*
| [InH] × 10–4, моль/л | w × 10–7, моль л–1 с–1 | τ, с |
|---|---|---|
| 0 | 8.1 | 0 |
| 0.9 | 5.5 | 691 |
| 1.4 | 4.7 | 821 |
| 2.3 | 3.9 | 2181 |
| 3.3 | 3.6 | 2954 |
| 3.9 | 2.7 | 4465 |
| 4.7 | 2.8 | 4784 |
| 4.7 | 2.6 | 5389 |
| 6.7 | 2.0 | 6782 |
| 9.3 | 2.1 | 8474 |
| 14.0 | 1.5 | –** |
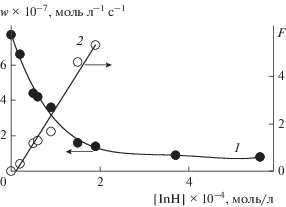
Для количественной оценки эффективности ингибирования изучали зависимость начальной скорости окисления 1,4-диоксана от концентрации 3Н-пиразол-3-она (рис. 2) и обрабатывали ее в координатах уравнения (2) [11]:
(2)
$F = {{w}_{0}}{{\left( w \right)}^{{ - 1}}}--\left( w \right){{\left( {{{w}_{0}}} \right)}^{{ - 1}}} = {\text{ }}f{{k}_{7}}\left[ {{\text{InH}}} \right]{{\left( {2{{k}_{6}}{{w}_{i}}} \right)}^{{ - 0.5}}},$Рис. 2.
Зависимость начальной скорости окисления субстрата от концентрации ингибитора и ее преобразование в координатах уравнения (2). Условия реакции: [1,4-диоксан] = 9.8 моль/л, wi = 1.0 × 10–7 моль л–1 с–1, ингибитор – 3Н-пиразол-3-он, 333 К.
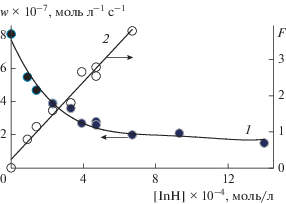
Удовлетворительная линеаризация зависимости параметра F от [InH] (рис. 2) позволяет рассчитать эффективную константу скорости реакции 3Н-пиразол-3-она с пероксильным радикалом 1,4-диоксана. В результате получено: fk7 = (5.4 ± 0.3) × × 104 л моль–1 с–1 (при расчете принимали 2k6 = = 109 × л моль–1 с–1 [19, 25]).
Стехиометрический коэффициент ингибирования (f) рассчитывали, опираясь на значение индукционного периода, из соотношения (3):
(3)
$\tau = {{f\left[ {{\text{InH}}} \right]} \mathord{\left/ {\vphantom {{f\left[ {{\text{InH}}} \right]} {{{w}_{{\text{i}}}}}}} \right. \kern-0em} {{{w}_{{\text{i}}}}}}.$Найдено f = 0.95 ± 0.14.
Константа скорости реакции пероксильного радикала этилбензола с 5-метил- 4-[(пропилсульфанил)метил]-2,4-дигидро- 3Н-пиразол-3-оном
Кинетику ингибированного 3Н-пиразол-3-оном окисления этилбензола изучали при температуре 333 К. Инициирование осуществляли АИБН, скорость инициирования wi = 4.4 × 10–8 моль л–1 с–1, концентрация субстрата составляла 7.4 моль/л. В этих условиях процесс протекает согласно схеме 1 [17].
Окисление этилбензола в присутствии 3Н-пиразол-3-она также протекает с индукционным периодом. Полученные значения индукционного периода приведены в табл. 2. Стехиометрический коэффициент ингибирования (f) определяли, подставляя значение индукционного периода в уравнение (3). Найдено f = 0.93 ± 0.15.
Таблица 2.
Зависимость скорости окисления этилбензола и длины индукционного периода от начальной концентрации 3Н-пиразол-3-она и константа скорости реакции k7*
| [InH] × 10–4, моль/л | w × 10–7, моль л–1 с–1 | τ, с | k7 × 104, л моль–1 с–1 |
|---|---|---|---|
| 0 | 7.7 | 0 | –** |
| 0.2 | 6.6 | 167 | –*** |
| 0.5 | 4.4 | 655 | –*** |
| 0.6 | 4.2 | 1224 | –*** |
| 0.9 | 3.6 | 2500 | 4.5 |
| 1.5 | 1.6 | 3555 | 5.2 |
| 1.9 | 1.4 | 4500 | 5.5 |
| 3.7 | 0.9 | 7986 | 5.3 |
| 5.6 | 0.8 | 10 056 | 3.8 |
Зависимость начальной скорости окисления этилбензола от концентрации 3Н-пиразол-3-она и ее преобразование в координатах уравнения (2) представлены на рис. 3 . Удовлетворительная линеаризация зависимости параметра F от [InH] позволяет рассчитать эффективную константу скорости реакции 3Н-пиразол-3-она с пероксильным радикалом этилбензола. В результате получено fk7 = (3.8 ± 0.3) × 104 л моль–1 с–1 (при расчете принимали 2k6 = 3.8 × 107 л моль–1 с–1 [26].
Рис. 3.
Зависимости начальной скорости окисления этилбензола от концентрации ингибитора и ее преобразование в координатах уравнения (2). Условия реакции: [этилбензол] = 7.4 моль/л, wi = 4.4 × 10–8 моль л–1 с–1, ингибитор – 3Н-пиразол-3-он, 333 К.
Также для определения константы скорости k7 применяли уравнение (4) [11]:
(4)
$\Delta \left[ {{{{\text{O}}}_{2}}} \right] = --{{k}_{2}}{{\left( {{{k}_{7}}} \right)}^{{ - 1}}}\left[ {{\text{RH}}} \right]{\text{ln}}\left( {1--{t \mathord{\left/ {\vphantom {t \tau }} \right. \kern-0em} \tau }} \right),$При использовании уравнения (3) нет необходимости знать точную концентрацию ингибитора. Это важно, так как известно, что некоторые ингибиторы в ходе радикально-цепного окисления могут расходоваться не только по реакции с пероксильными радикалами [27, 28]. Из тангенса угла наклона участка зависимости Δ[O2] от ln(1 – t/τ) находили k7 для опытов, в которых длина цепи в процессе ингибированного окисления составляет не менее 3 звеньев [29, 30]. При вычислении учитывали, что k2 = 2.5 л моль–1 с–1 [26]. В результате получено значение константы скорости взаимодействия пероксильного радикала этилбензола с 3Н-пиразол-3-оном k7 = (4.9 ± 0.6) × 104 л моль–1 с–1 (табл. 1).
Таким образом, реакционная способность пероксильного радикала этилбензола по отношению к 3Н-пиразол-3-ону ниже, чем у пероксильного радикала 1,4-диоксана, при этом на одной молекуле ингибитора гибнет также один пероксильный радикал.
Константа скорости реакции пероксильного радикала метилолеата с 5-метил- 4-[(пропилсульфанил)метил]-2,4-дигидро- 3Н-пиразол-3-оном
Жидкофазное окисление метилолеата проводили при температуре 333 К со скоростью инициирования wi = 6.6 × 10–8 моль л–1 с–1 при концентрации метилолеата 2.4 моль/л. Зависимость начальной скорости окисления метилолета от концентрации 3Н-пиразол-3-она обрабатывали в координатах уравнения (2) (табл. 3, рис. 4 ). В результате найдена эффективная константа скорости реакции пероксильных радикалов метилолеата с исследуемым веществом fk7 = (9.6 ± 1.2) × 103 л моль–1 с–1 (при расчете принимали 2k6 = 106 л моль–1 с–1 [31]. Обработка кинетических кривых в координатах уравнения (4) приводит к значению k7 = (1.1 ± ± 0.2) × 104 л моль–1 с–1 (в данном случае использовано значение константы скорости k2 = = 5.3 л моль–1 с–1 [16]). Стехиометрический коэффициент ингибирования f = (0.94 ± 0.15).
Рис. 4.
Зависимости начальной скорости окисления метилолеата от концентрации ингибитора и ее преобразование в координатах уравнения (2). Условия реакции: [метилолеат] = 2.4 моль/л, wi = = 6.6 × 10–8 моль л–1 с–1, ингибитор – 3Н-пиразол-3-он, 333 К.
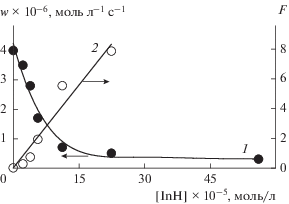
Таблица 3.
Зависимость скорости окисления метилолеата и длины индукционного периода от начальной концентрации 3Н-пиразол-3-она и константа скорости реакции k7*
| [InH] × 10–5, моль/л | w × 10–6, моль л–1 с–1 | τ, с | k7 × 104, л моль–1 с–1 |
|---|---|---|---|
| 0 | 4.0 | 0 | –** |
| 2.2 | 3.5 | 257 | –*** |
| 3.9 | 2.8 | 449 | 1.2 |
| 5.6 | 1.7 | 1100 | 1.4 |
| 11.2 | 0.7 | 1842 | 1.4 |
| 22.4 | 0.5 | 3200 | 1.1 |
| 56.0 | 0.3 | 7660 | 0.8 |
| 78.4 | 0.2 | 9570 | 0.8 |
В табл. 4 представлены эффективные константы скорости (fk7) реакции пероксильных радикалов с 5-метил-4-[(пропилсульфанил)метил]-2,4-дигидро-3Н-пиразол-3-оном, а также константы скорости k7, полученные из соотношения fk7/f, которые согласуются со значениями, найденными при обработке кинетических зависимостей расходования кислорода с применением уравнения (4) (табл. 2 и 3). Это свидетельствует о достоверности полученных данных.
Таблица 4.
Константа скорости реакции k7 взаимодействия 5-метил-4-[(пропилсульфанил)метил]-2,4-дигидро-3Н-пиразол-3-она с пероксильными радикалами и стехиометрический коэффициент ингибирования f (333 К)
| Среда (источник радикала ${\text{RO}}_{2}^{\centerdot }$) | fk7 × 104, л моль–1 с–1 | f | k7 × 104, л моль–1 с–1 |
|---|---|---|---|
| 1,4-Диоксан | 5.4 ± 0.3 | 0.95 ± 0.14 | 5.7 |
| Этилбензол | 3.8 ± 0.3 | 0.93 ± 0.15 | 4.1 |
| Метилолеат | 1.0 ± 0.1 | 0.94 ± 0.15 | 1.1 |
Таким образом, исследуемое соединение является эффективным ингибитором окисления. При этом константа скорости k7 зависит от структуры пероксильного радикала. Наиболее реакционно-способным радикалом по отношению к 3Н-пиразол-3-ону является пероксильный радикал 1,4-диоксана. Это коррелирует с прочностью связи в образующемся гидропероксиде. Энергия связи D(OО–Н) в гидропероксиде 1,4-диоксана составляет 370.0 кДж/моль и больше, чем в гидропероксиде этилбензола – 357.6 кДж/моль [32, 33]. Если предположить, что прочность связи OO–H слабо зависит от количества звеньев –СН2– в молекуле, то энергия связи D(ОO–H) в гидропероксиде метилолеата составляет ~356.6 кДж/моль, как это было показано для соединения (CH3(CH2)2CH=CHCH(OOH)CH2CH3) [32], и близка к значению для D(ОO–H) в гидропероксиде этилбензола. Однако константа скорости реакции пероксильного радикала метилолеата с исследуемым ингибитором в 4 раза ниже таковой для реакции с участием пероксильного радикала этилбензола. Вероятно, данный факт объясняется строением пероксильного радикала метилолеата, способного к формированию внутримолекулярного комплекса [32]. Другой возможной причиной снижения константы скорости реакции может быть образование водородной связи между атомом кислорода эфирной группы метилолеата и атомом водорода –NH- или –ОН-групп ингибитора, вследствие чего снижается активность антиоксиданта [34].
Как правило стехиометрический коэффициент ингибирования составляет f = 2 при условии, что кроме реакции (VII) (схема 1 ) протекает реакция (VIII) [11]:
(VIII)
${\text{RO}}_{2}^{\centerdot } + {\text{I}}{{{\text{n}}}^{\centerdot }} \to {{{\text{Р}}}_{8}}.$Для изученных систем f = ~1. Этот параметр зависит от участия ингибитора в побочных реакциях. Так, для систем радикально-цепного окисления 1,4-диоксана и этилбензола в присутствие производных 5-амино-6-метилурацила параметр f ≤ 1, и наблюдается расходование InH по реакции с пероксильным радикалом самого ингибитора. Поэтому при концентрации ингибитора более 2 × 10–4 моль/л скорость окисления значительно повышается за счет цепного окисления 5-амино-6-метилурацила [17]. В нашем случае при увеличении концентрации 5-метил-4-[(пропилсульфанил)метил]-2,4-дигидро-3Н-пиразол-3-она до 1.4 × 10–3 моль/л скорость окисления находится на предельно низком уровне, стремящемуся к значению wi (рис. 2–4 ). Следовательно, ингибитор в побочных реакциях не расходуется. Стехиометрический коэффициент ингибирования f = 1 свидетельствует о том, что образующийся из ингибитора радикал In• с пероксильным радикалом не реагирует, поэтому реакция ${\text{RO}}_{2}^{\centerdot }$ + In• не протекает. По данным работы [35] отрыв атома водорода от молекулы производного пиразолона увеличивает плоскостность структуры, что максимизирует делокализацию электронной плотности по пиразолоновому кольцу, тем самым повышая стабильность образующегося радикала In•. Это подтверждает наше предположение о неактивности этого радикала. Полученные результаты свидетельствуют о том, что пероксильные радикалы отрывают атом водорода от N–H-связи пиразолона (А), что согласуется с данными работы [35], в которой рассмотрена возможность таутомеризации пиразолона:
ЗАКЛЮЧЕНИЕ
Новый реагент 5-метил-4-[(пропилсульфанил)метил]-2,4-дигидро-3Н-пиразол-3-он является ингибитором окисления 1,4-диоксана, этилбензола и метилолеата. По силе антиоксидантной активности он не уступает ионолу [16]. Стехиометрический коэффициент ингибирования, равный 1, свидетельствует о том, что на молекуле 5-метил-4-[(пропилсульфанил)метил]-2,4-дигидро-3Н-пиразол-3-она гибнет один радикал. Установлено, что реакционная способность пероксильного радикала в изученной реакции снижается в ряду: пероксильный радикал 1,4-диоксана, этилбензола, метилолеата.
Список литературы
Alam Md.J., Alam O., Alam P., Naim M.J. // Int. J. Pharm. Sci. Res. 2015. V. 6. № 12. P. 1433.
Küçükgüzel Ş.G., Şenkardeş S. // Eur. J. Med. Chem. 2015. V. 97. P. 786.
Zhao Z., Dai X., Li C., Wang X., Tian J., Feng Y., Xie J., Ma C., Nie Z., Fan P., Qian M., He X., Wu S., Zhang Y., Zheng X. // Eur. J. Med. Chem. 2019. V. 186. 111 893.
Keri R.S., Chand K., Ramakrishnappa T., Nagaraja B.M. // Arch. Pharm. Chem. Life Sci. 2015. V. 348. № 5. P. 299.
Xu Z., Gao C., Ren Q.-C., Song X.-F., Feng L.-S., Lv Z.-S. // Eur. J. Med. Chem. 2017. V. 139. P. 429.
Ganesh A. // Int. J. Pharm. Bio. Sci. 2013. V. 4. № 2. P. 727.
Silva V.L.M., Elguero J., Silva A.M.S. // Eur. J. Med. Chem. 2018. V. 156. P. 394.
Моренко В.В., Книга О.П., Тихонова Г.А., Игнатьева В.В., Стрельцова Н.Ю. // Хим.-фарм. журн. 2020. Т. 54. № 2. С. 13.
Николаевский А.Н., Филиппенко Т.А., Мирошниченко Т.Н., Бовкуненко О.П. // Изв. вузов. Пищевая технология. 1997. № 2–3. С. 32.
Fujiwara N., Som A.T., Pham L.D., Lee B.J. // Neurosci. Lett. 2016. V. 633. P. 7.
Денисов Е.Т., Азатян В.В. Ингибирование цепных реакций. Черноголовка: Изд-во РАН, 1997. 266 с.
Amorati R., Baschieri A., Valgimigli L. // J. Chem. 2017. V. 2017. P. 1.
Якупова Л.Р., Сахаутдинов И.М., Маликова Р.Н., Сафиуллин Р.Л. // Кинетика и катализ. 2019. Т. 60. № 1. С. 25. (Yakupova L.R., Sakhautdinov I.M., Malikova R.N., Safiullin R.L. // Kinet. Catal. 2019. V. 60. № 1. P. 21.)
Якупова Л.Р., Насибуллина Р.А., Гимадиева А.Р., Сафиуллин Р.Л. // Кинетика и катализ. 2019. Т. 60. № 6. С. 763. (Yakupova L.R., Nasibullina R.A., Gimadieva A.R., Safiullin R.L. // Kinet. Catal. 2019. V. 60. № 6. P. 783.)
Якупова Л.Р., Иванова А.В., Сафиуллин Р.Л., Гимадиева А.Р., Чернышенко Ю.Н., Мустафин А.Г., Абдрахманов И.Б. // Изв. АН. Сер. хим. 2010. № 3. P. 507. (Yakupova L.R., Ivanova A.V., Safiullin R.L., Gimadieva A.R., Chernyshenko Yu.N., Mustafin A.G., Abdrakhmanov I.B. // Russ. Chem. Bull. 2010. V. 59. № 3. P. 517.)
Якупова Л.Р., Сафиуллин Р.Л. // Кинетика и катализ. 2011. Т. 52. № 6. С. 806. (Yakupova L.R., Safiullin R.L. // Kinet. Catal. 2011. V. 52. № 6. P. 785.)
Якупова Л.Р., Сахаутдинова Р.А., Фаттахов А.Х., Гимадиева А.Р., Сафиуллин Р.Л. // Кинетика и катализ. 2013. Т. 54. № 3. С. 291. (Yakupova L.R., Sakhautdinova R.A., Fattakhov A.Kh., Gimadieva A.R., Safiullin R.L. // Kinet. Catal. 2013. Т. 54. № 3. P. 279.)
Баева Л.А., Нугуманов Р.М., Бикташева Л.Ф., Нугуманов Т.Р., Фатыхов А.А. // Журн. орг. химии. 2019. Т. 55. № 4. С. 531. (Baeva L.A., Nugumanov R.M., Biktasheva L.F., Nugumanov T.R., Fatykhov A.A. // Russ. J. Org. Chem. 2019. V. 55. № 4. P. 442.)
Якупова Л.Р., Хайруллина В.Р., Герчиков А.Я., Сафиуллин Р.Л., Баймуратова Г.Р. // Кинетика и катализ. 2008. Т. 49. № 3. С. 387. (Yakupova L.R., Khairullina V.R., Gerchikov A.Ya., Safiullin R.L., Baimuratova G.R. // Kinet. Catal. 2008. V. 49. № 3. P. 366.)
Moroni A.F. // Makromol. Chem. 1967. V. 105. № 6. P. 43.
Денисов Е.Т. Константы скорости гомолитических жидкофазных реакций. Москва: Наука, 1971. 712 с.
Кулицки З.И., Терман Л.М., Цепалов В.Ф., Шляпинтох В.Я. // Изв. АН СССР. Сер. хим. 1963. № 2. С. 253.
Письменский А.В., Психа Б.Л., Харитонов В.В. // Нефтехимия. 2000. Т. 40. № 2. С. 112.
Loshadkin D., Roginsky V., Pliss E. // Int. J. Chem. Kinet. 2002. V. 34. № 3. P. 162.
Сафиуллин Р.Л., Запольских В.В., Якупова Л.Р., Зарипов Р.Н., Терегулова А.Н. // Хим. физика. 2001. Т. 20. № 5. С. 110. (Safiullin R.L., Zapol’skikh V.V., Yakupova L.R., Zaripov R.N., Teregulova A.N. // Khim. Fiz. 2001. V. 20. № 5. P. 110.)
Цепалов В.Ф., Шляпинтох В.Я. // Кинетика и катализ. 1962. Т. 3. № 6. С. 870.
Якупова Л.Р., Сахаутдинова Р.А., Панкратьев Е.Ю., Сафиуллин Р.Л. // Кинетика и катализ. 2012. Т. 53. № 6. С. 708. (Yakupova L.R., Sakhautdinova R.A., Pankratyev E.Y., Safiullin R.L. // Kinet. Catal. 2012. V. 53. № 6. P. 665.)
Насибуллина Р.А., Якупова Л.Р., Сафиуллин Р.Л. // Кинетика и катализ. 2016. Т. 57. № 6. С. 767. (Nasibullina R.A., Yakupova L.R., Safiullin R.L. // Kinet. Catal. 2016. V. 57. № 6. P. 758.)
Цепалов В.Ф. / Исследование синтетических и природных антиоксидантов in vitro и in vivo: Сб. науч. ст. Москва: Наука, 1992. С. 16.
Якупова Л.Р., Сафиуллин Р.Л. // Кинетика и катализ. 2020. Т. 61. № 6. С. 797. (Yakupova L.R., Safiullin R.L. // Kinet. Catal. 2020. V. 61. № 6. P. 878.)
Howard J.A., Ingold K.U. // Can. J. Chem. 1967. T. 45. № 8. P. 793.
Сахаутдинова Р.А., Гимадиева А.Р., Якупова Р.Л., Борисов И.М., Сафиуллин Р.Л. // Кинетика и катализ. 2015. Т. 56. № 2. С. 139. (Sakhautdinova R.A., Gimadieva A.R., Yakupova L.R., Borisov I.M., Safiullin R.L. // Kinet. Catal. 2015. V. 56. № 2. P. 125.)
Насибуллина Р.А., Якупова Л.Р., Сафиуллин Р.Л. / XXXII Всероссийский симпозиум молодых ученых по химической кинетике: тезисы докладов. Москва: МГУ, 2014. С. 32.
Денисов Е.Т., Александров А.Л., Щередин В.П. // Изв. АН. Сер. хим. 1964. № 9. С. 1583.
Orabi E.A., Orabi M.A.A., Mahross M.H., Abdel-Hakim M. // J. Saudi Chem. Soc. 2018. V. 22. № 6. P. 705.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ