Кинетика и катализ, 2021, T. 62, № 2, стр. 214-223
Высокая каталитическая активность цеолита на основе летучей золы и морской воды для алкилирования фенола
a Department of Industrial Chemistry, Faculty of Natural Sciences, University of Tirana
Tirana, Albania
b Department of Chemistry, Faculty of Natural Sciences, University of Tirana
Tirana, Albania
* E-mail: vanagjyli@yahoo.com
** E-mail: arjan.korpa@fshn.edu.al
Поступила в редакцию 06.05.2020
После доработки 11.08.2020
Принята к публикации 19.09.2020
Аннотация
В качестве катализаторов и материалов с высоким уровнем катионообмена используют цеолиты, поскольку они имеют подходящую структуру, однородный размер пор и высокую емкость катионного обмена. В данной работе цеолиты типа X, синтезированные из летучей золы, исследовали в качестве субстратов для получения катализаторов с улучшенными характеристиками. Чтобы определить возможности применения синтезированных продуктов в катализе полученные цеолиты (с разными значениями площади поверхности по БЭТ) были испытаны как оснóвные катализаторы газофазного алкилирования фенола диэтилкарбонатом в качестве инновационного алкилирующего агента. Результаты показали, что синтезированные цеолиты очень селективны в О-этилировании фенола даже при повышенной температуре. Цеолиты, синтезированные из летучей золы, проявили высокую каталитическую активность. Это экологически безопасные, рентабельные и эффективные катализаторы, пригодные для промышленного применения.
Летучая зола (ЛЗ) – побочный продукт сжигания угля на тепловых электростанциях, оказывает негативное воздействие на окружающую среду, экосистему и здоровье человека [1–5]. Поэтому большие усилия прилагаются для интенсификации утилизации ЛЗ и уменьшения ее негативного воздействия [6, 7]. Сходство химического состава ЛЗ и сырья, используемого для синтеза цеолитов, а также обилие в ней аморфной алюмосиликатной фазы стимулировали исследования цеолитов на основе ЛЗ [8, 9].
Цеолиты могут быть использованы для реакций, катализируемых основаниями, поскольку в них присутствуют щелочные и щелочноземельные элементы внутри структурных полостей [10].
Мы протестировали цеолиты, чтобы оценить их каталитическую эффективность в реакции функционализации фенольных соединений спиртами [11] и органическими карбонатами [12–15]. Наиболее изученным органическим карбонатом является самый легкий член ряда линейных карбонатов – диметилкарбонат (ДМК) [16]. Два цеолита были испытаны в качестве оснóвных катализаторов газофазного алкилирования фенола с использованием диэтилкарбоната (ДЭК) в качестве инновационного алкилирующего агента. Еще один синтетический образец, характеризующийся бóльшим количеством аморфного материала (геополимера) и меньшим содержанием кристаллических фаз, также был протестирован для понимания роли структуры цеолита в каталитической реакции. Он был выбран для изучения реакционной способности диэтилкарбоната как инновационного и более экологичного этилирующего агента для фенола по сравнению с традиционно используемыми алкилйодидом, бромэтаном и диэтилсульфатом.
МЕТОДИКА ЭКСПЕРИМЕНТА
Синтез цеолитов из летучей золы
Летучая зола (тип класса F) была предоставлена компанией “Bau Mineral GmbH Со.” (Германия). Гидроксид натрия (чистота >97.0%, безводные гранулы) и соляная кислота (37% HCl, “ос. ч.”) приобретены у “Sigma-Aldrich”.
Образцы цеолитов синтезировали из кремнеземистой летучей золы путем сплавления и гидротермальной обработки. ЛЗ добавляли к 20 мас. % HCl при соотношении 15 мл кислоты/1 г ЛЗ [17]. Смесь перемешивали при 300 об/мин при 80°C в течение 2 ч. Затем твердое вещество отфильтровывали и многократно промывали неионизированной водой до достижения нейтрального значения pH, после чего его сушили в течение ночи при 90°C в печи. ЛЗ, предварительно обработанную HCl, смешивали с гранулами безводного гидроксида натрия при массовом соотношении NaOH/ЛЗ = 1.25. Смесь ЛЗ с гидроксидом натрия измельчали в шаровой мельнице в течение 20 мин для получения мелкодисперсного однородно измельченного материала. Далее смесь сплавляли при 550°C в течение 1 ч в печи, как описано ранее [18]. Продукт охлаждали, измельчали и растворяли либо в дистиллированной воде, либо в морской (в зависимости от эксперимента) при соотношении твердое вещество/объем жидкости = 1 : 5 (г/мл). Затем проводили кристаллизацию в статических условиях при 60°C в течение 1–72 ч. Полученные твердые вещества отделяли фильтрованием и промывали неионизированной водой до достижения значения pH раствора 10–11. Влажное твердое вещество высушивали в течение ночи при 105°C, затем прокаливали при 550°C в течение 5 ч и использовали, как описано ранее. Таким образом были получены 3 образца: ZA72D – 72-ч кристаллизация и дистиллированная вода, ZA72S – 72-ч кристаллизация и морская вода, ZA24D – 24-ч кристаллизация и дистиллированная вода.
Методы характеризации
Химические характеристики основных химических компонентов и микроэлементов ЛЗ были получены с помощью рентгеновской флуоресценции (XRF) на спектрометре PANalytical AXIOS (“Malvern PANalytical”, Нидерланды). Порошковые рентгенограммы катализаторов и материалов регистрировали с помощью Ni-фильтрованного излучения CuKα (λ = 1.54178 Å) на вертикальном дифрактометре Philips X’ Pert (“Philips”, Нидерланды), оборудованном анализатором амплитуды импульса и вторичным изогнутым монохроматором на кристаллах графита. Анализ фаз, присутствующих на дифрактограммах, выполняли с использованием закона Брэгга для расчета величин d кристаллов и сравнения их с данными, приведенными в литературе и собранными в базе данных ICDD (Международный центр дифракционных данных). Площадь поверхности катализаторов по БЭТ определяли методом абсорбции–десорбции N2 при температуре жидкого N2 на приборе Sorpty 1750 (“Fison Instruments Ltd.”, Великобритания). Обычно для измерения использовали 0.2 г образца. Перед адсорбцией N2 образец дегазировали при 150°C. Сырье и синтетические цеолиты также анализировали при помощи сканирующего электронного микроскопа Zeiss Supra 40VP (“Carl Zeiss”, Германия), оснащенного энергодисперсионным спектрометром (EDS). Использовали также Фурье-ИК-спектрометр Bruker Alpha (“Bruker Optics”, Германия) в диапазоне 400–4000 см–1.
Каталитические испытания
Тесты каталитического алкилирования выполняли путем испарения жидкой смеси ДЭК-фенол с заданным мольным отношением ДЭК к ароматическому веществу. Поток жидкости составлял 0.0077 мл/мин в токе N2 (скорость 28 мл/мин). Жидкую смесь подавали с помощью шприцевого насоса KD Scientific Legacy Syringe-infusion Pump (“KD Scientific”, CША). Обычный состав подаваемого газа был следующим (мол. д.): DEC – 0.044, фенол – 0.011 и азот – 0.945. Общее давление соответствовало атмосферному. Поток газа/пара подавали в трубчатый стеклянный реактор (длиной 450 мм, с внутренним диаметром 19 мм), содержащий 1 см3 катализатора, равный 0.638, 0.616 и 0.628 г соответственно для ZA72D, ZA72S и ZA24D в виде частиц размером 250–595 мкм. Материалы испытывали в диапазоне температур реакции от 300 до 400°C. Время контакта составляло 1 с. Каждый тест проводили с загрузкой свежего катализатора. Частицы катализатора получали прессованием прокаленного порошка в таблетку, которую затем измельчали и просеивали через сита для получения частиц желаемого размера. Во время каталитических экспериментов поток на выходе реактора конденсировали в 25 мл 2-пропанола (степень чистоты для ВЭЖХ) в течение ~50 мин. Продукты, сконденсированные в 2-пропаноле, анализировали на газовом хроматографе. К раствору добавляли 20 мкл октана в качестве внешнего стандарта. Количественный анализ проводили на газовом хроматографе Thermo Focus GC (“Thermo Finnigan”, Италия), оснащенном неполярной капиллярной колонкой (25 м × 320 × 1.05 мкм) Agilent HP-5 (5% фенил–95% метилсилоксан). Температуру инжектора (280°C) поддерживали в режиме разделения (30 : 1), газом-носителем служил азот (1.2 мл/мин в колонке). Объем аликвоты раствора, вводимой для каждого анализа, составлял 0.5 мкл. Температуру печи поддерживали при 50°C в течение 2 мин, а затем ее линейно повышали со скоростью 20°C/мин до 280°C, после чего не меняли в течение 5 мин. Структуру продуктов определяли методом ГХ-МС и, по возможности, путем сравнения с коммерческими образцами. ГХ-масс-спектрометр (электронная ионизация, 70 эВ) представлял собой газовый хроматограф Agilent 6890 (“Agilent”, США), соединенный с масс-спектрометром 5973, оснащенным колонкой (30 м × 250 × 1.05 мкм) HP-5 с фазой 5% фенил–95% метилсилоксан. Газом-носителем служил гелий (1.0 мл/мин). Температуру инжектора (250°C) поддерживали в режиме разделения (50 : 1), начальная температура составляла 50°C (2 мин), скорость линейного нагрева – 20°C/мин, конечная температура – 280°C (5 мин). Коммерчески доступные соединения калибровали в подходящем диапазоне концентраций с использованием октана в качестве внешнего стандарта.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Химический состав ЛЗ и цеолитов определяли методом рентгенофлуоресцентного анализа. Суммарное содержание основных оксидов показало, что испытуемый материал представляет собой ЛЗ F-класса (алюмосиликат) в соответствии с ASTM C618-08 (2008) [19]. При этом для получения цеолита высокой чистоты исходную ЛЗ подвергали предварительной обработке, состоявшей в кислотной промывке для удаления примесей и повышения содержания Si- и Al-композиций [20]. В табл. 1 приведены результаты рентгенофлуоресцентного анализа исходной и обработанной HCl летучей золы.
Таблица 1.
Химический состав исходной и обработанной кислотой ЛЗ (по данным РФА)
| Образец | Химический состав (мас. %) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| SiO2 | Al2O3 | Fe2O3 | CaO | K2O | TiO2 | SO3 | MgO | Na2O | P2O5 | |
| Исходная ЛЗ | 50.96 | 27.45 | 7.02 | 4.22 | 3.34 | 1.74 | 1.52 | 1.28 | 0.92 | 0.77 |
| ЛЗ после обработки НСl | 61.7 | 24.2 | 5.5 | 1.1 | 3.2 | 1.9 | 0.2 | 0.8 | 0.7 | 0.2 |
Таблица 1 показывает, что большая часть примесей (Fe2O3, CaO и др.) при содержании в ЛЗ до 8% может быть удалена обработкой 20%-ной соляной кислотой и содержание SiO2 + Al2O3 соответственно увеличивается до 86%.
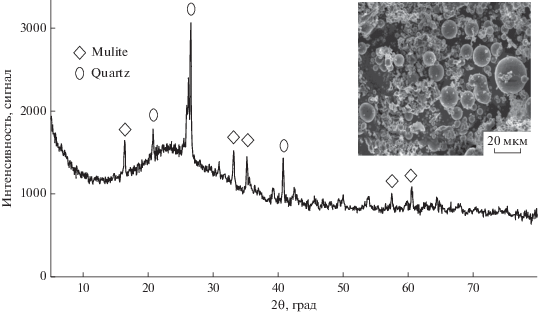
На рис. 1 приведены рентгенограмма и СЭМ-снимок исходного материала, полученный с помощью сканирующей электронной микроскопии. На СЭМ-изображении видна типичная морфология ЛЗ, характеризующаяся сферическими частицами, тогда как профиль рентгенограммы подтверждает присутствие аморфного материала. Основными кристаллическими фазами являются кварц и муллит.
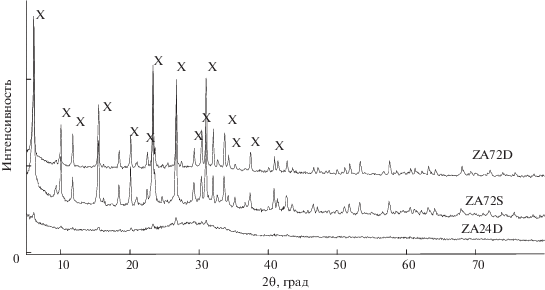
Присутствие цеолита X-типа после синтеза ясно видно на рис. 2. Это подтверждает, что алюмосиликаты, образовавшиеся после предварительного сплавления с NaOH, быстро растворялись как в дистиллированной, так и в морской воде с образованием цеолита во время гидротермального процесса. На рис. 2 показана рентгенограмма образца ZA72D, полученного при следующих условиях эксперимента: предварительно обработанная HCl ЛЗ с последующим предварительным сплавлением при 550°C в течение 1 ч (NaOH/ЛЗ = 1.25), температура кристаллизации – 60°C, время кристаллизации – 72 ч, раствор в дистиллированной воде.
Рис. 2.
Рентгенограммы синтезированных цеолитов из ЛЗ, предварительно обработанной кислотой (NaOH/ЛЗ = 1.25, температура кристаллизации 60°C). ZA72D – 72-ч кристаллизация и дистиллированная вода, ZA72S – 72-ч кристаллизация и морская вода, ZA24D – 24-ч кристаллизация и дистиллированная вода. Х – цеолит Х.
Морскую воду оценили на предмет ее пригодности для синтеза цеолита вместо дистиллированной воды с использованием ЛЗ в качестве сырья; цеолиты синтезировали щелочным сплавлением. В экспериментах морская вода обладала pH 7.75. Результаты анализа ее состава приведены в табл. 2.
Таблица 2.
Средние концентрации различных элементов в морской воде, использовавшейся в экспериментах
| Элементы | Средние концентрации (мг/л) |
|---|---|
| Соленость | 37 |
| Na | 9533 |
| Mg | 1318 |
| Ca | 411 |
| K | 369 |
| Sr | 7.52 |
Образец ZA72S (рис. 2) успешно синтезировали из сплавленной ЛЗ с использованием морской воды в качестве среды для кристаллизации. ZA72S был получен в тех же экспериментальных условиях, что и образец ZA72D, но с использованием морской воды вместо дистиллированной. Эти два образца показали очень похожие результаты. Использование морской воды улучшает синтез цеолита, и его действие проявляется при более низкой температуре инкубации. При этом полученный цеолит X имеет меньшую чистоту и меньшую удельную поверхность, но более высокую каталитическую активность, чем при кристаллизации в дистиллированной воде.
Образец цеолита X ZA24D готовили в тех же экспериментальных условиях, что и образец ZA72D, но время кристаллизации составляло 24 ч, тогда как образец ZA72D был получен после 72-ч кристаллизации.
Рентгенограммы ZA72D и ZA72S обнаружили хорошо окристаллизованный цеолит X-типа, а рентгенограмма ZA24D в основном указывает на наличие аморфных алюмосиликатов, хотя слабые пики цеолита X также присутствуют (рис. 2).
Химический состав цеолитов типа X (ZA72D, ZA72S и ZA24D) приведен в табл. 3. В них преобладают SiO2 и Al2O3, а оксиды металлов (Na2O, Fe2O3 и CaO) присутствуют в меньшем количестве, тогда как другие металлы в виде оксидов K2O, TiO2, сульфата и MgO – лишь в следовых количествах. Согласно литературным данным [21], синтезу этих цеолитов благоприятствовало соотношение SiO2/Al2O3 = 1.7 в исходной ЛЗ (табл. 1).
Таблица 3.
Химический состав цеолитов Х (по данным рентгенофлуоресцентного анализа)
| Химический состав (мас. %) | Цеолиты X | ||
|---|---|---|---|
| ZA72D | ZA72S | ZA24D | |
| SiO2 | 45.8 | 45.2 | 50.6 |
| Al2O3 | 27.0 | 25.4 | 24.3 |
| Fe2O3 | 6.1 | 5.7 | 4.9 |
| CaO | 1.3 | 2.1 | 1.7 |
| K2O | 1.4 | 1.3 | 1.7 |
| TiO2 | 1.9 | 1.5 | 1.3 |
| SO3 | <0.1 | <0.1 | <0.1 |
| MgO | 0.9 | 3.5 | 3 |
| Na2O | 15.2 | 13.9 | 11.7 |
| P2O5 | <0.1 | <0.05 | <0.05 |
| SiO2/Al2O3 (мас. отношение) | 1.7 | 1.8 | 2.1 |
| SiO2/Al2O3 (мол. отношение) | 2.9 | 3.0 | 3.5 |
| Площадь поверхности (м2/г) | 412 | 362 | 74 |
В химическом составе цеолитов обнаружены минимальные различия. Результаты показывают, что элементный состав синтетических цеолитов не представляет серьезной угрозы для окружающей среды и человека.
Типичная октаэдрическая морфология цеолита X-типа видна на СЭМ-изображениях (рис. 3).
Наконец, результаты метода BET показали, что время инкубации и тип используемой воды также влияют на удельную поверхность синтетических продуктов. Значения удельной поверхности (БЭТ), определенные для синтетических образцов ZA72D и ZA72S, составили 412 и 362 м2/г соответственно, тогда как образец ZA24D характеризовался площадью 74 м2/г.
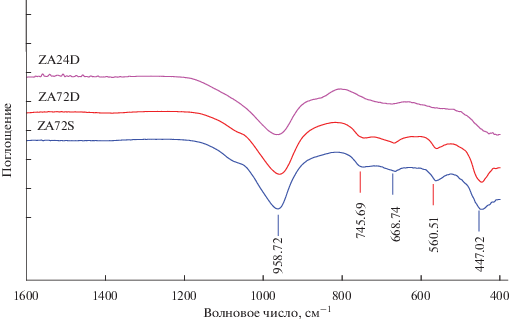
Для дальнейшего подтверждения присутствия цеолита типа X были сняты ИК-спектры синтезированных цеолитов до и после обработки их ацетатом аммония. Приведенные на рис. 4 ИК-спектры обнаружили присутствие цеолита типа X в образцах ZA72S и ZA72D по наличию двух наиболее интенсивных полос при 860–1230 и 420–500 см–1 [22]. Основная полоса при 960 см–1 асимметрична из-за наложения полосы при 1065 см–1. Полученные данные согласуются с данными для цеолита X. Кроме того, наблюдаются три полосы при 746, 669 и 690 см–1, также приписываемые цеолиту типа X. Симметричные, умеренно интенсивные полосы поглощения при 561 и 447 см–1, согласно [22], подтверждают наличие цеолита X. Напротив, интенсивность полосы в ИК-спектре образца ZA24D мала, что указывает на нуклеацию вторичной аморфной фазы, когда начинается рост кристаллов цеолита. ИК-спектры синтезированных цеолитов после обработки их ацетатом аммония полностью подтверждили наличие аморфной фазы.
Выход всех образцов находится в диапазоне 60–75% при чистоте до 90%.
Три образца синтетических цеолитов были испытаны в качестве гетерогенного оснóвного катализатора для газофазного алкилирования фенола диэтилкарбонатом (ДЭК). Для алкилирования обычно нужны небольшие функциональные группы, чтобы уменьшить стерические затруднения и избежать кинетических ограничений. Сообщалось, что алкилирование в оснóвных или нейтральных условиях более эффективно, селективно и протекает в более мягких условиях по сравнению с алкилированием кислотного типа. Твердые основания, такие как цеолиты с обмененными катионами щелочных или щелочноземельных металлов, являются хорошими катализаторами, в частности, для изомеризации соединений, содержащих оснóвный азот или оснóвный кислород, поскольку оснóвные центры не взаимодействуют с оснóвной группой реагирующей молекулы.
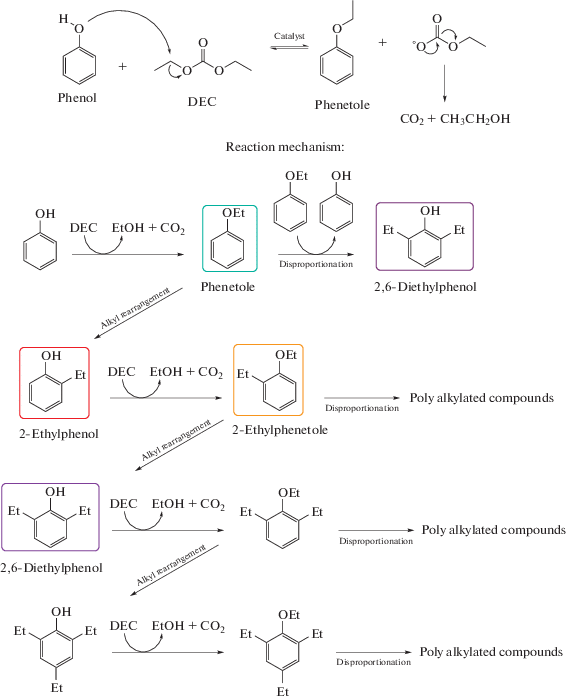
Мы решили исследовать реакционную способность диэтилкарбоната как инновационного и более экологичного алкилирующего агента для фенола по сравнению с традиционно используемыми алкилйодидом, бромэтаном и диэтилсульфатом в присутствии оснóвного катализатора. Отметим, что эта реакция изучена в литературе хуже, чем метилирование различных субстратов с использованием диметилкарбоната.
Важно подчеркнуть, что использование карбонатов в качестве алкилирующих агентов приводит к необратимой реакции из-за образования нестабильного алкоксикарбонатного аниона, который быстро разлагается до CO2 и спирта (метанола и этанола в случае ДМК и ДЭК соответственно), сдвигая реакцию в сторону получения продуктов и способствуя повышению их выходов [23, 24].
Более того, эта реакция имеет высокую специфическую селективность [25]. В случае фенола и фенольных соединений реакция очень специфична для О-алкилирования с образованием анизола (фенилметилового эфира) в присутствии оснóвного катализатора [26–28]. Основной ожидаемый продукт – фенетол (этилфениловый эфир), является важным промежуточным продуктом в синтезе фармацевтических препаратов и ароматизаторов, а также в качестве бустера октанового числа для бензина [29]. С другой стороны, C-алкилированные соединения, такие как моноэтилфенолы, применяются в производстве фенольных смол и лаков (в частности, 2-этилфенол используется в качестве предшественника инден-кумароновых смол и для получения некоторых фармацевтических препаратов [30]). Рентгеноструктурный анализ указал на отсутствие изменений в кристаллической структуре материалов и в интенсивности рефлексов во всех катализаторах после прокаливания при 550°C и таблетирования для проведения каталитических испытаний. Кроме того, их кристаллическая структура и физико-химические свойства остались неизменными и после каталитических реакций.
Синтетические образцы ZA72S и ZA72D показали очень похожие результаты. Интересно, что при низкой температуре 300°С наблюдается почти 100%-ная конверсия фенола с ожидаемой высокой селективностью по фенетолу. Мы обнаружили, что в этих условиях оба катализатора были активны в течение более 5 ч, показав лишь небольшую дезактивацию. При этом выход фенетола снизился до 90% при 400°С.
Однако при повышении температуры выросло количество полиалкилированных соединений, а конверсия фенола неожиданно снизилась. В принципе, это может быть связано с особенностями реакционной способности фенетола: при высоких температурах он разлагается до фенола с образованием реакционноспособных этокси-групп. Эти этокси-группы активнее в алкилировании, чем более доступное орто-положение фенольного кольца (схема 1 ). Действительно, фенол адсорбируется на оксидах и оснóвных гетерогенных системах в виде фенолята, следуя ортогональному способу адсорбции, предложенному Танабе [31]. Из этого следует, что реакция должна быть завершена, как показано на схеме 1 .
Схема 1 . Реакция алкилирования фенола диэтилкарбонатом (ДЭК).
Чтобы понять роль структуры цеолита в реакции, образец ZA24D, характеризующийся большим количеством аморфного материала, также использовали для каталитических испытаний. Полученные результаты показали совершенно иное влияние температуры на реакцию. Оказалось, что аморфный образец дает более низкую конверсию фенола, которая возрастает с повышением температуры реакции. Вероятно, это связано с меньшей площадью поверхности и кристалличностью этого образца по сравнению с лучше окристаллизованными образцами ZA72D и ZA72S.
В то же время было обнаружено сильное снижение конверсии фенола в течение продолжительного времени реакции из-за осаждения более тяжелых побочных продуктов на активных центрах, что происходит уже при 300°C.
Результаты каталитических тестов с кристаллическими образцами ZA72S и коммерческим NaY при 300°C представлены на рис. 5а и 5б соответственно. Промышленный цеолит FAU в Na-форме с большой площадью поверхности (NaY, 660 м2/г) использовали в качестве эталонного катализатора. Следует отметить, что с коммерческим NaY конверсия фенола и выход фенетола были намного ниже, чем с образцами, синтезированными из ЛЗ. Действительно, NaY показал самую низкую селективность по фенетолу также при относительно низкой температуре (300°C). Для получения дополнительных данных кислотность и оснóвность поверхности образцов были охарактеризованы методом NH3- и CO2-температурно-программируемой дисперсии (ТПД). В ZA72S и ZA72D найдена близкая концентрация оснóвных центров (~300 мкмоль CO2/г), что в 4 раза больше, чем в коммерческом NaY. Напротив, концентрация кислотных центров в образцах уменьшается в ряду NaY > ZA72D > ZA72S, но сила этих центров близка (Tмакс десорбции равна ~220°C).
Рис. 5.
Результаты каталитических тестов при различных температурах реакции синтетического цеолита ZA72S (а) и коммерческого образца NaY (б). Условия реакции: мольное отношение ДЭК/фенол = 4, время контакта – 1 с.
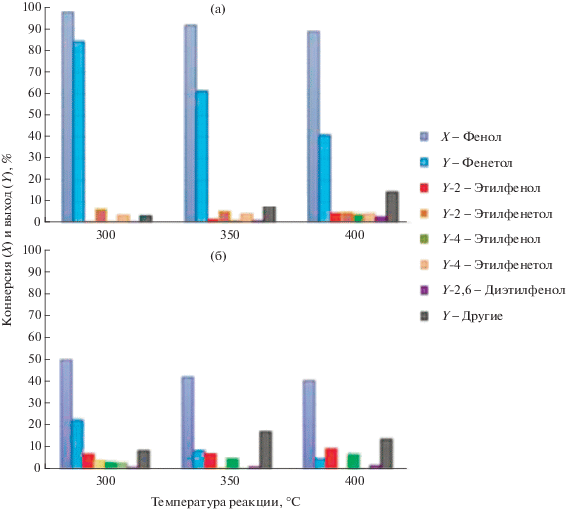
Разложение фенетола и алкильная перегруппировка в ароматическом кольце облегчаются как бóльшим количество кислотных центров, так и более низкой оснóвностью этого коммерческого цеолита NaY по сравнению с синтетическими цеолитами ZA72D и ZA72S.
ЗАКЛЮЧЕНИЕ
Летучую золу кремнеземного типа (побочный продукт сжигания угля на тепловых электростанциях) использовали для синтеза цеолитов. Полученные цеолиты протестировали в газофазном алкилировании фенола с использованием диэтилкарбоната (ДЭК) в качестве инновационного алкилирующего агента. Оказалось, что степень превращения фенола достигает 95% при более чем 85%-ной селективности по фенетолу. Каталитическая активность цеолитов, синтезированных из ЛЗ, оказалась очень высокой. Принимая во внимание низкий мольный избыток алкилирующего агента по сравнению с фенолом (4 : 1), относительно мягкие условия реакции (300°C, атмосферное давление) и стабильность катализаторов, представленные здесь результаты ясно показывают применимость нашего инновационного синтетического цеолита в качестве гетерогенного оснóвного катализатора. Этот метод обеспечивает высокие выходы, он экономичный и экологически чистый, что делает синтетические цеолиты очень эффективной каталитической альтернативой обычным коммерческим катализаторам, используемым в промышленности.
Список литературы
Belviso C. // Prog. Energy Combust. Sci. 2018. V. 65. P. 109.
Korpa A., Xhaxhiu K., Mele A., Spahiu E., Halimi E. // J. Int. Environ. Appl. Sci. 2012. V. 7. № 5. P. 847.
Korpa A., Xhaxhiu K., Mele A., Trettin R. // Albanian Journal of Natural and Technical Sciences. 2012. V. 33. № 2. P. 79.
Korpa A., Kota T., Spahiu E., Trettin R. // Zašt. Mater. 2013. V. 54. P. 334.
Korpa A., Seiti B., Xhaxhiu K., Mele A., Trettin R. // Zašt. Mater. 2014. V. 55. P. 251.
Behin J., Bukhari S.S., Kazemian H., Rohani S. // Fuel. 2016. V. 171. P. 195.
Hosseini Asl S.M., Ghadi A., Sharifzadeh Baei M., Javadian H., Maghsudi, M., Kazemian H. // Fuel. 2018. V. 217. P. 320.
Belviso C., Agostinelli E., Belviso S., Cavalcante F., Pascucci S., Peddis D., Varvaro G., Fiore S. // Micropor. Mesopor. Mater. 2015. V. 202. P. 208.
Querol X., Moreno N., Umaña J.C., Alastuey A., Hernandez E., Lopez-Soler A., Plana F. // Int. J. Coal Geology. 2002. V. 50. P. 413.
Ruen-ngam D., Rungsuk D., Apiratikul R., Pavasant P. // J. Air Waste Manag. Assoc. 2009. V. 59. P. 1140.
Corma A., Fornés V., Martín-Aranda R.M., García H., Primo J. // Appl. Catal. 1990. V. 59. P. 237.
Davis R.J. // J. Catal. 2003. V. 216. P. 396.
Ziosi P., Tabanelli T., Cavani F., Righi P., Fornasari G., Cocchi S. // Catal. Sci. Technol. 2014. V. 4. P. 4386.
Boeva R.S., Markov K.M., Kotov S.V. // React. Kinet. Catal. Lett. 1980. V. 13. P. 323.
Gelbard G. // Ind. Eng. Chem. Res. 2005. V. 44. P. 8468.
Hara Y., Endou K. // Appl. Catal. A. 2003. V. 239. P. 181.
Tundo P., Musolino M., Aricò F. // Green Chem. 2018. V. 20. P. 28.
Hathaway P.E., Davis M.E. // J. Catal. 1989. V. 119. № 2. P. 497.
ASTM C618-08, 2008. Standard Specification for Coal Fly Ash and Raw or Calcined Natural Pozzolan for Use in Concrete. ASTM International, Retrieved 09-18.
Panitchakarn P., Laosiripojana N., Viriya-Umpikul N., Pavasant P. // J. Air Waste Manag. Assoc. 2014. V. 64. P. 586.
Tanaka H., Fujii A. // Adv. Powder Technol. 2009. V. 20. P. 473.
Flanigen E.M. // Pure Appl. Chem. 1980. V. 52. P. 2191.
Tundo P., Rossi L., Loris A. // J. Org. Chem. 2005. V. 70. № 6. P. 2219.
Delledonne D., Rivetti F., Romano U. // J. Organomet. Chem. 1995. V. 488. P. C15.
Tundo P., Selva M. // Acc. Chem. Res. 2002. V. 35. P. 706.
Shieh W.-C., Dell S., Repic O. // Org. Lett. 2001. V. 3. P. 4279.
Ouk S., Thiébaud S., Borredon E., Le Gars P. // Green Chem. 2002. V. 4. P. 431.
Shen Z.L., Jiang X.Z., Mo W.M., Hu B.X., Sun N. // Green Chem. 2005. V. 7. P. 97.
Rajabi F., Saidi M.R. // Synth. Commun. 2004. V. 34. P. 4179.
Fiege H., Voges H.-W., Hamamoto T. Phenol Derivatives, Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2012.
Tanabe K. // Stud. Surf. Sci. Catal. 1985. V. 20. P. 1.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ