Кинетика и катализ, 2021, T. 62, № 2, стр. 233-244
Углеродные нанотрубки, допированные азотом, как эффективные носители гетерогенных катализаторов селективного окисления алкенов
А. Н. Субоч a, *, В. Ю. Евтушок a, Л. С. Кибис a, О. А. Холдеева a, О. Ю. Подъячева a
a ФГБУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
* E-mail: arina@catalysis.ru
Поступила в редакцию 15.06.2020
После доработки 08.10.2020
Принята к публикации 29.10.2020
Аннотация
Получены азотсодержащие углеродные нанотрубки (N-УНТ) с различной степенью допирования азотом. Изучено влияние азота в N-УНТ на гидрофильно-гидрофобные свойства углеродных нанотрубок и их активность в реакции разложения Н2О2. Исследованы различные подходы к модификации поверхности N-УНТ алкильными группами и обнаружена высокая устойчивость N-УНТ к алкилированию. Успешно синтезированы гетерогенные катализаторы на основе полиоксометаллата [PO4{WO(O2)2}4]3– и N-УНТ с малой степенью допирования азотом ≤1.8 ат. %. Показана высокая эффективность катализаторов в реакциях жидкофазного селективного окисления алкенов с использованием H2O2 в качестве “зеленого окислителя” и подтверждена гетерогенная природа катализа.
ВВЕДЕНИЕ
Эпоксиды широко используются как строительные блоки для базового и тонкого органического синтеза благодаря особой реакционной способности оксиранового кольца [1]. Окисление алкенов при помощи различных веществ, содержащих пероксидную группу, является одним из основных путей получения эпоксидов [2]. Большинство синтетических подходов основаны на применении надкислот [2] и алкилгидропероксидов [3] в качестве окислителей. Однако использование водного пероксида водорода как зеленого окислительного агента представляет значительный экономический и экологический интерес [4–6]. При гомолитической активации пероксида водорода происходит образование радикалов, которые направляют реакцию по маршруту аллильного окисления. Вследствие этого селективное эпоксидирование алкенов пероксидом водорода может проводиться только в присутствии катализатора, который будет гетеролитически активировать пероксид водорода [4, 5].
Металл-кислородные кластеры, или полиоксометаллаты (ПОМ), представляют большой интерес как катализаторы окислительных процессов, поскольку они термодинамически устойчивы к окислению, обладают большим разнообразием структур и способны активировать различные окислители [6]. Четырехъядерный фосфорвольфрамат [PO4{WO(O2)2}4]3– (PW4), также известный как комплекс Вентурелло, в течение долгого времени использовался как активный и селективный гомогенный катализатор для эпоксидирования алкенов пероксидом водорода [7, 8]. Однако для эффективного использования этого активного компонента необходима его иммобилизация на поверхности инертного носителя, проявляющего высокую стабильность в условиях агрессивной жидкой реакционной среды.
В настоящее время известно, что углеродные наноматериалы (УНМ) перспективны в конструировании гибридных неорганических композитов для электроники, преобразования энергии и ее хранения, молекулярных сенсоров и катализа [9]. Композиты на основе ПОМ и УНМ активно исследуются в качестве электрокатализаторов для расщепления воды или окислительно-восстановительных реакций в топливных элементах [10–13]. Основными способами иммобилизации ПОМ на поверхности УНМ является обычная адсорбция [12] или пропитка [14], однако используются и более сложные методы, такие как электростатическое связывание через функциональные группы, предварительно введенные на поверхность УНМ [10], или ковалентное связывание через органически-модифицированные ПОМ [13].
Дополнительные возможности иммобилизации активных центров открываются при допировании структуры УНМ атомами азота (N-УНМ). Азот в УНМ встраивается в пиридиноподобные (NPy), пиррольные (NPyr), графитоподобные (NQ) и окисленные (NOx) структурные позиции [15–17]. Морфология УНМ, количество азота и соотношение его форм являются основными факторами, влияющими на функциональные свойства композитов на основе N-УНМ. В многочисленных работах продемонстрировано увеличение каталитической активности катализаторов, нанесенных на азотсодержащие углеродные нановолокна [15, 18, 19], углеродные нанотрубки (N-УНТ) [20, 21], мезопористый углерод [22, 23] и т.д. Недавно нами была показана возможность устойчивой иммобилизации ПОМ на N-УНТ [24]. Согласно полученным данным конверсия и селективность синтезированного катализатора были сравнимы с таковыми для гомогенного катализатора в реакции селективного окисления алкилфенола в соответствующий алкил-п-бензохинон с использованием перекиси водорода в качестве окислителя.
Целью настоящей работы является исследование N-УНТ с различной степенью допирования азотом и получение эффективного гетерогенного катализатора на основе ПОМ и N-УНТ для селективного окисления различных алкенов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Циклооктен (98%) и циклогексен (98%) получены от “Fluka” и пропущены через нейтральный оксид алюминия перед использованием. Ацетонитрил (“Panreac”, класс ВЭЖК) был высушен и хранился в активированных молекулярных ситах 4 Å. Все остальные реагенты и растворители были высшей чистоты и применялись без дальнейшей очистки. Концентрацию H2O2 (примерно 30 вес. % в воде) определяли йодометрически перед использованием.
Синтез ПОМ
Тетрагексиламмониевую соль полиоксовольфрамата ((C7H15)4N)3[PO4{WO(O2)2}4] получали по методике, описанной в работе [25]. Чистота соединения была подтверждена ИК-спектроскопией и 31P ЯМР-спектроскопией.
Синтез УНТ и N-УНТ
Углеродные нанотрубки (УНТ) и азотсодержащие углеродные нанотрубки (N-УНТ) были синтезированы методом каталитического пирролиза этилена или этилен-аммиачной смеси на Fe–Ni–Al2O3-катализаторе при 700°С [26, 27]. Концентрацию аммиака в смеси варьировали от 10 до 60 об. %. Для удаления катализатора из УНТ и N‑УНТ материалы подвергали воздействию концентрированной соляной кислотой в течение 7 дней с последующим кипячением в 2 М HCl в течение 6 ч. Отмывку образцов от ионов хлора проводили многократным кипячением в дистиллированной воде до исчезновения положительной пробы на Cl–. Содержание катализатора уменьшалось до 1–2 вес. %. Микроскопия высокого разрешения показала, что оставшиеся частицы катализатора находились в капсулированном состоянии и, соответственно, отмытые углеродные нанотрубки были инертны в реакции разложении H2O2. Отмытые образцы сушили на воздухе, а затем прокаливали в Ar при 170°С в течение 2 ч. Перед иммобилизацией ПОМ N-УНТ дополнительно высушивали в вакууме при 100°C.
Алкилирование N-УНТ с помощью CH3I
Навеску 200 мг 1.8 ат. % N-УНТ (1.8% N-УНТ) помещали в стеклянный сосуд для высокого давления с закручивающейся пробкой, добавляли 50 мкл CH3I и оставляли при перемешивании на 48 ч при 25°C. Затем температуру поднимали до 50°C и перемешивали еще 8 ч. Углеродные нанотрубки отфильтровали, промывали небольшим количеством эфира и сушили в токе воздуха.
Алкилирование N-УНТ с помощью C4H9Br
Навеску 200 мг 4.8 ат. % N-УНТ (4.8% N-УНТ) помещали в стеклянный сосуд для высокого давления с закручивающейся пробкой, добавляли 3 мл толуола, 1 мл C4H9Br и оставляли при перемешивании на 24 ч при 120°C. Затем образец отфильтровали, промывали небольшим количеством эфира и сушили в токе воздуха.
Алкилирование N-УНТ с помощью C4H9Li
Навеску 200 мг 4.8% N-УНТ помещали в колбу с 5 мл концентрированного раствора KOH в этаноле, затем N-УНТ отфильтровали и промывали этанолом. После быстрой просушки на воздухе образец сушили в вакууме при 100°C и колбу заполняли аргоном. В токе аргона при комнатной температуре и перемешивании к N-УНТ добавляли 3 мл гексана, 400 мкл 2.5 М раствора C4H9Li в гексане и оставляли на 24 ч. Затем в смесь приливали 100 мкл C4H9Br и выдерживали еще 48 ч. Реакционную смесь гасили с помощью этанола, N-УНТ отфильтровали, промывали небольшим количеством эфира и сушили на воздухе.
Иммобилизация ПОМ
Адсорбцию PW4 на УНТ и N-УНТ осуществляли при комнатной температуре из раствора MeCN. Для повышения адсорбционной емкости при адсорбции на N-УНТ добавляли HClO4 (1 экв к PW4), адсорбцию на УНТ проводили без добавления HClO4. Завершение процесса адсорбции контролировали с помощью УФ-видимой спектроскопии. Полученный твердый материал отделяли фильтрованием, трижды промывали MeCN и сушили в вакууме при 60°C.
Разложение H2О2
Углеродный носитель, 10 мг, помещали в стеклянный реактор, содержащий 5 мл MeCN, и затем добавляли 50 мкл 11 М H2O2. Реакционную смесь интенсивно перемешивали при 50°C, и образцы раствора (300 мкл) периодически отбирали шприцем. Концентрацию H2O2 определяли титрованием раствором 0.002 М KMnO4. Начальные скорости разложения H2O2, W0, находили по тангенсу угла наклона исходных участков кинетических кривых.
Каталитическое окисление и анализ продуктов
Каталитические эксперименты проводили в термостатируемых стеклянных сосудах при интенсивном перемешивании (500 об./мин). Типичные условия реакций окисления: 0.1 М алкена, 0.1–0.2 М Н2О2, 10 мг 15 вес. % PW4/N-УНТ, 1 мл MeCN, 50°C. Условия реакции были выбраны на основании результатов проведенных ранее исследований гетерогенных катализаторов на основе PW4 [24, 25]. Реакции начинались при добавлении H2O2. Продукты реакции идентифицировали с помощью газовой хроматографии с масс-спектрометрией (ГХ-МС) и 1H ЯМР и количественно определяли с помощью газового хроматографа с использованием дифенила в качестве внутреннего стандарта.
Физико-химические методы исследования
Анализ реакционной смеси проводили с использованием газового хроматографа Хромос ГХ-1000 (“ХРОМОС Инжиниринг”, Россия), оборудованного пламенно-ионизационным детектором и кварцевой капиллярной колонкой BPX5 (30 м × × 0.25 мм). Спектры ЯМР 31P регистрировали на спектрометре AVANCE-400 (“Brüker”, Германия) при 161.67 МГц. Химический сдвиг для P был определен относительно 85% H3PO4. УФ-видимые спектры регистрировали на спектрофотометре Cary 60 (“Varian”, США). Спектры рентгеновской фотоэлектронной спектроскопии (РФЭС) были получены на фотоэлектронном спектрометре ES-300 (“KRATOS Analytical”, Великобритания) с применением AlKα-излучения (hν = 1486.6 эВ). Калибровку энергетической шкалы спектрометра проводили с использованием спектров внутренних уровней золота Au4f7/2 и меди Cu2p3/2, энергии связи которых принимали равными 84.0 и 932.7 эВ соответственно. Содержание азота в N-УНТ определяли как отношение N/C (ат. %), рассчитанное из интенсивностей соответствующих спектральных линий (N1s, C1s) с учетом поправок на атомные факторы чувствительности каждого элемента. Исследование текстурных характеристик осуществляли методом адсорбции азота при 77 К на анализаторе удельной поверхности ASAP-2400 (“Micrometrics”, США) с предварительной тренировкой образцов в вакууме при 200°C. Влагоемкость углеродных нанотрубок находили стандартным гравиметрическим способом. Для этого к определенной навеске образца добавляли растворитель (воду или ацетон) при перемешивании до влажного состояния и взвешивали полученный образец. Количество добавленной жидкости, отнесенное к массе образца, записывали как значение его влагоемкости.
Термический анализ (ТПО) образцов выполняли с помощью прибора синхронного термического анализа STA 449 С Jupiter (“NETZSCH”, Германия). Образец помещали в корундовый тигель без крышки в воздушной атмосфере. Скорость подачи воздуха в камеру образца составляла 30 мл/мин. В весовой блок подавали гелий со скоростью 20 мл/мин. Образец сначала нагревали со скоростью 2°С/мин от комнатной температуры до 50°С и выдерживали при данной температуре 30 мин, затем проводили программируемый температурный нагрев со скоростью 5°С/мин до 1000°С.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физико-химические свойства N-УНТ
Методом РФЭС было определено содержание азота и доля различных его форм в N-УНТ. Как видно из табл. 1, повышение концентрации аммиака в реакционной смеси от 10 до 60 об. % сопровождается увеличением содержания азота в N-УНТ от 0.8 до 4.8 ат. %. Во всех случаях азот встраивается в стандартные структурные позиции (NPy, NPyr и NQ), при этом с возрастанием степени допирования относительный вклад NQ уменьшается с 40 до 25%.
Таблица 1.
Общее содержание азота в N-УНТ и процентное содержание азота в различном электронном состоянии
| [NH3], об. % | [NОбщ], ат. % | NPy/NОбщ, % | NPyr/NОбщ, % | NQ/NОбщ, % | NOx/NОбщ, % | ${{{{{\text{N}}}_{{{{{\text{N}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{{{{\text{N}}}_{{{{{\text{N}}}_{{\text{2}}}}}}}} {{{{\text{N}}}_{{{\text{Общ}}}}}}}} \right. \kern-0em} {{{{\text{N}}}_{{{\text{Общ}}}}}}}{\text{,}}$ % |
|---|---|---|---|---|---|---|
| 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 10 | 0.8 | 23 | 10 | 40 | 10 | 17 |
| 25 | 1.8 | 16 | 13 | 33 | 11 | 26 |
| 40 | 3.1 | 18 | 10 | 32 | 13 | 27 |
| 60 | 4.8 | 27 | 18 | 25 | 10 | 20 |
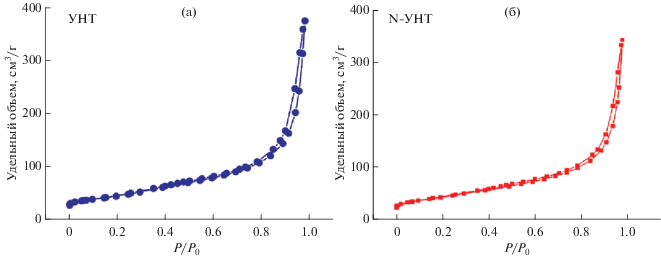
Проведенное исследование текстурных характеристик углеродных нанотрубок показало: N-УНТ, как и УНТ, являются мезопористыми материалами, на что указывает наличие капиллярно-конденсационного гистерезиса на изотермах адсорбции (рис. 1). Для УНТ/N-УНТ величины удельной поверхности, среднего размера пор и объема пор составляют 150–200 м2/г, 12–18 нм и 0.5–0.9 см3/г соответственно.
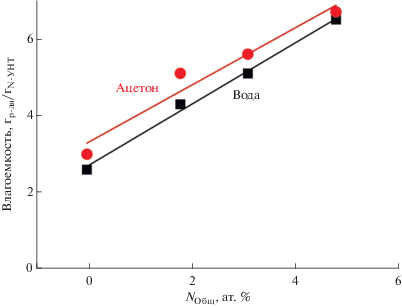
Способность углеродных нанотрубок адсорбировать различные растворители анализировали на основании данных влагоемкости материалов по воде и ацетону. Как видно из рис. 2, влагоемкость N-УНТ как в случае воды, так и в случае ацетона растет с увеличением содержания азота и достигает максимального значения 6 мл/г. Полученные значения влагоемкости значительно превышают величины объема пор углеродных нанотрубок, определенные по адсорбции азота. По всей видимости, азотные центры повышают гидрофильность углеродной поверхности, в результате чего происходит объемное заполнение внутренних каналов трубок [29, 30]. Увеличение влагоемкости с ростом содержания азота в N-УНТ может положительно влиять на количество адсорбированного на поверхности ПОМ.
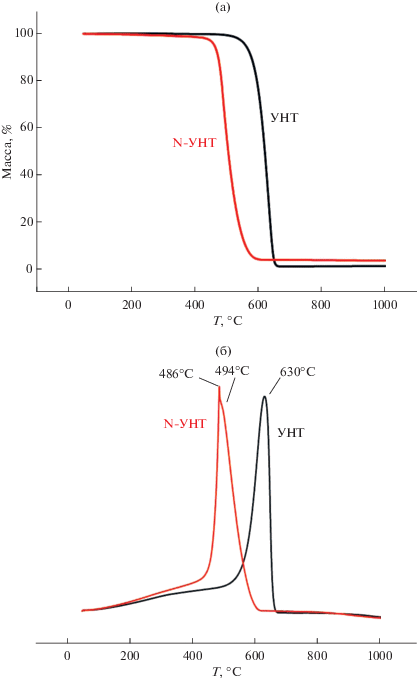
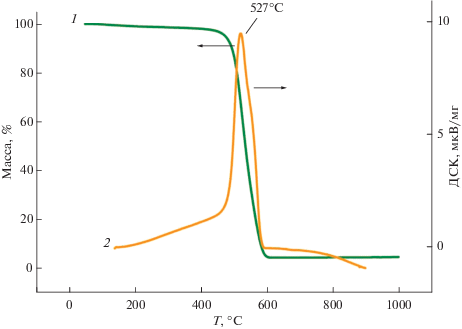
Термический анализ показал, что в УНТ и 4.8% N-УНТ отсутствуют примеси аморфного углерода, поскольку на ДТА-кривых имеется только один максимум в области 500–600°С. Наблюдаемый сдвиг максимума в область низких температур на 140°С (рис. 3) свидетельствует об уменьшении термической устойчивости N-УНТ по сравнению с УНТ вследствие их большей дефектности [27].
В рамках настоящей работы было проведено исследование возможности алкилирования азотсодержащих углеродных нанотрубок различными реагентами. Модифицирование поверхности N-УНТ алкильными группами может привести к увеличению гидрофобности поверхности, а это в свою очередь – повлиять на селективность реакций каталитического эпоксидирования алкенов пероксидом водорода в присутствии катализаторов ПОМ/N-УНТ. Поскольку селективность эпоксидирования для ПОМ/N-УНТ зависит в основном от скорости протекания побочной реакции раскрытия эпоксидного цикла, гидрофобизация поверхности должна уменьшить приповерхностную концентрацию воды и снизить скорость гидролитического раскрытия цикла, повышая таким образом выход эпоксидов. Вышеупомянутую модификацию в случае N-УНТ можно провести с помощью алкилирования N-групп на поверхности N-УНТ с использованием различных алкилирующих агентов, например, CH3I и C4H9Br. Предполагается, что наиболее реакционноспособными в этом процессе будут пиридиноподобные азотные группы за счет их высокой нуклеофильности. Пиррольные группы по аналогии с пирролом также могут быть доступны для алкилирования, но после обработки основанием и депротонирования.
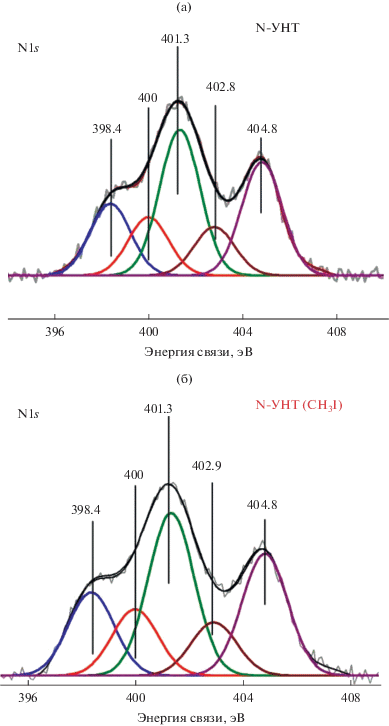
Для модификации поверхности 1.8% N-УНТ метильными группами в качестве метилирующего реагента был выбран метилиодид CH3I, который способен практически количественно метилировать пиридин в мягких условиях, поскольку среди N-групп в N-УНТ имеется примерно 20% пиридиноподобного N (табл. 1). Однако реакция N-УНТ с 2-кратным избытком CH3I не привела к модификации поверхности алкильными группами по данным РФЭС (рис. 4). Интенсивность сигнала от NPy (398.4 эВ) не изменилась после реакции. Кроме того, каждой образующейся пиридиниевой группе N+–Me должен соответствовать противоион I–, который по данным РФЭС обнаружен лишь в следовых количествах (табл. 2).
Таблица 2.
Данные о количественном составе поверхности образца, модифицированного CH3I, и исходного N-УНТ по данным РФЭС
| Образец | Содержание, ат. % | Nат/Сат, % | |||||
|---|---|---|---|---|---|---|---|
| С | О | N | Cl | Fe | I | ||
| N-УНТ-CH3I | 95.5 | 2.4 | 1.8 | 0.1 | 0.1 | 0.1 | 1.9 |
| N-УНТ | 95.6 | 2.4 | 1.8 | 0.1 | 0.1 | 0 | 1.9 |
Следующим этапом была попытка использовать более жесткие условия для алкилирования N-УНТ, но низкая температура кипения CH3I затрудняет проведение процесса при более высоких температурах. Исходя из этого, для модификации поверхности 4.8% N-УНТ был выбран 1-бромбутан C4H9Br [31]. Реакцию алкилирования N-УНТ проводили в смеси толуол/бромбутан с 10-кратным избытком бромбутана по отношению к азоту N-УНТ. Для анализа состояния поверхности применяли метод ТПО, поскольку при нагревании модифицированных бутильными группами N-УНТ должно наблюдаться элиминирование этих групп в диапазоне температур 100–250°С с соответствующей потерей массы ~10%. Однако на термограмме N-УНТ после реакции не наблюдалось ступени потери массы при этих температурах, а также отсутствовал и соответствующий максимум на ДТА-кривой (рис. 5).
Согласно данным ТПО алкилирование пиррольных азотных групп после депротонирования сильным основанием и использование C4H9Li для модификации поверхности N-УНТ за счет нуклеофильного замещения также не привело к ожидаемому результату. Возможно, это связано с доступностью азотных центров для реагента. Таким образом, вне зависимости от использованного подхода N-УНТ показали высокую устойчивость к алкилированию, и требуется дальнейшее проведение исследований по разработке эффективного способа алкилирования N-групп N-УНТ.
Активность катализатора 15 вес. % PW4/N-УНТ
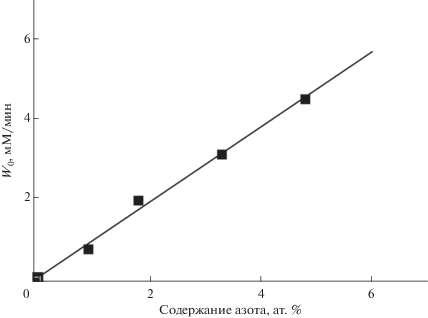
Ранее в работе [24] мы обнаружили, что наиболее эффективным носителем в ряду 1.8% N-УНТ – 4.8% N-УНТ являются азотсодержащие трубки с наименьшим содержанием азота. Было обнаружено, что при увеличении степени допирования азотом возрастает скорость непродуктивной реакции разложения Н2О2. Для подтверждения более высокой эффективности N-УНТ с низким содержанием азота в настоящей работе в качестве носителя для PW4 использовали 0.8% N-УНТ. Как видно из рис. 6, скорость разложения H2O2 падает более чем в 2 раза при уменьшении содержания азота от 1.8 до 0.8%.
Рис. 6.
Влияние содержания азота в N-УНТ на начальную скорость разложения H2O2. Условия реакции: 10 мг УНТ, 0.11 M H2O2, 5 мл CH3CN, 50°C.
Катализаторы PW4/N-УНТ получали адсорбцией PW4 из раствора в MeCN на N-УНТ в соответствии с методикой, описанной ранее [24]. В ходе приготовления образцов 15 вес. % PW4/0.8% N-УНТ и, для сравнения, 15 вес. % PW4/1.8% N-УНТ добавляли 1 экв HClO4. Для получения катализатора 5 вес. % PW4/УНТ добавка кислоты не применялась.
Каталитические характеристики 15 вес. % PW4/ 0.8% N-УНТ исследованы в реакции эпоксидирования различных алкенов 30%-ным водным H2O2 и приведены в сравнении с другими катализаторами в табл. 3. По конверсии и селективности в окислении циклооктена катализатор 15 вес. % PW4/ 0.8% N-УНТ незначительно уступает катализатору 15 вес. % PW4/1.8% N-УНТ (табл. 3, № 1 и № 2), однако благодаря меньшему количеству азота в нем этот образец демонстрирует на 15% более высокую эффективность использования H2O2, что было доказано при определении количества H2O2 в реакционной смеси за одинаковое время реакции. Это подтверждает предположение о том, что N-УНТ с малой степенью допирования являются оптимальными носителями для PW4-катализатора.
Таблица 3.
Окисление различных алкенов пероксидом водорода в присутствии катализаторов PW4/N-УНТ*
| Алкен | № | Катализатор | H2O2, M | Время, ч | Конверсия, % | Селективность по эпоксиду, % |
|---|---|---|---|---|---|---|
 |
1 | 15 вес. % PW4/0.8% N-УНТ | 0.2 | 3 | 90 | 95 |
| 2 | 15 вес. % PW4/1.8% N-УНТ | 0.2 | 2 | 95 | 99 | |
 |
3 | 15 вес. % PW4/0.8% N-УНТ | 0.1 | 4 | 55 | 43 |
| 4 | 5 вес. % PW4/УНТ** | 0.1 | 4 | 66 | 79 | |
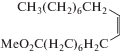 |
5 | 15 вес. % PW4/0.8% N-УНТ | 0.2 | 4 | 80 | 80 |
| 6 | 5 вес. % PW4/УНТ** | 0.1 | 4 | 85 | 85 |
В окислении циклогексена и метилолеата катализатор 15 вес. % PW4/0.8% N-УНТ демонстрирует умеренные селективность (43–80%) и конверсию (55–80%) (табл. 3, № 3 и № 5) и уступает по селективности катализатору без кислоты 5 вес. % PW4/УНТ (табл. 3, № 4 и № 6). Анализ продуктов реакции показал, что меньшая селективность по эпоксиду в окислении циклогексена катализатора 15 вес. % PW4/0.8% N-УНТ связана с образованием большого количества соответствующего диола. Ранее было обнаружено, что для гетерогенных катализаторов PW4/УНТ с увеличением количества кислоты HClO4, используемой при иммобилизации PW4, активность в реакциях эпоксидирования повышается, а селективность в эпоксидировании алкенов, эпоксиды которых чувствительны к кислотно-катализируемому раскрытию эпоксидного цикла, снижается [25].
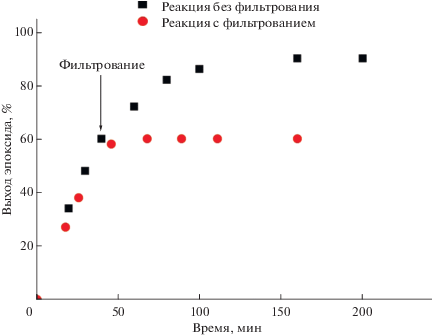
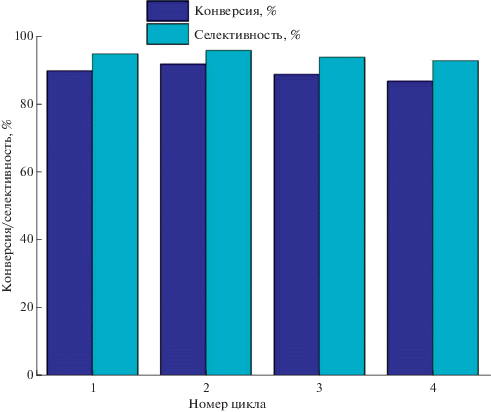
С помощью теста на горячее фильтрование подтверждена гетерогенная природа катализа (рис. 7). Такой вывод сделан на основании наблюдаемой нулевой конверсии субстрата после удаления катализатора из реакционной среды. Прочное закрепление активного компонента на поверхности N-УНТ доказывают эксперименты по циклированию, в которых образец катализатора реактивировали нагреванием в вакууме при 50°С между циклами. При использовании 15 вес. % PW4/0.8% N-УНТ в 4-х циклах реакции эпоксидирования циклооктена не обнаружено значимого падения конверсии (90 отн. 87%) и селективности (95 отн. 93%) (рис. 8). Следует отметить, что полученный мезопористый катализатор 15 вес. % PW4/0.8% N-УНТ способен участвовать в окислении объемных алкенов, таких как циклооктен или циклогексен, в отличие от известного микропористого титан-силикатного катализатора селективного окисления алкенов пероксидом водорода TS-1. Известно, что применение TS-1 без диффузионных затруднений ограничено небольшими алкенами, такими как пропен [32, 33]. Кроме того, в случае мезопористых титан-силикатов существует проблема быстрой деактивации катализатора за 3–4 цикла при использовании водного H2O2 в качестве окислителя, связанная с вымыванием Ti в ходе реакции, потерей иерархической структуры либо с олигомеризацией активных центров [34]. В свою очередь, устойчивый в эпоксидировании алкенов водным H2O2 катализатор Ti-MMM-2 менее активен и селективен в эпоксидировании циклооктена, чем 15 вес. % PW4/0.8% N-УНТ, в сравнимых условиях катализа. Так, в присутствии Ti-MMM-2 за 24 ч реакции конверсия циклооктена достигает лишь 12% при селективности образования эпоксида 65% [35]. Таким образом, приведенное сравнение показывает перспективность использования N-УНТ в качестве эффективного носителя гетерогенного катализатора селективного окисления широкого ряда различных алкенов.
ЗАКЛЮЧЕНИЕ
Синтезированные N-УНТ с различной степенью допирования азотом исследованы в качестве носителя гетерогенного катализатора селективного окисления алкенов. Продемонстрировано, что с ростом содержания азота в N-УНТ повышается сродство в отношении различных растворителей и возрастает скорость непродуктивного разложения Н2О2 в 5 раз. Обнаружена высокая устойчивость N-УНТ к алкилированию, как средству увеличения гидрофобности углеродной поверхности, с применением CH3I, 1-бромбутана C4H9Br и C4H9Li. Установлено, что применение наиболее гидрофобных N-УНТ с малой степенью допирования азотом (≤1.8%) позволяет провести прочную иммобилизацию PW4 на поверхности углеродных нанотрубок. Полученные катализаторы проявляют высокую активность и селективность в реакции эпоксидирования циклооктена и могут быть использованы многократно без значительного снижения характеристик.
Список литературы
Sienel G., Rieth R., Rowbottom K.T. // Ullmann’s Encyclopedia of Industrial Chemistry. 2000. V. 13. P. 139.
Swern D. Organic Peroxides, Vol. II. New York: Wiley-Interscience, 1971. 963 p.
Fine Chemicals through Heterogeneous Catalysis. Eds. Sheldon R.A., van Bekkum H. Wiley−VCH: Weinheim, 2001. 636 p.
Jones C.W. Applications of Hydrogen Peroxide and Derivatives. Cambridge: Royal Society of Chemistry, 1999. 264 p.
Catalytic oxidations with hydrogen peroxide as oxidant. Ed. Strukul G. Springer Science & Business Media, 2013. 286 p.
Hill C.L., Prosser-McCartha C.M. // Coord. Chem. Rev. 1995. V. 143. P. 407.
Venturello C., D’Aloisio R., Bart J.C.J., Ricci M. // J. Mol. Cat. 1985. V. 32. № 1. P. 107.
Паничева Л. П., Метелева Г. П., Берлина О.В., Паничев С. А. // Нефтехимия. 2006. Т. 46. № 6. С. 453.
Eder D. // Chem. Rev. 2010. V. 110. P. 1348.
Toma F.M., Sartorel A., Iurlo M., Carraro M., Parisse P., Maccato C., Rapino S., Gonzalez B.R., Amenitsch H., Da Ros T., Casalis L., Goldoni A., Marcaccio M., Scorrano G., Scoles G., Paolucci F., Prato M., Bonchio M. // Nat. Chem. 2010. V. 2. P. 826.
Guo S.-X., Liu Y., Lee C.-Y., Bond A., Zhang M.J., Geletii Y.V., Hill C.L. // Energy Environ. Sci. 2013. V. 6. P. 2654.
Kawasaki N., Wang H., Nakanishi R., Hamanaka S., Kitaura R., Shinohara H., Yokoyama T., Yoshikawa H., Awaga K. // Angew. Chem. Int. Ed. 2010. V. 50. P. 3471.
Ji Y., Huang L., Hu J., Streb C., Song Y.-F. // Energy Environ. Sci. 2015. V. 8. P. 776.
Wang R., Yu F., Zhang G., Zhao H. // Catal. Today. 2010. V. 150. P. 37.
Podyacheva O.Yu., Ismagilov Z.R. // Catal. Today. 2015. V. 249. P. 12.
Arrigo R., Schuster M.E., Xie Z., Yi Y., Wowsnick G., Sun L.L., Hermann K.E., Friedrich M., Kast P., Hävecker M., Knop-Gericke A., Schlögl R. // ACS Catal. 2015. V. 5. P. 2740.
Inagaki M., Toyoda M., Soneda Y., Morishita T. // Carbon. 2018. V. 132. P. 104.
Zacharska M., Podyacheva O.Y., Kibis L.S., Boronin A.I., Senkovskiy, B.V., Gerasimov E.Y., Taran O.P., Ayusheev A.B., Parmon V.N., Leahy J.J., Bulushev D.A. // ChemCatChem. 2015. V. 7. № 18. P. 2910.
Ayusheev A.B., Taran O.P., Seryak I.A., Podyacheva O.Y., Descorme C., Besson M., Kibis L.S., Boronin A.I., Romanenko A.I., Ismagilov Z.R., Parmon V.N. // Appl. Catal. B: Env. 2014. V. 146. P. 177.
Arrigo R., Schuster M.E., Xie Z.L., Yi Y.M., Wowsnick G., Sun L.L., Hermann K.E., Friedrich M., Kast P., Havecker M., Knop-Gericke A., Schlogl R. // ACS Catal. 2015. V. 5. № 5. P. 2740.
Суслова Е.В., Савилов С.В., Егоров А.В., Лунин В.В. // Кинетика и катализ. 2019. Т. 60. № 1. С. 108. (Suslova E.V., Savilov S.V., Egorov A.V., Lunin V.V. Kinet. Catal. 2019. V. 60. P. 87.)
Bulushev D.A., Zacharska M., Shlyakhova E.V., Chuvilin A.L., Guo Y.N., Beloshapkin S., Okotrub A.V., Bulusheva L.G. // ACS Catal. 2016. V. 6. № 2. P. 681.
He L., Weniger F., Neumann H., Beller M. // Angew. Chem. Int. Ed. Engl. 2016. V. 55. № 41. P. 12 582.
Evtushok V.Yu., Suboch A.N., Podyacheva O.Yu., Stonkus O.A., Zaikovskii V.I., Chesalov Yu.A., Kibis L.S., Kholdeeva O.A. // ACS Catal. 2018. V. 8. P. 1297.
Evtushok V.Yu., Ivanchikova I.D., Podyacheva O.Yu., Stonkus O.A., Suboch A.N., Chesalov Y.A., Zalomaeva O.V., Kholdeeva O.A. // Front. Chem. 2019. V. 7. P. 858:1-14.
Suboch A.N., Cherepanova S.V., Kibis L.S., Svintsitskiy D.A., Stonkus O.A., Boronin A.I., Chesnokov V.V., Romanenko A.I., Ismagilov Z.R., Podyacheva O.Yu. // Fullerenes, Nanotubes and Carbon Nanostructures. 2016. V. 24. P. 520.
Podyacheva O.Y., Cherepanova S.V., Romanenko A.I., Kibis L.S., Svintsitskiy D.A., Boronin A.I., Stonkus O.A., Suboch A.N., Puzynin A.V., Ismagilov Z.R. // Carbon. 2017. V. 122. P. 475.
de Correa C.M. // J. Mol. Catal. A: Chem. 2002. V. 185. № 1–2. P. 269.
Chizari K., Janowska I., Houllé M., Florea I., Ersen O., Romero T., Bernhardt P., Ledoux M.J., Pham-Huu C. // Appl. Catal. A: Gen. 2010. V. 380. P. 72.
Kumar K.V., Preuss K., Guo Z.X., Titirici M.M. // J. Phys. Chem. C. 2016. V. 120. P. 18 167.
Xu J., Wu F., Jiang Q., Li Y.-X. // Catal. Sci. Technol. 2015. V. 5. P. 447.
Clerici M. G. // Kinet. Catal. 2015. V. 56. № 4. P. 450.
Есипович А.Л., Белоусов А.С., Канаков Е.А., Миронова В.Ю., Рогожин А.Е., Данов С.М., Воротынцев А.В., Макаров Д.А. // Кинетика и катализ. 2019. Т. 60. № 1. С. 66. (Esipovich A.L., Belousov A.S., Kanakov E.A., Mironova V.Yu., Rogozhin A.E., Danov S.M., Vorotyntsev A.V., Makarov D.A. // Kinet. Catal. 2019. V. 16. P. 62.)
Kholdeeva O. A., Trukhan N. N. // Russ. Chem. Rev. 2006. V. 75. № 5. P. 411.
Bonon A.J., Mandelli D., Kholdeeva O.A., Barmatova M.V., Kozlov Y.N., Shul’pin G.B. // Appl. Cat. A: Gen. 2009. V. 365. № 1. P. 96.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ