Кинетика и катализ, 2021, T. 62, № 3, стр. 354-367
Медьсодержащие катализаторы на основе церий-циркониевых оксидных носителей в реакции превращения этанола по данным ИК-спектроскопии in situ
В. А. Матышак a, О. Н. Сильченкова a, *, А. Н. Ильичев a, В. Н. Корчак a
a ФГБУН Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН
119991 Москва, ул. Косыгина, 4, Россия
* E-mail: son1108@yandex.ru
Поступила в редакцию 15.07.2020
После доработки 20.10.2020
Принята к публикации 29.10.2020
Аннотация
Комплексом физико-химических методов исследованы приготовленные методом Пекини медьсодержащие катализаторы на основе твердых растворов CeO2–ZrO2. Установлено, что определяющий фактор в реакции превращения этанола − это прочность связи кислорода поверхности катализаторов, которая зависит от свойств кластеров нанесенного оксида меди и соотношения CeO2 к ZrO2 в носителе. Основные поверхностные соединения, образующиеся в процессе превращения этанола на катализаторах – этоксигруппы, ацетатные, формиатные комплексы и продукты уплотнения. Ключевой стадией в образовании водорода является разложение формиатного комплекса. Его возникновение на поверхности катализаторов обусловлено конкуренцией за подходящий по свойствам кислород между реакциями образования ацетатных комплексов и формиатов.
ВВЕДЕНИЕ
В настоящее время большое внимание уделяется процессам получения Н2-содержащих газовых смесей из этанола, что связано с разработкой технологии топливных элементов, работающих на водороде. Водородсодержащие газовые смеси, в частности, можно получать путем каталитического разложения, парового и автотермического риформинга этанола [1–4].
Ранее нами [5] с помощью ИК-спектроскопии in situ был изучен процесс превращения этанола на 5%CuO/CeO2. В условиях реакции на поверхности катализатора обнаружены этоксигруппы, ацетатный и формиатный комплексы [5–10] и продукты уплотнения (ПУ). В продуктах реакции зафиксированы ацетальдегид, ацетон, этилен, кротоновый альдегид, бутен, а также водород, CO и CO2. Формирование тяжелых продуктов связано с разложением ПУ. Механизм образования водорода основан на превращении высокотемпературного формиатного поверхностного комплекса.
Аналогичное исследование в присутствии 5%CuО/ZrO2 [11] показало: на поверхности этого катализатора образуются те же поверхностные комплексы, что и на 5%CuO/CeO2, кроме формиатных; в продуктах практически нет водорода и CO. Низкая скорость образования водорода на этом образце связана как раз с отсутствием на поверхности высокотемпературной формы формиатного комплекса. Результаты работ [5, 11] свидетельствуют, что применение катализаторов на основе смешанных церий-циркониевых носителей может быть перспективным. Целью настоящей работы было исследование возможности использовать в реакции превращения этанола положительные качества как CuО/СеO2 – способность к образованию водорода в высокой концентрации, так и CuО/ZrO2 – отсутствие СО в составе продуктов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методом Пекини [12] была приготовлена серия носителей на основе церий-циркониевых оксидных систем следующего состава:
Метод Пекини обеспечивает однородное распределение катионов по нанодоменам и поверхности/объему, что важно для высокой подвижности кислорода и стойкости к зауглероживанию. Поскольку метод Пекини не позволяет получить однофазную систему ZrO2 (образуется смесь тетрагональной и моноклинной фаз), в работе использовали ZrO2 тетрагональной модификации [11]. В этом случае и CeO2, и ZrO2 относятся к одному и тому же классу флюоритоподобных структур.
На носители наносили 5% CuO из водного раствора нитрата меди методом пропитки с последующим высушиванием при 100°С и прокаливанием при 500°С на воздухе в течение 2 ч.
Сравнительное исследование приготовленных катализаторов проводили с учетом данных, полученных для 5%CuO/CeO2 [5] и 5%CuO/ZrO2 [11]. Удельную поверхность носителей и катализаторов измеряли методом БЭТ по тепловой десорбции азота. Рентгенофазовый анализ (РФА) использовали для детального исследования структуры носителей и медьсодержащих катализаторов на их основе.
Для характеристики состояния меди в образцах применяли температурно-программированное восстановление (ТПВ) водородом, ЭПР, ИК-исследование адсорбции молекулы-зонда СО, термодесорбцию СО и СО2, измерение электронных спектров диффузного отражения ЭСДО. Спектры порошковых образцов регистрировали на приборе Hitachi 330 (“Hitachi”, Япония) при комнатной температуре.
Спектрокинетические измерения в условиях реакции превращения этанола проводили по методике, описанной в [13]. В качестве реагентов использовали газовую смесь этанола (7 об. %) в гелии. Экспериментальная установка для ИК-опытов включала ИК-Фурье спектрометр IFS-45 (“Brucker”, Германия), проточную обогреваемую кювету-реактор объемом 1 см3, блок подготовки газов и систему анализа продуктов и реагентов. Образец в виде таблетки массой 20–30 мг и площадью 2 см2 помещали в кювету, которая одновременно служила каталитическим проточным реактором. Перед измерениями образец обрабатывали в потоке инертного газа He при 400°С в течение 1 ч, охлаждали до необходимой температуры и включали поток реакционной смеси (30 мл/мин).
Методика нестационных спектрокинетических исследований заключалась в измерении концентрации поверхностных соединений методом ИК-спектроскопии in situ в процессе установления стационарного режима протекания реакции превращения этанола или при исключении этанола из потока реакционной смеси (изотермическая десорбция).
Интенсивность полос поглощения (п. п.) измеряли в единицах оптического поглощения (А) в разностных спектрах, которые получали вычитанием из спектра образца в потоке реакционной смеси спектра того же образца в потоке инертного газа при той же температуре. Обычное число сканирований – 64, разрешение – 4 см–1.
Изменение веса образца при протекании реакции превращения этанола на катализаторах и носителях изучали в термовесах SETSYS Evolution (“Setaram”, Франция). Свежий образец (навеска 40 мг) предварительно обрабатывали в потоке He + + O2 при температуре 400°С, затем охлаждали до 30°С. Этиловый спирт подавали через барботер, продуваемый потоком Не со скоростью 14 мл/мин. Образец нагревали до 500°С со скоростью 10°C/мин. Продукты на выходе из реактора анализировали с помощью масс-спектрометра OmniStar GSD 301 (“Pfeiffer Vacuum”, Германия).
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
Активная поверхность катализаторов
По данным РФА медьсодержащие катализаторы на основе смешанных оксидов представляют собой твердые растворы кубической структуры, объем ячейки которых линейно уменьшается при переходе от CeO2 к ZrO2 (рис. 1).
Рис. 1.
Зависимость объема ячейки от содержания катионов Zr4+ в твердых растворах Ce1 – xZrxO2 и 5%СuO/Ce1 – xZrxO2.
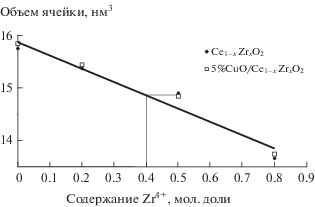
Исключение составляют данные для образца 5%CuO/Ce0.5Zr0.5O2. Величина объема ячейки находится несколько выше линейной зависимости. Причина этого будет обсуждена ниже.
Профиль ТПВ катализаторов водородом характеризуется, как правило, двухпиковой картиной, причем Тмакс пиков проходит через максимум для 5%CuO/Ce0.5Zr0.5O2 [14, 15]. Данные о величине удельной поверхности, размере области когерентного рассеяния (ОКР), положении пиков ТПВ медьсодержащих образцов приведены в табл. 1. Отметим наличие высокотемпературного пика ТПВ (360°С) для образца 5%CuO/ Ce0.5Zr0.5O2.
Таблица 1.
Характеристики медьсодержащих образцов
| Образец | Sуд, м2/г |
Размер ОКР, Å | Тмакс пиков на профилях ТПВ, °С |
|---|---|---|---|
| 5%CuO/CeO2 | 35 | 7.7 | 154; 196 |
| 5%CuO/Ce0.8Zr0.2O2 | 19 | 11.0 | 166; 220 |
| 5%CuO/Ce0.5Zr0.5O2 | 27 | 9.6 | 195; 368 |
| 5%CuO/Ce0..Zr0,8O2 | 42 | 6.4 | 150; 175; 239 |
| 5%CuO/ZrO2 (Т + М) | 53 | 8 | 150; 180; 230 |
По данным ЭПР изолированные ионы Сu2+ в составе катализаторов практически не наблюдаются [16]. В спектрах ЭСДО образца 5%CuO/ZrO2 обнаружены ионы Сu2+ [17] в составе высокодисперсных двумерных кластеров, в которых обменные взаимодействия пренебрежимо малы [18].
При изучении термодесорбции СО и СО2 после адсорбции СО при комнатной температуре оказалось, что суммарное количество десорбированных молекул СО и СО2 с единицы поверхности (м2) практически одинаково для всех медьсодержащих образцов (табл. 2). Полученные экспериментальные данные позволяют оценить количество ионов меди, доступных для адсорбции (эффективный размер кластеров CuO). Видно, что размер кластеров антибатен величине поверхности. Также можно отметить, что температура максимума десорбции и СО, и СО2 возрастает по мере увеличении содержания ZrO2 в составе катализатора.
Таблица 2.
Результаты ТПД СО и СО2 для медьсодержащих образцов
| Образец | Десорбция СО | Десорбция СО2 | N(CO + CO2) × 10–18,молекулa/м2 | N(CuO)/ N(CO + CO2) |
||
|---|---|---|---|---|---|---|
| Tмакс, °C | N(CO) × 10–18, молекулa/м2 | Tмакс, °C | N(CO2) × 10–18, молекулa/м2 | |||
| 5%CuO/CeO2 | 114 | 1.4 | 150 | 2.4 | 3.8 | 2 |
| 5%CuO/Ce0.8Zr0.2O2 | 110 | 1.4 | 160 | 2.4 | 3.8 | 5 |
| 5%CuO/Ce0.5Zr0.5O2 | 82 | 1.6 | 133 | 1.7 | 3.3 | 4 |
| 5%CuO/Ce0.2Zr0.8O2 | 85; 130 | 1.4 | 192 | 2.7 | 4.1 | 2 |
| 5%CuO/ZrO2 | 100; 170 | 1.4 | 230 | 2.2 | 3.6 | 2 |
В ИК-спектрах адсорбированных молекул СО наблюдаются полосы поглощения карбонильных (Cu+–CO) и карбонатных комплексов (рис. 2). В табл. 3 приведены характеристики карбонильных комплексов. Частота п. п. карбонилов для всех катализаторов практически одинакова. Исключение составляет образец CuО/Ce0.5Zr0.5O2 – частота полосы поглощения для него значительно сдвинута в сторону высоких значений. Количество карбонилов на единицу веса в ряду катализаторов при возрастании содержания ZrO2 уменьшается, а температура их десорбции повышается. Полезную информацию об активной фазе дают карбонатные комплексы. Для образцов с большим содержанием СeO2 характерно образование моно- и бидентатных карбонатов с п. п. 1550, 1495 и 1320 см–1, в то время как на образцах с высоким содержанием ZrO2 преобладают мостиковые карбонатные структуры с п. п. 1620, 1345 см–1 (рис. 2). Такие же результаты были получены для СuО/ СeO2 и СuО/ZrO2 [19, 20].
Рис. 2.
ИК-спектры CO, адсорбированного на образцах 5%СuO/Ce0.8Zr0.2O2 при Т = 75°С (спектр 1) и 5%СuO/Ce0.2Zr0.8O2 при Т = 65°С (спектр 2).
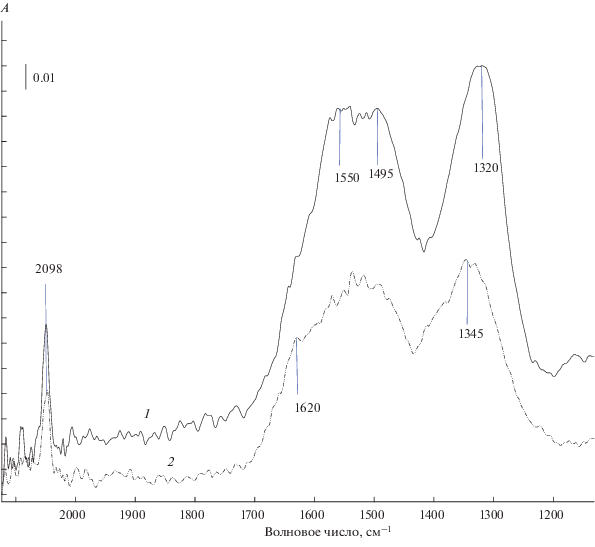
Таблица 3.
Характеристики карбонильных комплексов на медьсодержащих образцах
| Образец | Частота п. п. Cu+−CO | Интенсив-ность п. п. (А) |
Количество молекул CO | Tмакс десорбции СО, °С | |
|---|---|---|---|---|---|
| на 1 г | на 1 м2 | ||||
| Cu/CeO2 | 2102 | 0.5 | 1.1 × 1018 | 3.1 × 1016 | 110 |
| Cu/Ce0.8Zr0.2O2 | 2104 | 0.3 | 1.2 × 1018 | 6.3 × 1016 | 125 |
| Cu/Ce0.5Zr0.5O2 | 2127 | 0.4 | 1.1 × 1018 | 4.1 × 1016 | 100 |
| Cu/Ce0.2Zr0.8O2 | 2101 | 0.2 | 0.4 × 1018 | 0.9 × 1016 | 150 |
| Сu/ZrO2 | 2102 | 0.20 | 0.3 × 1018 | 0.6 × 1016 | 170 |
Отметим, что данные по термодесорбции СО (табл. 2) и полученные методом ИК-спектроскопии количественные показатели десорбции СО (табл. 3) хорошо совпадают. Различия для двух последних образцов ряда связано как раз с существованием на них мостиковых карбонатов, образующихся уже при комнатной температуре и разрушающихся при Т < 100°С с выделением СО в газовую фазу [19, 20]. В профилях ТПД эти два источника СО (карбонилы и мостиковые карбонаты) неразличимы.
Полученный данные свидетельствуют о том, что, изменяя соотношение СeO2 и ZrO2 в носителе, возможно влиять на состояние активной фазы. Более подробно результаты этих исследований приведены в нашей работе [14].
Поверхностные соединения в реакции превращения этанола
Cтационарные измерения. На рис. 3а показаны ИК-спектры, зарегистрированные в процессе превращения этанола на ряде изучаемых катализаторов при 200°С. Для сравнения на рис. 3б представлены аналогичные спектры для носителей. В спектрах присутствуют полосы поглощения колебаний этоксигрупп (1050−1160 см–1), ацетатных (1560, 1440, 1340 и 1026 см–1) и формиатных комплексов (характерный дублет 1370, 1357 см–1) [5, 21–26]. Этоксигруппам принадлежит и п. п. при 1380 см–1 (колебание δs СН2).
Рис. 3.
ИК-спектры этанола при Т = 200°С на носителях Ce1 – xZrxO2 (а) и катализаторах 5%СuO/Ce1 – xZrxO2 (б). Состав носителей: CeO2 (1), Ce0.8Zr0.2O2 (2), Ce0.5Zr0.5O2 (3), Ce0.2Zr0.8O2 (4), ZrO2 (5).
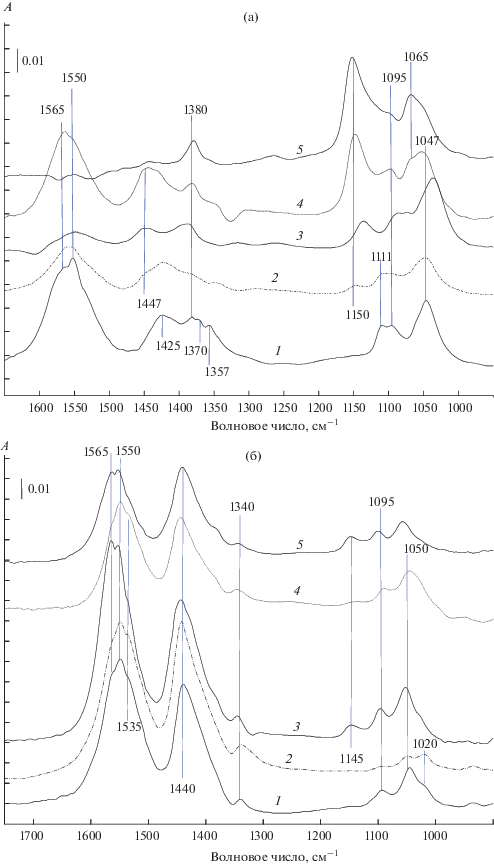
Наблюдающиеся п. п. этоксигрупп относят к колебаниям связи СО в линейных (1150−1095 см–1) и мостиковых (1050−1060 см–1) структурах [21–26].
Сравнение спектров на рис. 3 показывает, что местом локализации этоксигрупп с частотой 1150 см–1 являются ионы циркония, а этоксигруппы с частотой 1110 см–1 расположены на центрах, содержащих ионы церия; остальные находятся на центрах, в состав которых входят и ионы церия, и ионы циркония. Отметим, что частоты п. п. этоксигрупп несколько повышаются с увеличением концентрации ZrO2 в составе образцов, в то время как частоты п. п. ацетатных комплексов практически одинаковы и для катализаторов, и для носителей (табл. 4). Последний факт позволяет утверждать, что этоксигруппы расположены на поверхности, свободной от нанесенного оксида меди.
Таблица 4.
Частоты полос поглощения поверхностных комплексов в ИК-спектрах при температуре 200°С
| Образец | Частота полосы поглощения, см–1 | |||||
|---|---|---|---|---|---|---|
| этоксигруппы | ацетаты | |||||
| CeO2 | 1046 | 1095 | 1110 | Не набл. | 1552 | 1565 |
| Ce0.8Zr0.2O2 | 1048 | 1097 | 1107 | 1148 | 1557 | Не набл. |
| Ce0.5Zr0.5O2 | 1036 | 1073 | 1086 | 1135 | 1550 | 1558 |
| Ce0.2Zr0.8O2 | 1048 | 1095 | 1109 | 1150 | 1554 | 1562 |
| ZrO2 (250°C) | 1068 | 1099 | Не набл. | 1151 | 1551 | 1560 |
| CuO/CeO2 | 1045 | 1093 | 1110 | Не набл. | 1551 | 1562 |
| CuO/Ce0.8Zr0.2O2 | 1048 | 1095 | Не набл. | След | 1550 | 1562 |
| CuO/Ce0.5Zr0.5O2 | 1045 | 1091 | Не набл. | 1139 | 1550 | 1562 |
| CuO/Ce0.2Zr0.8O2 | 1051 | 1095 | Не набл. | 1147 | 1552 | 1562 |
| СuO/ZrO2 | 1057 | 1100 | Не набл. | 1149 | 1552 | 1565 |
При повышении температуры опыта форма п. п. ацетатных комплексов 1555 и 1440 см–1 [11] усложняется и происходит их уширение. Такие изменения свидетельствуют о появлении в этой области спектра п. п. дополнительных поверхностных соединений.
Как отмечалось в [5], ацетатные комплексы расположены как на кластерах CuO, так и на свободной поверхности. Отметим, что частота п. п. ацетатных комплексов практически не зависит от состава катализатора.
Полосы поглощения, относящиеся к формиатным комплексам, удается наблюдать на фоне п. п. ацетатных комплексов при условии небольшой интенсивности последних и только для первых трех членов ряда изучаемых образцов. Следует отметить высокую термостабильность формиатов. Они существуют при высоких температурах, когда происходит эффективное превращение ацетатных комплексов.
Общая картина изменения интенсивности п. п. обнаруженных поверхностных соединений при повышении температуры реакции подробно описана в [5, 11]. Уменьшение интенсивности п. п. этоксигрупп сопровождается ростом и последующим падением интенсивности п. п. ацетатов, которое, в свою очередь, приводит к возрастанию интенсивности п. п. (увеличению концентрации) формиатных комплексов.
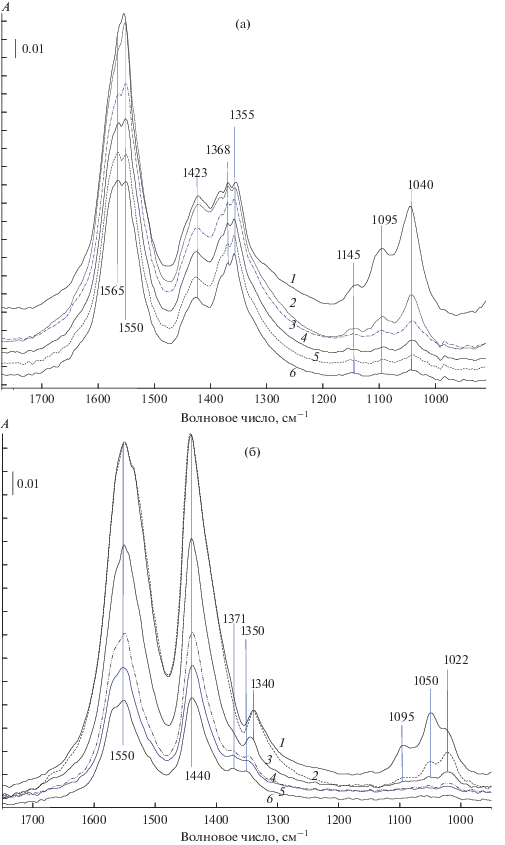
Нестационарные спектрокинетические измерения. В ходе экспериментов после установления стационарных значений концентрации поверхностных соединений (в потоке 7% этанола в гелии) и исключения этанола из реакционной смеси осуществляли изотермическую десорбцию поверхностных соединений в потоке Не или в потоке смеси Не и паров воды. При этом по ИК-спектрам следили за интенсивностью п. п. этоксигрупп и ацетатных комплексов. На рис. 4а и 4б приведены результаты типичных опытов. Видно, что по мере уменьшения интенсивности п. п. ацетатных комплексов в спектрах проявляются п. п. формиатных комплексов. Этот эффект наблюдается только для первых трех катализаторов и носителей изучаемого ряда.
Рис. 4.
ИК-спектры, полученные в условиях переключения потока этанола на поток He при различном времени пропускания He: а − на носителе Ce0.8Zr0.2O2 при Т = 240°С в этаноле (1) и в Не через 2 (2), 10 (3), 20 (4), 30 (5) и 40 (6) мин; б − на катализаторе 5%CuО/Ce0.8Zr0.2O2 при Т = 228°С в этаноле (1) и в Не через 10 (2), 45 (3), 55 (4), 60 (5) и 65 (6) мин.
На рис. 5 представлены результаты обработки данных типичного спектрокинетического опыта для образца 5%CuО/Ce0.8Zr0.2O2. Кривые 1−3 представляют собой зависимости интенсивности п. п этоксигрупп от времени при 180°С, а кривые 4−6 − зависимости интенсивности п. п. ацетатных комплексов от времени при 180, 210 и 228°С.
Рис. 5.
Зависимости от времени интенсивностей п. п. этоксигрупп при 1055 (1), 1095 (2), 1155 (3) см–1 при Т = 180°С и п. п. ацетатных комплексов при 1440 см–1 при температурах 180 (4), 210 (5) и 228°С (6) после переключения потока этанола на поток He на образце 5%CuО/Ce0.8Zr0.2O2.
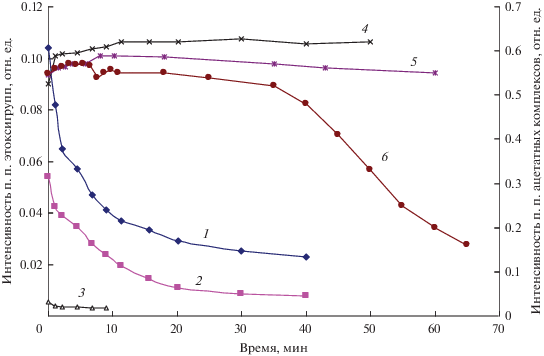
Кинетические кривые для этоксигрупп описываются в координатах уравнения первого порядка. Значения констант скорости превращения этоксигрупп для некоторых образцов приведены в табл. 5. Видно, что при повышении температуры >250°С наблюдается значительный рост величин констант для катализаторов на основе CeO2, Ce0.8Zr0.2O2. Для остальных образцов константы слабо зависят от температуры и типа катализатора. Зависимости интенсивности п. п. ацетатных комплексов от времени при разных температурах имеют сложный характер: при низких температурах опыта (рис. 5, кривые 4 и 5) интенсивность практически не меняется, а при повышении температуры (рис. 5, кривая 6) она остается постоянной в течение длительного времени и падает только тогда, когда концентрация этоксигрупп становится пренебрежимо мала.
Таблица 5.
Константы скорости превращения этоксигрупп с различными частотами полос поглощения на медьсодержащих образцах
| Образец | Температура реакции, °С | Константы скорости превращения этоксигрупп k, мин–1 | |||
|---|---|---|---|---|---|
| Частоты полос поглощения этоксигрупп, см–1 | |||||
| 1055 | 1095−1100 | 1110−1115 | 1150 | ||
| Cu/CeO2 | 150 | 0.02 | 0.03 | 0.01 | Отсутств. |
| 200 | 0.02 | 0.14 | Слаб. интенс. | ||
| 250 | 0.14 | 0.28 | |||
| Cu/Ce0.8Zr0.2O2 | 180 | 0.03 | 0.05 | Слаб. интенс. | 0.05 |
| 210 | 0.03 | 0.04 | Слаб. интенс. | ||
| 228 | 0.05 | 0.15 | |||
| Cu/Ce0.5Zr0.5O2 | 180 | 0.05 | 0.09 | Слаб. интенс. | Слаб. интенс. |
| 200 | 0.11 | Слаб. интенс. | |||
| 220 | 0.07 | ||||
| Cu/Ce0.2Zr0.8O2 | 180 | 0.02 | 0.03 | Слаб. интенс. | 0.02 |
| 220 | 0.03 | 0.04 | 0.03 | ||
| 235 | 0.05 | 0.05 | 0.04 | ||
| Cu/ZrO2 | 150 | 0.05 | 0.05 | Слаб. интенс. | 0.04 |
| 200 | 0.06 | 0.05 | 0.08 | ||
| 250 | 0.07 | 0.06 | 0.09 | ||
Активность в превращении этанола. На рис. 6а показаны результаты измерения концентрации продуктов превращения этанола в зависимости от температуры на катализаторе CuО/Ce0.8Zr0.2O2. Данные для других катализаторов качественно похожи и частично приведены в [5, 11].
Рис. 6.
а − Зависимости концентраций продуктов превращения этанола от температуры реакции на образце 5%CuО/Ce0.8Zr0.2O2: H2 (1), этилен (2), ацетальдегид (3), CO2 (4), CO (5), ацетон (6), бутен (7), толуол (8); б − изменение веса образца 5%CuО/Ce0.8Zr0.2O2, измеренного в процессе реакции, в зависимости от температуры реакции.
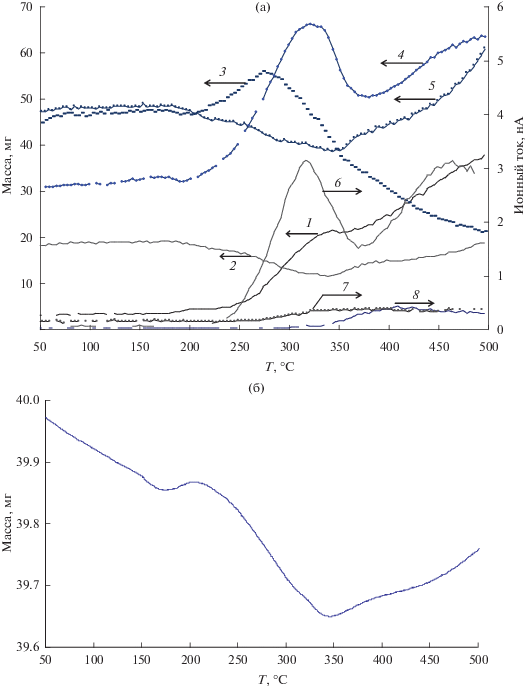
Образование продуктов происходит в двух температурных областях. В низкотемпературной (200–350°С) начинается выделение H2 (кривая 1), а также наблюдается образование ацетальдегида (кривая 3), CO2 (кривая 4), ацетона (кривая 6) и бутена (кривая 7), при этом их концентрация проходит через максимум. Отметим, что температурная область их существования совпадает с областью наличия на поверхности продуктов уплотнения (ПУ), идентифицируемых по данным ИК-спектрального анализа [5, 11] и по увеличению веса образца (рис. 6б). Продукты аналогичного состава образуются и на остальных катализаторах. Индивидуальные свойства образцов проявляются в различном количественном соотношении продуктов и несколько повышающейся температуре начала их появления с ростом содержания ZrO2.
При повышении температуры выше 350°С наблюдается эффективный рост концентрации водорода, сопровождаемый увеличением концентрации СО2 и выделением незначительного количества этилена (кривая 2), СО (кривая 5) и толуола (кривая 8).
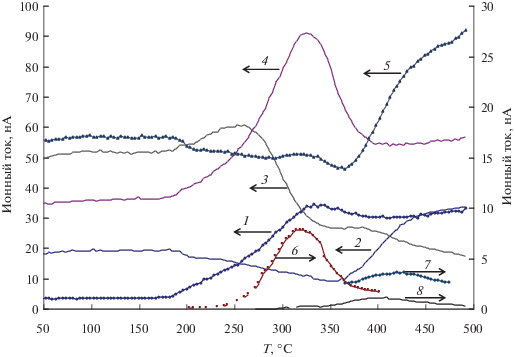
Иной характер имеет образование водорода на катализаторах с высокой концентрацией ZrO2 в составе носителя: СuО/ZrO2 [11] и 5%CuO/ Ce0.2Zr0.8O2 (рис. 7). В присутствии этих образцов роста концентрации водорода с температурой не происходит. Отметим практически полное отсутствие СО в составе продуктов. Общая картина для ряда катализаторов от CuО/CeO2 до CuО/ZrО2 характеризуется уменьшением образования водорода, СО, этилена и некоторым увеличением доли СО2.
Рис. 7.
Зависимости концентраций продуктов превращения этанола от температуры реакции на образце 5%CuО/Ce0.2Zr0.8O2: H2 (1), этилен (2), ацетальдегид (3), CO2 (4), CO (5), ацетон (6), кротоновый альдегид (7), толуол (8).
Опыты на образцах носителей показали, что на них образуются только этилен и небольшие количества СО2 и водорода. Увеличения веса образцов в термогравиметрических опытах при этом не наблюдалось.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Модель активной поверхности
По данным РФА медьсодержащие катализаторы на основе смешанных оксидов представляют собой твердые растворы кубической структуры, параметр решетки которых линейно уменьшается при переходе от CeO2 к ZrO2 (рис. 1 и табл. 1).
На профилях ТПВ катализаторов водородом имеются, как правило, два пика, причем Тмакс пиков проходит через максимум для 5%CuO/ Ce0.5Zr0.5O2 (табл. 2). Аналогичный результат был получен в [26]. Оценка количества поглощенного в процессе ТПВ водорода показывает, что в восстановлении участвует не только кислород оксида меди, но и кислород приповерхностных слоев носителя [14]. По-видимому, это связано с тем, что на восстановленном до металла оксиде меди происходит диссоциация молекул водорода. Образовавшиеся атомы водорода диффундируют на носитель и участвуют в реакции с поверхностным кислородом. Полученные данные говорят о том, что CuO на поверхности носителей находится в двух состояниях. В дальнейшем была проведена характеристика этих состояний.
По данным ЭПР изолированные ионы Сu2+ в составе катализаторов отсутствуют. В спектрах ЭСДО [17] наблюдается Сu2+ в составе высокодисперсных (двумерных, в которых обменные взаимодействия пренебрежимо малы) кластерах [18]. Координация Сu2+ в таких кластерах меняется от плоского квадрата для 5%CuО/CeO2 до октаэдрической с тетрагональным искажением для 5%CuО/ZrO2.
В ИК-спектрах адсорбированных молекул СО наблюдаются п. п. кaрбонильных (Cu+–CO) и карбонатных комплексов (рис. 2). Интересно отметить, что в окисленных образцах присутствуют ионы Cu+, идентифицируемые по наличию карбонильных комплексов Cu+–СО. Объяснить их существование можно тем, что первичным актом при адсорбции СО является образование поверхностных карбонатных комплексов, в результате чего происходит частичное восстановление ионов меди.
Особые свойства проявляет образец 5%CuO/ Ce0.5Zr0.5O2. Полосы поглощения карбонильного комплекса (2127 см–1) для него значительно сдвинуты в сторону высоких частот (табл. 3). В профиле ТПВ этого образца (табл. 1) обнаруживается высокотемпературный пик поглощения водорода при 360°С. Его наличие свидетельствует о том, что из состава образца выпадет часть ZrO2 моноклинной структуры [14]. Этот вывод подтверждают данные рентгеноструктурного анализа. Объем ячейки кристаллической решетки оставшейся части твердого раствора носителя в нем примерно соответствует составу Ce0.6Zr0.4O2 (рис. 1).
Смещение частот п. п. этоксигрупп (табл. 4) в область низких значений и сдвиг частоты карбонила в сторону высоких значений свидетельствует о том, что поверхность образца 5%CuO/ Ce0.5Zr0.5O2 обогащена кислородом [17, 27, 28]. Связано это с тем, что на поверхность кристаллитов этого образца выходят кислородсодержашие кристаллографические плоскости.
Полезную информацию об активной фазе дают карбонатные комплексы. Для образцов с большим содержанием СeO2 характерно преимущественное образование моно- и бидентатных карбонатов, в то время как на образцах с высоким содержанием ZrO2 преобладают мостиковые карбонатные структуры. С учетом того, что мостиковые карбонатные структуры формируются с участием терминальных атомов кислорода [28], можно утверждать, что состояние поверхности кластеров CuO в ряду изученных катализаторов меняется. С увеличением концентрации ZrO2 в носителе (и с уменьшением объема ячейки кристаллической решетки) количество терминальных атомов кислорода на поверхности кластеров CuO возрастает, а расстояние между ними уменьшается. Наличие терминальных атомов кислорода связано с выходом на поверхность кристаллитов кристаллографических плоскостей с высокими индексами. Ионы меди оказываются в координационно ненасыщенном состоянии. Координационная ненасыщенность понижается как раз за счет присутствия терминальных атомов кислорода.
Данные табл. 2 показывают, что количество десорбированных молекул СО практически вдвое меньше количества десорбированных молекул СО2. Это означает, что формирование не каждого комплекса приводит к восстановлению ионов меди. По-видимому, образование бидентатного карбоната, имеющего заряд 2–, стабилизируется существованием Cu2+. Образование же монодентатного карбоната с зарядом 1– сопровождается возникновением анионной вакансии, в результате чего состояние Cu+ стабилизируется.
Использование комплекса физико-химических методов позволяет наблюдать следующие изменения свойств в изучаемом ряду катализаторов с ростом концентрации ZrO2 в носителе:
1) параметр кристаллической решетки и, следовательно, расстояние между ионами меди в кластерах уменьшаются (табл. 1);
2) число кристаллитов, на поверхность которых выходят грани с высокими индексами, а значит и концентрация терминальных атомов кислорода возрастают;
3) уменьшение размера кластеров коррелирует с увеличением удельной поверхности (табл. 1);
4) повышается прочность связи поверхностного кислорода (табл. 2);
5) координация Сu2+ в кластерах меняется от плоского квадрата до октаэдрической с тетрагональным искажением;
6) прочность связи карбонильных комплексов Cu+–CO возрастает (табл. 3).
Таким образом, меняя соотношение СeO2 и ZrO2 в носителе, можно воздействовать на состояние активной фазы. Далее интересно проследить, как перечисленные выше изменения свойств катализаторов влияют на свойства формирующихся поверхностных соединений и активность образцов в реакции превращения этанола.
Свойства поверхностных соединений
Этоксигруппы. Образование этоксигрупп при взаимодействии этанола с поверхностью происходит с участием гидроксильных групп поверхности [5, 16]. Сравнение интенсивности и положения п. п. этоксигрупп (табл. 4), формирующихся на поверхности носителей и катализаторов, показывает, что местом локализации этих комплексов является поверхность носителя.
Повышение частот п. п. этоксигрупп с увеличением содержания ZrO2 в твердом растворе связано, очевидно, с изменением координационного окружения центров их локализации. С другой стороны, по данным [27, 29] окисление поверхности катализатора приводит к сдвигу п. п. этоксигрупп в сторону низких частот. С учетом этого обстоятельства, наблюдающееся в нашем случае повышение частот п. п. этоксигрупп можно трактовать как снижение степени окисления (окислительной способности) поверхности в ряду изученных катализаторов. Особые свойства катализатора 5%CuO/Ce0.5Zr0.5O2 были обсуждены выше.
Данные о скорости превращения этоксигрупп приведены в табл. 5. Видно, что при приближении к 250°С существенно возрастают значения констант скорости превращения этоксигрупп, которым соответствуют п. п. при 1095−1100 см–1, для катализаторов CuO/CeO2 и CuO/Ce0.8Zr0.2O2. Это следует связать с началом реакции превращения этанола. Для остальных образцов значения констант в указанной температурной области слабо зависят и от Т, и от типа катализатора, что объясняется расходованием этоксигрупп в реакции образования ацетатных комплексов. Превращение этанола на этих образцах начинается при более высоких температурах.
Ацетатные комплексы. В ИК-спектрах, полученных в условиях реакции на поверхности носителей и катализаторов (рис. 3а и 3б) наблюдаются п. п. при 1570−1550, 1450−1440 и 1340 см–1, принадлежащие колебаниям в ацетатных комплексах. Подробный анализ ИК-спектров в [5, 11] показал, что источником образования ацетатов являются этоксигруппы. Об этом свидетельствует вид зависимостей интенсивностей п. п. ацетатов и этоксигрупп от времени в опытах по изотермической десорбции поверхностных соединений (рис. 5). Видно, что интенсивность п. п. ацетатов (кривая 4) не изменяется до тех пор, пока не израсходуются все этоксигруппы (кривые 1, 2). Такое возможно, если количество ацетатов, занимающих все отведенные для них места, постоянно восполняется за счет превращения этоксигрупп.
Любопытно, что частоты п. п. карбоксильной группы (1570−1550 см–1) практически не зависят ни от типа катализатора, ни от типа носителя (табл. 4). Можно допустить, что процесс образования ацетатов малочувствителен к свойствам поверхностных центров изучаемых твердых растворов.
Формиатные комплексы. Формиатные комплексы в реакции превращения этанола образуются на поверхности только трех первых членов ряда катализаторов с малым содержанием ZrO2 в носителе, и относящиеся к ним полосы поглощения наблюдаются лишь в нестационарных опытах на фоне уменьшающейся интенсивности п. п. ацетатных комплексов (рис. 3а и 3б). Отметим, что при адсорбции метанола формиатные комплексы формируются на всех изучаемых катализаторах [16]. Поскольку формиаты образуются в результате окислительного превращения этоксигрупп и ацетатных комплексов, важную роль в этом процессе играют свойства поверхностного кислорода. Данные табл. 1 показывают, что прочность связи поверхностного кислорода с увеличением содержания ZrO2 в ряду изучаемых катализаторов возрастает. По-видимому, при взаимодействии с этанолом поверхностная реакция образования ацетатных комплексов выигрывает конкуренцию за подходящий по свойствам кислород у реакции образования формиатов. При адсорбции метанола такой конкуренции, естественно, нет. По аналогии с адсорбцией метанола на этих катализаторах можно полагать, что формиаты локализуются и на носителе, и на медных кластерах. Следует отметить высокую термостабильность формиатных комплексов.
Продукты уплотнения. В наших работах [5, 11] было показано, что изменение формы и увеличение полуширины п. п. ацетатных комплексов при повышении температуры реакции связано с появлением продуктов уплотнения. Источниками для них могут быть все перечисленные выше поверхностные комплексы, однако ключевую роль играют этоксигруппы, поскольку образование ПУ прекращается при отсутствии этоксигрупп на поверхности катализатора. Скорее всего, продукты уплотнения образуются на кластерах CuO, поскольку в аналогичных опытах с носителями ПУ на них не обнаружены.
Сравнение данных о поверхностных комплексах на носителях и на катализаторах показывает, что их поведение определяется свойствами поверхностного кислорода. Нанесение оксида меди приводит к его активации, в результате чего снижается температура начала формирования ацетатных и формиатных комплексов. Кроме того, в присутствии CuO на поверхности становится возможным взаимодействие между комплексами с образованием продуктов уплотнения.
Роль поверхностных соединений в образовании продуктов превращения этанола
В условиях реакции на поверхности носителей и катализаторов наблюдается один и тот же состав поверхностных комплексов, а набор продуктов различается. Это означает, что в присутствии CuO на поверхности между теми же комплексами протекают принципиально различные реакции. Одна из них – образование продуктов уплотнения. Полученные в работе результаты говорят о том, такие продукты реакции, как ацетон, бутен, толуол, получаются за cчет превращения ПУ. Как показано в [5], подходящие заготовки для этого есть. В литературе появление этих продуктов описывается с помощью схем без учета возможного участия ПУ [20]. Образование ацетальдегида из этанола по стехиометрии сопровождается выделением водорода. И действительно, на кривой зависимости концентрации водорода от температуры (рис. 6а и 7, кривые 1) наблюдаются максимумы при температурах образования ацетальдегида.
Сравнительный анализ данных, полученных в настоящей работе, а также в [5, 11] показал, что значительные количества водорода наблюдаются в присутствии катализаторов, на поверхности которых эффективно формируется высокотемпературный формиатный комплекс. Образование водорода сопровождается при этом выделением СО. Наличие формиатного комплекса на носителе не приводит к появлению водорода. Это означает, что существование формиатов на кластерах CuO является необходимым условием получения водорода. Еще одним условием будет присутствие на поверхности достаточного количества кислорода, способного участвовать в образовании формиатов. Определяющую роль в этом опять же играют кластеры CuO.
Сделанные выводы подтверждаются данными для катализаторов с высокой концентрацией ZrO2 в составе носителя: СuО/ZrO2 [11] и CuO/Ce0.2Zr0.8O2 (рис. 7). Для этих образцов не наблюдается постоянный рост концентрации водорода с температурой. Первый пик при температуре около 300°С связан с образованием ацетальдегида, а увеличение концентрации при дальнейшем повышении температуры – с рекомбинацией на кластерах меди атомов водорода, получающихся в поверхностных стадиях превращения этанола. Отметим практически полное отсутствие СО в составе продуктов.
ЗАКЛЮЧЕНИЕ.
Комплексом физико-химических методов исследованы медьсодержащие катализаторы на основе твердых растворов CeO2–ZrO2. Охарактеризована их активная поверхность и обнаружено, что главным ее свойством, влияющим на скорость образования продуктов превращения этанола, является прочность связи кислорода поверхности, которая в большой степени определяется свойствами кластеров нанесенного оксида меди и соотношением CeO2/ZrO2 в носителе.
Основные интермедиаты в превращении этанола на этих катализаторах – это этоксигруппы, ацетатные, формиатные комплексы и продукты уплотнения.
Превращение продуктов уплотнения в интервале 200−350°С приводит к таким продуктам реакции, как ацетальдегид, ацетон, бутен. Ключевой стадией в появлении водорода является разложение формиатного комплекса. Поэтому эффективное образование водорода наблюдается только на тех катализаторах, на поверхности которых существует высокотемпературный формиатный комплекс, локализованный на кластерах CuO. Его присутствие на поверхности обусловлено конкуренцией за подходящий по свойствам кислород между реакциями образования ацетатных комплексов и формиатов.
Список литературы
Lindström B., Pettersson L., Menon P.G. // Appl. Catal. A. General. 2002. V. 234. P. 111.
Zhang X., Shi P. // J. Mol. Catal. A. Chem. 2003. V. 194. P. 99.
Iwasa N., Mayanagi T., Ogawa N. // Catal. Lett. 1998. V. 54. P. 119.
Kapoor M.P., Raj A., MatsumuraY. // Micropor. Mesopor. Mater. 2001. V. 44. P. 565.
Матышак В.А., Сильченкова О.Н., Бычков В.Ю., Тюленин Ю.П. // Кинетика и катализ. 2018. Т. 59. № 3. С. 324. (Matyshak V.A., Sil’chenkova O.N., Bychkov V.Y., Tyulenin Y.P. // Kinet. Catal. 2018. V. 59. № 3. P. 320.)
Schiffino R.S., Merril R.P. // J. Phys. Chem. 1993. V. 97. P. 6425.
Крылов О.В., Матышак В.А. Промежуточные соединения в гетерогенном катализе. Москва: Наука, 1996. 316 с.
Матышак В.А., Хоменко Т.И., Лин Г.И., Завалишин И.Н., Розовский А.Я. // Кинетика и катализ. 1999. Т. 40. № 2. С. 295.
Neophytides S.G., Marchi A.J., Froment G.F. // Appl. Catal. A. General. 1992. V. 86. P. 45.
Martin K.A., Zabransky R.F. // Appl. Spectrosc. 1991. V. 45. P. 68.
Матышак В.А, Сильченкова О.Н., Бычков В.Ю., Корчак В.Н. // Кинетика и катализ. 2020. Т. 61. № 3. С. 428. (Matyshak V.A., Sil’chenkova O.N., Bychkov V.Y., Korchak V.N. // Kinet. Catal. 2020. V. 61. № 3. P. .)
Sadykov V.A., Shmakov A.N., Cherepanova S.V., Zyuzin D.A., Fedorova Y.E., Bobrikov L.A., Roger A.C., Adamski A. // Open Chem. 2017. V. 15. № 1. P. 438.
Matyshak V.A., Krylov O.V. // Catal. Today. 1996. V. 25. P. 1.
Ильичев А.Н., Быховский М.Я., Фаттахова З.Т., Шашкин Д.П., Федорова Ю.Е., Матышак В.А., Корчак В.Н. // Кинетика и катализ. 2019. Т. 60. № 5. С. 654. (Il’ichev A.N., Bykhovsky M.Y., Fattakhova Z.T., Shashkin D.P., Matyshak V.A., Korchak V.N., Fedorova Y.E. // Kinet. Catal. 2019. V. 60. № 5. P. 661.)
Manzoli M., Di Monte R., Boccuzzi F., Coluccia S., Caspar J. // Appl. Catal. B: General. 2005. V. 61. P. 192.
Ильичев А.Н., Фирсова А.А., Корчак В.Н. // Кинетика и катализ. 2006. Т. 47. С. 602. (Il’ichev A.N., Firsova A.A., Korchak V.N. // Kinet. Catal. 2006. V. 47. № 4. P. 585.)
Матышак В.А., Сильченкова О.Н., Исмаилов И.Т., Третьяков В.Ф. // Кинетика и катализ. 2010. Т. 51. С. 447. (Matyshak V.A., Sil’chenkova O.N., Ismailov I.T., Tret’yakov V.F. // Kinet. Catal. 2010. V. 51. № 3. P. 428.)
Шинкаренко В.Г. Дисс. … канд. хим. наук. Институт катализа СО РАН: Новосибирск, 1978.
Ильичев А.Н., Матышак В.А., Корчак В.Н. // Кинетика и катализ. 2015. Т. 56. № 1. С. 125. (Il’ichev A.N., Matyshak V.A., Korchak V.N. // Kinet. Catal. 2015. V. 56. № 1. P. 115.)
Ильичев А.Н., Шашкин Д.П., Матышак В.А., Корчак В.Н. // Кинетика и катализ. 2015. Т. 56. № 2. С. 198. (Il’ichev A.N., Shashkin D.P., Matyshak V.A., Korchak V.N. // Kinet. Catal. 2015. V. 56. № 2. P. 197.)
Yee A., Morrison S.J., Idriss H. // J. Catal. 1999. V. 186. P. 279.
Scott M., Goeffroy M., Chiu W., Blackford M.A. // Top. Catal. 2008. V. 51. P. 13.
Akdim O., Kai W., Fierro V., Provendier H., Andre van Veen, Shen W., Mirodatos C. // Top. Catal. 2008. V. 51. P. 22.
Sheng P.-Y., Yee A., Bowmaker G. A., Idriss H. // J. Catal. 2002. V. 208. P. 393.
Sania M. de Lima, Ivna O. da Cruz, Gary Jacobs, Burtron H. Davis, Lisiane V. Mattos, Fabio B. Noronha // J. Catal. 2008. V. 257. P. 356.
Sania M. de Lima, Adriana M. Silva, Uschi M. Graham, Gary Jacobs, Burtron H. Davis, Lisiane V. Mattos, Fabio B. Noronha // Appl. Catal. A: General. 2009. V. 352. P. 95.
Binet C., Daturi M. // Catal. Today. 2001. V. 70. P. 155.
Давыдов А.А. ИК-спектроскопия в химии поверхности окислов. Новосибирск: Наука, 1984. 241 с. (Davydov A.A. Molecular spectroscopy of oxide catalyst surfaces. Wiley, 2003. 668 р.)
Daturi M., Binet C., Lavalley J.-C., Galtayries A., Sporken R. // Phys. Chem. Chem. Phys. 1999. V. 1. P. 571.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


