Кинетика и катализ, 2021, T. 62, № 3, стр. 325-333
Фотодеградация напроксена с использованием композита Ag/AgCl–PANI под действием солнечного света: продукты превращения и кинетика реакции
Hossam A. Ghaly a, Amer S. El-Kalliny b, Tarek A. Gad-Allah b, Nour E. A. Abd El-Sattar c, *
a Справочная лаборатория питьевой воды, Холдинговая компания по воде и сточным водам, Шубра Эль Хейма
П.О. 13864 Кальюбия, Египет
b Отдел исследований загрязнения воды Национального исследовательского центра
12622 Докки, Гиза, ул. Эль-Бухут, 33, Египет
c Кафедра химии, факультет естественных наук, Университет Айн-Шамс
11566 Аббасия, Каир, Египет
* E-mail: nourel-dinahmed@sci.asu.edu.eg
Поступила в редакцию 13.09.2020
После доработки 10.11.2020
Принята к публикации 14.11.2020
Аннотация
Исследовано фотокаталитическое разложение органического микрозагрязнителя напроксена (NPX) под действием солнечного света с использованием фотокатализатора Ag/AgCl-полианилин (Ag/AgCl–PANI). Степень деградации контролировали с помощью высокоэффективной жидкостной хроматографии (UPLC) в сочетании с ионизацией электрораспылением и тандемной масс-спектрометрией. Обнаружены высокая стабильность фотокатализаторов и высокая скорость фотокаталитического разложения NPX. Процесс описывается уравнением кинетики первого порядка. Скорость разложения увеличивается с ростом загрузки фотокатализатора и уменьшается с повышением начальной концентрации NPX. Наибольшая фотокаталитическая активность Ag/AgCl–PANI (5%) в отношении удаления NPX была в оснóвных средах (pH 11). Однако для полной минерализации NPX требовалось больше времени, чем для его фоторазложения, что указывает на присутствие побочных продуктов деградации NPX. Продукты превращения идентифицировали методом газовой хроматографии–масс-спектрометрии. Частицы h+ и ${\text{O}}_{2}^{{\centerdot - }}$ осуществляют процесс окисления с переносом электрона по двум различным реакционным маршрутам.
1. ВВЕДЕНИЕ
Появление фармацевтических препаратов (ФП) в окружающей среде было отмечено в нескольких мониторинговых исследованиях. Причина заключается в том, что ФП были разработаны таким образом, чтобы быть биологически активными и противостоять химическим процессам, которые должны разрушать их в окружающей среде. Следовательно, ФП могут легко проходить через очистные сооружения, сбрасываться в реки, озера и далее попадать в питьевую воду [1–3].
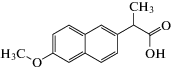
NPX (схема 1 ) – это нестероидный противовоспалительный препарат с анальгетическими и жаропонижающими свойствами, который в основном используется для снятия боли и лечения ревматоидного артрита [4].
Схема 1 . Химическая структура напроксена.
NPX был обнаружен в водной среде в очень разных концентрациях (от нг/л до мкг/л) в поверхностных, грунтовых и даже питьевых водах [5–7]. Следовательно, крайне необходимо разработать новые более эффективные технологии очистки для удаления этого загрязнителя из воды. NPX удаляли, в частности, с помощью разных видов облучения (например, УФ-светом [6, 8], солнечным светом [9] и гамма-лучами [10]), гомогенного катализа (например, реактива Фентона [11] и УФ/H2O2 [12]), а также гетерогенных катализаторов (например, TiO2 [13, 14], Bi-модифицированного титаната [15], нано-γ-FeOOH [16], и окисления пероксида на гибридным магнитным катализаторе на основе железа [17]).
Гетерогенный фотокатализ – перспективный метод удаления ФП и других микрозагрязнителей из воды и сточных вод. Полупроводниковые фотокатализаторы TiO2 и ZnO широко используются при очистке воды и сточных вод [18]. Однако эти фотокатализаторы имеют некоторые недостатки, которые затрудняют их применение с практической точки зрения. Они имеют низкую квантовую эффективность и могут быть активированы только ультрафиолетовым излучением, которое составляет всего ~5% солнечного спектра. Кроме того, в них происходит быстрая рекомбинация фотогенерированных электронно-дырочных пар (e–/h+) [19, 20]. Поэтому разработка новых фотокатализаторов, чувствительных к видимому свету и обладающих высокой фотокаталитической эффективностью, стабильностью и коэффициентом использовния солнечной энергии, превышающими показатели TiO2 и ZnO, стала важной целью прикладного фотокатализа.
Фотокатализаторы поверхностного плазмонного резонанса (ППР), в особенности серебро/галогениды серебра, привлекли большое внимание в последнее десятилетие из-за их приемлемой фотокаталитической активности при облучении видимым светом [21]. Однако было обнаружено, что фотокатализаторы серебро/галогениды серебра проявляют низкую фотокаталитическую активность и стабильность в процессе фотодеградации из-за некоторых ограничений, таких как: (i) агрегация в более крупные частицы, что уменьшает их удельную площадь поверхности, (ii) высокая зарядовая рекомбинация и (iii) низкая стабильность в видимом свете [22]. Сообщалось о нескольких методах преодоления этих недостатков, включая комбинирование с другими полупроводниками [23] или углеродными материалами, такими как активированный уголь [24], углеродные нанотрубки (УНТ) [25], графен [26] и нитрид углерода (g-C3N4) [27]. В нашей недавней работе мы улучшили фотоактивность и стабильность фотокатализатора Ag/AgCl, объединив его с полианилином (PANI) в один композит [28]. Было обнаружено, что композит Ag/AgCl–PANI, содержащий 5 мас. % PANI, проявляет наивысшую активность и стабильность в деструкции красителя метиленового синего (МС). Мы объяснили эти изменения сильным поглощением в области видимого света, большой площадью поверхности и эффективным синергизмом структуры гетероперехода, образованного на границе раздела между Ag/AgCl и PANI, что привело к лучшему разделению фотогенерируемых пар e–/h+ [28].
Предыдущие исследования свойств NPX показали, что его биопробы обладают высокой хронической токсичностью, а некоторые из побочных продуктов его фотодеградации более токсичны для Daphnia magna и Vibrio fischeri, чем сам NPX [29, 30]. Таким образом, настоящая работа была направлена на изучение фотокаталитических характеристик Ag/AgCl–PANI(5%) при разложении NPX под воздействием искусственного солнечного света и на определение побочных продуктов его фоторазложения. Влияние экспериментальных параметров, таких как pH, начальная концентрация NPX и загрузка фотокатализатора, на характеристики процесса разложения изучали с помощью жидкостной хроматографии с тандемной масс-спектрометрией (ЖХ/МС-МС). Промежуточные продукты фоторазложения и маршруты реакции NPX были идентифицированы с помощью газовой хроматографии–масс-спектрометрии (ГХ/МС-МС).
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Синтез фотокатализатора Ag/AgCl–PANI(5%)
Плазмонный фотокатализатор Ag/AgCl–PANI(5%) готовили методом нанесения–осаждения с последующим фотовосстановлением. Подробная процедура приготовления описана в нашей предыдущей работе [28].
2.2. Оценка фотокаталитической активности
Применение фотокатализатора Ag/AgCl–PANI(5%) для разложения NPX было исследовано в условиях моделирования солнечного света металл-галогенной лампой мощностью 400 Вт. Интенсивность излучения, измеренная с помощью люксметра PCE 174 (“PCE Group CO KG”, Великобритания), расположенного на расстоянии 25 см от верхней поверхности раствора, составляла 40 000 люкс. Металл-галогенную лампу стабилизировали в течение не менее 60 мин перед облучением суспензий. Температуру реакции поддерживали постоянной на уровне 25 ± 2°C с помощью внешнего охлаждающего вентилятора и контролировали с помощью регистратора данных каждые 4 мин. 25 мг порошка фотокатализатора суспензировали в 50 мл раствора NPX (10 мг/л). Адсорбционно-десорбционное равновесие загрязнителя на поверхности фотокатализатора достигали путем перемешивания суспензии в течение 90 мин в темноте перед облучением. Затем суспензию облучали для инициирования фотокаталитического процесса. Образцы (3 мл) отбирали из реакционной системы шприцем каждые 4 мин и после центрифугировали в течение 5 мин (при 3000 об/мин) для отделения частиц фотокатализатора. Затем определяли остаточную концентрацию NPX в супернатанте. Повторное использование фотокатализатора осуществляли в соответствии с той же процедурой при pH 7. После каждого экспериментального цикла фотокатализатор собирали фильтрованием и промывали деионизированной водой и затем сушили при 80°C в печи перед повторным применением.
2.3. Анализы
Концентрацию NPX определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ, ACQUITY UPLC, “Waters Corporation”) в сочетании с ионизацией электрораспылением и тандемной масс-спектрометрией (Xevo TQ-S, “Waters Corporation”). Пробу объемом 20 мкл инжектировали со скоростью потока 0.45 мл/мин в прибор ВЭЖХ с обращенной фазой, колонка C18 (ACQUITY UPLC, BEH C18, 1.7 мкм × 2.1 мм × × 10 мм). Разделение аналитов достигалось в условиях градиентного элюирования смесью 0.1% муравьиной кислоты (об./об.) с водой (А) и 100% метанолом (В). Градиентное элюирование начинали с 90% (A), поддерживали этот режим в течение первых 2.5 мин, затем линейно уменьшали (А) до 10% в период 2.5–7.75 мин, постепенно увеличивали до 100% (B) в период 7.75–8.5 мин, а затем снова до 90% (A) в период 8.5–10.0 мин. После ВЭЖХ элюирования NPX определяли с помощью детектора МС-МС (Xevo TQ-S) с использованием источника ионизации электрораспылением Z-спрея (ESI) в отрицательном режиме. Оптимизированные параметры МС-МС (конусное напряжение и энергия столкновения) и переходы для мониторинга множественных реакций (MМР) для NPX приведены в табл. 1. Температура источника ионов была установлена на уровне 150°C, капиллярное напряжение – 3.2 кВ; температура десольватации – 450°C; распылитель – 7 бар.
Таблица 1.
Оптимизированные параметры МС-МС
| Аналит | Режим ионизации | Окно времени удерживания, мин | Напряжение конуса, В | ММР-переход | Энергия столкновения, эВ |
|---|---|---|---|---|---|
| Напроксен | Отрицательный | 5.5–6.5 | 15 | MMР1 229→170 MMР2 229→185 |
20 5 |
Для контроля качества метод был подтвержден путем оценки диапазона линейности с использованием согласованных с матрицей калибровочных кривых, методики обнаружения и количественной оценки пределов, матричных эффектов, прецизионности и точности. Метод прошел квалификационные испытания и показал хорошие результаты. Стандартные калибровочные кривые были построены для каждой партии образцов. Коэффициенты калибровочной регрессии (R2) составляли 0.99. Был сделан один холостой анализ для каждой партии или каждых 10 образцов, чтобы убедиться в отсутствии загрязнения. Коэффициенты извлечения в экспериментах варьировались от 90 до 110%, что указывает на превосходную точность. Все эксперименты проводили дважды.
Для оценки минерализации NPX определяли общий органический углерод (ООУ). Все отфильтрованные образцы анализировали прямым вводом в анализатор ООУ (Vario TOC cube, “Cientec Instrumentos”). Прибор был откалиброван с использованием гидрофталата калия. Начальную концентрацию ООУ измеряли после установления равновесия адсорбции NPX на поверхности фотокатализатора.
Образующиеся в процессе фотодеградации NPX побочные продукты идентифицировали с помощью газового хроматографа CP-3800 (“Varian”), оснащенного масс-спектрометром 320-MS (“Varian”) и капиллярной колонкой BR-5 (“Bruker”, длина – 30 м; внутренний диаметр – 0.25 мм; толщина пленки – 0.25 мкм; неподвижная фаза – 5% дифенил, 95% диметилполисилоксан). Начальную температуру печи 40°C поддерживали в течение 3.5 мин, затем повышали ее со скоростью 5°C/мин до 250°C и поддерживали на этом уровне в течение 10 мин. После этого повышали температуру до 280°C со скоростью 2°C/мин и поддерживали ее в течение 5 мин. Температура впрыска составляла 275°C, в качестве газа-носителя использовали гелий при скорости потока 1 мл/мин. Режим сбора данных ГХ/МС осуществляли в режиме сканирования. Образец был предварительно обработан следующим образом: 1) фотокатализатор удаляли из реакционного раствора; 2) при естественном pH проводили процедуры экстракции с использованием 50 мл среды образца, полученной трехкратной экстракцией 30 мл хлористого метилена. Затем органический слой отделяли и обезвоживали с применением безводного сульфата натрия; 3) обезвоженный органический слой концентрировали до 1 мл по объему; 4) 1.0 мкл конечной пробы вводили и анализировали с помощью ГХ/МС.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
3.1. Кинетика фотодеградации
Перед началом экспериментов по фотокаталитическому разложению композит Ag/AgCl–PANI(5%) находился в контакте с NPX в течение 90 мин в темноте для достижения адсорбционного равновесия. Были определены фотокаталитические характеристики композита Ag/AgCl–PANI(5%) в отношении его способности к разложению NPX. Разложение NPX описывалось следующим уравнением:
(1)
$\frac{{ - {\text{d}}\left[ {{\text{NPX}}} \right]}}{{{\text{d}}t}} = {{k}_{{{\text{app}}}}}\left[ {{\text{NPX}}} \right],$Рис. 1.
Влияние pH на фотодеградацию NPX композитом Ag/AgCl–PANI(5%) в условиях искусственного солнечного света; точки – экспериментальные значения, линии – аппроксимация кинетики 1-го порядка. Условия: загрузка фотокатализатора – 0.5 г/л, [NPX]0 = 10 мг/л.
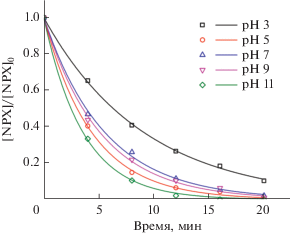
Рис. 2.
Влияние загрузки фотокатализатора на фотодеградацию NPX композитом Ag/AgCl–PANI(5%) в условиях искусственного солнечного света; точки – экспериментальные значения, линии – аппроксимация кинетики 1-го порядка. Условия: pH 7, [NPX]0 = = 10 мг/л.
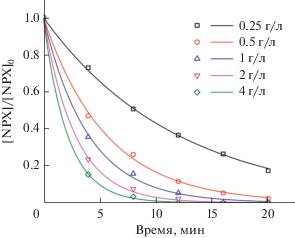
Рис. 3.
Влияние начальной концентрации NPX на фотодеградацию NPX композитом Ag/AgCl–PANI(5%) в условиях искусственного солнечного света; точки – экспериментальные значения, линии – аппроксимация кинетики 1-го порядка. Условия: загрузка фотокатализатора – 0.5 г/л, pH 7.
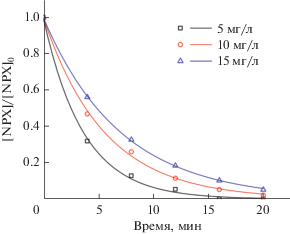
Таблица 2.
Кажущиеся значения констант скорости 1-го порядка, полученные в результате нелинейной аппроксимации результатов экспериментов по деградации в различных условиях
| pH | kapp ± SD*, мин–1 | R2 |
|---|---|---|
| 3 | 0.110 ± 0.001 | 0.9994 |
| 5 | 0.229 ± 0.004 | 0.9994 |
| 7 | 0.180 ± 0.004 | 0.9987 |
| 9 | 0.196 ± 0.005 | 0.9986 |
| 11 | 0.280 ± 0.005 | 0.9995 |
| Загрузка фотокатализатора, г/л | kapp, мин–1 | R2 |
| 0.25 | 0.085 ± 0.001 | 0.9992 |
| 0.5 | 0.180 ± 0.004 | 0.9987 |
| 1 | 0.251 ± 0.007 | 0.9987 |
| 2 | 0.354 ± 0.008 | 0.9995 |
| 4 | 0.467 ± 0.007 | 0.9999 |
| Начальная концентрация NPX, мг/л | kapp, мин–1 | R2 |
| 5 | 0.275 ± 0.008 | 0.9988 |
| 10 | 0.180 ± 0.004 | 0.9987 |
| 15 | 0.142 ± 0.001 | 0.9998 |
3.1.1. Влияние рН. Эффективность фотокаталитических процессов сильно зависит от pH реакционного раствора, поскольку pH влияет на поверхностный заряд самого фотокатализатора, а также на ионизацию NPX [13]. Влияние pH на скорость разложения NPX (рис. 1) было исследовано после облучения в течение 20 мин в диапазоне pH от 3 до 11 при постоянной загрузке катализатора 0.5 г/л в условиях искусственного солнечного света. Скорость разложения NPX возрастает в интервале рН 3–5, а затем уменьшается при pH 7. С ростом pH раствора до 9 наблюдали небольшое повышение этого показателя, а при pH 11 скорость разложения резко увеличивается, достигая максимального значения. Способ приготовления фотокатализатора может изменить его химическую природу и точку нулевого заряда (ТНЗ), которая влияет на поверхностный заряд фотокатализатора. При pH ниже pHТНЗ поверхность фотокатализатора протонируется и заряжается положительно, в то время как при pH выше pHтнз поверхность фотокатализатора депротонируется и заряжается отрицательно. Значение рНТНЗ для Ag/AgCl–PANI(5%) равно 5.8 [28], а значение pKa (Ka – константа диссоциации кислоты) NPX составляет 4.1 [13]. Это означает, что поверхность фотокатализатора и NPX при pH раствора ниже 4.1 заряжены положительно, а при pH раствора выше 5.8 – отрицательно, что приводит к электростатическому отталкиванию между NPX и фотокатализатором в обеих областях. При значении рН 4.1 ≤ pH ≤ 5.8 катализатор заряжается положительно, а NPX имеет отрицательный заряд. Это облегчает адсорбцию NPX на поверхности фотокатализатора или приближает молекулы NPX к частицам фотокатализатора, что способствует увеличению скорости фотодеградации. С другой стороны, скорость разложения резко возрастает в более щелочной среде при pH 11 из-за присутствия гидроксид-ионов (OH–), которые реагируют с дырками и создают бόльшую концентрацию гидроксильных радикалов (•OH), повышая таким образом скорость фотодеградации [31].
3.1.2. Влияние загрузки катализатора. Чтобы исследовать влияние загрузки катализатора на скорость разложения, были выполнены некоторые эксперименты при pH 7 и концентрации NPX 10 мг/л с изменением количества катализатора от 0.25 до 4.00 г/л. Полученные результаты представлены на рис. 2. Скорость разложения NPX возрастает по мере повышения концентрации Ag/AgCl–PANI(5%). Это связано с тем, что начальная концентрация NPX сохраняется постоянной, но количество активных центров увеличивается за счет увеличения загрузки фотокатализатора (т.е. количество активных центров, доступных для молекулы NPX, становится больше), что приводит к росту числа фотогенерируемых радикалов и, следовательно, к повышению скорости деградации NPX [31].
3.1.3. Влияние начальной концентрации NPX. Влияние начальной концентрации NPX на эффективность разложения было исследовано в интервале начальных концентраций 5–15 мг/л при pH 7 при постоянной загрузке катализатора 0.5 г/л в условиях искусственного солнечного облучения (рис. 3). Константа скорости разложения уменьшается при увеличении начальной концентрации NPX. Этот результат можно объяснить тем, что, хотя начальная концентрация NPX повышается, количество активных центров на поверхности фотокатализатора не изменяется (т.е. количество активных центров, доступных для молекул NPX, сокращается). Более того, проникновение света через реакционную среду уменьшается вследствие увеличения начальной концентрации NPX, что, в свою очередь, снижает поглощение фотонов активными центрами фотокатализатора. Соответственно, количество фотогенерируемых активных радикалов становится меньше [32].
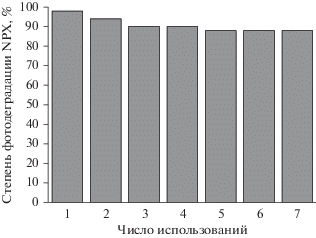
3.2. Повторное использование фотокатализатора
Одной из важнейших характеристик катализатора является его стабильность. Как было показано в нашем предыдущем исследовании [28], полианилин (PANI) не только улучшает эффективность фотодеградации красителя МС на Ag/AgCl, но также повышает его стабильность. В настоящей работе была определена стабильность фотокатализатора Ag/AgCl–PANI(5%) в деградации NPX после семи циклов реакции. На рис. 4 показаны результаты экспериментов по повторному использованию фотокатализатора Ag/AgCl–PANI(5%). Оказалось, что процент удаления NPX незначительно снижается с 98% в первом цикле и остается стабильным на уровне около 88% в последних трех циклах, что указывает на превосходную стабильность этого фотокатализатора по отношению к разложению NPX после семи циклов. Таким образом, возможно практическое применение этого фотокатализатора для обработки органических микрозагрязнителей.
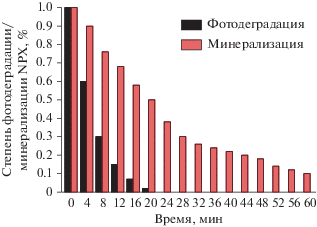
3.3. Минерализация напроксена
Чтобы гарантировать полную минерализацию NPX, важно оценить изменение ООУ в процессе его фотокаталитического разложения. В условиях искусственного солнечного света минерализация достигает только 50% при 98% фотокаталитической деградации через 20 мин (рис. 5 ). Это означает, что в результате реакции образуются некоторые побочные органические продукты, полное разложение которых требует больше времени, чем фотокаталитическое разложение самого NPX (рис. 5 б). После 60 мин фотокаталитического процесса минерализация достигает 92%. Это указывает, что большая часть полученных промежуточных продуктов минерализовалась до CO2 и H2O. Следовательно, Ag/AgCl–PANI(5%) может рассматриваться как высокоэффективный фотокатализатор разложения NPX; однако для полной минерализации требуется больше времени. Это согласуется с предыдущими исследованиями [14, 17, 33].
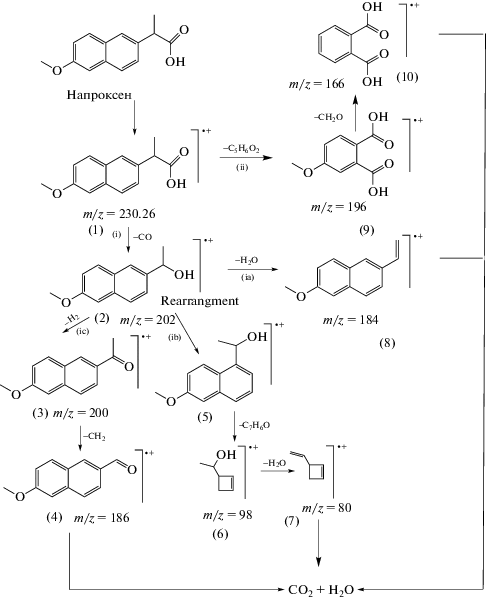
3.4. Маршруты реакций и побочные продукты разложения
Разложение промежуточных и побочных продуктов так же важно, как и разложение исходных лекарственных веществ. Промежуточные соединения, образующиеся при фотодеградации NPX, были проанализированы с помощью ГХ/МС. Обнаружены некоторые промежуточные соединения, о которых сообщалось в литературе. Структуру побочных продуктов разложения определяли, основываясь на анализе масс-спектров. За процесс окисления на большинстве описанных в литературе гетерогенных фотокатализаторах ответственны гидроксильные радикалы. Они участвуют преимущественно в бимолекулярных реакциях присоединения и отрыва атома водорода, в то время как основной процесс окисления с участием частиц ${{h}^{ + }}$ и ${\text{O}}_{2}^{{\centerdot - }}$ представляет собой процесс переноса электрона [14]. Реакции NPX с реакционноспособными окислителями осуществляются по двум разным маршрутам, как показано на схеме 2 и в табл. 3.
Таблица 3.
Номенклатура продуктов фрагментации
| № фраг-мента | Название фрагмента |
|---|---|
| 1 | Напроксен |
| 2 | 1-(6-Метокси-2-нафтилметил)этанол |
| 3 | (6-Метоксинафталин-2-ил)этан-1-он |
| 4 | 6-Метокси-2-нафтальдегид |
| 5 | 1-(6-Метоксинафталин-1-ил)этан-1-ол |
| 6 | 1-(Циклобут-2-ен-1-ил)этан-1-ол |
| 7 | 3-Винилциклобут-1-ен |
| 8 | 2-Метокси-6-винилнафталин |
| 9 | 4-Метоксифталевая кислота |
| 10 | Фталевая кислота |
Схема 2 . Предполагаемые маршруты реакции разложения NPX на фотокатализаторе Ag/AgCl–PANI.
На первом маршруте (i) из NPX образуется 1‑(6-метокси-2-нафтилметил)этанол (m/z = 202), который далее превращается по трем разным маршрутам:
(ia) потеря молекулы воды с образованием 2‑метокси-6-винилнафталина (m/z = 184);
(ib) перегруппировка с образованием 1-(6-метоксинафталин-1-ил)этан-1-ола с последующей фрагментацией с появлением 1-(циклобут-2-ен-1-ил)этан-1-ола (m/z = 98), который теряет молекулу воды, давая 3-винилциклобут-1-ен (m/z = = 80). На последнем этапе образуются диоксид углерода и вода;
(ic) удаление H2 с образованием 1-(6-метоксинафталин-2-ил)этан-1-он (m/z = 200) с последующей потерей карбена с образованием 6-метокси-2-нафтальдегида (m/z = 186).
На втором маршруте (ii) NPX фрагментируется до 4-метоксифталевой кислоты (m/z = 196) с последующей потерей CH2O с образованием фталевой кислоты (m/z = 166).
Следует отметить, что токсичность фталевой кислоты (7.9 г/кг) намного ниже таковой исходного NPX (>2 г/кг). Это указывает, что Ag/AgCl–PANI(5%) является перспективным фотокатализатором разложения и детоксикации NPX.
ЗАКЛЮЧЕНИЕ
Ag/AgCl–PANI(5%) демонстрирует превосходную фотокаталитическую активность в деградации NPX в условиях искусственного солнечного света. Результаты экспериментов показывают, что плазмонный фотокатализатор Ag/AgCl–PANI(5%) обеспечивает высокую степень фотодеградации, превышающую степень минерализации. Это свидетельствует об образовании побочных продуктов фотодеградации, для полного удаления которых требуется больше времени. Степень фотодеградации NPX возрастает с увеличением загрузки фотокатализатора и уменьшается с повышением начальной концентрации NPX. Кроме того, фотокаталитическая активность Ag/AgCl–PANI(5%) в удалении NPX оптимальна в оснόвной среде (pH 11) благодаря присутствию OH–, которые, реагируя с h+ с образованием OH-радикалов, увеличивают скорость фотодеградации. Помимо этого, ${{h}^{ + }}$ и ${\text{O}}_{2}^{{\centerdot - }}$ участвуют в процессе окисления с переносом электрона, что приводит к двум различным реакционным маршрутам. Наконец, полученные результаты подтверждают, что Ag/AgCl–PANI(5%) является эффективным, стабильным и перспективным плазмонным фотокатализатором для разложения органических микрозагрязнителей.
Список литературы
Azzouz A., Ballesteros E. // Chemosphere. 2013. V. 93. № 9. P. 2046.
Ebele A.J., Abdallah M.A.-E., Harrad S. // Emerging Contaminants. 2017. V. 3. № 1. P. 1.
Yang Y., Ok Y.S., Kim K.-H., Kwon E.E., Tsang,Y.F. // Sci. Total Environ. 2017. V. 596. P. 303.
Grenni P., Patrolecco L., Ademollo N., Tolomei A., Caracciolo A.B. // Microchem. J. 2013. V. 107. P. 158.
Benotti M.J., Trenholm R.A., Vanderford B.J., Holady J.C., Stanford B.D., Snyder S.A. // Environ. Sci. Technol. 2008. V. 43. № 3. P. 597.
Marotta R., Spasiano D., Di Somma I., Andreozzi R. // Wat. Res. 2013. V. 47. № 1. P. 373.
Vidal-Dorsch D.E., Bay S.M., Maruya K., Snyder S.A., Trenholm R.A., Vanderford B.J. // Environ. Toxicol. Chem. 2012. V. 31. № 12. P. 2674.
Arany E., Szabó R.K., Apáti L., Alapi T., Ilisz I., Mazellier P., Dombi A., Gajda-Schrantz K. // J. Hazard. Mater. 2013. V. 262. P. 151.
Ma D., Liu G., Lv W., Yao K., Zhang X., Xiao H. // Environ. Sci. Pollut. Res. 2014. V. 21. № 13. P. 7797.
Zheng B., Zheng Z., Zhang J., Liu Q., Wang J., Luo X., Wang L. // Environ. Eng. Sci. 2012. V. 29. № 6. P. 386.
Lan R.-J., Li J.-T., Sun H.-W., Su W.-B. // Water Sci. Technol. 2012. V. 66. № 12. P. 2695.
Felis E., Marciocha D., Surmacz-Gorska J., Miksch K. // Water Sci. Technol. 2007. V. 55. № 12. P. 281.
Jallouli N., Elghniji K., Hentati O., Ribeiro A.R., Silva A.M., Ksibi, M. // J. Hazard. Mater., 2016. V. 304. P. 329.
Romeiro A., Azenha M.E., Canle M., Rodrigues V.H., Da Silva J.P., Burrows H.D. // ChemistrySelect. 2018. V. 3. № 39. P. 10915.
Fan G., Ning R., Luo J., Zhang J., Hua P., Guo Y., Li Z. // J. Photochem. Photobiol. A. 2020. V. 386. P. 112108.
Li Z., Liu G., Su Q., Lv C., Jin X., Wen X. // Front. Chem. 2019. V. 7. P. 847.
Huaccallo-Aguilar Y., Álvarez-Torrellas S., Larriba M., Águeda V.I., Delgado J.A., Ovejero G., García J. // Catalysts. 2019, V. 9. № 3. P. 287.
Wang Y., Wang Q., Zhan X., Wang F., Safdar M., He J. // Nanoscale. 2013. V. 5. № 18. P. 8326.
Pelaez M., Nolan N.T., Pillai S.C., Seery M.K., Falaras P., Kontos A.G., Dunlop P.S., Hamilton J.W., Byrne J.A., O’shea K. // Appl. Catal. B. 2012. V. 125. P. 331.
Wang H., Zhang L., Chen Z., Hu J., Li S., Wang Z., Liu J., Wang X. // Chem. Soc. Rev. 2014. V. 43. № 15. P. 5234.
Hou W., Cronin S.B. // Adv. Funct. Mater. 2013. V. 23. № 13. P. 1612.
Zhou X., Liu G., Yu J., Fan W. // J. Mater. Chem. 2012. V. 22. № 40. P. 21337.
Cao J., Xu B., Luo B., Lin H., Chen S. // Appl. Surf. Sci. 2011. V. 257. № 16. P. 7083.
McEvoy J.G., Cui W., Zhang Z. // Appl. Catal. B. 2014. V. 144. P. 702.
Eliseev A., Yashina L., Brzhezinskaya M., Chernysheva M., Kharlamova M., Verbitsky N., Lukashin A., Kiselev N., Kumskov A., Zakalyuhin R. // Carbon. 2010. V. 48. № 10. P. 2708.
Zhu M., Chen P., Liu M. // ACS Nano. 2011. V. 5. № 6. P. 4529.
Kang S., Fang Y., Huang Y., Cui L.-F., Wang Y., Qin H., Zhang Y., Li X., Wang Y. // Appl. Catal. B. 2015. V. 168. P. 472.
Ghaly H. A., El-Kalliny A.S., Gad-Allah T.A., El-Sattar N.E.A., Souaya E.R. // RSC Adv. 2017. V. 7. № 21. P. 12726.
DellaGreca M., Brigante M., Isidori M., Nardelli A., Previtera L., Rubino M., Temussi F. // Environ. Chem. Lett. 2003. V. 1. № 4. P. 237.
Isidori M., Lavorgna M., Nardelli A., Parrella A., Previtera L., Rubino M. // Sci. Total Environ. 2005. V. 348. № 1. P. 93.
Barakat M., Schaeffer H., Hayes G., Ismat-Shah S. // Appl. Catal. B. 2005. V. 57. № 1. P. 23.
El-Kalliny A.S., Rivandi A.H., Uzun S., Ruud van Ommen J., Nugteren H.W., Rietveld L.C., Appel P.W. // Water Supply. 2019. V. 19. № 6. P. 1718.
Ray S.K., Dhakal D., Lee S.W. // Chem. Eng. J. 2018. V. 347. P. 836.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ