Кинетика и катализ, 2021, T. 62, № 3, стр. 305-315
Кинетика каталитического гидролиза концентрированных водных растворов NaBH4 на порошке Co/TiO2
С. И. Шабуня a, В. Г. Минкина a, *, В. И. Калинин a, Н. Д. Санкир b, С. Т. Алтаф b
a Институт тепло- и массообмена имени А.В. Лыкова Национальной академии наук Беларуси
220072 Минск, ул. П. Бровки, 15, Республика Беларусь
b TOBB Университет экономики и технологии, Согутозу C
4306560 Анкара, Турция
* E-mail: minkina@dnp.itmo.by
Поступила в редакцию 25.09.2020
После доработки 04.12.2020
Принята к публикации 28.01.2021
Аннотация
Представлены результаты экспериментальных исследований гидролиза концентрированных водных растворов борогидрида натрия в интервале концентраций 1.05–6.3 моль/кг и температур 20–80°C с использованием порошка Co/TiO2 в качестве модельного катализатора. По результатам экспериментов для кинетического режима гидролиза предложена аппроксимация скорости процесса, учитывающая неодноканальный характер гидролиза за счет введения линейной зависимости энергии активации от степени гидролиза.
ВВЕДЕНИЕ
Химические гидриды признаны перспективными материалами для хранения и подачи газообразного водорода в топливные элементы. Среди них выделяется борогидрид натрия (NaBH4). Применение процесса гидролиза NaBH4 для получения водорода имеет ряд преимуществ: образуется водород высокой чистоты и экологически безопасный продукт реакции метаборат натрия (NaBO2); используемые водные растворы NaBH4 невоспламеняемы; водород можно генерировать даже при низких температурах, а добавление катализатора позволяет ускорить выработку водорода [1, 2]. Все эти характеристики делают NaBH4 удобным источником водорода для портативных применений [3, 4]. За последние годы опубликовано большое количество работ, посвященных каталитическому гидролизу NaBH4 [5–7] и описанию данного процесса с помощью различных кинетических моделей [8–10]. В то же время механизм каталитического гидролиза до конца не изучен и остается интересной областью исследований особенно в случае растворов высоких концентраций, где актуальны и брутто модели, необходимые для решения прикладных задач.
Представляемые материалы – это результаты экспериментальных исследований кинетики каталитического гидролиза водных растворов NaBH4 с использованием порошка Co/TiO2 в качестве модельного катализатора, который разрабатывался для генератора водорода. Прикладная направленность работ определила диапазоны рассматриваемых концентраций и температур.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Химические реагенты для синтеза катализатора являются аналитически чистыми и не требуют дополнительной очистки. Поливинилпирролидон (ПВП) растворяли в деионизированной воде и в полученный раствор добавляли тетрагидрат ацетата кобальта Co(OAc)2, перемешивая до образования гомогенного раствора Co(OAc)2-ПВП. Наночастицы кобальта (NPs-Co) готовили, приливая деионизированный водный раствор NaBH4 в качестве восстановителя в раствор Co(OAc)2-ПВП при интенсивном перемешивании. Полученный черный порошок NPs-Co, отделенный от раствора, тщательно промывали деионизированной водой, ацетоном и гексаном, сушили в вакууме при 60°С и хранили в боксе. TiO2 – микронный порошок. Для нанесения NPs-Co на порошок TiO2 готовили две суспензии: NP-Co и TiO2 в гексане. Суспензии обрабатывали ультразвуком и перемешивали. Полученный серый порошок Co-TiO2 отделяли с помощью магнита и сушили в вакууме при 60°C. Удельную поверхность катализатора определяли методом БЭТ на анализаторе ASAP 2020 V3.04 H (“Micromeritics”, США), распределение частиц по размерам определяли с помощью лазерного анализатора частиц Analysette 22 NanoТec (“Fritsch GmbH”, Германия).
В качестве исходного компонента использовали гранулированный порошок NaBH4 “Sigma-Aldrich” (содержание основного вещества 98%).
Кинетические эксперименты проводили в реакторах с максимальной герметичностью, так как водород, выделяющийся в результате гидролиза NaBH4, обладает высокой текучестью. Все узлы и детали изготовлены из нержавеющей стали. Объем теплоизолированного реактора составляет 219.25 см3, диаметр – 5 см. Температуру раствора в реакторе регистрировали датчиком с платиновым термосопротивлением Pt100 (“Autonics Corporation”, Корея). В качестве измерителя давления использовали электронные датчики фирмы “Keller” (Швейцария) на рабочие давления 10, 25 и 50 бар.
При проведении экспериментов применяли методику восстановления степени гидролиза NaBH4 по измерениям температуры и давления в замкнутом реакторе. Такая методика предусматривает фиксирование изменения объема выделяющегося при гидролизе борогидрида натрия водорода. Перерасчет количества разложившегося NaBH4 выполняли, исходя из формулы брутто процесса
Степень разложения NaBH4 (ξ) в результате его гидролиза рассчитывали по соотношению
Применялись две методики экспериментов, которые условно можно назвать “изотермической” и “адиабатической”. Первый вариант в большей мере ориентирован на разработку кинетической модели, а второй приближен к способу использования катализатора в генераторе водорода.
Изотермические кинетические эксперименты по гидролизу водных растворов NaBH4 проводили в термостате. Методика предусматривает следующую последовательность действий: в термостате устанавливают заданную температура ${{T}_{0}}$ и помещают в него реактор с сухим порошком NaBH4 и катализатором; после нагрева реактора до температуры ${{T}_{0}}$ шприцем вводят дистиллированную воду и реактор герметизируют. С момента заливки воды и до окончания гидролиза фиксируют температуру раствора и давление в реакторе. В таких экспериментах теплота гидролиза отводится в термостат, но не с идеальной эффективностью, и в результате температура раствора слабо изменяется (возрастает) в момент максимальной скорости гидролиза. По мере уменьшения скорости процесса температура раствора становится практически равной температуре термостата.
Неизотермические эксперименты проводят без термостата в теплоизолированном реакторе. В ходе гидролиза температура раствора возрастает до некоторого максимума, а затем понижается по мере естественной теплоотдачи от реактора к окружающему воздуху. Когда реактор теплоизолирован, гидролиз протекает как бы в адиабатических условиях. Отличие от идеальных адиабатических условий, даже при идеальной теплоизоляции, состоит в потерях тепла для нагрева собственно реактора, что порождает пространственные неоднородности температуры и концентраций. Для точного количественного описания таких процессов требуется сложное трехмерное моделирование. Альтернативой является приближенное моделирование для средних по объему величин.
В табл. 1 приведены результаты проведенных экспериментов в термостате.
Диапазон выбранных концентраций растворов связан с разработкой малогабаритного генератора водорода. Низкие концентрации неинтересны, поскольку содержат мало водорода, а при $C_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}$ = 7 моль/кг конечный продукт метаборат натрия имеет концентрацию близкую к пределу растворимости. Ошибка определения степени разложения связана с расчетом давления пара воды над раствором и неконтролируемыми течами водорода через уплотнения. Последний фактор накапливается, и суммарная ошибка может достигать ~5% в конце процесса. Погрешности, связанные с взвешиванием NaBH4 и H2О и измерениями давления и температуры, много меньше.
Катализатор использовали многократно. После каждого эксперимента порошок промывали дистиллированной водой до установления pH 6–7 и высушивали при 50°С. В результате исследования образцов порошка на сканирующем электронном микроскопе SUPRA 55 (“Carl Zeiss”, Германия) было обнаружено, что после нескольких испытаний концентрация кобальта на поверхности увеличилась с 1.9 до 3.4 вес. %, а затем стабилизировалась. Данные экспериментов на воспроизводимость показали небольшое увеличение активности катализатора в первых 20 опытах, после чего шла его деградация (табл. 2). Опыты, проведенные для построения кинетических кривых, проводили с катализатором, который был использован 10–20 раз. Найденное распределение частиц деградировавшего катализатора по размеру показало сокращение доли частиц малых размеров (<2 мкм), что привело к уменьшению удельной поверхности примерно вдвое.
Таблица 1.
Экспериментальные результаты каталитического гидролиза водных растворов NaBH4
| Реактор в термостате | |||||||
|---|---|---|---|---|---|---|---|
| № | ${{T}_{{{\text{ts}}}}}$, °С | $m_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}$, г | ${{m}_{{{\text{cat}}}}}$, г | $m_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{0}$, г | $C_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}$, моль/кг | ${{\xi }_{{\max }}}$ | ${{t}_{{\xi = 0.9}}}$, с |
| 1 | 20 | 0.8 | 0.4 | 10 | 2.12 | 0.94 | 5860 |
| 2 | 20 | 1.6 | 0.4 | 10 | 4.24 | 0.97 | 10980 |
| 3 | 20 | 2.4 | 0.4 | 10 | 6.36 | 0.96 | 19900 |
| 4 | 30 | 1.6 | 0.4 | 10 | 4.24 | 0.96 | 4030 |
| 5 | 40 | 1.6 | 0.4 | 10 | 4.24 | 0.97 | 1310 |
| 6 | 40 | 2.1 | 0.4 | 10 | 5.56 | 0.97 | 1810 |
| 7 | 40 | 2.4 | 0.4 | 10 | 6.36 | 0.97 | 1830 |
| 8 | 60 | 1.6 | 0.4 | 10 | 4.24 | 0.97 | 270 |
| 9 | 80 | 1.6 | 0.4 | 10 | 4.24 | 0.96 | 145 |
| 10 | 20 | 0.1 | 0.4 | 10 | 0.265 | 0.87 | 1500 |
| 11 | 20 | 0.4 | 0.4 | 10 | 1.06 | 0.93 | 3740 |
| 12 | 40 | 1.6 | 0.03 | 10 | 4.24 | 0.96 | 18475 |
| 13 | 60 | 0.8 | 0.03 | 10 | 2.12 | 0.96 | 2025 |
| 14 | 60 | 1.6 | 0.03 | 10 | 4.24 | 0.99 | 4200 |
| 15 | 60 | 2.1 | 0.03 | 10 | 5.56 | 0.97 | 5140 |
| 16 | 60 | 2.4 | 0.03 | 10 | 6.36 | 0.97 | 7135 |
| 17 | 80 | 2.4 | 0.03 | 10 | 6.36 | 0.96 | 1350 |
| Теплоизолированный реактор | |||||||
| 18 | – | 2.1 | 0.4 | 40 | 1.39 | 0.92 | 9710 |
| 19 | – | 2.1 | 0.4 | 30 | 1.85 | 0.95 | 4900 |
| 20 | – | 2.1 | 0.4 | 20 | 2.78 | 0.94 | 3300 |
| 21 | – | 1.05 | 0.4 | 10 | 2.78 | 0.93 | 1665 |
| 22 | – | 1.6 | 0.4 | 10 | 4.24 | 0.94 | 2060 |
| 23 | – | 2.1 | 0.4 | 10 | 5.56 | 0.95 | 2725 |
| 24 | – | 2.4 | 0.4 | 10 | 6.36 | 0.95 | 5635 |
Прочерки означают, что в соответствующих экспериментах реактор в термостат не помещали.
Примечание. ${{T}_{{{\text{ts}}}}}$ – температура термостата; $m_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}$ – исходная масса NaBH4; ${{m}_{{{\text{cat}}}}}$ – количество катализатора; $m_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{0}$ – исходная масса воды; $C_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}$ – начальная моляльная концентрация NaBH4; ${{\xi }_{{\max }}}$ – конечная степень разложения NaBH4; ${{t}_{{\xi = 0.9}}}$ – длительность эксперимента при $\xi = 0.9$.
РАЗРАБОТКА И НАСТРОЙКА КИНЕТИЧЕСКОЙ МОДЕЛИ
Сформулируем простейшую схему физических и химических процессов каталитического гидролиза водных растворов NaBH4, на основе которых будут записаны математические соотношения модели. Первое и проблематичное физическое допущение – это мгновенное приготовление водного раствора NaBH4. Большинство моделей гидролиза использует такое допущение в форме: “рассмотрим водный раствор NaBH4 с концентрацией $C_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}$, температурой ${{T}_{0}}$ и с равномерным распределением порошкового катализатора по объему этого раствора”. Проблемы, связанные со временем растворения, неравномерностью концентраций во время растворения, выделением тепла растворения, неравномерностью полей температуры и распределения катализатора в растворе и протеканием гидролиза в таких условиях остаются за рамками модели. В зависимости от применяемой методики эксперимента начальный участок гидролиза имеет свою длительность и свои особенности эволюции свойств раствора. По истечении некоторого времени ${{t}_{0}}$ раствор можно считать “однородным”. В растворах относительно низкой концентрации NaBH4 преобладают эффекты неоднородности концентрации и неравномерности распределения катализатора, а в случае высоких концентраций NaBH4 главными становятся тепловые эффекты. В связи с этим при обработке экспериментальных данных требуется индивидуальная обработка начального участка, т.е. определение ${{t}_{0}}$, степени разложения $\xi \left( {{{t}_{0}}} \right)$ и температуры $T\left( {{{t}_{0}}} \right)$. Для кинетических исследований следует использовать данные при $t > {{t}_{0}}$.
Гидролиз в растворе NaBH4 протекает и на поверхности катализатора, и в объеме раствора. При значительном преобладании гетерогенного процесса гидролиз можно считать “каталитическим”, при этом реализуется либо кинетический, либо диффузионный режим. Кинетический режим реализуется, если скорость переноса реагентов к поверхности катализатора превышает скорость химической реакции. Отметим, что конечная стадия гидролиза всегда идет в диффузионном режиме.
Исследователи часто стараются описать весь процесс гидролиза, т.е. и кинетическую, и диффузионную стадию, в виде единого “кинетического” уравнения. На самом деле диффузионная стадия процесса не зависит от кинетических свойств катализатора, а отражает специфику гидродинамических и диффузионных процессов в реакторе конкретной формы и при использовании конкретного катализатора. Результаты успешного описания диффузионной стадии в том или ином исследовании все равно придется творчески адаптировать для своего реактора, т.е. построить свою диффузионную схему. Из-за медленности диффузионной стадии в большинстве приложений ограничиваются некоторой разумной степенью гидролиза $\xi $ < 1, исходя из соображений оптимальности габаритов, производительности и цены устройства. Мы ограничились разработкой модели только кинетического режима каталитического процесса, для чего выбирали такие участки экспериментальных кривых, где гидролиз протекал в соответствующем режиме, и выполнялось требование преобладания гетерогенного процесса над гомогенным. В результате для настройки модели из 24 экспериментов (табл. 1 ) были отобраны № 1–9.
Выбор функциональной зависимости для скорости гидролиза определяется спецификой химического процесса. Гидролиз NaBH4 часто моделируют в брутто приближении, хотя известно, что выделение водорода осуществляется в четыре этапа, со следующими превращениями ионов [11]:
(I)
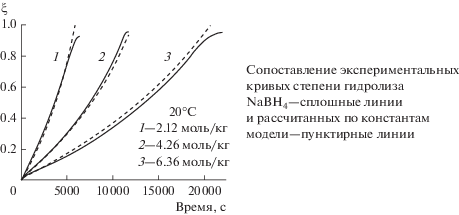
$\begin{gathered} {\text{BH}}_{4}^{ - }\xrightarrow{{ \uparrow {{{\text{H}}}_{2}}}}{\text{B}}{{{\text{H}}}_{3}}{\text{O}}{{{\text{H}}}^{ - }}\xrightarrow{{ \uparrow {{{\text{H}}}_{2}}}} \\ \to {\text{B}}{{{\text{H}}}_{2}}\left( {{\text{OH}}} \right)_{2}^{ - }\xrightarrow{{ \uparrow {{{\text{H}}}_{2}}}} \\ \to {\text{BH}}\left( {{\text{OH}}} \right)_{3}^{ - }\xrightarrow{{ \uparrow {{{\text{H}}}_{2}}}}{\text{B}}\left( {{\text{OH}}} \right)_{4}^{ - }. \\ \end{gathered} $Поскольку лимитирующим процессом является первый этап, а последующие этапы “быстрые” [12], этот факт служит основанием для использования модели брутто реакции. Альтернативный подход с учетом всех четырех этапов включал бы большое количество кинетических коэффициентов, определять которые на основе экспериментов, измеряющих только степень превращения (брутто характеристика) не корректно. Простая экспериментальная методика предполагает модель с малым количеством параметров. В кинетическом режиме при постоянной температуре график $\xi \left( t \right)$ должен быть линейным, но в экспериментах № 1–3, которые практически изотермические, графики демонстрируют слабое, но явное ускорение гидролиза со временем (рис. 1а, сплошные линии).
Рис. 1.
Сопоставление экспериментальных кривых функций ${{\xi }_{{\exp }}}\left( t \right)$ (сплошные линии) и функций ${{\xi }_{{{\text{calc}}}}}\left( t \right)$, рассчитанных по константам модели (7) (пунктирные линии).
Такое поведение кривых требует анализа. Мы сформулировали две гипотезы. Первая – температурная – предполагает, что наблюдаемое ускорение объясняется нагревом раствора. Измеренные значения ${{T}_{{\exp }}}\left( t \right)$ являются некоторым средним, которое зависит от ряда неконтролируемых процессов переноса тепла от раствора к реактору и далее в термостат. Максимальная температура в растворе всегда будет выше, чем измеренная, и чтобы приблизиться к реальной ситуации, требуется добавлять к температуре ${{T}_{{\exp }}}$ некоторую величину, которая в первом приближении пропорциональна тепловому потоку, т.е. разности ${{T}_{{\exp }}}$ и температуры термостата ${{T}_{{{\text{ts}}}}}$: $T = {{T}_{{\exp }}} + \beta \left( {{{T}_{{\exp }}} - {{T}_{{{\text{ts}}}}}} \right)$, где $\beta $ – компенсирующий параметр. Вторая гипотеза – кинетическая – предполагает, что в зависимости от степени гидролиза изменяется эффективная энергия активации брутто процесса. Такую ситуацию можно смоделировать, введя линейную зависимость энергии активации процесса от степени превращения: $U = {{U}_{{{\text{get}}}}} - {{u}_{{{\text{get}}}}}\xi $. С учетом этих предположений аппроксимация Аррениуса константы скорости гетерогенного гидролиза запишется в виде:
(1)
${{A}_{{{\text{get}}}}} = {{a}_{{{\text{get}}}}}\exp \left( { - \frac{{{{U}_{{{\text{get}}}}} - {{u}_{{{\text{get}}}}}\xi }}{T}} \right),$В рамках брутто модели под количеством молей реагента nreag мы понимаем сумму молей ионов:
(2)
${{n}_{{{\text{reag}}}}} = {{n}_{{{\text{BH}}_{4}^{ - }}}} + {{n}_{{{\text{B}}{{{\text{H}}}_{{\text{3}}}}{\text{O}}{{{\text{H}}}^{ - }}}}} + {{n}_{{{\text{B}}{{{\text{H}}}_{{\text{2}}}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{ - }}}} + {{n}_{{{\text{BH}}\left( {{\text{OH}}} \right)_{{\text{3}}}^{ - }}}}.$Для записи кинетического уравнения, описывающего эволюцию ${{n}_{{{\text{reag}}}}}$, надо предположить, какие частицы адсорбируются на поверхности катализатора. Адсорбироваться должны нейтральные частицы, участвующие в гидролизе. В растворе NaBH4 это могут быть молекулы воды или комплексы $\left[ {{\text{BH}}_{4}^{ - }{\text{H}}_{{}}^{ + }} \right]$, $\left[ {{\text{B}}{{{\text{H}}}_{3}}{\text{O}}{{{\text{H}}}^{ - }} \cdot {{{\text{H}}}^{ + }}} \right]$, $\left[ {{\text{B}}{{{\text{H}}}_{2}}({\text{OH}})_{2}^{ - } \cdot {{{\text{H}}}^{ + }}} \right]$ и $\left[ {{\text{BH}}({\text{OH}})_{3}^{ - } \cdot {{{\text{H}}}^{ + }}} \right]$. Модель с адсорбцией четырех метастабильных комплексов кажется громоздкой, поэтому рассмотрим вариант, в котором катализатор адсорбирует молекулы воды. В рамках такой гипотезы молекулы воды в адсорбированном состоянии (${{H}_{2}}{{{\text{O}}}^{{\text{S}}}}$) становятся активными, так что ускоряются необратимые реакции, которые можно записать в виде:
(II)
$\begin{gathered} {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}^{{\text{S}}}} + {\text{BH}}_{4}^{ - } \to {\text{H}}_{2}^{{}} + {\text{B}}{{{\text{H}}}_{3}}{\text{O}}{{{\text{H}}}^{ - }}, \\ {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}^{{\text{S}}}} + {\text{B}}{{{\text{H}}}_{{\text{3}}}}{\text{O}}{{{\text{H}}}^{ - }} \to {\text{H}}_{2}^{{}} + {\text{B}}{{{\text{H}}}_{2}}\left( {{\text{OH}}} \right)_{2}^{ - }, \\ {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}^{{\text{S}}}} + {\text{B}}{{{\text{H}}}_{{\text{2}}}}\left( {{\text{OH}}} \right)_{2}^{ - } \to {\text{H}}_{2}^{{}} + {\text{BH}}\left( {{\text{OH}}} \right)_{3}^{ - }, \\ {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}^{{\text{S}}}} + {\text{BH}}\left( {{\text{OH}}} \right)_{3}^{ - } \to {\text{H}}_{2}^{{}} + {\text{B}}\left( {{\text{OH}}} \right)_{4}^{ - }, \\ \end{gathered} $(III)
$\begin{gathered} {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}^{{\text{S}}}} + \left[ {{\text{BH}}_{4}^{ - } \cdot {{{\text{H}}}^{ + }}} \right] \to {\text{H}}_{2}^{{}} + \left[ {{\text{B}}{{{\text{H}}}_{{\text{3}}}}{\text{O}}{{{\text{H}}}^{ - }} \cdot {{{\text{H}}}^{ + }}} \right], \\ {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}^{{\text{S}}}} + \left[ {{\text{B}}{{{\text{H}}}_{{\text{3}}}}{\text{O}}{{{\text{H}}}^{ - }} \cdot {{{\text{H}}}^{ + }}} \right] \to {\text{H}}_{2}^{{}} + \left[ {{\text{B}}{{{\text{H}}}_{2}}\left( {{\text{OH}}} \right)_{2}^{ - } \cdot {{{\text{H}}}^{ + }}} \right], \\ {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}^{{\text{S}}}} + \left[ {{\text{B}}{{{\text{H}}}_{{\text{2}}}}\left( {{\text{OH}}} \right)_{2}^{ - } \cdot {{{\text{H}}}^{ + }}} \right] \to {\text{H}}_{2}^{{}} + \left[ {{\text{BH}}\left( {{\text{OH}}} \right)_{3}^{ - } \cdot {{{\text{H}}}^{ + }}} \right], \\ {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}^{{\text{S}}}} + \left[ {{\text{BH}}\left( {{\text{OH}}} \right)_{3}^{ - } \cdot {{{\text{H}}}^{ + }}} \right] \to {\text{H}}_{2}^{{}} + \left[ {{\text{B}}\left( {{\text{OH}}} \right)_{4}^{ - } \cdot {{{\text{H}}}^{ + }}} \right]. \\ \end{gathered} $В такой модели количество свободных и занятых молекулами воды активных центров является равновесной характеристикой, которая зависит от констант сорбции/десорбции катализатора. В любом случае поток молекул воды на единицу поверхности катализатора будет пропорционален их числовой плотности в растворе. В чистой воде количество занятых центров на единице поверхности катализатора максимальное. По мере увеличения концентрации NaBH4 количество занятых центров, в принципе, должно снижаться, поскольку уменьшается числовая плотность молекул воды в растворе. Скорость гидролиза в кинетическом режиме пропорциональна числу адсорбированных молекул воды, т.е. для каждой концентрации NaBH4 будет своя скорость, причем тем меньше, чем выше концентрация.
Если в реальном процессе реализуются оба канала (II) и (III), то скорость гидролиза – это сумма двух выражений Аррениуса с постоянными энергиями активации. В этом случае дополнительно потребуются кинетические соотношения для расчета концентрации нейтральных комплексов и ионов в растворе, что значительно усложнит модель. Здесь мы ограничились более простым подходом с одним каналом, т.е. выражением (1), в котором уменьшение энергии активации с ростом степени разложения NaBH4 моделирует конкуренцию процессов (II) и (III).
Оценим зависимость потока молекул воды на поверхность катализатора с ростом концентрации NaBH4. Начальный раствор состоит из $n_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{0} = {{m_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{0}} \mathord{\left/ {\vphantom {{m_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{0}} {{{M}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}} \right. \kern-0em} {{{M}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}$ молей воды и $n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0} = {{m_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}} \mathord{\left/ {\vphantom {{m_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}} {{{M}_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}}}}} \right. \kern-0em} {{{M}_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}}}}$ молей NaBH4 (${{M}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ и ${{M}_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}}$ – молекулярные массы H2O и NaBH4). Поскольку NaBH4 диссоциирован, то в растворе находятся положительные ионы ${\text{N}}{{{\text{a}}}^{ + }}$ в количестве, равном $n_{{{\text{N}}{{{\text{a}}}^{{\text{ + }}}}}}^{{}} = n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}$, и пять основных отрицательных ионов ${\text{BH}}_{4}^{ - }$, ${\text{B}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}_{{}}^{ - }$, ${\text{B}}{{{\text{H}}}_{{\text{2}}}}({\text{OH}})_{2}^{ - }$, ${\text{BH}}({\text{OH}})_{3}^{ - }$, ${\text{B}}({\text{OH}})_{4}^{ - }$ с суммарным количеством примерно равным $n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}$. Другие частицы ${{{\text{H}}}_{{\text{3}}}}{\text{O}}_{{}}^{ + }$, ${\text{OH}}_{{}}^{ - }$ и ${\text{B}}({\text{OH}})_{3}^{{}}$ содержатся в растворе в существенно меньших количествах, которые не влияют на расчет потока молекул воды на единицу поверхности катализатора. Суммарный поток частиц на поверхность катализатора пропорционален количеству частиц в единице объема ${{n}_{{{\text{sum}}}}}$, а поток молекул воды – их количеству в единице объема ${{n}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$. Доля потока молекул воды – это отношение ${{{{n}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} \mathord{\left/ {\vphantom {{{{n}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} {{{n}_{{{\text{sum}}}}}}}} \right. \kern-0em} {{{n}_{{{\text{sum}}}}}}}$. Хотя во многих работах конечным продуктом гидролиза NaBH4 считается NaBO2, более точно записывать брутто реакцию, используя NaB(OН)4:
(IV)
${\text{NaB}}{{{\text{H}}}_{{\text{4}}}} + {\text{4}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{4}}{{{\text{H}}}_{{\text{2}}}} + {\text{NaB}}{{\left( {{\text{OН}}} \right)}_{{\text{4}}}}.$Исходя из реакции (IV) можно записать изменение количества молекул воды ${{n}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ в зависимости от степени разложения $\xi $:
(3)
$n_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{0} = n_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{0} - 4\xi n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}.$Суммарное количество частиц в растворе будет складываться из молекул воды (3), ионов ${\text{N}}{{{\text{a}}}^{{\text{ + }}}}$ и всех ионов с бором. В результате имеем:
(4)
${{n}_{{{\text{sum}}}}} \approx n_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{0} - 4\xi n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0} + 2n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}.$Тогда доля потока частиц, определяющих адсорбцию, будет:
(5)
$\frac{{{{n}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}{{{{n}_{{{\text{sum}}}}}}} \approx {1 \mathord{\left/ {\vphantom {1 {\left( {1 + \frac{{2n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}}}{{n_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{0} - 4\xi n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}}}} \right)}}} \right. \kern-0em} {\left( {1 + \frac{{2n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}}}{{n_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{0} - 4\xi n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}}}} \right)}}.$Используя выражение для степени разложения $\xi = 1 - {{{{n}_{{{\text{reag}}}}}} \mathord{\left/ {\vphantom {{{{n}_{{{\text{reag}}}}}} {n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}}}} \right. \kern-0em} {n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}}}$, можно записать кинетическое уравнение
(6)
$\frac{{{\text{d}}{{n}_{{{\text{reag}}}}}}}{{{\text{d}}t}} = - n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}\frac{{{\text{d}}\xi }}{{{\text{d}}t}} = - {{S}_{{{\text{cat}}}}}{{m}_{{{\text{cat}}}}}\frac{{{{n}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}{{{{n}_{{{\text{sum}}}}}}}{{A}_{{{\text{get}}}}}\left( {T,\xi } \right).$Записывая кинетическое уравнение в виде (6), мы предполагаем, что
Поскольку у нас не было достаточно обоснованного выражения для расчета ${{A}_{{{\text{gom}}}}}$ в исследуемых условиях гидролиза, решение о применимости чисто каталитической модели принималось исходя из вида экспериментальных кривых. Подставляя выражение (5) в (6), получаем следующий вид кинетического уравнения:
(7)
$\frac{{{\text{d}}\xi }}{{{\text{d}}t}} = \frac{{{{m}_{{{\text{cat}}}}}{{S}_{{{\text{cat}}}}}{{a}_{{{\text{get}}}}}\exp \left( { - \frac{{{{U}_{{{\text{get}}}}} - {{u}_{{{\text{get}}}}}\xi }}{T}} \right)}}{{n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}\left( {1 + \frac{{2n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}}}{{n_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{0} - 4\xi n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}}}} \right)}}.$Для расчетов по (7) кроме констант требуется функция $T\left( t \right)$, в выражение которой входит измеренная функция ${{T}_{{\exp }}}\left( t \right)$ и неизвестный параметр $\beta $, введенный для коррекции теплообмена. При заданных константах ${{m}_{{{\text{cat}}}}}$, ${{S}_{{{\text{cat}}}}}$, $n_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{0}$, $n_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}$, ${{a}_{{{\text{get}}}}}$, ${{U}_{{{\text{get}}}}}$, ${{u}_{{{\text{get}}}}}$ и $\beta $ по уравнению (7) можно рассчитать функцию ${{\xi }_{{{\text{calc}}}}}\left( t \right)$ и построить функционал невязки экспериментальных и расчетных значений, зависящий от констант модели ${{a}_{{{\text{get}}}}}$, ${{U}_{{{\text{get}}}}}$, ${{u}_{{{\text{get}}}}}$, $\beta $. Значения параметров ${{a}_{{{\text{get}}}}}$, ${{U}_{{{\text{get}}}}}$, ${{u}_{{{\text{get}}}}}$, $\beta $, при которых функционал невязок имеет минимум, считаются оптимальными для модели (7). Первые три – именно кинетические, а параметр $\beta $ – это адаптация измерений температуры к модели расчета. Для расчета невязки использовался функционал:
(8)
$\begin{gathered} {\text{Dev}}\left( {{{a}_{{{\text{get}}}}},{{U}_{{{\text{get}}}}},{{u}_{{{\text{get}}}}},\beta } \right) = \frac{1}{9} \times \\ \times \,\,{{\sum\limits_{i = 1}^9 {\left( {\frac{1}{{{{t}_{{{\text{end\_}}i}}} - {{t}_{{0\_i}}}}}\int\limits_{{{t}_{{0\_i}}}}^{{{t}_{{end\_i}}}} {{{{\left( {{{\xi }_{{{\text{calc}}\_i}}}\left( t \right) - {{\xi }_{{\exp \_i}}}\left( t \right)} \right)}}^{2}}{\text{d}}t} } \right)} }^{{0.5}}}. \\ \end{gathered} $Пределы интегрирования по времени ${{t}_{{0\_i}}}$, ${{t}_{{{\text{end\_}}i}}}$ для каждого эксперимента выбирались таким образом, чтобы исключить начальный участок растворения и конечный участок гидролиза в диффузионном режиме. Дополнительное ограничение связано с интервалами времени, в которых происходит быстрый и значительный разогрев раствора. В такие моменты времени значения функции ${{\xi }_{{\exp }}}\left( t \right)$ имеют неконтролируемые погрешности, связанные с использованием модели равновесного испарения воды, а функция ${{\xi }_{{\exp }}}\left( t \right)$ не учитывает возникающие сильные неоднородности температуры раствора. Минимизация функционала (8) была выполнена в трех вариантах (табл. 3).
Таблица 3.
Значения параметров модели (7)
| Номер варианта | $\beta $ | ${{u}_{{{\text{get}}}}}$, К | ${{a}_{{{\text{get}}}}}$, моль кг–1 c–1 | ${{U}_{{{\text{get}}}}}$, К | Невязка |
|---|---|---|---|---|---|
| 1 | 0 | 303 | 1.102 × 105 | 7950 | 0.0154 |
| 2 | 0.142 | 275 | 0.695 × 105 | 7810 | 0.0143 |
| 3 | 0.159 | 0 | 0.403 × 105 | 7570 | 0.0285 |
В первом варианте нет коррекции температуры, т.е. $\beta $ = 0. Во втором варианте включение дополнительного параметра $\beta $ немного уменьшило невязку (8). Третий вариант минимизации – без изменения энергия активации, ${{u}_{{{\text{get}}}}}$ = 0. В этом случае невязка (8) значительно увеличилась, и исчез эффект ускорения гидролиза с ростом степени разложения. Как видно, кинетические параметры изменяются не принципиально, но качественное поведение экспериментальных кривых описывает только модель с ${{u}_{{{\text{get}}}}}$ > 0. Влияние ошибок измерения температуры относительно слабое, но поскольку коррекция температуры физически обоснована, мы считаем предпочтительным второй набор кинетических параметров.
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
На рис. 1–4 приводится сопоставление экспериментальных кривых степени разложения ${{\xi }_{{\exp }}}\left( t \right)$ и ${{\xi }_{{{\text{calc}}}}}\left( t \right)$, рассчитанных по найденным константам модели (7).
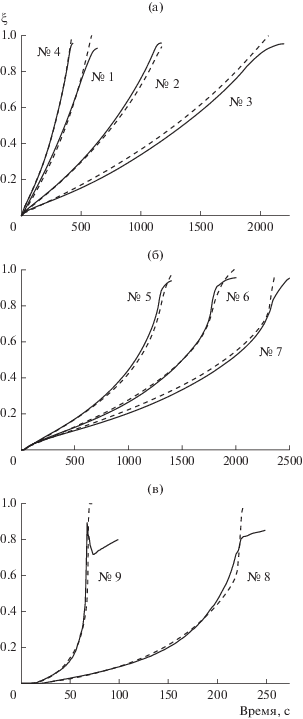
Рис. 2.
Зависимость степени разложения NaBH4 от времени в термостатируемом реакторе растворов с $C_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}$ = 0.265 (№ 10) и 1.06 моль/кг (№ 11); ${{\xi }_{{\exp }}}\left( t \right)$ – сплошные линии, ${{\xi }_{{{\text{calc}}}}}\left( t \right)$ – пунктирные линии.
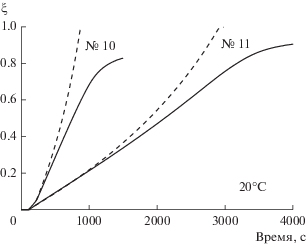
Рис. 3.
Влияние гомогенных процессов, проходящих в термостатируемом реакторе с ${{m}_{{{\text{cat}}}}}$ = 0.03 г; ${{\xi }_{{\exp }}}\left( t \right)$ – сплошные линии, ${{\xi }_{{{\text{calc}}}}}\left( t \right)$ – пунктирные линии.
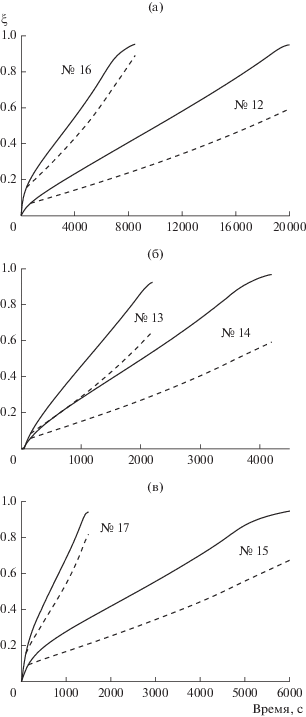
Рис. 4.
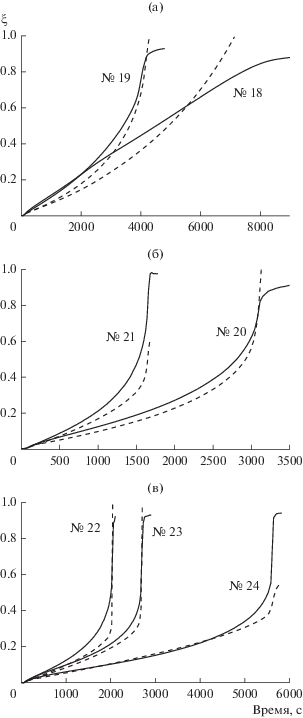
Сопоставление экспериментальных кривых функций ${{\xi }_{{\exp }}}\left( t \right)$ (сплошные линии) и ${{\xi }_{{{\text{calc}}}}}\left( t \right)$ (пунктирные линии) в теплоизолированном реакторе.
Для экспериментов в термостате № 1–9, по которым выполнялась настройка, совпадение очень хорошее (рис. 1), но следует заметить, что варьировались не все параметры рабочих растворов: изменялись ${{T}_{{{\text{ts}}}}}$ = 20–80°С и $m_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}$ = 0.8–2.4 г при ${{m}_{{{\text{cat}}}}}$ = 0.4 г и $m_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{0}$ = 10 г.
Моделирование других экспериментов из табл. 1 показывает следующее. Эксперименты № 10–11 имеют относительно низкие концентрации, и для них модель завышает скорость гидролиза, причем отклонение больше для более низкой концентрации (рис. 2). Вероятным объяснением является переход гидролиза в диффузионный режим, который не описывается моделью кинетического режима.
В серии экспериментов № 12–17 катализатора мало, и гомогенные процессы сопоставимы с гетерогенными, что приводит к заниженным значениям рассчитанной степени гидролиза (рис. 3). Такие эксперименты нельзя описывать чисто каталитической моделью, необходимо учитывать и гомогенный процесс. С ростом температуры роль гомогенных процессов уменьшается, что естественно, поскольку энергия активации гетерогенного процесса ниже, чем гомогенного.
Эксперименты в теплоизолированном реакторе № 18–24 соответствуют условиям применимости каталитической модели, и их моделирование в области относительно медленного изменения температур дает разумные результаты (рис. 4).
По концентрации раствора и рабочим температурам эксперимент № 18 (рис. 4а) близок к эксперименту № 11 (рис. 2), но объем раствора в № 18 в четыре раза больше. В обоих опытах экспериментальные кривые имеют диффузионный характер, а особенности эксперимента № 18 можно объяснить спецификой растворения порошка в большом объеме.
В теплоизолированном реакторе реализуются режимы с высокими температурами и большими производными $T{\kern 1pt} '\left( t \right)$. В таких условиях приближение единой температуры порождает ошибки и в значениях ${{\xi }_{{\exp }}}\left( t \right)$, поскольку при их расчете используется равновесное давление пара воды, вычисленное по показаниям термопары, и в расчете ${{\xi }_{{{\text{calc}}}}}\left( t \right)$, предполагающем раствор без пространственных неоднородностей.
Эксперименты в теплоизолированном реакторе проводили с целью достижения эффекта разогрева раствора для быстрого завершения гидролиза. Тепловой эффект гидролиза ${\text{NaB}}{{{\text{H}}}_{{\text{4}}}}$ $\Delta {{H}_{{{\text{hydr}}}}}$ = = 212 кДж/моль. В диапазоне наших рабочих концентраций (1–6.36 моль/кг) адиабатический нагрев раствора изменяется практически линейно примерно от 50 до 300°C. Из-за теплообмена раствора с массивным стальным реактором максимальная температура раствора всегда будет ниже адиабатической, и ее эволюцию упрощенно описывает уравнение:
Профили температуры в экспериментах № 18–24 разбиты на две группы и показаны на рис. 5. В экспериментах на рис. 5a начальная масса воды постоянная, а рост концентрации достигается увеличением массы NaBH4. Для экспериментов на рис. 5б постоянной является масса NaBH4, а варьируется масса воды.
Рис. 5.
Профили температур в теплоизолированном реакторе: а – $C_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}$= 2.78 (1), 4.24 (2), 5.56 (3), 6.36 моль/кг (4); б – $C_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}$= 1.39 (1); 1.85 (2), 2.78 (3), 5.56 моль/кг (4).
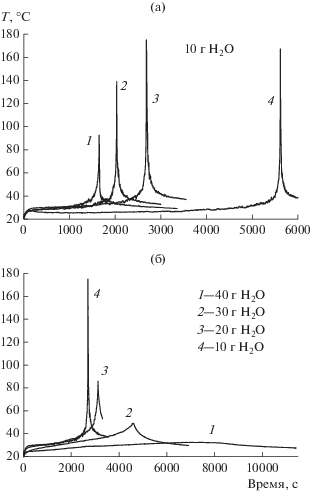
При низких концентрациях раствора нагрев раствора незначительно ускоряет гидролиз. При старте процесса в комнатных условиях существенный разогрев раствора и ускорение гидролиза наблюдается при $C_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0} \geqslant $ 2.5 моль/кг.
При сравнении экспериментов № 2 и № 22 с $C_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}$= 4.24 моль/кг можно отметить, что степень разложения $\xi = 0.9$ в теплоизолированном реакторе достигается быстрее в 5.3 раза, а для экспериментов № 3 и № 24 с $C_{{{\text{NaB}}{{{\text{H}}}_{{\text{4}}}}}}^{0}$ = 6.36 моль/кг – в 3.5 раза. Приведенные значения не универсальны, поскольку результат зависит от ряда других параметров, таких как начальная температура, масса реактора, условия теплообмена.
ЗАКЛЮЧЕНИЕ
Кинетическое уравнение (7), дополненное уравнением энергии, учитывающим теплообмен в реальной конструкции реактора, позволяет проводить оптимизационные расчеты под сформулированные технологические требования.
Предложенная простая модель кинетической стадии каталитического гидролиза использует всего три кинетические константы. Тем не менее, она позволяет рассчитывать производство водорода в водных растворах NaBH4 высокой концентрации с порошковым катализатором кобальта. Скорее всего, аналогичный подход можно применить и для порошковых катализаторов с другими активными металлами. Предположения о снижении энергии активации с ростом степени превращения и об уменьшении заселенности поверхности катализатора активными частицами с повышением концентрации растворов являются чисто феноменологическими. Можно предложить другие схемы, но они будут использовать большее количество неизвестных констант модели.
Одним из вариантов может быть сосуществование двух гетерогенных каналов (II) и (III) с разными энергиями активации. По мере роста степени гидролиза в растворе будет расти рН, что меняет соотношение между количеством ионов ${\text{BH}}_{4}^{ - }$ и их нейтральных комплексов $\left[ {{\text{BH}}_{4}^{ - } \cdot {\text{H}}_{{}}^{ + }} \right]$. Тем самым изменяется вклад каналов (II) и (III) в производстве водорода, что в брутто модели выглядит как уменьшение энергии активации. Для реализации такой модели потребуются не только константы для двух гетерогенных каналов, но и гомогенная модель равновесия образования и разрушения комплексов $\left[ {{\text{BH}}_{4}^{ - } \cdot {\text{H}}_{{}}^{ + }} \right]$.
Полученное значение энергии активации равное 65 кДж/моль (7810 К) не выпадает из ряда значений, приводимых другими авторами для катализатора кобальта [13–15], и может использоваться как хорошее начальное приближение для более сложных моделей.
Список литературы
Amendola S.C., Sharp-Goldman S.L., Janjua M.S., Spencer N.C., Kelly M.T., Petillo P.J., Binder M. // Int. J. Hydrogen Energy. 2000. V. 25. № 10. P. 969.
Ay M., Midilli A., Dincer I. // J. Power Sources. 2006. V. 157. P. 104.
Santos D.M.F., Sequeira C.A.C. // Renew. Sust. Energ. Rev. 2011. V. 15. № 8. P. 3980.
Marrero-Alfonso E.Y., Beaird A.M., Davis T.A., Matthews M.A. // Ind. Eng. Chem. Res. 2009. V. 48. № 3. P. 3703.
Ekinci A. // Кинетика и катализ. 2020. Т. 61. № 4. С. 540.
Brack P., Dann S.E., Wijayantha K.G.U. // Energy Sci. Eng. 2015. V. 3. № 3. P. 174.
Xin Y., Wang Z., Jiang Y. // Mater. Res. Express. 2019. V. 6. № 12. P. 125530.
Hung A.-J., Tsai S.-F., Hsu Ya-Yi, Ku J.-R., Chen Y.-H., Yu C.-C. // Int. J. Hydrogen Energy. 2008. V. 33. № 21. P. 6205.
Retnamma R., Novais A.Q., Rangel C.M. // Int. J. Hydrogen Energy. 2011. V. 29. № 3. P. 263.
Demirci U.B., Miele P. // Comptes Rendus Chimie. 2014. V. 17. № 7–8. P. 707.
Мочалов К.Н., Хаин В.С. // Кинетика и катализ. 1965. Т. 6. № 4. С. 541.
Gardiner J.A., Collat J.W. // J. Am. Chem. Soc. 1965. V. 87. № 8. P. 1692.
Zhao J.Z., Ma H., Chen J. // Int. J. Hydrogen Energy. 2007. V. 32. № 18. P. 4711.
Zhang X., Zhao J., Cheng F., Liang J., Tao Z., Chen J. // Int. J. Hydrogen Energy. 2010. V. 35. № 15. P. 8363.
Lu Y.C., Chen M.S., Chen Y.W. // Int. J. Hydrogen Energy. 2012. V. 37. № 5. P. 4254.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


