Кинетика и катализ, 2021, T. 62, № 3, стр. 343-353
Механизм антиоксидантного действия и взаимосвязь строения и активности N-монозамещенных аминокислотных производных фуллерена С60
В. А. Волков a, *, М. В. Воронков a, Н. Н. Сажина a, Д. В. Курилов b, Д. В. Вохмянина c, О. В. Ямскова d, Ю. Ц. Мартиросян a, e, Д. Л. Атрошенко c, Л. Ю. Мартиросян a, e, В. С. Романова d
a ФГБУН Институт биохимической физики имени Н.М. Эмануэля Российской академии наук
119334 Москва, ул. Косыгина, 4, Россия
b ФГБУН Институт органической химии им. Н.Д. Зелинского Российской академии наук
119991 Москва, Ленинский просп., 47, Россия
c Химический факультет МГУ им. М.В. Ломоносова
119911 Москва, Ленинские горы, 1, Россия
d ФГБУН Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук
119991 Москва, ул. Вавилова, 28, Россия
e ФГБНУ ВНИИ сельскохозяйственной биотехнологии
127422 Москва, ул. Тимирязевская, 42, Россия
* E-mail: vl.volkov@mail.ru
Поступила в редакцию 02.11.2020
После доработки 27.12.2020
Принята к публикации 28.01.2021
Аннотация
Проведено исследование кинетических характеристик, механизмов действия и закономерностей взаимосвязи антиоксидантной активности с молекулярным и надмолекулярным строением фуллерена С60 и некоторых его N-монозамещенных аминокислотных производных. Показано, что введение аминокислотного заместителя в молекулу фуллерена С60 приводит к повышению его ингибирующей эффективности при свободнорадикальном окислении водорастворимой мишени (флуоресцеина). При этом, механизм антиоксидантной активности аминокислотных производных фуллерена не связан с переносом атома водорода, отдачей электрона, либо катализом распада пероксидов. Продемонстрировано, что строение аминокислотного заместителя не оказывает влияния на антирадикальные свойства, которые детерминируются, таким образом, только эффективной суммарной площадью поверхности наночастиц производных фуллерена С60 и возрастают с уменьшением их размера. Эту поверхность можно охарактеризовать как наностенки, на которых происходит гибель радикалов. Изменение концентрации исследуемых соединений в растворе не приводит к изменению относительной антирадикальной активности и, соответственно, размеров образуемых ими наночастиц. Полученные результаты имеют важное значение для понимания закономерностей биологической активности данной группы соединений.
ВВЕДЕНИЕ
Свободнорадикальные процессы являются неотъемлемой частью метаболизма всех живых систем. С одной стороны, избыточное образование свободных радикалов ведет к повреждению клеточных структур и может приводить к развитию большого числа различных заболеваний. С другой стороны, свободные радикалы, генерируемые фагоцитирующими клетками, – это существенный фактор неспецифической иммунной защиты. Кроме того, свободно-радикальные процессы участвуют в регуляции многих важных биологических процессов, включая пролиферацию и апоптоз клеток [1].
Особый интерес представляет изучение антирадикальных свойств различных наноматериалов, в том числе и наноструктур на основе углерода, к числу которых относится фуллерен С60. Было отмечено [2, 3], что антирадикальные свойства фуллерена С60 влияют на кинетику радикальной полимеризации стирола и метилметакрилата вплоть до полного ее подавления. В [4] описаны кинетика и стехиометрия реакции фуллерена С70 с озоном. Помимо этого, в современной научной литературе имеется множество работ, в которых продемонстрированы уникальные свойства фуллеренов С60 и различных их производных при взаимодействии с живыми организмами. В [5] было показано, что производные фуллерена с такими аминокислотами, как пролин, ε-аминокапроновая кислота, аргинин, проявляют мембранотропную активность и проникают сквозь мембраны клеток в ионизированной форме, тем самым вызывая их деполяризацию. Методом иммунофлуоресцентной микроскопии на примере карбоксилированного фуллерена C61(CO2H)2 было обнаружено, что водорастворимые производные фуллерена С60 способны проникать через мембранный слой клетки, а также то, что вышеуказанное соединение преимущественно локализуется в мембранной и богатой митохондриями фракциях клетки [6]. Поскольку митохондрии являются основными первичными источниками свободных радикалов, полученные в [6] результаты в совокупности с данными об антирадикальных свойствах производных фуллерена С60, благодаря которым эти молекулы часто называют “радикальными губками” [7], указывают на то, что основу их биологических эффектов составляет способность участвовать в регуляции окислительного стресса.
В связи с вышесказанным актуален вопрос подробного изучения ингибирующего действия фуллерена С60 и его производных по отношению к различным свободным радикалами и выявление корреляций химического строения фуллереновых соединений с их антирадикальной активностью. На предмет активности по отношению к супероксидному радикалу первыми были исследованы фуллеренолы [8] и гексасульфобутилфуллерены [9]. Супероксидный анион-радикал в этих исследованиях генерировали системой ксантин/ксантиоксидаза, о расходовании супероксидного радикала судили по интенсивности хемилюминесценции люцигенина. Было установлено, что гексасульфобутилфуллерены обладают высокой активностью по отношению к супероксидному радикалу и ингибируют 60 и 96% свободных радикалов при концентрациях 50 и 100 мкМ соответственно, в то время как фуллеренолы ингибируют только 59 и 70% при концентрациях 50 и 100 мкМ соответственно. Был сделан вывод о том, что производные с меньшим количеством заместителей обладают более высокой активностью, поскольку в таком случае система сопряженных π-электронов сохраняется. Также авторами [8] продемонстрировано, что присутствие фуллеренола в диапазоне концентраций 0‒47 мкМ в системе кстантин/ксантиноксидаза не влияет на активность фермента, что исключает двойственность толкования исследований с использованием данной системы.
Введение заместителя из группы органических кислот значительно повышало антирадикальную активность фуллерена в неполярной среде (модельная система инициированного окисления этилбензола) [10].
Примерно в это же время были исследованы антиоксидантные свойства аддуктов фуллерена с малоновой кислотой. Методом электронного парамагнитного резонанса (ЭПР) с использованием системы ксантин/ксантиноксидаза в качестве источника супероксидного радикала и 5,5-диметил-1-пирролин-N-оксида в качестве спиновой ловушки было показано, что триаддукты фуллерена с малоновой кислотой способны полностью ингибировать супероксидные анион-радикалы [11].
Теоретическим методом компьютерного моделирования был предположен механизм ингибирования супероксидного радикала производным фуллерена С60 с тремя остатками малоновой кислоты [12]. Согласно этой модели, реакция происходит в несколько стадий:
1) ${\text{O}}_{2}^{{\centerdot - }}$ переносит неспаренный электрон на ядро фуллерена с образованием O2 и анион-радикала производного фуллерена;
2) происходит перенос электрона с анион-радикала производного фуллерена на второй ${\text{O}}_{2}^{{\centerdot - }}$ с последующим переносом на него протона H+ с образованием –OOH;
3) перенос следующего протона водорода H+ на –OOH приводит к образованию перекиси водорода H2O2.
Однако факт подобных каталитических свойств малонового производного фуллерена экспериментальных подтверждений не имеет.
Методом ЭПР с использованием спиновой ловушки 13С было показано присоединение бензильных радикалов в среде толуола к молекуле фуллерена С60 [13]. Обнаружено существование как минимум двух промежуточных радикальных аддуктов при присоединении 3 бензильных радикалов (${{{\text{R}}}_{3}}{\text{C}}_{{60}}^{\centerdot }$) и 5 бензильных радикалов (${{{\text{R}}}_{5}}{\text{C}}_{{60}}^{\centerdot }$), стабильных при 50°С. Предположено, что максимально к 1 молекуле фуллерена может присоединиться до 15 бензильных радикалов. Также масс-спектрометрическими методами найдено, что 1 молекула фуллерена может присоединять до 34 метильных групп.
Методом импульсного радиолиза показано эффективное связывание различными карбоксилированными фуллеренами сольватированного электрона, гидроксильного радикала, синглетного кислорода. При взаимодействии с сольватированным электроном карбоксилированные производные фуллерена, по предположению авторов, образуют моноанион-радикал [14].
Относительно связывания гидроксильного радикала •OH гидроксилированными производными фуллерена предлагаемые механизмы делятся на два типа: 1) •OH захватывает H от гидроксильной группы с образованием эфирной связи на поверхности фуллеренового ядра; 2) •OH присоединяется к двойной связи фуллеренового ядра [15].
Ингибирующее действие гидроксифуллерена на нитроксильный радикал NO• продемонстрированно как в химической, так и в биологической системах [16]. В последнем случае введение гидроксифуллерена мышам, которым предварительно вводили источник NO• радикала (нитропруссид натрия), предотвращало снижение активности ферментов: супероксиддисмутазы (СОД), каталазы, глутатион-s-трансферазы и глутатионпероксидазы.
Резюмируя имеющиеся данные о механизмах ингибирующего действия фуллерена и его производных в отношении свободных радикалов, можно сделать вывод о том, что исследования антиоксидантных свойств проводились в отношении ограниченного числа структур, при этом взаимосвязь химического строения и антирадикальной активности малоизучена. Выдвигаемые механизмы действия в большинстве случаев носят предположительный характер. Активность фуллерена и его производных в отношении такой биологически важной активной формы кислорода, как перекись водорода, также не рассматривалась в научных публикациях. Все это указывает на то, что исследование механизма действия различных производных фуллерена является актуальной научной задачей.
С точки зрения применения в качестве регуляторов свободно-радикальных процессов представляет интерес изучение конъюгатов фуллерена с молекулами, участвующими в метаболизме биологических систем, в частности, протеиногенными аминокислотами [17], а также аминокислотами, которые являются нейромедиаторами и/или обладают иной биологической активностью. Токсичность фуллерена С60 и его производных давно вызывает споры. С одной стороны, имеются сведения, что в присутствии света фуллерен С60 оказывает токсическое действие на биологические объекты [18]. С другой стороны, существует большое количество подтверждений тому, что введение даже высоких доз фуллерена С60 не влияет негативно на жизнедеятельность живых организмов. Так, введение мышам фуллерена в дозе 2.5 г/кг не приводило к гибели и изменениям в поведении животных [19]. Парентеральное введение мышам N-моногидрофуллеренил-L-серина в дозировке 80 мкг/кг не влияло на поведение и жизнеспособность мышей [20].
Известно, что фуллерен и его производные в водных растворах находится в виде коллоидного раствора наночастиц [21, 22], их физико-химические свойства определяются как строением молекул, так и размером наночастиц [23, 24].
В настоящей работе проведено исследование механизмов антиоксидантного действия и корреляций строения с антирадикальной активностью N-моноаминокислотных производных фуллерена С60 на основании анализа их поведения в различных модельных системах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение водной дисперсии фуллерена С60
Водная дисперсия фуллерена C60 была приготовлена в соответствии с методикой [25] путем получения насыщенного раствора в толуоле, к которому приливали воду и обрабатывали в темноте в ультразвуковой ванне (42 кГц, 50 Вт) в течение нескольких часов с перерывами на охлаждение.
Синтез аминокислотных производных фуллерена (АПФ)
Соединения: N-(моногидрофуллеренил)-L-аланина калиевая соль (Н–C60–L-Ala–ОК), N‑(моногидрофуллеренил)-D-аланина калиевая соль (Н–C60–D-Ala–ОК), N-(моногидрофуллеренил)-L-валина калиевая соль (Н–C60–L-Val–ОК), N-(моногидрофуллеренил)-D-валина калиевая соль (Н–C60–D-Val–ОК), N-(моногидрофуллеренил)-L-аспарагиновой кислоты дикалиевая соль (Н–C60–L-Asp–(ОК)2), N-(моногидрофуллеренил)-D-аспарагиновой кислоты дикалиевая соль (Н–C60–D-Asp–(ОК)2), N-(моногидрофуллеренил)-ε-аминокапроновой кислоты калиевая соль (Н–C60–ε-ACA–ОК) получены в результате одностадийного синтеза, путем непосредственного присоединения аминокислотного остатка к фуллереновому ядру по методике [26].
Флуориметрия
Кинетические кривые изменения интенсивности флуоресценции флуоресцеина во времени измеряли на спектрофлуориметре FluoroLog 3.21 (“HORIBA Scientific”, США) с использованием термостатируемого при 37 ± 0.2°C кюветного отделения. Наблюдаемую флуоресценцию детектировали на длине волны 515 нм при длине волны возбуждающего света 491 нм. Температуру образца поддерживали при помощи жидкостного термостата 12108-15 (“Cole-Parmer”, США).
Определение относительной антиоксидантной активности проводили по методике, представленной в [27].
Растворы флуоресцеина и AAPH (2,2'-азобис(2-амидинопропан) дигидрохлорида) готовили в фосфатном буфере (75 мМ, рН 7.4), а затем инкубировали в течение 10 мин при 37°C. В кювете флуориметра сначала смешивали растворы флуоресцеина и исследуемого образца; раствор AAPH вводили последним и немедленно начинали запись кинетической кривой изменения интенсивности флуоресценции. Конечные концентрации компонентов смеси в кювете составляли: 9.6 мМ (AAPH), 10–8 М (флуоресцеин), 2.5 × 10–6 М (исследуемый раствор). Фосфатный буфер (75 мМ) использовали для холостого опыта, тролокс (6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновую кислоту) в концентрации 1.2 × 10–6 М – в качестве препарата сравнения. Значение величины, характеризующей относительную антирадикальную активность (ОАА), рассчитывали как отношение разностей площадей под кривыми тушения флуоресценции соответственно для исследуемого образца (Sобр) и для тролокса (Sтр) с учетом холостого опыта (“бланка”, то есть без добавления антиоксидантов (Sбл), а также концентраций тролокса (Cтр) и исследуемых образцов (Cобр):
Вольтамперометрия
Амперометрическая установка ЦветЯуза-01-АА (НПО “Химавтоматика”, Россия) представляет собой электрохимическую ячейку со стеклоуглеродным анодом и катодом из нержавеющей стали, к которым может быть приложена разность потенциалов в диапазоне от 0.1 до 2.0 В [28]. Анализируемую пробу с помощью шестиходового крана-дозатора с объемом петли 20 мкл вводили в поток элюента (дистиллированная вода), прокачиваемый насосом через электрохимическую ячейку со скоростью 1.2 мл/мин. При прохождении пробы через ячейку регистрировали ток (нА) электрохимического окисления, развертку которого во времени (с) выводилия на монитор компьютера и определяли площадь для исследуемых образцов S (нА с). На основе данных, полученных при разном анодном потенциале, строили зависимость значений S от приложенного напряжения и находили потенциал ионизации исследуемого вещества.
Модельная реакция с ДФПГ-радикалом
Для оценки антиоксидантной активности по механизму, связанному с отдачей атома водорода, наблюдали за реакцией исследуемых соединений со стабильным хромоген-радикалом 2,2-дифенил-1-прикрилгидразилом (ДФПГ) [29].
В раствор ДФПГ, смешанный с водой в соотношении 1 : 1, добавляли различные объемы исследуемого образца таким образом, чтобы суммарный объем реакционной системы составлял 3.6 мл. Изменение оптической плотности регистрировали при длине волны 517 нм (максимум поглощения видимой области спектра ДФПГ) на спектрофотометре ПЭ 5400ВИ (ООО “ЭКРОСХИМ” Россия).
Потенциометрическое исследование кинетики разложения пероксида водорода
В ячейку объемом 5 мл, заполненную 1.6 × 10–5 М раствором исследуемого образца в фосфатном буферном растворе (0.05 М KH2PO4/K2HPO4, 0.1 M KCl, pH 6.0), при постоянном перемешивании помещали трехэлектродную планарную печатную систему, состоящую из электрода сравнения, вспомогательного электрода и рабочего электрода, модифицированного берлинской лазурью и гексацианоферратом никеля по методике [30]. Измерения проводили при рабочем потенциале 0 В относительно встроенного электрода сравнения. В течение 5–7 мин фиксировали значение фонового тока до выхода его на постоянный уровень, после чего инжектировали пероксид водорода до конечной концентрации в ячейке 5 × 10–5 М и регистрировали изменение его концентрации по падению потенциала на электроде.
Инициированное окисление липосом
Липосомы на основе фосфатидилхолина (ФХ) служат моделями для изучения биохимических процессов в биомембранах, в частности перекисного окисления липидов (ПОЛ), и регулирования окисления различными субстанциями. Для приготовления липосом применяли суспензию соевого ФХ марки P 3644 (“Sigma”) в фосфатном буфере (рН 7.4, ионная сила 1 мM). Липосомы ФХ готовили согласно методике [31] с концентрацией ФХ 1 мг/мл. Для инициирования окисления липосом использовали водорастворимый азоинициатор (ААРН, “Fluka”, Германия) с конечной концентрацией в растворе липосом 0.33 мМ. Окисление липосом с концентрацией 0.1 мг/мл проводили в кварцевых кюветах, термостатированных при физиологической (37°C) температуре, на спектрофотометре (“Perkin Elmer”, Германия). Кинетику образования продуктов перекисного окисления липидов (ПОЛ) – диеновых конъюгатов (ДК) – регистрировали во времени на длине волны максимума поглощения ДК 234 нм. Для исследования ингибирующего действия N-моногидрофуллеренил-D-аланина в раствор липосом перед окислением вводили разные объемы (30–80 мкл) раствора данного аминокислотного производного с концентрацией 4.81 × 10–4 М. Для сравнения с действием тролокса окисление липосом провели также с добавлением от 0.5 до 2 мкл тролокса с концентрацией 0.5 мМ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В работе [32] были представлены результаты скринингового исследования относительной антирадикальной активности (ОАА) фуллерена С60 и 6-ти его аминокислотных производных методом флуоресцентного наблюдения ингибирования свободнорадикальной деструкции флуоресцирующей молекулы-мишени. Из рис. 1 видно, что введение аминокислотного заместителя приводит к существенному увеличению антирадикальной активности соединений, образующих в водной фазе агрегаты аналогичного размера. При этом нахождение аминокислотных производных фуллерена с разным строением заместителя на одной линии регрессии говорит о том, что строение аминокислотного заместителя не оказывает существенного влияния на антирадикальную активность соединений. Дальнейшие исследования показали, что корреляционная зависимость, представленная на рис. 1, выполняется и тогда, когда в результате синтеза одного и того же соединения получились наночастицы, имеющие иной средний размер. В этом случае соответствующая ему точка ложится на ту же линию регрессии. Таким образом, N-моногидрофуллеренил-D-аланин 2-го синтеза, имеющий размер наночастиц аналогичный таковому для N-моногидрофуллеренил-L-валина, совпадает с этим соединением и по величине антирадикальной активности.
Рис. 1.
Корреляционная зависимость между величиной ОАА и размерами наночастиц аминокислотных производных фуллерена С60: С60 (1); Н–C60–L-Ala–ОК (2); Н–C60–D-Ala–ОК, синтез 1 (3); Н–C60–D-Ala–ОК, синтез 2 (3'); Н–C60–L-Val–ОК (4); Н–C60–D-Val–ОК (5); Н–C60–L-Asp–(ОК)2 (6); Н–C60–D-Asp–(ОК)2 (7). Значение коэффициента парной корреляции Пирсона rxy = – 0.981.
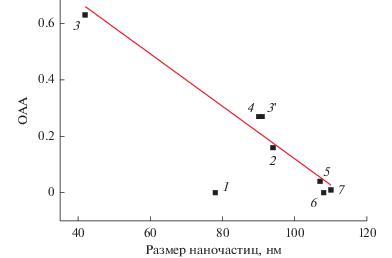
Выявленная корреляционная зависимость между величиной относительной антирадикальной активности (ОАА) и размером наночастиц аминокислотных производных фулерена (АПФ) обусловлена, по-видимому, стерическим фактором: при увеличении размеров наночастиц возрастает, пропорционально кубу их радиуса, число молекул, изолированных от радикалов, находящихся в реакционной среде, что и приводит к снижению эффективных величин ОАА.
Для моделирования защитного воздействия на биомембраны было проведено исследование ингибирующего действия производных фуллерена на инициированное окисление ФХ в липосомной модельной системе. Для этого был использован N-(моногидрофуллеренил)-D-аланин синтеза 2 (рис. 2).
Рис. 2.
Увеличение оптической плотности (D) диеновых конъюгатов (ДК) при индуцированном AAPH (0.33 мМ) окислении ФХ липосом (0.1 мг/мл) в холостом опыте (1); при добавлении тролокса в концентрации 0.17 мкМ (2); при добавлении Н–C60–D-Ala–ОК (синтез 2) в концентрации 4.81 мкМ (3).
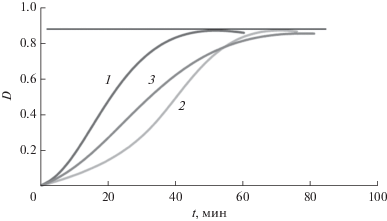
В сложных гетерогенных системах, моделирующих биологические мембраны (ФХ липосомы), исследуемые соединения проявляют дозозависимую ингибирующую активность, снижая скорость образования ДК при окислении ФХ липосом, инициируемом AAPH.
Значение протективного эффекта производного D-аланина (синтеза 2) в липосомной модели, рассчитанное по площадям над кривой окисления ФХ (2) аналогично методу, примененному в случае с гомогенной флуоресцентной системой, оказалось равным 0.03 по тролоксу, что в 9 раз ниже, чем значение, полученное при ингибировании окисления флуоресцеина. Данное явление, по-видимому, связано с повышенным сродством наночастиц замещенного аминокислотой фуллерена к водной среде:
(2)
${\text{AOA}} = \frac{{\left( {S_{{{\text{обр}}}}^{{\text{н}}} - ~S_{{{\text{бл}}}}^{{\text{н}}}} \right)}}{{\left( {S_{{{\text{тр}}}}^{{\text{н}}} - ~S_{{{\text{бл}}}}^{{\text{н}}}} \right)}}\frac{{{{C}_{{{\text{тр}}}}}}}{{{{C}_{{{\text{обр}}}}}}},$Следует обратить внимание на разный характер кинетических кривых окисления ФХ липосом в присутствии тролокса и исследуемого образца. Кривые окисления в опытах с тролоксом имеют s‑образный характер, что свидетельствует о его быстром полном расходовании, сопровождающимся почти полным ингибированием окисления, и последующем неингибированном окислении липидных мембран. При этом, форма кривых окисления в экспериментах с производными фуллерена свидетельствует о частичном снижении интенсивности окислительных процессов на протяжении всего эксперимента при незначительном изменении ингибирующего действия тестируемого соединения. Таким образом, производные фуллерена действуют как ингибиторы в течение гораздо более длительного времени. Подобный характер ингибирования свободнорадикального окисления, с точки зрения получения оптимальных биологических эффектов в виде защиты живых организмов от окислительного стресса, является более предпочтительным, поскольку свободные радикалы в живых системах играют не только негативную роль, но и являются участниками ряда нормальных биологических процессов.
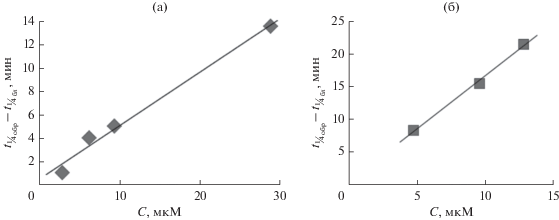
Линейный характер зависимости прироста времени ¼ превращения окисляемого соединения относительно контрольного опыта от концентрации производного фуллерена (рис. 3) говорит о том, что разбавление не влияет на величины ОАА и АОА, а, следовательно, и на константы скорости взаимодействия моноаминокислотных производных фуллерена с радикалами. То, что антирадикальная активность исследуемых соединений находится в отрицательной линейной зависимости от размеров образуемых ими агрегатов, приводит, в свою очередь, вопреки некоторым литературным данным [33], к выводу, что разбавление раствора не вызывает и изменения размерных характеристик наночастиц, образуемых производными фуллерена.
Рис. 3.
Зависимость прироста времени превращения ¼ исходного окисляемого соединения относительно контрольного опыта (${{t}_{{{{{{\raise0.5ex\hbox{$\scriptstyle 1$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 4$}}}}_{{{\text{обр}}}}}}}}$ – ${{t}_{{{{{{\raise0.5ex\hbox{$\scriptstyle 1$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 4$}}}}_{{{\text{бл}}}}}}}}$) от концентрации Н–C60–D-Ala–ОК в реакционной среде: а – окисление флуоресцеина; б – окисление ФХ липосом.
Спрямление убывающих экспонент окисления флуоресцеина в отсутствие и в присутствии ингибитора в полулогарифмических координатах указывает на то, что в выбранных условиях проведения эксперимента процесс протекает по псевдопервому порядку (рис. 4). Это согласуется и с результатами других наших экспериментов, показавших независимость времени полупревращения флуоресцеина от его начальной концентрации в диапазоне от 10–8 до 5 × 10–8 М при фиксированной концентрации AAPH 9.6 мМ, а также с теоретическими предположениями, поскольку вследствие невысокой (1.3 × 10–6 с–1 [34]) константы скорости распада инициатора за время реакции его количество существенно не меняется, и, таким образом, в реакционной системе концентрация радикалов находится в квазистационарном равновесном состоянии.
Рис. 4.
Кинетические кривые уменьшения интенсивности флуоресценции флуоресцеина (I) в результате его деградации при взаимодействии с радикалами, образующимися при распаде AAPH (а), и их полулогарифмические анаморфозы (б) в холостом опыте (1) и в присутствии Н–C60–D-Ala–ОК в количестве 2.89 (2); 6.27 (3) и 9.41 мкМ (4). Начальные концентрации растворов флуоресцеина и AAPH составляют соответственно 0.01 мкМ и 9.6 мМ.
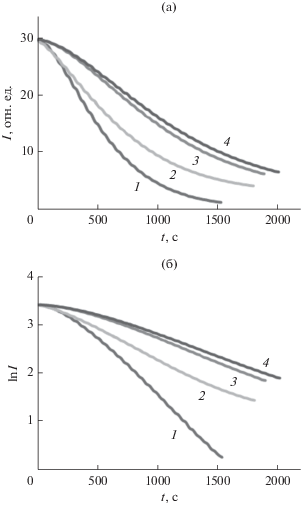
Общее кинетическое уравнение реакции псевдопервого порядка при флуориметрическом наблюдении расходования исходного компонента имеет вид:
(4)
$k{\kern 1pt} ' = ~\frac{{{\text{ln}}4}}{{{{t}_{{{\raise0.5ex\hbox{$\scriptstyle 1$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 4$}}}}}}} = {{k}_{{{\text{Fl}}}}}{{C}_{{\text{R}}}},$На основании формулы (4) получаем:
(5)
${{t}_{{{\raise0.5ex\hbox{$\scriptstyle 1$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 4$}}}}} - {{t}_{{{{{{\raise0.5ex\hbox{$\scriptstyle 1$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 4$}}}}_{{{\text{бл}}}}}}}} = \ln 4\frac{{k{\kern 1pt} '\,\, - ~\,\,k_{{{\text{бл}}}}^{'}}}{{k{\kern 1pt} '~k_{{{\text{бл}}}}^{'}}}.$Интегрируя площади под кинетическими кривыми, выводим взаимосвязь между приростом времени ¼ превращения флуоресцеина относительно контрольного опыта и ОАА:
(6)
$S = {{I}_{0}}\int\limits_0^{t \to \infty } {{{e}^{{ - k{\kern 1pt} 't}}}} {\text{d}}t = \frac{{{{I}_{0}}}}{{k{\kern 1pt} '}},$(7)
${{S}_{{{\text{обр}}}}} - {{S}_{{{\text{бл}}}}} = ~\,\,{{I}_{0}}~~\frac{{k{\kern 1pt} '\,\, - \,\,~k_{0}^{'}}}{{k{\kern 1pt} 'k_{0}^{'}}} = ~{{I}_{0}}~~\frac{{{{t}_{{{\raise0.5ex\hbox{$\scriptstyle 1$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 4$}}}}}~ - ~{{t}_{{{{{{\raise0.5ex\hbox{$\scriptstyle 1$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 4$}}}}_{0}}}}}}}{{\ln 4}},$Учитывая, что
где Wi – скорость зарождения радикалов в системе, подставляя (7) и (8) в (1), получаем:(10)
${\text{OAA}} = \frac{{{{t}_{{{{{{\raise0.5ex\hbox{$\scriptstyle 1$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 4$}}}}_{{{\text{обр}}}}}}}}{\text{\;}}--{\text{\;}}{{t}_{{{{{{\raise0.5ex\hbox{$\scriptstyle 1$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 4$}}}}_{{{\text{бл}}}}}}}}{\text{\;}}}}{{{\text{ln4\;}}}}~~\frac{{{{W}_{i}}}}{{{{C}_{{{\text{AO}}}}}}},$Таким образом, линейная связь между ${{t}_{{{{{{\raise0.5ex\hbox{$\scriptstyle 1$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 4$}}}}_{{{\text{обр}}}}}}}}{\text{\;}}$– ${{t}_{{{{{{\raise0.5ex\hbox{$\scriptstyle 1$} \kern-0.1em/\kern-0.15em \lower0.25ex\hbox{$\scriptstyle 4$}}}}_{{{\text{бл}}}}}}}}$ и CАО (рис. 3а) свидетельствует о неизменности величины ОАА при изменении концентрации производного фуллерена в растворе в исследованном диапазоне.
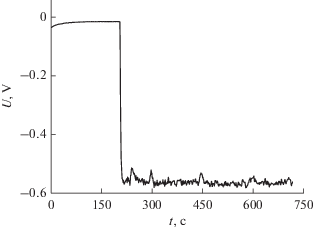
Исследование электронодонорной способности АПФ проводили амперометрическим методом, регистрируя площадь под кривой тока S при увеличении разности потенциалов между электродами U [30]. Как видно из рис. 5, значительное электрохимическое окисление моноаминокислотных производных начинается при значении анодного потенциала более 1.2 В.
Рис. 5.
Зависимость площади под кривой тока (S) от величины анодного потенциала (U): Н–C60–D-Ala–ОК (1); Н–C60–D-Asp–(ОК)2 (2); Н–C60–ε-ACA–ОК (3).
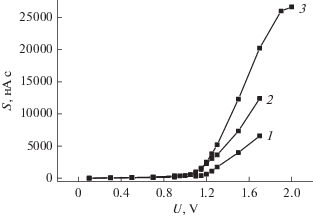
Такие высокоактивные антиоксиданты, как флавоноиды, начинают отдавать электроны уже при значениях анодного потенциала 0.4–0.6 В [35]. Известно, что флавоноиды могут проявлять антиоксидантную активность как по радикальному механизму (HAT – hydrogen atom transfer), так и по ионным механизмам, основанным на электронном переносе (SPLET – sequential proton loss–electron transfer и ET–PT – electron transfer–proton transfer) [36]. Исходя из полученных для производных фуллерена С60 вольтамперограмм (рис. 5), можно сделать вывод, что эти соединения не проявляют антирадикальной активности по механизму, связанному с переносом электрона, из-за высокого значения потенциала окисления. Различные величины тангенса угла наклона обусловлены изменением отклика электрода в различные даты эксперимента.
Наблюдение за оптической плотностью раствора стабильного хромоген-радикала 2,2-дифенил-1-пикрилгидразила при добавлении в реакционную систему Н–C60–D-Ala–ОК и Н–C60–ε-ACA–ОК показало отсутствие их активности в отношении этого радикала. Стабильный экранированный радикал ДФПГ взаимодействует только с антиоксидантами, способными легко отдавать атом водорода. Таким образом, аминокислотные производные фуллерена активности по указанному выше механизму HAT не проявляют.
Антипероксидную активность (способность разрушать пероксидные соединения по различным механизмам) производного D-аланина исследовали, добавляя его в буферную систему, содержащую пероксид водорода, концентрация которого контролировалась потенциометрически. Из рис. 6 видно, что после момента смешивания компонентов реакционной системы (вертикальный участок кривой) измеряемое значение потенциала, пропорциональное концентрации пероксида водорода, не менялось в течение всего времени эксперимента. Таким образом, исследуемое производное фуллерена не является катализатором распада пероксидов и, следовательно, не может способствовать разветвлению цепных реакций перекисного окисления или, наоборот, предотвращать его.
ЗАКЛЮЧЕНИЕ
Данные, полученные методами вольтамперометрии, потенциометрии и ДФПГ-анализа, указывают на то, что антиоксидантный механизм действия аминокислотных производных фуллерена не связан с отдачей электрона либо переносом атома водорода, и что данные соединения не являются катализаторами распада пероксидов. В тоже время, линейный характер связи антирадикальных свойств, которые N-монозамещенные аминокислотные производные фуллерена демонстрируют во флуоресцентной модели, с размерами наночастиц, образуемых ими в водных растворах, позволяет сделать вывод о том, что основной фактор, определяющий их антиоксидантную активность, – это суммарная площадь поверхности наночастиц. Введение N-аминокислотного заместителя значительно повышает ингибирующую эффективность соединений в отношении окисления водорастворимой мишени (флуоресцеина).
Строение аминокислотного заместителя существенного воздействия на антирадикальную активность наночастиц не оказывает, что подтверждается как при сопоставлении ОАА соединений с разными заместителями, так и при сопоставлении ОАА одного соединения из разных синтезов, в ходе которых сформировались агрегаты с разным средним размером. Линейный характер зависимости ингибирующего действия наночастиц от концентрации, как во флуоресцентной, так и в липосомной модели указывает на то, что изменение концентрации не приводит к изменению размерных характеристик наночастиц. Фуллерен и его производные являются электрондефицитными молекулами, обладающими системой сопряженных двойных связей. Очевидно, что именно доступность π-связей атомов определяет возможность реакций радикального присоединений для наночастиц аминокислотных производных фуллерена. Активную поверхность таких наночастиц можно охарактеризовать как наностенки, на которых происходит гибель свободных радикалов.
Список литературы
Кондакова И.В. / Автореферат дис. … докт. мед. наук. Томск, 2005.
Юмагулова Р.Х., Медведева Н.А., Кузнецов С.И., Крайкин В.А., Колесов С.В. // Кинетика и катализ. 2014. Т. 55. № 1. С. 67.
Юмагулова Р.Х., Кузнецов С.И., Диниахметова Д.Р., Фризен А.К., Крайкин В.А., Колесов С.В. // Кинетика и катализ. 2016. Т. 57. № 3. С. 383.
Разумовский С.Д., Булгаков Р.Г., Пономарева Ю.Г., Будтов В.П. // Кинетика и катализ. 2006. Т. 47. № 3. С. 353.
Андреев И.М., Романова В.С., Петрухина А.О., Андреев С.М. // Физика твердого тела. 2002. Т. 44. Вып. 4. С. 658.
Foley S., Growley C., Smaihi M., Bonfils C., Erlanger B.F., Seta P., Larroque C. // Biochem. Biophys. Res. Commun. 2002. V. 294. P. 116.
Beuerle F., Lebovitz R., Hirsch A. / Medicinal Chemistry and Pharmacological Potential of Fullerenes and Carbon Nanotubes. Carbon Materials: Chemistry and Physics. Eds. Cataldo F., Da Ros T. Springer, Dordrecht, 2008. V. 1. P. 51. https://doi.org/10.1007/978-1-4020-6845-4_3
Chiang L.Y., Lu F.-J., Lin J.-T. // Chem. Commun. 1995. № 12. P. 1283.
Chi Y., Bhonsle J.B., Canteenwala T., Huang J-P., Shiea J., Chen B-J., Chiang L.Y. // Chem. Lett. 1998. V. 27. № 5. P. 465.
Якупова Л.Р., Сахаутдинов И.М., Маликова Р.Н., Сафиуллин Р.Л. // Кинетика и катализ. 2019. Т. 60. № 1. С. 25.
Dugan L.L., Turetsky D.M., Du C., Lobner D., Wheeler M., Almli C.R., Shen C.K.-F., Luh R.-Y., Choi D.W., Lin T.-S. // Proc. Natl. Acad. Sci. USA. 1997. V. 94. № 17. P. 9434.
Osuna S., Swart M., Solà M. // Chem. Eur. J. 2010. V. 16. № 10. P. 3207. https://doi.org/10.1002/chem.200902728
Krustic P.J., Wasserman E., Keizer P.N., Morton J.R., Preston K.F. // Science. 1991. V. 254. № 5035. P. 1183.
Bensasson R.V., Brettreich M., Frederiksen J., Göttinger H., Hirsch A., Land E.J., Leach S., McGarvey D.J., Schönberger H. // Free Radic. Biol. Med. 2000. V. 29. № 1. P. 26.
Wang Z., Wang S., Lu Z., Gao X. // J. Clust. Sci. 2015. V. 26. P. 375.
Mirkov S. M., Djordjevic A. N., Andric N. L., Andric S.A., Kostic T.S., Bogdanovic M.B., Vojinovic-Miloradov M.B., Kovacevic R.Z. // Nitric Oxide. 2004. V. 11. № 2. P. 201. https://doi.org/10.1016/j.niox.2004.08.003
Sun T., Xu Z. // Bioorg. Med. Chem. Lett. 2006. V. 16. № 14. P. 3731.
Пиотровский Л.Б., Еропкин М.Ю., Еропкина Е.М., Думпис М.А., Кисилев О.И. // Психофармокология и биологическая наркология. 2007. Т. 7. № 2. С. 1548.
Moussa F., Trivin F., Ceolin R., Hadchouel M., Sizaret P.Y., Greugny V., Fabre C., Rassat A., Szwarc H. // Fullerene Sci. Technol. 1996. V. 4. № 1. P. 21.
Андреев С.М., Бабахин А.А., Петрухина А.О., Романова В.С., Петров Р.В. // Докл. АН. 2000. Т. 370. № 2. С. 261.
Бобылев А.Г., Пеньков Н.В., Трошин П.А., Гудков С.В. // Биофизика. 2015. Т. 60. № 1. С. 38.
Андреев С.М., Пургина Д.Д., Башкатова Е.Н., Гаршев А.В., Маерле А.В., Хаитов М.Р. // Российские нанотехнологии. 2014. Т. 9. № 7–8. С. 24.
Burgess S., Vishnyakov A., Tsovko C., Neimark A.V. // J. Phys. Chem. Lett. 2018. V. 9. № 17. P. 4872. https://doi.org/10.1021/acs.jpclett.8b01696
Park S., Xie Y., Weaver M.J. // Langmuir. 2002. V. 18. № 15. P. 5792. https://doi.org/10.1021/la0200459
Andrievsky G.V., Kosevich M.V., Vovk O.M., Shelkovsky V.S., Vashchenko L.A. // J. Chem. Soc. Chem. Commun. 1995. № 12. P. 1281.
Романова В.С., Цыряпкин В.А., Ляховецкий Ю.А. Парнес З.Н., Вольпин М.Е. // Изв. РАН. Сер. хим. 1994. Т. 43. № 6. С. 1151.
Ou B., Hampsch-Woodill M., Prior R.L. // J. Agric. Food Chem. 2001. V. 49. № 10. P. 4619. https://doi.org/10.1021/jf010586o
Яшин А.Я. // Рос. хим. журн. 2008. Т. 52. № 2. С.130.
Bondet W., Brand-Williams W., Berset C. // Lebensm.-Wiss u.-Technol. 1997. V. 30. № 6. P. 609.
Karpova E.V., Karyakina E.E., Karyakin A.A. // J. Electrochem. Soc. 2017. V. 164. № 5. P. 3056.
Сажина Н.Н., Антипова A. С., Семенова М.Г., Пальмина Н.П. // Биоорг. химия. 2019. Т. 45. № 2. С. 34.
Волков В.А., Ямскова О.В., Шепель Н.Э., Романова В.С., Курилов Д.В., Трегубов А.В., Вышиванная О.В., Воронков М.В., Ямсков И.А., Мисин В.М., Зубарева Н.Д., Кустов Л.М. // Журн. физ. химии. 2019. Т. 93. № 11. С. 1674.
Тимофеева Г.И., Романова В.С., Лопанова Л.А. // Изв. РАН. Сер. хим. 1996. Т. 45. № 4. С. 879.
Niki E. // Methods in enzymology. 1990. V.186. P. 100.
Яшин А.Я. // Сорбционные и хроматографические процессы. 2014. Т. 14. № 3. С. 419.
Ján Rimarčík, Vladimír Lukeš, Erik Klein, Michal Ilčin // J. Mol. Struct.: THEOCHEM. 2010. V. 952. № 1–3. P. 25.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ