Кинетика и катализ, 2021, T. 62, № 4, стр. 472-482
Pt/N-графен в разложении муравьиной кислоты
В. В. Чесноков a, *, А. С. Лисицын a, В. И. Соболев a, Е. Ю. Герасимов a, И. П. Просвирин a, Ю. А. Чесалов a, А. С. Чичкань a, О. Ю. Подъячева a
a ФГБУН ФИЦ “Институт катализа им. Г.К. Борескова СО РАН”
630090 Новосибирск, просп. Акад. Лаврентьева 5, Россия
* E-mail: chesn@catalysis.ru
Поступила в редакцию 04.02.2021
После доработки 24.03.2021
Принята к публикации 10.04.2021
Аннотация
Исследованы свойства новой каталитической системы Pt/N-графен в реакции газофазного разложения муравьиной кислоты с целью получения чистого водорода. В качестве углеродного носителя использовали допированный и недопированный атомами азота графеновый порошок. Для характеризации синтезированных катализаторов использовали методы: комбинационного рассеяния, рентгеновской фотоэлектронной спектроскопии (РФЭС), просвечивающей микроскопии высокого разрешения (ПЭМВР) и хемосорбции СО. Установлено, что при допировании графена атомами азота и с увеличением концентрации платины от 0.2 до 1 мас. % возрастает активность катализатора, при этом его селективность в изучаемой реакции достигает 96–99%.
ВВЕДЕНИЕ
Разработка эффективных процессов получения чистого водорода из возобновляемых источников на сегодняшний день является одной из важнейших задач ресурсосберегающей энергетики. Муравьиная кислота (МК), которая может быть синтезирована путем химических превращений целлюлозы, рассматривается в качестве перспективного участника цепочки: возобновляемый источник – водород [1, 2]. Каталитическое разложение МК может протекать по двум маршрутам, приводящим к образованию H2 и CO2 или Н2О и СО. Соответственно, катализатор должен обеспечивать одновременно высокую скорость реакции и, что особенно важно, селективность по водороду в широком температурном интервале.
В качестве активного компонента катализатора используют различные металлы или сплавы (Pd, Pt, Au, Pd–Au, Pd–Ag, Ru, Pt–Ru, Co), которые наносят на оксидные (SiO2, CeO2, ZrO2) или углеродные материалы [3]. Применение углеродных материалов в качестве носителей для катализаторов вызывает большой интерес, что обусловлено их специфическими свойствами: инертностью и возможностью контролировать их пористость и модифицировать углеродную поверхность путем введения различных функциональных групп, которые могут облегчить контролируемый синтез металлических наночастиц с высокой дисперсностью. Среди углеродных наноструктур нанотрубки и нановолокна обладают замечательными физическими и химическими свойствами и наиболее часто используются в качестве носителей для катализаторов в гетерогенном катализе, в том числе для разложения МК [4–8].
Свойства катализаторов, содержащих металлы подгруппы платины, сильно зависят от структуры углеродного носителя. Например, в работе [9] при сравнении углеродных нанотрубок с коаксиально-цилиндрической упаковкой графеновых слоев и углеродных нановолокон с коаксиально-конической и стопчатой упаковкой слоев обнаружено, что высокодисперсные частицы Pd наиболее сильно взаимодействуют с торцевыми гранями графита, выходящими на поверхность носителя. В работе [10] впервые было показано, что при концентрации нанесенного палладия <0.2 мас. % на углеродном носителе со стопчатой структурой металл стабилизируется в атомарно-дисперсном состоянии.
Допирование углеродных наноматериалов азотом также позволяет стабилизировать металл в атомарном состоянии, что приводит к увеличению активности и селективности катализаторов в разложении МК [11–15]. Для ряда металлов было установлено, что активность снижается в следующем ряду: Pt > Pd > Ru. Поэтому в настоящей работе в качестве активного компонента катализатора для разложения МК выбрана платина.
Среди множества углеродных материалов графен как носитель металлических катализаторов для различных реакций привлекает особое внимание вследствие своей высокой удельной поверхности, электрической проводимости и стабильности [16]. Так, результаты квантово-химических расчетов говорят о возможности селективного образования водорода при разложении МК на атомарном палладии или на центре, состоящем из двух палладиевых атомов, нанесенных на дефектный графен [17]. Перспективность данного носителя в реакции разложения муравьиной кислоты была также подтверждена в других теоретических работах, в которых показана положительная роль допирования графена азотом [18, 19]. Однако в практических работах для реакции разложения муравьиной кислоты в жидкой фазе большей частью используется восстановленный оксид графена, в том числе модифицированный аминными группами, для улучшения гидрофильности носителя [20–23]. Авторы продемонстрировали, что этот носитель позволяет синтезировать эффективные катализаторы получения водорода благодаря улучшению дисперсности нанесенных металлов и сплавов (Mo, Pd, Au, AgAuPd, NiPd) и изменению их электронной плотности в результате прочного взаимодействия. Однако работ, посвященных использованию графена в вышеуказанной реакции, очень мало. Например, в [24] авторы для нанесения 4.9% Mo2C размером 2 нм применяли графен с удельной поверхностью 610 м2/г (SingleLayerGraphene, “ACS Material”). Значение скорости газофазной реакции в единицах TOF изменялось от 8.5 до 31 с–1 при повышении температуры реакции от 275 до 310°С.
Целью настоящей работы было исследование влияния допированного и недопированного атомами азота графенового носителя на свойства нанесенной платины в реакции разложения МК в газовой фазе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез графена
Графен был синтезирован темплатным методом, который предусматривал зауглероживание частиц оксида магния бутадиен-аргоновой смесью при температуре 600°С с последующим вытравливанием подложки соляной кислотой [25]. Изучение полученных углерод-минеральных композитов после травления методами ЭПР, рентгенофазового анализа (РФА), спектроскопии комбинационного рассеяния (КР) и просвечивающей электронной микроскопии высокого разрешения (ПЭМВР) показало, что после удаления темплата синтезированный материал представляет собой малослойный графен. Удельная поверхность графена составляла 1500 м2/г.
Синтез графена, допированного атомами азота
В качестве источника каталитического углерода выбран азотсодержащий прекурсор (смесь 40% NH3–1% C2H2–C2H4), так как компоненты этой смеси склонны к образованию углеродных отложений по консекутивному механизму [26], т.е. через реакции полимеризации и конденсации. Зауглероживали также оксид магния при температуре 650°С в течение 90 мин. При использовании газообразной смеси 40% NH3–1% C2H2–C2H4 аммиак может встраиваться в виде азотсодержащих групп в углеродные цепочки промежуточных продуктов в ходе образования углеродных отложений. Таким образом, происходит модификация формирующегося углеродного материала атомами азота.
Оксид магния из композита N–С/MgO удаляли с помощью раствора соляной кислоты. Удельная поверхность N-графена составляла 1300 м2/г.
Синтез Pt/графен и Pt/N-графен катализаторов
Платину на графен и N-графен наносили из водного раствора Pt(NO3)4 с концентрацией платины 250 мкг/мл. К рассчитанному объему раствора Pt(NO3)4 прибавляли 10–15 мл дистиллированной воды, а затем, при перемешивании на магнитной мешалке, навеску 1.00 г углерода. Воду выпаривали досуха, сухой остаток перемещали в фарфоровую чашку, прокаливали в муфельной печи при 150°С в течение 30 мин. Концентрацию нанесенной платины в образцах изменяли от 0.2 до 1 мас. %. Катализаторы Pt/графен и Pt/N-графен перед каталитическими экспериментами восстанавливали в проточном кварцевом реакторе в смеси 50% Н2–Ar при температуре 250°С в течение 30 мин.
Разложение муравьиной кислоты на катализаторах Pt/графен и Pt/N-графен
Эксперименты по разложению МК проводили в проточной установке с использованием кварцевого реактора (внутренний диаметр – 6 мм). Загрузка катализатора составляла 20 мг, катализатор равномерно смешивали с 0.5 см3 кварца. Тренировку катализаторов осуществляли водородсодержащей смесью 10% Н2 (Не) при температуре 200°С в течение 1 ч.
Состав исходной смеси – 5 об. % МК в гелии. Скорость потока – 20 см3/мин. Эксперименты выполняли в температурно-программируемом режиме (скорость подъема температуры – 2 град/мин). За ходом реакции следили по выделению СО, СО2, концентрации которых определяли хроматографическим методом. Конверсию МК рассчитывали как отношение суммы концентраций СО и СО2 к начальной концентрации МК. Селективность образования СО2 (Н2) находили как отношение концентрации СО2 к сумме концентраций СО и СО2.
Физико-химические методы исследования катализаторов Pt/графен и Pt/N-графен
Для исследования структуры и микроструктуры образцов применяли метод просвечивающей электронной микроскопии высокого разрешения (ПЭМВР) с использованием электронного микроскопа ThemisZ (“Thermo Fisher Scientific”, США) c ускоряющим напряжением 200 кВ и предельным разрешением по решетке 0.07 нм. Запись изображений осуществляли с помощью ПЗС-матрицы Ceta 16 (“Thermo Fisher Scientific”, США).
Удельную поверхность и пористость получаемых образцов определяли методом Баррета–Джойнера–Халенды [27, 28] с помощью прибора ASAP-2400 (“Micromeritics”, США).
Регистрацию РФЭ-спектров проводили на фотоэлектронном спектрометре фирмы “SPECS” с использованием излучения AlKα (hν = 1486.6 эВ, 150 Вт). Шкала энергий связи (Есв) была предварительно откалибрована по положению пиков остовных уровней золота и меди Au4f7/2 (84.0 эВ) и Cu2p3/2 (932.67 эВ). Как обзорные спектры, так и отдельные спектральные регионы (Pt4f, C1s, N1s и O1s) записывали при энергии пропускания анализатора 20 эВ.
Деконволюцию измеренных фотоэлектронных спектров на индивидуальные компоненты осуществляли с аппроксимацией пиков суммой функций Лоренца и Гаусса. Для этих целей использовали программу XPS Peak 4.1 [29], которая позволяет проводить деконволюцию РФЭ-спектров смешанными функциями Гаусса–Лоренца с автоматическим подбором параметров пиков таким образом, чтобы разница между описывающей пики кривой, являющейся их суммой, и экспериментальными данными была минимальна.
КР-спектры были измерены в геометрии обратного рассеяния с помощью спектрометра Lab-RamHR (“Horiba Jobin Yvon”, Франция), оборудованного детектором CCD-2048 × 512 с азотным охлаждением и микроскопом BX41 (“Olympus”, Япония). Возбуждение осуществляли ионным аргоновым лазером (λ = 488 нм) со спектральным разрешением 2 см–1.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Определение размера частиц платины в катализаторах Pt/графен и Pt/N-графен
На рис. 1а и 1б представлены электронно-микроскопические снимки графена и N-графена, использовавшихся в настоящей работе в качестве носителей. В обоих случаях частицы графена, состоящие из 2–4 графеновых слоев, имеют размер от 20 до 100 нм и сферическую форму, которая определяется геометрическими параметрами кристаллитов исходного MgO. В качестве примера на рис. 1в приведен снимок катализатора 0.2 мас. % Pt/N-графен, из которого видно, что средний размер частиц платины составляет 12 нм.
Рис. 1.
Электронно-микроскопические снимки графена (а), N-графена (б) и катализатора 0.2 мас. % Pt/N-графен (в). На вставке: распределение частиц по размерам для катализатора 0.2 мас. % Pt/N-графен.

Данные о размере частиц платины для катализаторов Pt/графен и Pt/N-графен, полученные методом ПЭМВР, хорошо согласуются с результатами хемосорбции СО (табл. 1). Как видно, увеличение содержания платины в катализаторах сопровождается уменьшением отношения СO/Pt, на основании чего можно предположить, что дисперсность катализаторов снижается.
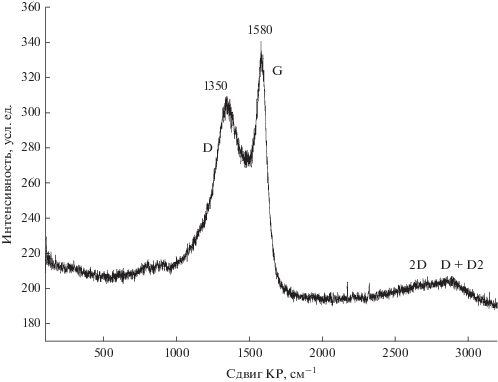
ИсследованиеN-графена методом КР-спектроскопии
Спектр комбинационного рассеяния образца N-графена показан на рис. 2. В спектре наблюдаются основные полосы при 1580 и 1350 см–1. Полоса G (графит) около 1580 см–1 соответствует колебательной моде идеальной графитовой решетки с симметрией E2g [30]. Полоса около 1350 см–1, которая отсутствует в спектре монокристаллического графита и высокоориентированного поликристаллического графита, в литературе называется полосой D (или дефектной полосой). Она соответствует моде колебаний графитовой решетки с симметрией A1g. Появление ее в спектре углеродных материалов связано с разупорядочением структуры графита. В спектре второго порядка наблюдаются полосы около 2680 (2D) и 2900 (D + D2) см–1 [30]. Отношение D/G используется для характеристики количества дефектов в углеродных материалах. В случае исследуемого образца соотношение D/G = 2.77. Наличие в спектре слабо интенсивной 2D-полосы при ~2680 cм–1 (2D/D = 0.18) подтверждает выраженную дефектную структуру N-графена [31].
РФЭС-исследования катализаторов Pt/N-графен
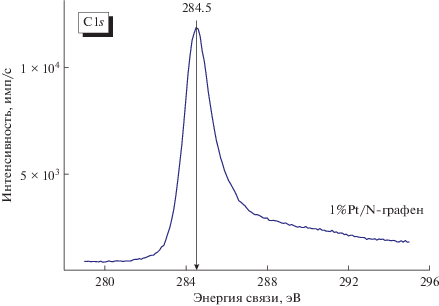
На рис. 3 представлена спектральная линия С1s. Основной C1s-пик для всех образцов имеет положение типичное для sp2-гибридизованного углерода (284.5 эВ), что дополнительно подтверждается характерным сателлитом в области ~291 эВ, обусловленным π → π*-переходом.
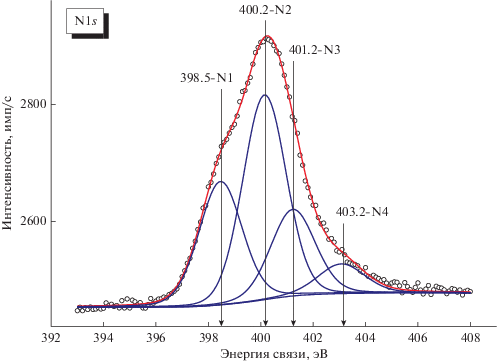
Формы спектральной линии N1s для всех катализаторов Pt/N-графен были подобны, указывая на близкий набор состояний азота на их поверхности. На рис. 4 показан типичный спектр N1s, разложенный на индивидуальные компоненты.
В соответствии с литературными данными [32, 33] компоненты N1 и N3 можно отнести к пиридино- и графитоподобной азотным формам. Компоненту N2 с промежуточной между N1 и N3 энергией связи относят к аминогруппам или пиррольным формам азота на поверхности углеродных материалов [34–36]. Компонента N4 c энергией связи >403 эВ может говорить о присутствии окисленных форм азота (например, пиридин-N-оксида). Таким образом, N-графен содержит следующие формы азота: пиридиновую (N1), пиррольную или аминогруппу (N2), графитоподобную (N3) и окисленную (N4). Концентрация атомов азота в N-графене составляет 5.0 мас. %. Описанные выше азотные центры находятся на внешней поверхности носителя, так как сферические частицы N‑графена состоят из 2–4 графеновых слоев, т.е. не имеют объема.
Спектры Pt4f для образцов 0.2%Pt/N-графен, 0.4%Pt/N-графен и 1.0%Pt/N-графен представлены на рис. 5. Результаты анализа и деконволюции полученных спектров Pt4f позволяют сделать вывод о наличии на поверхности образцов нескольких состояний платины. Пик с энергией связи 71.5 ± 0.1 эВ типичен для мелкодисперсных частиц металлической платины (Pt0). Присутствие пика с Есв = 73.1 эВ свидетельствует о том, что исходная поверхность платиновых частиц в изученных катализаторах преимущественно находится в окисленном состоянии Pt4+. Пик со значением энергии связи 72.4 эВ может быть отнесен к состоянию Pt2+, которое образуется в результате взаимодействия с азотными центрами N-графена [4, 37, 38].
Рис. 5.
Деконволюция спектров Pt4f на индивидуальные состояния платины для образцов 0.2%Pt/N-графен, 0.4%Pt/N-графен и 1%Pt/N-графен.
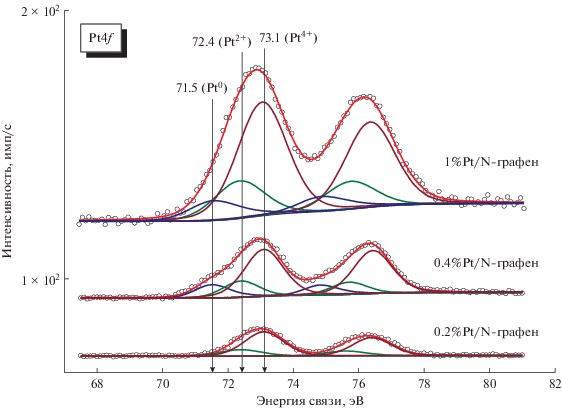
В табл. 2 приведены количественные соотношения форм платины на поверхности образцов 0.2%Pt/N-графен, 0.4%Pt/N-графен и 1%Pt/N-графен. Из спектров на рис. 5 следует, что платина на воздухе окисляется несмотря на то, что она предварительно была восстановлена в кварцевом реакторе с весами Мак-Бена. Чем меньше размер частиц платины, тем глубже она окисляется.
Таблица 2.
Количественные соотношения форм платины на поверхности образцов Pt/N-графен
| Образец | Pt0, % | Pt2+, % | Pt4+, % |
|---|---|---|---|
| 0.2%Pt/N-графен | 0 | 23.9 | 76.1 |
| 0.4%Pt/N-графен | 14.4 | 20.6 | 65.0 |
| 1%Pt/N-графен | 15.0 | 20.5 | 64.5 |
На рис. 6 показаны результаты деконволюции спектров Pt4f на индивидуальные состояния платины для образцов 0.4%Pt/N-графен и 1%Pt/N-графен до и после восстановления в водородом в камере спектрометра при температуре 250°С.
Рис. 6.
Деконволюция спектров Pt4f на индивидуальные состояния платины для образцов 0.4%Pt/N-графен (а) и 1%Pt/N-графен (б) до и после восстановления в водороде в камере спектрометра при температуре 250°С.
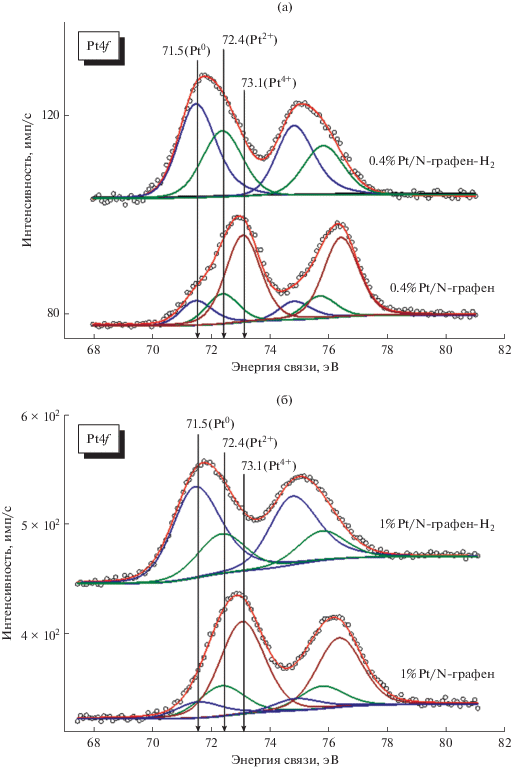
Из данных табл. 3 видно, после восстановления катализаторов в водороде в камере спектрометра платина находится в основном в виде металла, однако некоторая ее часть остается в виде Pt2+. Вероятно, наличие Pt2+ связано с сильным взаимодействием платины с азотсодержащими центрами носителя (N-графена).
Таблица 3.
Количественное соотношение форм платины на поверхности образцов Pt/N-графен исходных и после восстановления в водороде в камере спектрометра при температуре 250°С
| Образец | Pt0, % | Pt2+, % | Pt4+, % |
|---|---|---|---|
| 0.4%Pt/N-графен | 14.4 | 20.6 | 65.0 |
| 0.4%Pt/N-графен, восстановлен в спектрометре | 62.0 | 38.0 | 0 |
| 1%Pt/N-графен | 15.0 | 20.5 | 64.5 |
| 1%Pt/N-графен, восстановлен в спектрометре |
72.6 | 24.6 | 0 |
Разложение муравьиной кислоты на катализаторах Pt/графен и Pt/N-графен
Для того чтобы выяснить, по какому маршруту происходит разложение МК на катализаторах Pt/N-графен, были проведены эксперименты в проточной установке с использованием кварцевого реактора. Для сравнения были протестированы катализаторы Pt/графен, поверхность носителя которых не была допирована атомами азота.
Данные по каталитическому превращению МК на носителе N-графен и катализаторах Pt/графен и Pt/N-графен представлены на рис. 7.
Рис. 7.
Зависимость конверсии муравьиной кислоты от температуры для катализаторов: 1– 1%Pt/N-графен; 2 – 1%Pt/графен; 3 – 0.2%Pt/N-графен; 4 – 0.2%Pt/графен; 5 – N-графен.
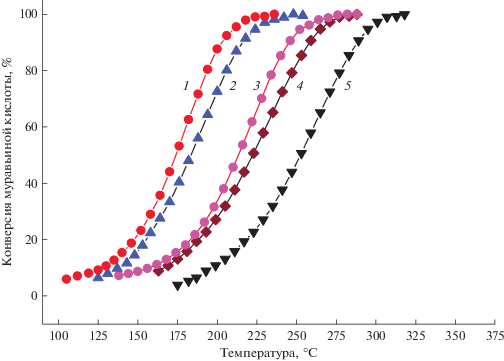
Активность катализаторов в разложении МК можно охарактеризовать температурой, при которой достигается 50%-ная конверсия муравьиной кислоты.
Как показали исследования, N-графен сам по себе может вести разложение муравьиной кислоты, однако обладает крайне низкой активностью, о чем свидетельствуют данные, приведенные на рис. 7 и в табл. 4.
Таблица 4.
Температуры 50%-го превращения муравьиной кислоты в присутствии исследованных катализаторов и носителя
| Катализатор | Т50%, °С |
|---|---|
| 1%Pt/N-графен | 170 |
| 1%Pt/графен | 183 |
| 0.2%Pt/N-графен | 213 |
| 0.2%Pt/графен | 222 |
| N-графен | 245 |
Из рис. 7 видно, что нанесение 0.2 мас. % платины на графен и N-графен резко увеличивает активность катализаторов на их основе. Следует отметить, что образец 0.2%Pt/N-графен обладает более высокой активностью в разложении МК по сравнению с 0.2%Pt/графен. Так, температура достижения 50%-ной конверсии муравьиной кислоты снижается с 222°С для 0.2%Pt/графен до 213°С для 0.2%Pt/N-графен. Рост активности объясняется увеличением дисперсности частиц платины в катализаторе 0.2% Pt/N-графен по сравнению с 0.2%Pt/графен, что подтверждается данными о хемосорбции СО (табл. 1).
Дальнейшее повышение концентрации платины в катализаторах до 1 мас. % приводит к возрастанию их каталитической активности. Сравнение образцов 1%Pt/N-графен и 1%Pt/графен показывает, что азотсодержащий катализатор активнее, чем недопированный азотом. Более высокая дисперсность и, соответственно, активность азотсодержащих образцов 0.2%Pt/N-графен и 1%Pt/N-графен по сравнению с 0.2%Pt/графен и 1%Pt/графен объясняется положительной ролью азотных центров графенового носителя в стабилизации дисперсных частиц платины.
Важной характеристикой изучаемых катализаторов является их селективность в реакции разложения МК. Как отмечалось выше, N-графен обладает низкой активностью в разложении МК. Селективность реакции в его присутствии также невысока и меняется от 96% при 225°С до 90% при 325°С.
Селективности катализаторов 0.2%Pt/N-графен и 0.2%Pt/графен одинаковы и с температурой реакции изменяются от 97% при 150°С до 93% при 280°С.
Увеличение содержания платины в составе образцов до 1 мас. % приводит к повышению их селективности в разложении муравьиной кислоты с образованием Н2 и СО2. Для катализатора 1%Pt/графен ее значение меняется от 99.2% при 125°С до 96.6% при 250°С, а для образца 1%Pt/N-графен – от 99.6% при 105°С до 95.2% при 235°С. Таким образом, катализаторы 1%Pt/графен и 1%Pt/N-графен имеют практически одинаковую селективность.
Увеличение селективности с ростом концентрации платины в составе образцов может быть связано с изменением соотношения вкладов в разложение МК металлической платины и графенового носителя.
ЗАКЛЮЧЕНИЕ
Исследованы свойства новой каталитической системы Pt/N-графен в реакции газофазного разложения муравьиной кислоты с целью получения чистого водорода. В качестве углеродного носителя использовали допированный и недопированный атомами азота графеновый порошок. Для характеризации синтезированных катализаторов использовали методы: КР-спектроскопии, рентгеновской фотоэлектронной спектроскопии, просвечивающей электронной микроскопии высокого разрешения и хемосорбции СО. Электронно-микроскопические исследования показали, что частицы графена и N-графена имеют сферическую форму. Размеры сфер (20–100 нм) определяются геометрическими параметрами темплата MgO. Образцы 0.2%Pt/графен, 0.2%Pt/N-графен, 1%Pt/графен и 1%Pt/N-графен синтезированы методом пропитки. С помощью РФЭС показано, что исходная поверхность платиновых частиц в изученных катализаторах преимущественно находится в окисленном состоянии Pt4+. Пик со значением энергии связи 72.4 эВ может быть отнесен к состоянию Pt2+, которое образуется в результате взаимодействия с азотными центрами N-графена. После восстановления образцов Pt/N-графен в водороде в камере спектрометра при температуре 250°С значительная часть платины восстанавливается до металла, однако некоторая ее часть остается в виде Pt2+. Вероятно, наличие Pt2+ связано с ее сильным взаимодействием с азотсодержащими центрами носителя (N-графена). Более высокая дисперсность и, соответственно, активность азотсодержащих катализаторов 0.2%Pt/N-графен и 1%Pt/N-графен по сравнению с образцами 0.2%Pt/графен и 1%Pt/графен объясняется положительной ролью азотных центров графенового носителя в стабилизации дисперсных частиц платины. Каталитическое разложение муравьиной кислоты может идти по двум маршрутам, приводящим к образованию H2 и CO2 или Н2О и СО. Установлено, что при допировании графена атомами азота и с увеличением концентрации платины от 0.2 до 1 мас. % повышается активность катализатора, при этом его селективность в реакции, протекающей по маршруту образования H2 и CO2, достигает 96–99%.
Список литературы
Grasemann M., Laurenczy G. // Energy Environ. Sci. 2012. V. 5. P. 8171.
Bulushev D.A., Ross J.R.H. // ChemSusChem. 2018. V. 11. P. 821.
Tang C., Surkus A.E., Pohl M.M., Agostini G., Schneider M., Junge H., Beller M. // Angew. Chem. Int. Ed. Engl. 2017. V. 56. P. 16616.
Jia L., Bulushev D.A., Podyacheva O.Yu., Boronin A. I., Kibis L.S., Gerasimov E.Yu., Beloshapkin S., Seryak I.A., Ismagilov Z.R., Ross J.R.H. // J. Catal. 2013. V. 307. P. 94.
Ayusheev A.B., Taran O.P., Seryak I.A., Podyacheva O.Yu., Descorme C., Besson M., Kibis L.S., Boronin A.I., Romanenko A.I., Ismagilov Z.R., Parmon V.N. // Appl. Catal. B: Environ. 2014. V. 146. P. 177.
Исмагилов З.Р., Шалагина А.Е., Подъячева О.Ю., Барнаков Ч.Н., Козлов А.П., Квон Р.И., Исмагилов И.З., Керженцев М.А. // Кинетика и катализ. 2007. Т. 48. № 4. С. 621.
Podyacheva O.Yu., Ismagilov Z.R. // Catal. Today. 2015. V. 249. P. 12.
Zacharska M., Bulusheva L.G., Lisitsyn A.S., Beloshapkin S., Guo Y., Chuvilin A.L., Shlyakhova E.V., Podyacheva O.Y., Leahy J.J., Okotrub A.V., Bulushev D.A. // ChemSusChem. 2017. V. 10. P. 720.
Chesnokov V.V., Prosvirin I.P., Zaikovskii V.I., Zaitseva N.A. // Eurasian Chem. Technol. J. 2003. V. 5. № 2. P. 127.
Kochubey D.I., Chesnokov V.V., Malykhin S.E. // Carbon. 2012. V. 50. № 8. P. 2782.
Чесноков В.В., Кривенцов В.В., Малыхин С.Е., Чичкань А.С., Подъячева О.Ю. // ЖСХ. 2018. Т. 59. № 4. С. 876. (Chesnokov V.V., Kriventsov V.V., Malykhin S.E., Chichkan A.S., Podyacheva O.Y. // J. Struct. Chem. 2018. V. 59. № 4. P. 839.)
Chesnokov V.V., Kriventsov V.V., Malykhin S.E., Svintsitskiy D.A., Podyacheva O.Y., Lisitsyn A.S., Richards R.M. // Diam.Relat. Mater. 2018. V. 89. P. 67.
Bulushev D.A., Zacharska M., Lisitsyn A.S., Podyacheva O.Y., Hage F.S., Ramasse Q.M., Bangert U., Bulusheva L.G. // ACS Catal. 2016. V. 6. P. 3442.
Zacharska M., Podyacheva O.Y., Kibis L.S., Boronin A.I., Senkovskiy B.V., Gerasimov E.Y., Taran O.P., Ayusheev A.B., Parmon V.N., Leahy J.J., Bulushev D.A. // ChemCatChem. 2015. V. 7. P. 2910.
Golub F.S., Beloshapkin S., Gusel’nikov A.V., Bolotov V.A., Parmon V.N., Bulushev D.A. // Energies. 2019. V. 12. № 20. P. 3885.
Huang C., Li C., Shi G. // Energy Environ. Sci. 2012. V. 5. P. 8848.
Luo Q., Zhang W., Fu C.F., Yang J. // Int. J. Hydrogen Energy. 2018. V. 43. P. 6997.
Jeyakumar T.C., Sivasankar C. // New J. Chem. 2019. V. 43. P. 1440.
Feng J.R., Wang G.C. // Appl. Surf. Sci. 2021. V. 539. P. 148192:1-10.
Grad O., Mihet M., Dan M., Blanita G., Radu T., Berghian-Grosan C., Lazar M.D. // J. Mater. Sci. 2019. V. 54. P. 6991.
Li S.J., Ping Y., Yan J.M., Wang H.L., Wu M., Jiang Q. // J. Mater. Chem. A. 2015. V. 3. P. 14535.
Zhao X., Dai P., Xu D., Li Z., Guo Q. // Int. J. Hydrogen Energy. 2020. V. 45. P. 30396.
Yan J.M., Li S.J., Yi S.S., Wulan B.R., Zheng W.T., Jiang Q. // Adv. Mater. 2018. V. 30. P. 1703038.
Gray J.T., Kang S.W., Yang J.I., Kruse N., McEwen J.S., Park J.C., Ha S. //Appl. Catal. B: Environ. 2020. V. 264. P. 118478:1-12.
Чесноков В.В., Чичкань А.С., Бедило А.Ф., Шуваракова Е.И., Пармон В.Н. // ДАН. 2019. Т. 488. № 5. С. 508.
Буянов Р.А. Закоксование катализаторов. Москва: Наука. 1983. 207 с.
Gor G.Yu., Thommes M., Cychosz K.A., Neimark A.V. // Carbon. 2012. V. 50. P. 1583.
Thommes M., Kaneko K., Neimark A.V., Olivier J.P., Rodriguez-Reinoso F., Rouquerol J., Sing K.S.W. // Pure Appl. Chem. 2015. V. 87. P. 1051.
http://xpspeak.software.informer.com/4.1/
Sadezky A., Muckenhuber H., Grothe H., Niessner R., Pöschl U. // Carbon. 2005. V. 43. P. 1731.
Podyacheva O.Yu., Suboch A.N., Bokova-Sirosh S.N., Romanenko A.I., Kibis L.S., Obraztsova E.D., Kuznetsov V.L. // Phys. Status Solidi. B. 2018. V. 255. P. 1700253
Чесноков В.В., Чичкань А.С., Паукштис Е.А., Свинцицкий Д.А., Исмагилов З.Р., Пармон В.Н. // ДАН. 2017. Т. 476. № 5. С. 535. (Chesnokov V.V., Chichkan A.S., Paukshtis E.A., Svintsitskiy D.A., Ismagilov Z.R., Parmon V.N. // Doklady Physical Chemistry. 2017. V. 476. № 2. P. 186.)
Arrigo R., Schuster M.E., Xie Z., Yi Y., Wowsnick G., Sun L.L., Hermann K.E., Friedrich M., Kast P., Hävecker M., Knop-Gericke A., Schlögl R. // ACS Catal. 2015. V. 5. P. 2740.
Shao Y., Zhang S., Engelhard M.H., Li G., Shao G., Wang Y., Liu J., Aksay I.A., Lin Y. // J. Mater. Chem. 2010. V. 20. P. 7491.
Li D., Yu C., Wang M., Zhang Y., Pan C. // RSC Adv. 2014. V. 4. P. 55394.
Santiago S.R.M., Wong Y.-A., Lin T.-N., Chang C.-H., Yuan C.-T., Shen J.-L. // Optics Lett. 2017. V. 42. P. 3642.
Guo L., Jiang W.-J., Zhang Y., Hu J.-S., Wei Z.-D., Wan L.-J. // ACS Catal. 2015. V. 5. P. 2903.
Ma J., Habrioux A., Luo Y., Ramos-Sanchez G., Calvillo L., Granozzi G., Balbuena P.B., Alonso-Vante N. // J. Mater. Chem. A. 2015. V. 3. P. 11891.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ