Кинетика и катализ, 2021, T. 62, № 4, стр. 466-471
Окисление диоксида серы во фторидах натрия и кальция
М. С. Иванова a, *, Ю. В. Савицкая b, М. В. Вишнецкая b, К. О. Томский a
a ФГАОУ ВО Политехнический институт (филиал) Северо-Восточного федерального университета
имени М.К. Аммосова в г. Мирном
678170 Мирный, Тихонова, 5, корп. 1, Россия
b ФГАОУ ВО РГУ нефти и газа (НИУ) им. И.М. Губкина
119991 Москва, Ленинский просп., 65, Россия
* E-mail: ims.06@mail.ru
Поступила в редакцию 07.12.2020
После доработки 10.02.2021
Принята к публикации 19.02.2021
Аннотация
Установлено, что в водных растворах фторида натрия и суспензиях фторида кальция при комнатной температуре и атмосферном давлении протекают реакции окисления диоксида серы. Показано, что растворы NaF и CaF2 можно многократно использовать после их регенерации кислородом воздуха.
ВВЕДЕНИЕ
Известно, что вещества, в состав которых входит фтор, широко используются в органическом синтезе как растворители в различных окислительных реакциях [1–3]. Применение фторсодержащих соединений в этом качестве становится возможным благодаря тому, что они могут растворять молекулярный кислород.
В работе [4] была продемонстрирована способность фторсодержащих веществ к довольно устойчивому комплексообразованию с молекулярным кислородом. В результате формирования комплекса изменяется электронная конфигурация молекулы кислорода до синглетного состояния, что, вероятно, и обуславливает его очень сильные окислительные свойства в соединениях фтора, а также прочность связи растворенного кислорода с этими молекулами.
В работах [5–7] нами было показано, что фторсодержащие системы, такие как перфтораны, растворы трифторуксусной кислоты (ТФК) и трифторацетаты (ТФА) непереходных металлов, не только растворяют молекулярный кислород, но и способны активировать его при стандартных условиях. Высокая реакционная способность кислорода обнаружена при взаимодействии с диоксидом серы, оксидом азота, диоксидом азота, монооксидом углерода, пропиленом, этиленом, алкилароматическими соединениями и др. [8, 9].
Активация молекулярного кислорода в качестве окислителя в таких реакциях является наиболее сложным этапом, поскольку при стандартных условиях кислород крайне затруднительно вступает в химические реакции. Из возможных промежуточных веществ, осуществляющих превращения, молекулярный кислород 1О2 в синглетной форме был исключен [10], потому что для появления такой формы кислорода требуется 112 кДж/моль. Кроме того, на основании квантово-химических расчетов было сделано заключение, что активация молекулярного кислорода в основном состоянии через образование такого высокореакционного интермедиата, как катион ${\text{HO}}_{2}^{ + },$ в водных растворах ТФК маловероятна. Активными промежуточными соединениями окислительных реакций различных субстратов молекулярным кислородом в среде трифторуксусной кислоты могут быть либо гидропероксидные радикалы, либо радикальные пары CF3COO• + OOH• [5].
Необходимо отметить, что реакции окисления активной формой молекулярного кислорода органических и неорганических соединений в трифторуксусной кислоте проходят через стадию образования пероксосоединений, что было доказано качественными аналитическими реакциями и спектральными методами [11].
Однако все перечисленные фторсодержащие вещества (кроме перфторанов) хорошо растворяются в воде, что создает сложности при последующем разделении продуктов реакции. Поскольку остальные соединения экологически небезопасны и имеют немалую цену, стоило сравнить окислительную активность фторида кальция (флюорита) с уже изученными фторсодержащими системами.
В России флюорит представлен внушительным списком месторождений. Одними из крупнейших по добыче флюорита являются Воскресенское и Пограничное месторождения в Хорольском районе Приморского края, разрабатывавшиеся ОАО “Ярославский горно-обогатительный комбинат”.
В настоящей работе исследована кинетика окисления SO2 дикислородом в растворах NaF и суспензиях CaF2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Процесс окисления диоксида серы во фторидах кальция и натрия осуществляли при стандартных условиях (P = 1 атм и T = 25°С). Исследования проводили с различными концентрациями солей, для изменения кислотности среды до рН 1.90–2.00 использовали разбавленные растворы соляной и уксусной кислот.
Установка для окисления SO2 состояла из системы подачи диоксида серы, устройства для пропускания газа через систему с исследуемым фторидом. Для определения количества непрореагировавшего диоксида серы на выходе из системы его улавливали 0.0001 М раствором дихромата калия.
Диоксид серы получали при взаимодействии сульфата натрия с разбавленной соляной кислотой. Образующийся в результате реакции SO2 пропускали через фториды натрия и кальция со скоростью равной 65 мл/мин. Из-за нерастворимости фторида кальция в воде диоксид серы барботировали через систему с магнитной мешалкой.
Момент выхода диоксида серы, не вступившего в реакцию, определяли качественной реакцией по изменению окраски раствора бихромата калия. Для измерения концентрации бихромата калия использовали халькогенидный хромселективный электрод и хлорсеребряный электрод на анализаторе Эксперт-001 (ООО “Эконикс-Эксперт”, Россия). Количественное содержание сульфат-иона измеряли методом потенциометрического титрования на анализаторе Эксперт-001 с помощью ионоселективного электрода ЭЛИТ-081 (“Новолаб”, Россия) путем осаждения сульфата бария. Для этого из реактора отбирали 5–20 мл раствора, величину кислотности среды доводили до 4 и нагревали при 50°С в течение 20–40 мин. Нагревание было необходимо для разрушения пероксокомплексов сульфат-иона, которые препятствуют осаждению BaSO4. Пероксосоединения образуются при взаимодействии активного кислорода с диоксидом серы, что было установлено методом ИК-спектроскопии [11]. Анализ содержимого барботера показал полное отсутствие S(IV) в растворе и присутствие S(VI), количество которой почти полностью совпадало с количеством поглощенного SO2, т.е. поглощенный SO2 количественно превращался в сульфат-ион.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Данные, полученные в результате проведенных экспериментов по пропусканию диоксида серы через системы, содержащие суспензии фторида кальция и растворы фторида натрия, представлены на рис. 1 и 2. Как видно из рисунков, в начальный период времени диоксид серы поглощается полностью, так как скорости сорбции соответствуют скорости подачи SO2 в системы. Для систем с различными концентрациями фторида кальция полное поглощение диоксида серы происходит в течение 15–22 мин, а для систем с фторидом натрия – в течение 15–47 мин.
Рис. 1.
Зависимости скорости поглощения SO2 водными суспензиями CaF2 от времени при различных концентрациях растворов CaF2 (скорость подачи 65 мл/мин SO2).
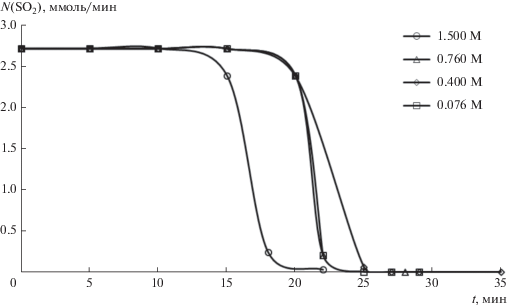
Рис. 2.
Зависимости скорости поглощения SO2 водными растворами NaF от времени при различных концентрациях растворов NaF (скорость подачи 65 мл/мин SO2).
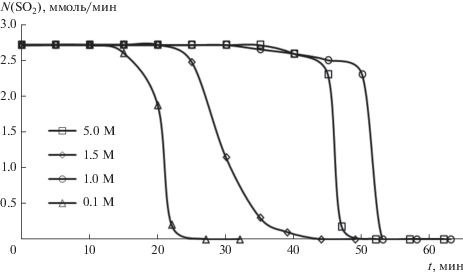
Полученные результаты свидетельствуют о практически мгновенном поглощении диоксида серы сразу после начала эксперимента.
Площадь под кривыми зависимостей скорости поглощения SO2 от времени численно равна количеству поглощенного и окисленного SO2 при данной концентрации растворов/суспензий.
Ранее в работе [6] была показана возможность многократного использования фторсодержащих соединений, таких как трифторуксусная кислота и трифторацетаты, путем их регенерации кислородом воздуха. Подобная возможность повторного применения была исследована и для фторидов. Для этого через системы, содержащие фториды натрия и кальция, сначала пропускали диоксид серы до полного их насыщения, а затем в течение часа – кислород воздуха. В результате проведенных операций способности фторидов к окислению восстанавливались в полной мере.
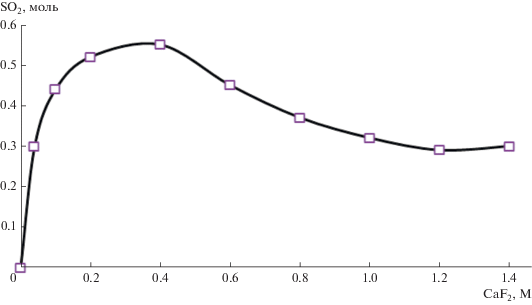
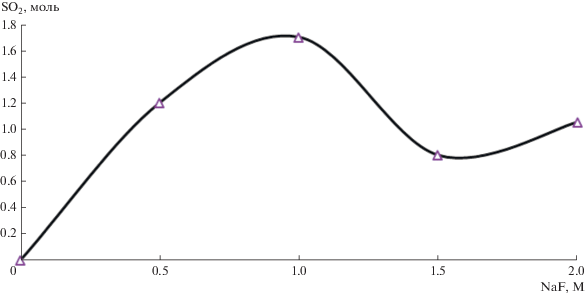
На основании кинетических данных (рис. 1 и 2) были получены зависимости количества окисленного SO2 от концентраций CaF2 и NaF (рис. 3 и 4 соответственно). Вид кривой на рис. 4 можно объяснить с помощью концепции ионных тройников [12]. При незначительных концентрациях NaF в растворе содержатся только молекулы электролита и соответствующие им простые ионы. С увеличением содержания фторида натрия в растворе электропроводность получившейся системы снижается, т.к. равновесие между ионами и молекулами смещается в сторону ионных пар. По мере дальнейшего роста концентрации NaF становится возможным образование ионных тройников, и электропроводность начинает повышаться за счет их прямого участия в переносе тока.
Из данных зависимостей количества окисленного SO2 с помощью трифторацетата натрия [13], фторидов кальция (рис. 3) и натрия (рис. 4) видно, что максимальное его количество может быть окислено в 1 M растворе фторида натрия (рис. 4).
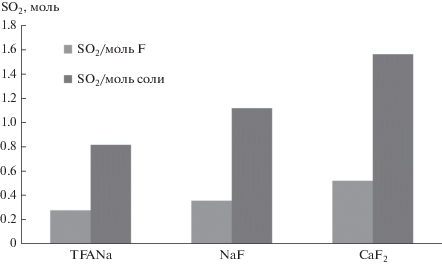
Однако количества окисленного диоксида серы в расчете на моль фтора и на моль соли оказались максимальными в случае использования суспензии фторида кальция (рис. 5), превышая на 28 и 30% соответствующие показатели, полученные при применении раствора фторида калия. В случае трифторацетатa натрия отличия были еще более существенными.
Следует сказать, что в уксусной кислоте при таком же значении рН (1.8–2.00) окисления SO2 не наблюдалось. В дифторуксусной кислоте (ДФК) количество окисленного SO2 в расчете на моль кислоты было в 1.6–1.8 раза меньше, чем в ТФК той же концентрации и при том же значении величины рН; количества окисленного SO2 в расчете на моль фтора практически совпали [13].
Из-за растворимости в воде трифторацетата и фторида натрия последующее разделение образующихся продуктов реакции имеет определенные сложности. В случае использования гетерогенной системы с фторидом кальция этот процесс осуществить гораздо проще. К тому же, чередуя стадии насыщения CaF2 кислородом воздуха и окисления диоксида серы, можно окислить практически неограниченное его количество.
ЗАКЛЮЧЕНИЕ
Анализ экспериментальных данных показал, что растворы фторидов натрия и кальция способны растворять и активировать молекулярный кислород, что позволяет использовать его для окисления диоксида серы при стандартных условиях. С учетом того, что по окислительным свойствам суспензия фторида кальция (основа флюорита) не уступает ТФА, трифторацетатам и NaF, а гетерогенность системы позволяет значительно упростить процесс выделения продукта, а также того, что в России флюорит представлен внушительным списком месторождений, его практическое применение вполне возможно.
Список литературы
Масоуд С.М., Акмалов Т.Р., Артюшин О.И., Бруно К., Осипов С.Н. // Изв. АН. Серия хим. 2017. № 9. С. 1601.
Шокова Э.А., Тафеенко В.А., Ковалев В.В. // Журн. орг. химии. 2020. Т. 56. № 10. С. 1605.
Гехман А.Е., Столяров И.П., Ершова Н.В., Моисеева Н.И., Моисеев И.И. // Кинетика и катализ. 2004. Т. 45. № 1. С. 45. (Gekhman A.E., Stolyarov I.P., Ershova N.V., Moiseev I.I., Moiseeva N.I. // Kinet. Catal. 2004. V. 45. № 1. P. 40.)
Бучаченко А.Л. // Успехи химии. 1985. Т. 54. № 2. С. 195.
Вишнецкая М.В., Иванова М.С., Солкан В.Н., Жидомиров Г.М., Мельников М.Я. // Журн. физ. химии. 2012. Т. 86. № 5. С. 990. (Vishnetskaya M.V., Ivano-va M.S., Solkan V.N., Zhidomirov G.M., Melnikov M.Y. // Russ. J. Phys. Chem. A. 2012. V. 86. № 5. P. 889.)
Вишнецкая М.В., Иванова М.С., Свичкарев О.М., Будынина Е.М., Мельников М.Я. // Журн. физ. химии. 2013. Т. 87. № 5. С. 756. (Vishnetskaya M.V., Ivanova M.S., Svichkarev O.M., Budynina E.M., Mel’nikov M.Ya. // Russ. J. Phys. Chem. A. 2013. V. 87. № 5. P. 742.)
Вишнецкая М.В., Мельников М.Я. // Журн. физ. химии. 2016. Т. 90. № 9. С.1434. (Vishnetskaya M.V., Mel’nikov M.Y. // Russ. J. Phys. Chem A. 2016. V. 90. № 9. P. 1909.
Вишнецкая М.В., Якимова И.Ю., Сидоренкова И.А. // Журн. физ. химии. 2006. № 2. С. 236. (Vishnetskaya M.V., Yakimova I.Yu., Sidorenkova I.A. // Russ. J. Phys. Chem. A. 2006. V. 80. № 2. P. 173.)
Вишнецкая М.В., Якимова И.Ю., Сидоренкова И.А. // Журн. физ. химии, 2006. № 2. С.239. (Vishnetskaya M.V., Yakimova I.Yu., Sidorenkova I.A. // Russ. J. Phys. Chem. A. 2006. V. 80. № 2. P. 176.)
Солкан В.Н., Жидомиров Г.М., Мельников М.Я. // Хим. физика. 2010. Т. 29. № 10. С. 14.
Скреплева И.Ю., Волошенко Г.И., Либрович Н.Б., Майоров В.Д., Вишнецкая М.В., Мельников М.Я. // Вестн. Моск. ун-та. Серия 2. Химия. 2011. Т. 52. № 4. С. 281. (Skrepleva I.Y., Mel’nikov M.Y., Voloshenko G.I., Librovich N.B., Maiorov V.D., Vishnetskaya M.V. // Moscow University Chem. Bull. 2011. V. 66. № 4. P. 232.)
Антропов Л.И. Теоретическая электрохимия. Москва: Высшая школа, 1975. 568 с.
Вишнецкая М.В., Савицкая Ю.В., Скреплева И.Ю. // Защита окружающей среды в нефтегазовом комплексе. 2010. № 1. С. 32. (Vishneckaja M.V., Savickaja Ju.V., Skrepleva I.Ju. // Zashhita okruzhajushhej sredy v neftegazovom komplekse. 2010. № 1. P. 32.)
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ