Кинетика и катализ, 2021, T. 62, № 4, стр. 437-445
Новые композитные фотокатализаторы на основе твердых растворов сульфидов кадмия и цинка, диоксида титана и платины для фотокаталитического восстановления углекислого газа парами воды под воздействием видимого света
Д. В. Марковская a, М. Н. Люлюкин a, А. В. Журенок a, Е. А. Козлова a, *
a ФГБУН ФИЦ “Институт катализа им. Г.К. Борескова СО РАН”
630090 Новосибирск,
просп. Акад. Лаврентьева, 5, Россия
* E-mail: kozlova@catalysis.ru
Поступила в редакцию 12.01.2021
После доработки 10.03.2021
Принята к публикации 11.03.2021
Аннотация
В ходе работы были синтезированы и охарактеризованы методом рентгенофазового анализа (РФА) и спектроскопии диффузного отражения (СДО) фотокатализаторы Cd1– xZnxS/TiO2. Каталитические свойства полученных образцов были исследованы в реакции фотокаталитического восстановления углекислого газа парами воды под действием излучения видимого диапазона (400–510 нм, максимальная интенсивность излучения наблюдается при длине волны 450 нм). Наибольшую каталитическую активность продемонстрировали 20%Cd0.7Zn0.3S/TiO2 и 50%Cd0.7Zn0.3S/TiO2. Было изучено влияние порядка нанесения компонентов Pt, Cd0.7Zn0.3S и TiO2 на эффективность фотокаталитических процессов. Самые высокие значения скоростей реакции были получены на фотокатализаторе 50%Cd0.7Zn0.3S/1%Pt/TiO2 и составили 4.2 мкмоль ч–1 г–1 монооксида углерода, 0.6 мкмоль ч–1 г–1 метана.
ВВЕДЕНИЕ
Энергетические потребности человечества ежегодно возрастают [1]. Несмотря на прогресс в развитии альтернативных источников энергии, значительная часть тепла вырабатывается за счет сгорания органических веществ до углекислого газа и воды. Диоксид углерода способен поглощать инфракрасное излучение, вследствие чего его относят к категории парниковых газов [2], содержание которых в атмосфере необходимо контролировать. За последние 50 лет концентрация СО2 в атмосфере выросла практически в два раза [3]. Следовательно, поиск химических процессов, проходящих с участием диоксида углерода и позволяющих снизить его концентрацию в атмосфере, – это актуальная задача современной науки.
Интересным решением вопроса об утилизации углекислого газа представляется его фотокаталитическое восстановление, подобное процессу природного фотосинтеза. Данные процессы проходят в газовой фазе при комнатной температуре, продуктами являются ценные органические вещества (например, метан), источником энергии служит солнечный свет, вследствие чего фотокаталитическое восстановление углекислого газа привлекательно с экологической точки зрения [2]. Несмотря на большое число работ в этой области, задача поиска активных фотокатализаторов до сих пор не решена. Наиболее перспективным для осуществления фотокаталитических превращений представляется использование видимого света, поскольку его доля в солнечном спектре достаточно велика [4–7]. Твердые растворы сульфидов кадмия и цинка часто применяют в качестве фотокатализаторов, активирующихся под действием видимого излучения, поскольку варьирование состава твердого раствора позволяет изменять оптические свойства, положения уровней энергии краев валентной зоны и зоны проводимости и таким образом управлять каталитической активностью образцов [8].
Ранее было показано, что фотокатализаторы на основе твердых растворов сульфидов кадмия и цинка Сd0.8Zn0.2S и Cd0.7Zn0.3S проявляют высокую каталитическую активность под действием освещения видимого диапазона [9]. Накопленные экспериментальные данные в области фотокаталитического выделения водорода или окисления паров органических веществ дают возможность определить две наиболее эффективных стратегии к повышению величин каталитической активности: нанесение благородных металлов [10–12] и создание композитных образцов на основе твердого раствора сульфидов кадмия и цинка и других полупроводников, например, диоксида титана [13]. Среди благородных металлов особое внимание следует уделить платине [10, 11]. Интересной задачей является изучение возможности обеих стратегий улучшения каталитической активности в рамках одной работы. Таким образом, целью настоящего исследования было формирование активных композиционных материалов, состоящих из Cd1– xZnxS, TiO2 и Pt, для процессов фотокаталитического восстановления углекислого газа парами воды, протекающего под действием видимого света.
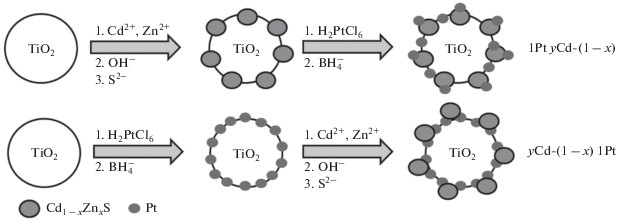
В представленной работе синтезированы композитные фотокатализаторы Cd0.8Zn0.2S/TiO2 и Cd0.7Zn0.3S/TiO2 с разными массовыми соотношениями компонентов, изучены их физико-химические свойства и каталитическая активность. Впервые получены образцы Pt/Cd0.7Zn0.3S/TiO2 и Cd0.7Zn0.3S/Pt/TiO2. Фотокатализаторы Pt/Cd0.7Zn0.3S/TiO2 продемонстрировали более высокую эффективность фотокаталитического восстановления диоксида углерода парами воды по сравнению с серией образцов Cd0.7Zn0.3S/Pt/TiO2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление фотокатализаторов
Фотокатализаторы состава y%Cd1 – xZnxS/TiO2 (х – мольная доля цинка по отношению к общему содержанию переходных металлов в сульфидном фотокатализаторе, х = 0.2–0.3; у – массовое содержание соответствующего твердого раствора сульфидов кадмия и цинка в композитном фотокатализаторе, у = 10, 20, 50) были приготовлены по следующей методике: к водной суспензии диоксида титана Evonik Р25 приливали рассчитанное количество 0.1 М растворов хлоридов кадмия и нитрата цинка (соотношение металлов [Cd] : : [Zn] = (1 – x) : x), добавляли стехиометрическое количество 0.1 М раствора гидроксида натрия и перемешивали в течение 15 мин. К полученной взвеси приливали двукратный избыток 0.1 М раствора сульфида натрия и перемешивали на магнитной мешалке в течение часа. Осадок центрифугировали и несколько раз промывали дистиллированной водой, после чего сушили при температуре 50°С.
Композитные фотокатализаторы, состоящие из диоксида титана, твердого раствора сульфидов кадмия и цинка и платины, синтезировали по двум схемам (рис. 1). Согласно первой схеме на поверхность предварительно приготовленного образца y%Cd1– xZnxS/TiO2 наносили платину методом химического восстановления платинохлороводородной кислоты избытком боргидрида натрия способом, описанном ранее в [14]. Полученные образцы 1%Pt/y%Cd1– xZnxS/TiO2 (х = = 0.2, 0.3; у = 20, 50) для краткости далее обозначены как 1Pt yCd-(1 – x). По второй схеме поверхность диоксида титана Evonik Р25 модифицировали платиной (1 мас. %) по методу химического восстановления [14], после чего на приготовленный образец наносили твердый раствор сульфида кадмия и цинка выбранного состава согласно методике двухстадийного синтеза [15], изложенной выше. Синтезированные таким образом фотокатализаторы y%Cd1 – xZnxS/1%Pt/TiO2 (х = 0.2, 0.3; у = 20, 50) далее в тексте статьи обозначены как yCd-(1 – x) 1Pt.
Изучение физико-химических и каталитических свойств приготовленных образцов
Фазовый состав синтезированных образцов изучали на рентгеновском дифрактометре Bruker D8 (“Bruker”, Германия, излучение CuKα с длиной волны λ = 1.5418 Å). Спектры диффузного отражения образцов регистрировали на спектрофотометре Lambda 35 (“Perkin Elmer”, США) с приставкой для диффузного отражения RSA-PE-20 (“Labsphere”, США), в качестве стандартного образца использовали сульфат бария.
Каталитическую активность полученных фотокатализаторов исследовали в реакции фотокаталитического восстановления углекислого газа [9]. Эксперименты проводили в статическом реакторе объемом 130 мл при постоянном перемешивании. Исследуемый фотокатализатор, масса которого составила 30 мг, наносили на стеклянную пластину круглой формы площадью 9.1 см2 и помещали на тефлоновую подложку в реактор. Перед началом эксперимента реактор предварительно продували аргоном в течение часа для удаления кислорода. После этого в реактор вносили 2 мл бидистиллированной воды и продували углекислым газом (“PTK Kriogen”, Россия, чистота >99.999%). Общее давление в реакторе составило 1 атм, начальное количество углекислого газа в реакторе – 5.24 ммоль. Реактор освещали в течение 10 ч светодиодом 450-LED, спектр которого содержит длины волн от 400 до 510 нм [9], мощность излучения 285 мВт/см2. Качественный и количественный состав продуктов реакции анализировали методом газовой хроматографии (“Хромос”, Россия). В ходе экспериментов определяли количество выделяющихся водорода, метана и монооксида углерода; количество кислорода, образующегося в ходе фотокаталитических реакций, не измеряли.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физико-химические свойства приготовленных катализаторов
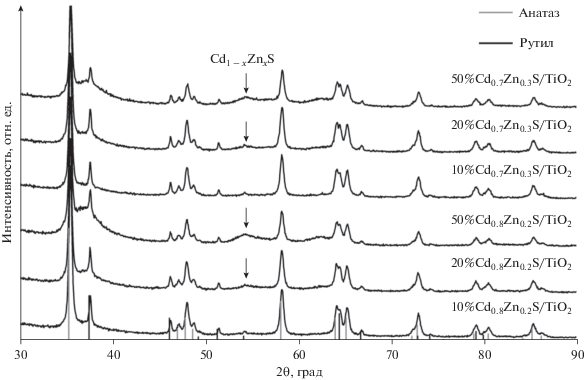
Фазовый состав приготовленных фотокатализаторов определяли методом РФА, полученные рентгенограммы показаны на рис. 2. Для всех фотокатализаторов были идентифицированы две политропные модификации диоксида титана – анатаз и рутил. Размеры областей когерентного рассеяния (ОКР), оцененные по уравнению Шеррера, составили 85 нм для анатаза и 65 нм для рутила для всех анализируемых образцов. На рентгенограммах фотокатализаторов 20%Cd0.8Zn0.2S/TiO2, 50%Cd0.8Zn0.2S/TiO2, 20%Cd0.7Zn0.3S/TiO2, 50%Cd0.7Zn0.3S/TiO2 присутствует широкий пик небольшой интенсивности с максимумом около 44° (показан стрелкой на рис. 2). Этот пик можно отнести к твердым растворам сульфидов кадмия и цинка с разупорядоченной структурой [16]; состав твердых растворов соответствует заложенному на этапе приготовления образцов. Размер ОКР фазы Cd1 – xZnxS равен менее 2 нм. По-видимому, по причине малых размеров и относительно небольшого содержания твердых растворов Cd1 – xZnxS в фотокатализаторах 10%Cd0.8Zn0.2S/TiO2 и 10%Cd0.7Zn0.3S/TiO2 пики, относящиеся к сульфидсодержащему компоненту, не идентифицируются на рентгенограммах.
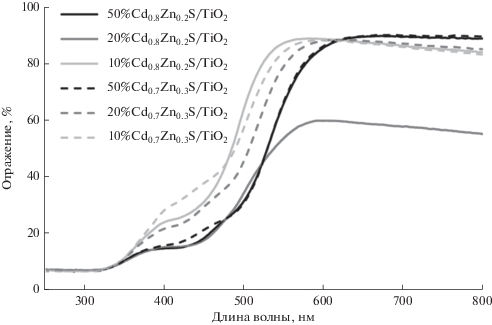
Оптические свойства приготовленных фотокатализаторов изучали методом спектроскопии диффузного отражения. Спектры поглощения исследованных образцов представлены на рис. 3. Видно, что для всех композитных фотокатализаторов можно выделить две области поглощения: 350–400 и 400–550 нм. Первая область связана с поглощением диоксида титана [17–19], вторая характерна для твердых растворов сульфидов кадмия и цинка [9, 20–23]. Таким образов, фазовый состав приготовленных фотокатализаторов был подтвержден методами РФА и СДО.
Дополнительно были построены графики в координатах Таука (рис. 4) и рассчитаны края поглощения синтезированных фотокатализаторов (табл. 1). Из литературных данных известно, что края поглощения фотокатализаторов Cd0.7Zn0.3S и Cd0.8Zn0.2S составляют 470–500 нм в зависимости от метода приготовления образцов и их фазового состава [21–23]. При нанесении твердых растворов Сd1– xZnxS на поверхность диоксида титана край поглощения смещается в синюю область, что может быть обусловлено генерированием электрон-дырочных пар под действием падающего излучения видимого диапазона и переносом электронной плотности из зоны проводимости Сd1– xZnxS в зону проводимости диоксида титана. Это явление описано для композитных образцов, в состав которых входят диоксид титана и сульфиды переходных металлов [8]. Следует отметить, что сдвиг края поглощения в синюю область спектра наблюдается для всех фотокатализаторов с одинаковым массовым содержанием твердого раствора при переходе от образцов y%Cd0.8Zn0.2S/TiO2 к образцам y%Cd0.7Zn0.3S/TiO2, что связано с оптическими свойствами Сd1 – xZnxS и характерно в случае уменьшения относительной доли кадмия в образце [9, 21, 23]. Для образцов, включающих разное количество Cd0.8Zn0.2S, край поглощения изменяется в пределах экспериментальной погрешности. Аналогичная закономерность отмечается для образцов с разным содержанием Cd0.7Zn0.3S, что согласуется с данными, описанными в литературе [22].
Рис. 4.
Графики в координатах Таука, построенные для композитных катализаторов y%Cd0.8Zn0.2S/TiO2 и y%Cd0.7Zn0.3S/TiO2.
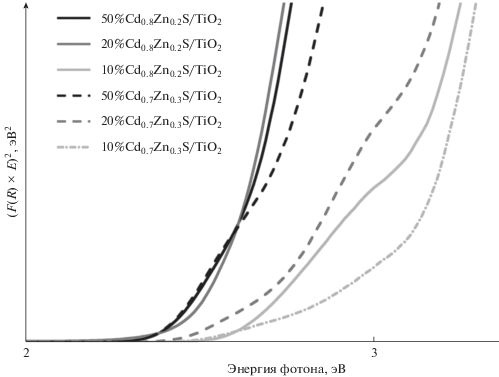
Таблица 1.
Физико-химические и каталитические свойства фотокатализаторов y%Cd1– xZnxS/TiO2
| Образец | Край поглощения, нм | W(CO), мкмоль г–1 ч–1 |
W(CH4), мкмоль г–1 ч–1 | W(H2), мкмоль г–1 ч–1 |
|---|---|---|---|---|
| Cd0.8Zn0.2S | 512 | 0.6 ± 0.3 | 0.02 ± 0.01 | 0.10 ± 0.05 |
| 10%Cd0.8Zn0.2S/TiO2 | 471 | 0.3 ± 0.2 | 0.03 ± 0.02 | 0.24 ± 0.07 |
| 20%Cd0.8Zn0.2S/TiO2 | 482 | 1.1 ± 0.6 | 0.53 ± 0.09 | 0.33 ± 0.06 |
| 50%Cd0.8Zn0.2S/TiO2 | 479 | 1.1 ± 0.8 | 0.4 ± 0.2 | 0.5 ± 0.2 |
| Cd0.7Zn0.3S | 500 | 0.4 ± 0.2 | 0.03 ± 0.01 | 0.10 ± 0.05 |
| 10%Cd0.7Zn0.3S/TiO2 | 463 | 0.3 ± 0.2 | 0.22 ± 0.09 | 0.11 ± 0.07 |
| 20%Cd0.7Zn0.3S/TiO2 | 464 | 0.9 ± 0.4 | 0.13 ± 0.07 | 0.10 ± 0.05 |
| 50%Cd0.7Zn0.3S/TiO2 | 470 | 0.9 ± 0.3 | 0.4 ± 0.1 | 0.03 ± 0.02 |
Каталитическая активность синтезированных образцов
Продуктами фотокаталитического восстановления углекислого газа парами воды, согласно литературным данным, могут быть монооксид углерода [2, 14, 24], метан [2, 14, 25], метанол [2, 14, 26], формальдегид [2, 14], муравьиная кислота [2, 27]. В присутствии всех изученных в настоящей работе фотокатализаторов продуктами реакции были метан, монооксид углерода и водород, идентифицированные методом газовой хроматографии. Вероятно, в системе происходит образование протонов из воды (уравнение (I)), которые впоследствии могут связываться между собой с выделением молекулярного водорода (уравнение (II)) либо вступать в химические взаимодействия с углекислым газом (уравнения (III) и (IV)) [9]:
(I)
${\text{2}}{{{\text{Н}}}_{{\text{2}}}}{\text{О + 4}}{{{\text{h}}}^{{\text{ + }}}}{\text{ = 4}}{{{\text{H}}}^{{\text{ + }}}}{\text{ + }}{{{\text{O}}}_{{\text{2}}}}{\text{,}}$(II)
${\text{2}}{{{\text{H}}}^{{\text{ + }}}} + {\text{2}}{{{\text{e}}}^{ - }} = {{{\text{H}}}_{{\text{2}}}}{\text{,}}$(III)
${\text{C}}{{{\text{O}}}_{{\text{2}}}} + {\text{2}}{{{\text{H}}}^{{\text{ + }}}} + {\text{2}}{{{\text{e}}}^{ - }} = {\text{CO + }}{{{\text{H}}}_{{\text{2}}}}{\text{О,}}$(IV)
${\text{C}}{{{\text{O}}}_{{\text{2}}}} + {\text{8}}{{{\text{H}}}^{{\text{ + }}}} + {\text{8}}{{{\text{e}}}^{ - }} = {\text{C}}{{{\text{H}}}_{{\text{4}}}} + {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$На первом этапе работы были исследованы каталитические свойства композитных образцов, в состав которых входят диоксид титана и твердые растворы Cd1– xZnxS, показавшие высокую активность в реакции фотокаталитического восстановления углекислого газа парами воды [9]. Количественные показатели проведенных экспериментов приведены в табл. 1. Видно, что увеличение содержания твердых растворов сульфидов кадмия и цинка Cd0.8Zn0.2S и Cd0.7Zn0.3S с 10 до 20 мас. % сопровождается повышением скорости генерирования (W) монооксида углерода и метана. Это может быть связано с ростом доли частиц, чувствительных к действию излучения видимого диапазона, что способствует увеличению количества генерируемых электрон-дырочных пар, участвующих в последующих окислительно-восстановительных превращениях. Следует отметить, что повышение содержания фазы Cd1– xZnxS приводит к возрастанию числа термодинамически выгодных гетеропереходов электронов из зоны проводимости Cd1 –xZnxS в зону проводимости TiO2 и улучшению степени пространственного разобщения носителей зарядов. Таким образом, повышение скорости целевых реакций в данном случае наблюдается за счет увеличения количества фотогенерируемых электронов и времени их жизни. Последующий рост массовой доли Cd1– xZnxS до 50 мас. %, как показывают данные табл. 1, не оказывает значительного влияния на скорость реакции выделения СН4 и СО. В случае фотокаталитического выделения водорода на образцах у%Cd0.8Zn0.2S/TiO2 сохраняется та же тенденция, что и для образования метана и монооксида углерода, которая, по-видимому, тоже связана с увеличением количества электрон-дырочных пар и гетеропереходов носителей зарядом между частицами Cd0.8Zn0.2S и TiO2. Для дальнейших экспериментов были выбраны фотокатализаторы 20%Cd0.7Zn0.3S/TiO2 и 50%Cd0.7Zn0.3S/TiO2, поскольку для них наблюдаются наибольшие значения скоростей образования метана и монооксида углерода и низкая скорость побочного процесса генерирования водорода.
Известно, что нанесение платины на поверхность фотокатализаторов способствует росту их каталитической активности [10]. Осаждение платины приводит к образованию различных межфазных контактов, играющих важную роль в фотокатализе. В связи с этим были синтезированы два типа платиносодержащих катализаторов: в первой серии платину наносили на поверхность y%Cd0.7Zn0.3S/TiO2 (образцы 1Pt yCd-0.7), во второй серии платиновый сокатализатор наносили непосредственно на диоксид титана перед добавлением твердого раствора сульфидов кадмия и цинка (образцы yCd-0.7 1Pt). Количественные результаты каталитических испытаний синтезированных образцов представлены на рис. 5.
Рис. 5.
Скорости образования водорода (а), монооксида углерода (б) и метана (в) при проведении фотокаталитического восстановления углекислого газа парами воды в присутствии платиносодержащих катализаторов; соотношения продуктов реакции, идентифицированных при использовании платиносодержащих образцов (г).
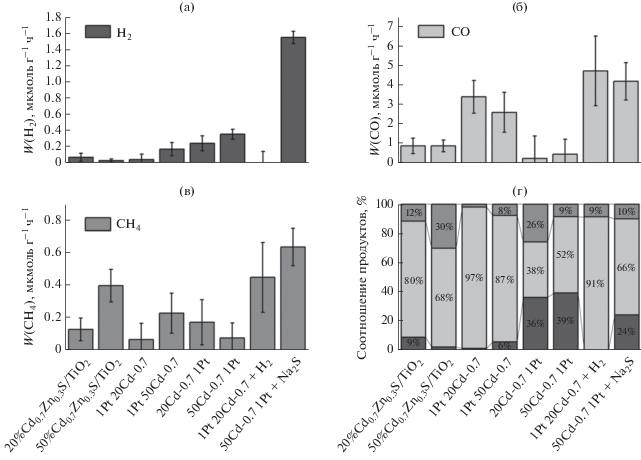
Нанесение платины на образцы двумя способами приводит к росту скорости фотокаталитического выделения водорода по сравнению с образцами 20%Cd0.7Zn0.3S/TiO2 и 50%Cd0.7Zn0.3S/TiO2 (рис. 5а), причем в обоих случаях сохраняется тенденция увеличения скорости реакции с повышением содержания фазы Cd0.7Zn0.3S в образце. Вероятно, это связано с возрастанием количества генерируемых электронов в системе. Отметим, что для фотокаталитического выделения водорода более активными оказываются образцы 20Cd-0.7 1Pt и 50Cd-0.7 1Pt, в которых в равной степени формируются межфазные контакты Pt/Cd0.7Zn0.3S и Pt/TiO2. В случае образования монооксида углерода наблюдается противоположная тенденция (рис. 5б) – значения каталитической активности выше при использовании образцов 1Pt 20Cd-0.7 и 1Pt 50Cd-0.7, в которых большинство частиц платины осаждены на твердые растворы сульфидов кадмия и цинка. Нанесение платины по второй схеме приводит к резкому снижению скорости генерирования СО по сравнению с серией 1Pt уCd-0.7 и немодифицированными образцами. Вероятно, это обусловлено расположением платины на частицах диоксида титана. В таком случае при освещении композитного фотокатализатора фотогенерированные электроны будут переходить из валентной зоны Cd0.7Zn0.3S в валентную зону диоксида титана, а оттуда – на частицы платины. Ранее экспериментально было показано, что нанесение платины на диоксид титана существенно уменьшает выход монооксида углерода [8, 14]. Возможно, это связано с более низкой восстановительной способностью электронов, находящихся на частицах платины. Потенциал зоны проводимости диоксида титана составляет –0.1 эВ (pH 0) [28], потенциал восстановления углекислого газа до монооксида углерода в соответствии с уравнением (IV) равен –0.12 эВ (pH 0) [29], вследствие этого выход СО на диоксиде титана минимален. При непосредственном контакте платины и диоксида титана электрохимический потенциал электронов понижается и становится непригодным для образования монооксида углерода, в то время как процессы образования водорода и метана термодинамически не запрещены. Отметим, что последовательность нанесения компонентов фотокатализатора не оказывает воздействия на скорость образования метана (рис. 5в). Следовательно, для эффективного фотокаталитического восстановления углекислого газа платину необходимо наносить на поверхность фазы, чувствительной к действию видимого излучения. Необходимо отметить, что в присутствии образцов 1Pt 20Cd-0.7 и 1Pt 50Cd-0.7 преимущественным продуктом восстановления углекислого газа оказывается монооксид углерода, а для серии уCd-0.7 1Pt в составе продуктов значительна доля водорода (рис. 5г). Таким образом, образцы серии 1Pt уCd-0.7 обладают высокой каталитической активностью и селективностью образования СО.
Управление скоростью фотокаталитических процессов можно осуществлять путем введения в систему различных веществ. Добавление в реакционную смесь водорода приводит к дополнительным превращениям в системе (уравнения (V)–(VI)) [14]:
(V)
${\text{C}}{{{\text{O}}}_{{\text{2}}}} + {{{\text{H}}}_{{\text{2}}}} = {\text{CO}} + {{{\text{H}}}_{{\text{2}}}}{\text{О,}}$(VI)
${\text{C}}{{{\text{O}}}_{{\text{2}}}} + {\text{4}}{{{\text{H}}}_{{\text{2}}}} = {\text{C}}{{{\text{H}}}_{{\text{4}}}} + {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$Вследствие протекания реакций (V) и (VI) ожидается рост скорости образования углеродсодержащих продуктов реакции. Данное предположение получило экспериментальное подтверждение: введение водорода в смесь углекислого газа и воды в присутствии фотокатализатора 1Pt 20Cd-0.7 способствует увеличению скорости образования монооксида углерода и метана и подавлению процесса выделения водорода (рис. 5а–5в). Альтернативным подходом к повышению каталитической активности является добавление в систему донорных реагентов, позволяющих улучшить степень пространственного разобщения носителей зарядов за счет дополнительных химических превращений. Для катализаторов, содержащих сульфиды переходных металлов, в качестве донорных реагентов используют сульфид натрия (уравнение (VII)) [30]:
(VII)
${\text{2}}{{{\text{S}}}^{{{\text{2}} - }}} + {\text{2}}{{h}^{{\text{ + }}}} = {\text{S}}_{2}^{{2 - }}{\text{.}}$Добавление сульфида натрия к реакционной системе привело к росту скорости выделения водорода в 4.3 раза, монооксида углерода – в 8.8 раз, метана – в 8 раз. Таким образом, введение донорных агентов является более эффективным методом повышения каталитической активности образцов.
ЗАКЛЮЧЕНИЕ
В заключение хотелось бы отметить, что в ходе настоящей работы были синтезированы композитные фотокатализаторы на основе диоксида титана и твердых растворов сульфидов кадмия и цинка Cd0.8Zn0.2S и Cd0.7Zn0.3S. Наибольшую каталитическую активность и селективность образования углеродсодержащих продуктов восстановления углекислого газа парами воды продемонстрировали 20%Cd0.7Zn0.3S/TiO2 и 50%Cd0.7Zn0.3S/TiO2. Дополнительно были приготовлены платинированные фотокатализаторы Pt/Cd0.7Zn0.3S/TiO2 и Cd0.7Zn0.3S/Pt/TiO2. Фотокатализаторы серии Pt/Cd0.7Zn0.3S/TiO2 показали более высокую эффективность фотокаталитического восстановления диоксида углерода парами воды по сравнению с серией. Cd0.7Zn0.3S/Pt/TiO2. Максимальные значения скоростей реакции были получены на фотокатализаторе 50%Cd0.7Zn0.3S/1%Pt/TiO2 в присутствии сульфида натрия и составили 1.6 мкмоль ч–1 г–1 водорода, 4.2 мкмоль ч–1 г–1 монооксида углерода и 0.6 мкмоль ч–1 г–1 метана.
Список литературы
Owusu P.A., Asumadu – Sarkodie // Cogent Eng. 2016. V. 3. P. 1167990-1.
Shehzad N., Tahir M., Johari K., Murugesan T., Hussain M. // J. CO2 Util. 2018. V. 26. P. 98.
Wang W., Nemani R. // Adv. Atmos. Sci. 2016. V. 33. P. 247.
Liu Y., Guo L., Yan W., Liu H. // J. Power Sources. 2006. V. 159. P. 1300.
Краснякова Т.В., Юрчило С.А., Моренко В.В., Носолев И.К., Глазунова Е.В., Хасбулатов С.В., Вербенко И.А., Митченко С.А. // Кинетика и катализ. 2020. Т. 61. № 3. С. 359.
Jain A., Ameta C. // Кинетика и катализ. 2020. Т. 61. № 2. С. 246.
An C.W., Liu T., Zhang D.F., Yan J.S. // Кинетика и катализ. 2020. Т. 61. № 6. С. 818.
Li Q., Meng H., Zhou P., Zheng Y., Wang J., Yu J., Gong J.R. // ACS Catal. 2013. V. 3. P. 882.
Kozlova E.A., Lyulyukin M.N., Markovskaya D.V., Selischev D.S., Cherepanova S.V., Kozlov D.V. // Photochem. Photobio. S. 2019. V. 18. P. 871.
Sakthivel S., Shankar M.V., Palanichamy M., Arabindoo B., Bahnemann D., Murugesan V. // Water Res. 2004. V. 38. P. 3001.
Куренкова А.Ю., Козлова Е.А., Каичев В.В. // Кинетика и катализ. 2020. Т. 61. № 6. С. 812.
Воронцов А.В., Козлова Е.А., Бесов А.С., Козлов Д.В., Киселев С.А., Сафатов А.С. // Кинетика и катализ. 2010. Т. 51. № 6. С. 829.
Shi J.-W., Yan X., Cui H.-J., Zong X., Fu M.-L., Chen S., Wang L. // J. Mol. Catal. A. Chem. 2012. V. 356. P. 53.
Lyulyukin M.N., Kurenkova A.Y., Bukhtiyarov A.V., Kozlova E.A. // Mendeleev Commun. 2020. V. 30. P. 192.
Kozlova E.A., Gribov E.N., Kurenkova A.Y., Cherepanova S.V., Gerasimov E.Y., Kozlov D.V. // Int. J. Hydrogen Energy. 2019. V. 44. P. 23589.
Cherepanova S.V. // J. Struct. Chem. 2012. V. 53. P. 109.
Tryba B., Piszcz M., Morawski A.V. // Int. J. Photoenergy. 2009. V. 2009. P. 297319-1.
Ding L., Yang S., Liang Z., Qian X., Chen X., Cui H., Tian J. // J. Colloid Interface Sci. 2020. V. 567. P. 181.
Krysova H., Zlamalova M., Tarabkova H., Jirkovsky J., Frank O., Kohout M., Kavan L. // Electrochim. Acta. 2019. V. 321. P. 134685.
Любина Т.П., Козлова Е.А. // Кинетика и катализ. 2012. Т. 53. № 2. С. 197.
Antoniadou M., Daskalaki V.M., Balis N., Kondarides D.I., Kordulis C., Lianos P. // Appl. Catal. B: Environ. 2011. V. 107. P. 188.
Liu L., Guo D., Cui W., Hu J., Lianga Y. // J. Wuhan Univ. Technol. Mater. Sci. Ed. 2015. V. 30. P. 928.
Baykul M.C., Orhan N. // Thin Solid Films. 2010. V. 518. P. 1925.
Yoon H.J., Yang J.H., Park S.J., Rhee S.C., Sohn Y. // Appl. Surf. Sci. 2021. V. 536. P. 147753.
Devi P., Singh J.P. // J. CO2 Util. 2021. V. 43. P. 101376.
Zhu Z., Liu X., Bao C., Zhang K., Song C., Xuan Y. // Energy Convers. Manag. 2020. V. 222. P. 113236-1.
Zhang H., Li Y., Wang J., Wu N., Sheng H., Chen C., Zhao J. // Appl. Catal. B: Environ. 2021. V. 284. P. 119692.
Zhao X., Zhang G., Zhang Z. // Environ. Int. 2020. V. 136. P. 105453-1.
Nabisreutinger S.N., Schmidt-Mende L., Stolarczyk G.K. // Angew. Chem. Int. Ed. 2013. V. 52. P. 7372.
Nasir J.A., Rehman Z., Shah S.N.A., Khan A., Butler I.S., Catlow C.R.A. // J. Mater. Chem. A. 2020. V. 8. P. 20752.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ