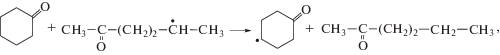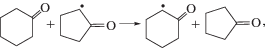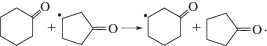Кинетика и катализ, 2021, T. 62, № 4, стр. 426-436
Оценка реакционной способности CH-связей циклогексанона в реакциях с трет-бутилпероксирадикалом квантово-химическими методами
С. В. Пучков a, *, Ю. В. Непомнящих a
a Кузбасский государственный технический университет им. Т.Ф. Горбачева,
Институт химических и нефтегазовых технологий
650000 Кемерово, ул. Весенняя, 28, Россия
* E-mail: psv.toos@kuzstu.ru
Поступила в редакцию 27.11.2020
После доработки 01.02.2021
Принята к публикации 30.03.2021
Аннотация
Методом теории функционала плотности (DFT) с гибридными функционалами B3LYP в базисе 6-311g++ (d,p), X3LYP в базисах 6-311g++(d,p), D95++(d,p), pbe1pbe в базисе D95++(d,p) и методом МР2 в базисе 6-311g++(d,p) рассчитаны эффективные заряды на атомах водорода и углерода, функции Фукуи для электрофильной и радикальной атак для атомов водорода конформаций “кресло” и “ванна” циклогексанона. Для этих конформаций локализованы переходные состояния, определена длина разрывающейся СН-связи в переходном состоянии, вычислены энергии активации, энтропии активации, энтальпии элементарных реакций трет-бутилпероксильного радикала ((СН3)3СOO•) со всеми типами СН-связей циклогексанона. Рассчитаны относительная реакционная способность СН-связей циклогексанона в реакциях с (СН3)3СOO•; локальные индексы электрофильности углеродцентрированных радикалов, образующихся из циклогексанона при отрыве атома водорода; разности энергий (ΔЕSOMO) однозаполненных молекулярных орбиталей этих углеродцентрированных радикалов и радикала (СН3)3СOO•. Методами DFT\B3LYP 6-311g++(d,p), CBS-QB3, G3MP2B3 с применением метода изодесмических реакций рассчитаны энергии разрыва СН-связей циклогексанона. Рассмотрены факторы, определяющие реакционную способность СН-связей циклогексанона в реакциях с радикалом (СН3)3СOO•. Показано, что повышенная реакционная способность СН-связей циклогексанона в положениях 2, 6 (α) обусловлена низкой энергией разрыва связи, высокой электронодонорной способностью атомов водорода, меньшей длиной разрываемой СН-связи в переходном состоянии, малой величиной ΔЕSOMO. Более низкая реакционная способность СН-связей в положениях 3, 5 (β) и 4 (γ) обусловлена более высокими энергиями разрыва связей, снижением их электронной плотности под действием индуктивного эффекта карбонильной группы, нуклеофильностью образующихся углеродцентрированных радикалов, большей длиной разрываемых СН-связей в переходном состоянии и большей величиной ΔЕSOMO. Различие в реакционной способности СН-связей в положениях 3, 5 (β) и 4 (γ) определяется не различием в энергиях разрыва этих связей, а действием других факторов, перечисленных выше. Реакционная способность СН-связей конформации “ванна” выше реакционной способности СН-связей конформации “кресло” по положениям в реакциях с радикалом (СН3)3СOO•.
ВВЕДЕНИЕ
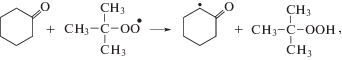
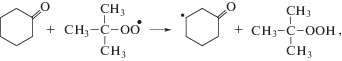
Циклогексанон – важнейший полупродукт в промышленном производстве капролактама и адипиновой кислоты [1–3]. Наиболее широко распространен процесс получения циклогексанона жидкофазным окислением циклогексана [1–3]. Известно, что в большинстве процессов окисления органических соединений с ростом степени превращения субстрата происходит снижение селективности по целевому продукту [1–3]. Поэтому, для поддержания селективности по циклогексанону на уровне 80–85%, промышленный процесс окисления циклогексана проводят при низких степенях превращения 5–7% [1–3]. Основной причиной снижения селективности окисления циклогексана до циклогексанона являются последовательные реакции окисления последнего с образованием побочных продуктов [1–3], причем α-СН-связи циклогексанона имеют бόльшую реакционную способность, чем СН-связи циклогексана [1–4]. В работе [5] было показано, что по сравнению с СН-связями циклогексана реакционная способность α-СН-связей циклогексанона в реакции с трет-бутилпероксирадикалом повышена в 12.5 раз. В процессе окисления циклогексанона наряду с наиболее активированными α-СН-связями кетона атаке пероксильными радикалами подвергаются также его β- и γ-СН-связи [5]. Так β-СН-связи кетона дезактивированы почти в 1.5 раза, а γ-СН-связи имеют такую же реакционную способность, как и СН-связи циклогексана [5]. Различия в реакционной способности α-, β- и γ-СН-связей циклогексанона в реакциях с пероксильными радикалами объясняются суммарным воздействием двух противоположных электронных эффектов: индуктивного и эффекта сопряжения [4, 5]. Такие объяснения носят преимущественно описательный характер и поэтому требуют дополнительного изучения с применением квантово-химических расчетов.
Целью работы является теоретическое изучение элементарных реакций трет-бутилпероксирадикала с различными типами СН-связей циклогексанона квантово-химическими методами и выявление факторов, определяющих реакционную способность СН-связей циклогексанона в реакциях с пероксильными радикалами.
МЕТОДЫ РАСЧЕТА
Оптимизацию геометрии молекулы циклогексанона, соответствующих углеродцентрированных радикалов, переходных состояний, трет-бутилпероксильного радикала, трет-бутилгидропероксида, атома водорода при расчете энтропий, энтальпий и энергий однозаполненных молекулярных орбиталей проводили методом теории функционала плотности (DFT) с гибридным функционалом B3LYP в базисе 6-311g++(d,p) [6–10]. При вычислении энергий разрыва связей также применяли методы G3MP2B3 и CBS-QB3 [8, 11].
Анализ заселенности осуществляли методом натуральных валентных орбиталей (NBO) по схеме NPA [12] методами DFT c гибридными функционалами B3LYP в базисе 6-311g++(d,p), X3LYP в базисах 6-311g++(d,p), D95++(d,p), pbe1pbe в базисе D95++(d,p) и МР2 в базисе 6-311g++(d,p) [6, 7]. Анализ заселенности для структур с одним дополнительным электроном (N + 1) и без одного электрона (N – 1) проводили в однодетерминантном приближении [13], используя оптимизированную геометрию структуры с N электронами.
Функции Фукуи для электрофильной (${{f}^{ - }}$) и радикальной (${{f}^{0}}$) атак по атомам водорода всех типов СН-связей циклогексанона рассчитывали по формулам [14, 15]:
(2)
${{f}^{0}} = {{({{q}_{{k(N\,\, - \,\,1)}}} - {{q}_{{k(N\,\, + \,\,1)}}})} \mathord{\left/ {\vphantom {{({{q}_{{k(N\,\, - \,\,1)}}} - {{q}_{{k(N\,\, + \,\,1)}}})} 2}} \right. \kern-0em} 2},$Энергии разрыва СН-связей циклогексанона находили по формуле [8]:
(3)
$D(C{\kern 1pt} - {\kern 1pt} H) = H^\circ ({{R}^{\centerdot }}) + H^\circ ({{H}^{\centerdot }}) - H^\circ (RH),$Для расчета энергии разрыва СН-связей циклогексанона использовали метод изодесмических реакций (ИДР) [9], применение которого позволяет повысить точность вычисления энергии разрыва связи, так как при определении энтальпии изодесмической реакции неучтенная часть энергии электронной корреляции в начальных и конечных соединениях примерно одинакова и взаимно сокращается [9].
Для проведения расчета прочности СН-связей циклогексанона методом ИДР были составлены формальные изодесмические реакции:
Энергию разрыва СН-связей циклогексанона $D({\text{RH}})$ по методу ИДР рассчитывали по формуле [9]:
где $D({\text{repH}})$ – энергия разрыва СН-связи в соединении сравнения (реперном соединении), $\Delta {{H}_{{{\text{ИДР}}}}}$ – энтальпия изодесмической реакции.Энтальпия изодесмической реакций равна разности прочностей СН-связей в циклогексаноне и реперном соединении [9]:
(5)
$\begin{gathered} \Delta {{H}_{{{\text{ИДР}}}}} = H^\circ ({{{\text{R}}}^{\centerdot }}) + H^\circ ({\text{repH}}) - \\ - \,\,H^\circ ({\text{RH}}) - H^\circ ({\text{re}}{{{\text{p}}}^{\centerdot }}) = D({\text{RH}}) - D({\text{repH}}), \\ \end{gathered} $Прочности связей в реперных соединениях определяли с помощью метода G3MP2B3, а значения тепловых эффектов ИДР вычисляли, применяя метод CBS-QB3 [8]. Для циклопентанона также использовали справочное значение энергии разрыва α-СН-связи, равное 368.2 или 396.5 кДж/моль [16].
Поиск переходных состояний проводили релаксированным сканированием по координате реакции [17]. Решением колебательной задачи подтверждено, что все структуры являются стационарными точками на поверхности потенциальной энергии [9].
Общий индекс электрофильности углеродцентрированных радикалов, образованных из циклогексанона, рассчитывали по формуле [18]:
(6)
${{\omega }} = {{{{{{\mu }}}^{2}}} \mathord{\left/ {\vphantom {{{{{{\mu }}}^{2}}} {2{{\eta }}}}} \right. \kern-0em} {2{{\eta }}}},$Необходимые для расчета μ и η потенциал ионизации (IP) и энергию сродства к электрону (EA) находили по формулам [19, 20]:
где EN – энергия структуры с N электронами, EN – 1 и EN + 1 – энергии структур с N – 1 и N + 1 электронами, рассчитанные в однодетерминантном приближении с использованием оптимизированной геометрии структуры с N электронами.Локальный индекс электрофильности для радикального центра углеродцентрированного радикала вычисляли по формуле [21–23]:
Относительную реакционную способность (RR) СН-связей циклогексанона в реакциях с трет-бутилпероксильным радикалом определяли как отношение константы скорости соответствующей реакции (${{k}_{i}}$) к константе скорости (${{k}_{{{\text{ср}}}}}$) реакции сравнения – реакции трет-бутилпероксильного радикала с СН-связью циклогексанона в положении 4 (γ):
(10)
$RR = \frac{{{{k}_{i}}}}{{{{k}_{{{\text{ср}}}}}}} = \frac{{{{k}_{{i,0}}}}}{{{{k}_{{{\text{ср}},0}}}}}{{e}^{{\frac{{ - {{E}_{i}}\,\, + \,\,{{E}_{{{\text{ср}}}}}}}{{RT}}}}} = \frac{{{{k}_{{i,0}}}}}{{{{k}_{{{\text{ср}},0}}}}}{{e}^{{\frac{{ - ({{E}_{i}}\,\, - \,\,{{E}_{{{\text{ср}}}}})}}{{RT}}}}},$Отношение предэкспоненциальных множителей находили как:
(11)
$\frac{{{{k}_{{i,0}}}}}{{{{k}_{{{\text{ср}},0}}}}} = {{e}^{{\frac{{\Delta S_{i}^{ \ne }\,\, - \,\,\Delta S_{{{\text{ср}}}}^{ \ne }}}{R}}}},$Для расчета отношения реакционных способностей СН-связей по положениям конформаций “ванна” и “кресло” (RR“ванна”/“кресло”) применяли уравнения (10) и (11), при этом использовали соответствующие значения энергий и энтропий активации для этих конформаций.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для молекулы циклогексанона известны семь возможных конформаций [24]. Наиболее устойчивы две из них – “кресло” и “ванна”, при этом энергия последней на 11.3 кДж/моль выше [25–27]. По данным расчетов методом B3LYP/6-311g++(d,p) эта разница составляет 16.3 кДж/моль. Вычисления проводили для этих двух конформаций циклогексанона.
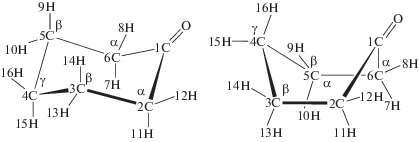
В молекуле циклогексанона десять СН-связей (четыре в положениях 2, 6 (α), четыре в положениях 3, 5 (β) и две в положении 4 (γ)):
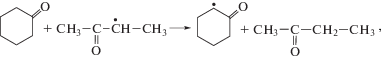
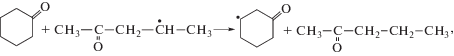
Все СН-связи кетона могут быть вовлечены в реакции радикального отрыва атома водорода пероксильным радикалом (реакции (VI)–(VIII)):Направленность превращений и реакционная способность СН-связей субстрата в реакциях радикального отрыва определяются многими факторами, например, такими как природа субстрата, природа атакующей частицы, строение переходного состояния и другими [4].
Электронная плотность СН-связей циклогексанона
Пероксильные радикалы проявляют электрофильные свойства [28–30] и, следовательно, в реакциях радикального отрыва с большей вероятностью будут атаковать атомы и связи субстрата с более высокой электронной плотностью. Для оценки распределения электронной плотности в СН-связях циклогексанона были рассчитаны эффективные заряды на атомах водорода и углерода этих связей для конформаций “кресло” и “ванна”. Результаты, полученные с применением всех перечисленных выше методов, близки, в табл. 1 приведены эффективные заряды, рассчитанные методом DFT\B3LYP 6-311g++(d,p).
Таблица 1.
Распределение зарядов по атомам молекулы циклогексанона конформаций “кресло” и “ванна”*
| Атом | Заряд | |
|---|---|---|
| “кресло” | “ванна” | |
| 1C | 0.589 | 0.591 |
| 2C | –0.476 | –0.481 |
| 3C | –0.379 | –0.379 |
| 4C | –0.384 | –0.387 |
| 5C | –0.379 | –0.389 |
| 6C | –0.476 | –0.485 |
| 7H | 0.214 | 0.231 |
| 8H | 0.224 | 0.225 |
| 9H | 0.193 | 0.207 |
| 10H | 0.204 | 0.190 |
| 11H | 0.214 | 0.217 |
| 12H | 0.224 | 0.226 |
| 13H | 0.204 | 0.198 |
| 14H | 0.193 | 0.201 |
| 15H | 0.188 | 0.204 |
| 16H | 0.205 | 0.191 |
| O | –0.557 | –0.562 |
Из табл. 1 видно, что как для конформации “кресло”, так и для конформации “ванна” наибольший положительный заряд имеют атомы водорода 7Н, 8Н, 11Н, 12Н в α-положении. Средняя величина положительного заряда на атомах водорода 9Н, 10Н, 13Н, 14Н в β-положении в обеих конформациях немного больше положительного заряда на атомах водорода 15Н, 16Н в γ-положении. Таким образом, вероятность атаки электрофильными пероксильными радикалами СН-связей циклогексанона увеличивается в ряду по положениям α < β < γ.
Наибольшее значение отрицательного заряда для конформации “кресло” циклогексанона наблюдается на α-углеродных 2С, 6С атомах, а наименьшее – на атомах углерода 3С, 5С кетона в β-положении (табл. 1). Для конформации “ванна” величина отрицательного заряда на атомах углерода в α-положении также максимальна, а среднее значение отрицательного заряда минимально на β-углеродных атомах, как и для конформации “кресло”. Таким образом, по величине отрицательного заряда на атомах углерода вероятность атаки СН-связей циклогексанона электрофильными пероксильными радикалами для обеих конформаций увеличивается в ряду по положениям β < γ < α.
По данным 13С-ЯМР [31] (табл. 2) для α-углеродных атомов циклогексанона значение химического сдвига максимально, что указывает на наибольшее снижение электронной плотности на ближайших к электроноакцепторной карбонильной группе углеродных атомах под действием индуктивного эффекта этой группы. При переходе к β- и, далее, к γ-углеродным атомам электронная плотность возрастает. По величинам химического сдвига вероятность атаки электрофильными пероксильными радикалами СН-связей циклогексанона увеличивается в ряду по положениям α < β < γ.
Таблица 2.
Относительная реакционная способность СН-связей циклогексанона конформаций “кресло”/“ванна” в реакциях с трет-бутилпероксильным радикалом и параметры, влияющие на нее
| Параметр | Метод расчета | Положение (тип СН-связи) | |||
|---|---|---|---|---|---|
| α | β | γ | |||
| D(C–H), кДж/моль | Метод ИДР |
Реакции I–III | 376.3/359.0 | 410.5/396.7 | 414.3/399.0 |
| Реакции IV, V | 371.4/354.0 | 406.4/392.6 | –** | ||
| Реакция IV* | 377.2/359.8 и 402.9/388.1 | –** | –** | ||
| ωrc, эВ | DFT/ B3LYP6-311g++(d,p) |
0.778/0.786 | 1.097/0.932 | 0.608/0.508 | |
| l, Å | 1.356/1.354 | 1.389/1.374 | 1.386/1.370 | ||
| ΔH, кДж моль–1 | 33.1/16.7 | 67.4/53.9 | 70.7/55.8 | ||
| Ea, кДж моль–1 | 75.6/56.0 | 80.5/72.0 | 78.3/71.0 | ||
| $\Delta {{S}^{ \ne }}$, Дж моль–1 К–1 | –143.5/–161.8 | –161.1/–148.0 | –152.7/–149.5 | ||
| ΔЕSOMO, эВ | 1.04/1.04 | 2.17/2.24 | 1.96/2.19 | ||
| RRрасчет | Расчет по формуле (10) | 8.2/51.5 | 0.2/0.8 | 1.0/1.0 | |
| RR“ванна”/“кресло” | 131.7 | 104.5 | 20.6 | ||
| RRэксп [5] | Литературные данные | 12.5 | 0.7 | 1.0 | |
| δ, м. д. [31] | 41.5 | 26.6 | 24.6 | ||
Примечание: RRрасчет, RRэксп – расчетная и экспериментальная относительная реакционная способность соответственно; RR“ванна”/“кресло” – отношение реакционной способности СН-связей по положениям для конформаций “ванна” и “кресло”; D(C–H) – энергии разрыва СН-связей циклогексанона, ωrc – локальные индексы электрофильности образующихся углеродцентрированных радикалов; l – длины разрываемых СН-связей в переходном состоянии, ΔЕSOMO – разность энергий однозаполненной молекулярной орбитали радикала субстрата и трет-бутилпероксильного радикала, δ – химический сдвиг 13С-ЯМР, м. д. относительно ТМС, Ea – энергии активации; $\Delta {{S}^{ \ne }}$ – энтропии активации; ΔH – энтальпии реакций. * В расчетах использованы справочные значения энергий разрыва СН-связи циклопентанона в положении α: 368.2 и 393.9 кДж/моль соответственно [16]. ** Расчет не проводился.
В соответствии с экспериментальными данными [5] (табл. 2) о реакционной способности СН-связей циклогексанона в реакциях с трет-бутилпероксильным радикалом вероятность атаки СН-связей кетона увеличивается в ряду по положениям β < γ < α.
Во всех приведенных выше рядах порядок изменения вероятности атаки β- и γ-СН-связей молекулы циклогексанона пероксильными радикалами одинаковый как для конформации “кресло’, так и для конформации “ванна”. Совпадение расчетных и экспериментальных данных позволяет заключить, что используемый подход применим для оценки вероятности атаки β- и γ-СН-связей циклогексанона пероксильными радикалами, а электронная плотность этих связей является одним из факторов, определяющих их реакционную способность. Вместе с тем результаты расчета эффективных зарядов на атомах молекулы циклогексанона не позволяют однозначно оценить вероятность атаки α-СН-связей пероксильными радикалами. Вероятно, это связано с тем, что на реакционную способность α-СН-связей кетонов в реакциях с электрофильными пероксильными радикалами оказывает влияние не только электронная плотность связи, но и ее электронодонорная способность.
Электронодонорная способность
Рассчитанные средние значения функций Фукуи для радикальной атаки $\overline {{{f}^{0}}} $, приведенные в табл. 3, для конформации “кресло” снижаются в ряду по положениям γ > β > α, а для конформации “ванна” – β > α ≥ γ. Из приведенных данных видно, что во всех случаях вероятность атаки радикалами α-СН-связей кетона не максимальна, что не согласуется с существующим представлениeм о реакционной способности α-СН-связей кетонов [4, 5] в реакциях с пероксильными радикалами. Из экспериментальных данных [5] (табл. 2) следует, что реакционная способность γ-СН-связей выше таковой для СН-связей в β положении, что соответствует расчетным данным только для СН-связей конформации “кресло”. Возможно, такое неполное согласование между результатами расчетов и экспериментальными данными можно объяснить тем, что пероксильные радикалы в реакциях радикального отрыва проявляют электрофильные свойства [28–30], и направленность атаки СН-связей субстрата определяется электронной плотностью СН-связей и их электронодонорной способностью.
Таблица 3.
Функции Фукуи для радикальной (${{f}^{0}}$) и электрофильной (${{f}^{ - }}$) атак для атомов водорода циклогексанона конформаций “кресло”/“ванна”, средние значения этих функций по положениям ($\overline {{{f}^{0}}} $,$\overline {{{f}^{ - }}} $)*
| Положение (тип СН-связи) |
Атом (Н) | ${{f}^{0}}$** | $\overline {{{f}^{0}}} $** | ${{f}^{ - }}$** | $\overline {{{f}^{ - }}} $** |
|---|---|---|---|---|---|
| α | 7H, 11H | $\frac{{0.07151}}{{0.07060}}$ | $\frac{{0.05250}}{{0.05343}}$ | $\frac{{0.06205}}{{0.06005}}$ | $\frac{{0.05114}}{{0.05223}}$ |
| 8H, 12H | $\frac{{0.03348}}{{0.03625}}$ | $\frac{{0.04023}}{{0.04441}}$ | |||
| β | 9H, 14H | $\frac{{0.02767}}{{0.06170}}$ | $\frac{{0.05928}}{{0.07934}}$ | $\frac{{0.02854}}{{0.04683}}$ | $\frac{{0.04642}}{{0.04412}}$ |
| 10H, 13H | $\frac{{0.09088}}{{0.09698}}$ | $\frac{{0.06429}}{{0.04141}}$ | |||
| γ | 15H | $\frac{{0.09620}}{{0.08070}}$ | $\frac{{0.08824}}{{0.05208}}$ | $\frac{{0.02142}}{{0.03893}}$ | $\frac{{0.03055}}{{0.03030}}$ |
| 16H | $\frac{{0.08028}}{{0.02345}}$ | $\frac{{0.03967}}{{0.02167}}$ |
Вероятность атаки электрофильными пероксильными радикалами СН-связей циклогексанона оценивали по электронодонорной способности атомов водорода этих СН-связей. Для атомов водорода молекулы циклогексанона в конформациях “кресло” и “ванна” были рассчитаны средние значения функций Фукуи для электрофильной атаки $\overline {{{f}^{ - }}} $(табл. 3).
Из данных, представленных в табл. 3, видно, что как для конформации “кресло”, так и для конформации “ванна” по мере удаления атомов водорода от карбонильной группы в молекуле циклогексанона для них наблюдается снижение значений $\overline {{{f}^{ - }}} $, следовательно, вероятность атаки СН-связей кетона пероксильными радикалами уменьшается в ряду α > β > γ. Полученные данные о преимущественной атаке α-СН-связей циклогексанона электрофильными пероксильными радикалами соответствуют существующим представлениям о реакционной способности α-СН-связей кетонов [4, 5], в то время как для β- и γ-СН-связей кетона в этой конформации согласия с экспериментальными данными нет. Таким образом, только совместная оценка электронной плотности и электронодонорной способности связей дает представление о направленности атаки пероксильными радикалами СН-связей циклогексанона, обусловленной полярным взаимодействием реагирующих частиц.
Энергия разрыва СН-связи
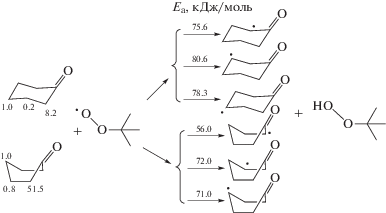
На реакционную способность СН-связей субстрата в реакциях радикального отрыва может оказывать влияние энергия разрыва СН-связи (D(С–Н)). Результаты вычисления D(С–Н) циклогексанона для конформаций “кресло” и “ванна”, методом изодесмических реакций представлены в табл. 2. Наиболее близки к имеющимся справочным значениям (393.5 кДж/моль [16]) энергии разрыва α-СН-связей циклогексанона, полученные с применением метода ИДР, когда в качестве реперного соединения использовался циклопентанон. Расчеты энергий разрыва СН-связей методами DFT/B3LYP6311g++(d,p), G3MP2B3, CBS-QB3 дают близкие результаты, но энергии разрыва α-СН-связей, определенные этими методами, в большей степени занижены по сравнению со справочным значением. Величины D(С–Н) по положениям для конформации “ванна”, как можно было ожидать, оказались ниже, чем для конформации “кресло”. Вместе с тем характер изменения энергий разрыва СН-связей при переходе от α-положения к более удаленным от функциональной группы СН-связям оказался одинаков для обеих конформаций.
Минимальное значение D(С–Н) наблюдается в α-положении, что соответствует максимальной относительной реакционной способности (RR). Энергии разрыва β- и γ-СН-связей больше таковой для α-СН-связей, что свидетельствует об их меньшей реакционной способности. Вместе с тем D(С–Н) γ-СН-связи не более чем на 4 кДж/моль выше, чем для β-СН-связи (табл. 2). Более низкое значение энергии разрыва β-СН-связей кетона по сравнению с этой величиной для γ-СН-связей оказалось неожиданным, поскольку экспериментально установлено, что RR γ-СН-связей выше, чем β-СН-связей. Поэтому можно предположить, что энергия разрыва β- и γ-СН-связей циклогексанона не является фактором, определяющим их реакционную способность в реакциях с пероксильными радикалами, вероятно, ввиду небольшой разницы значений.
Длина разрываемой СН-связи в переходном состоянии
В работе [32] отмечается, что в реакциях радикального отрыва с участием атомов хлора, реакционная способность СН-связей в замещенных бутанах возможно зависит, в том числе, и от величины диполь-дипольного отталкивания образующихся в структуре переходного состояния углеродцентрированного радикала и хлороводорода. Учитывая, что в соответствии с постулатом Хэммонда для эндотермичных реакций радикального отрыва (VI)–(VIII), расчетные значения энтальпий которых приведены в табл. 2, структура переходного состояния близка к строению конечных продуктов [33], такое объяснение различной реакционной способности СН-связей кетона в этих реакциях представляется вполне обоснованным.
С целью подтверждения данного предположения для элементарных реакций (VI)–(VIII) были локализованы переходные состояния с оптимизацией их геометрических параметров. В работе [30] показано, что количественно диполь-дипольное взаимодействие между образующимися в переходном состоянии углеродцентрированным радикалом и гидропероксидом можно оценить по длине разрываемой СН-связи. Результаты расчета длин разрываемых связей в структуре переходного состояния для конформаций “кресло” и “ванна” приведены в табл. 2.
Из табл. 2 видно, что длины разрываемых α-СН-связей в переходных состояниях для конформаций “кресло” и “ванна” практически одинаковы, а для β- и γ-СН-связей для конформации “ванна” эти значения ниже. При этом для обеих конформаций наибольшей RR α-СН-связи соответствует наименьшая длина разрываемой СН-связи, и при ее увеличении в переходных состояниях реакций трет-бутилпероксильного радикала с γ- и β-СН-связями кетона наблюдается снижение относительной реакционной способности этих связей. Таким образом, можно полагать, что диполь-дипольное взаимодействие образующихся продуктов в структуре переходного состояния в реакциях радикального отрыва с участием пероксильных радикалов, наряду с другими факторами, определяет реакционную способность СН-связей циклогексанона. Такая же зависимость между длинами разрываемых СН-связей и их RR наблюдалась в реакциях гидропероксильного и 2-гидрокси-2-бутилпероксильного радикалов с СН-связями 2-бутанола [30].
Нуклеофильность образующегося углеродцентрированного радикала
Известно, что углеродцентрированные радикалы являются нуклеофильными частицами [28, 34, 35], при этом количественно их нуклеофильность можно оценить по величинам индексов электрофильности [30, 34, 35]. Были рассчитаны локальные индексы электрофильности для углеродцентрированных радикалов, образующихся по реакциям (VI)–(VIII), их значения приведены в табл. 2. Величины индексов электрофильности для конформаций “кресло” и “ванна” оказались близки, и характер их изменения при переходе от α-углеродных атомов к более удаленным одинаков для обеих конформаций.
Наличие электроноакцепторной функциональной группы у соседнего с радикальным центром атома углерода должно уменьшать нуклеофильность радикального центра [29, 34], а по мере удаления от функциональной группы нуклеофильность радикального центра должна увеличиваться с затуханием индуктивного эффекта [29, 34]. Таким образом, можно было ожидать наибольшее значение индекса электрофильности для радикала в α-положении и последовательное снижение электрофильности при переходе к радикалам в положениях β и γ. Действительно, при переходе от радикала в β-положении к радикалу в положении γ индекс электрофильности снижается, что указывает на бόльшую нуклеофильность углеродцентрированного радикала в γ-положении. Однако для углеродцентрированного радикала в α-положении индекс электрофильности оказался меньше, чем для радикала в положении β. Такое неожиданно низкое значение индекса электрофильности для радикала в α-положении можно объяснить эффектом сопряжения соседней карбонильной группы, который увеличивает электронную плотность радикального центра, тем самым повышая его нуклеофильность.
Сопоставление индексов электрофильности углеродцентрированных радикалов с относительной реакционной способностью СН-связей циклогексанона (табл. 2) показало, что в β- и γ-положениях со снижением индекса электрофильности углеродцентрированного радикала значение RR соответствующей СН-связи увеличивается. Для α-СН-связей, имеющих наибольшее значение RR, индекс электрофильности оказался не минимальным. Поэтому можно предположить, что для α-СН-связи циклогексанона нуклеофильность углеродцентрированного радикала не является фактором, определяющим ее высокую реакционную способность.
Энергии однозаполненных молекулярных орбиталей радикалов
В работе [36] эффективность ингибиторов в реакциях с пероксильными радикалами оценивали по разнице энергий однозаполненных молекулярных орбиталей (ΔЕSOMO) пероксильного радикала и радикала, образующегося из молекулы ингибитора в результате отрыва атома водорода пероксильным радикалом. По данным [36] минимальное значение ΔЕSOMO соответствует наибольшей скорости реакции радикального отрыва. Вероятно, такой же подход может быть применен для оценки реакционной способности СН-связей циклогексанона в реакциях с трет-бутилпероксильным радикалом. Для конформаций “кресло” и “ванна” были рассчитаны энергии однозаполненных молекулярных орбиталей трет-бутилпероксильного радикала и углеродцентрированных радикалов, образующихся в реакциях радикального отрыва (VI)–(VIII). По этим значениям вычислены разности энергий однозаполненных молекулярных орбиталей (ΔЕSOMO) трет-бутилпероксильного и углеродцентрированных радикалов (табл. 2). Значения ΔЕSOMO в α-положении конформаций “кресло” и “ванна” оказались одинаковы, в β- и γ-положениях величины ΔЕSOMO для конформации “ванна” были немного выше.
Из табл. 2 видно, что как для конформации “кресло”, так и для конформации “ванна” наименьшее значение ΔЕSOMO соответствует наибольшей относительной реакционной способности СН-связей циклогексанона в α-положении в реакции с трет-бутилпероксильным радикалом, а максимальное значение ΔЕSOMO – минимальной реакционной способности СН-связей кетона в положении β. Таким образом, можно предположить, что величина ΔЕSOMO является одним из факторов, определяющих реакционную способность СН-связей циклогексанона в реакциях с трет-бутилпероксильным радикалом.
Энергия активации
Для оценки реакционной способности СН-связей конформаций “кресло” и “ванна” циклогексанона в реакциях с трет-бутилпероксильным радикалом (VI)–(VIII) были рассчитаны энергии активации этих реакций (табл. 2). Как можно было ожидать, энергии активации для конформации “ванна” оказались ниже, чем для конформации “кресло”, что, вероятно, обусловлено большей энергией конформации “ванна”. Максимальное различие энергий активации для этих конформаций наблюдается для реакции (VI) и составляет 19.6 кДж/моль. Эта величина близка к расчетному значению (16.3 кДж/моль) разницы энергий конформаций “кресло” и “ванна”, из чего можно сделать вывод о близкой энергии переходных состояний реакции (VI) для обеих конформаций. Вместе с тем практически одинаковые значения длин разрываемых α-СН-связей в переходных состояниях, значений ΔЕSOMO, индексов электрофильности образующихся углеродцентрированных радикалов в α-положении для этих конформаций указывают на сходное строение переходных состояний в реакции с трет-бутилпероксильным радикалом. Как для конформации “кресло”, так и для конформации “ванна” расчетные значения энергий активации реакций (VI)–(VIII) хорошо согласуются с данными об относительной реакционной способности СН-связей циклогексанона в реакциях с трет-бутилпероксильным радикалом (табл. 2). Наименьшее значение энергии активации соответствует наибольшей реакционной способности α-СН-связей, а самая высокая энергия активации – самой низкой реакционной способности β-СН-связей.
Относительная реакционная способность СН-связей циклогексанона
С использованием полученных величин энергий активации и рассчитанных по уравнению (10) энтропий реакций (VI)–(VIII) (табл. 2) определена относительная реакционная способность СН-связей конформаций “кресло” и “ванна” циклогексанона в реакциях с трет-бутилпероксильным радикалом (табл. 2). Из табл. 2 видно, что для обеих конформаций характер изменения рассчитанной с применением квантово-химических методов относительной реакционной способности СН-связей в молекуле циклогексанона в реакциях с трет-бутилпероксирадикалом совпадает с экспериментально определенной относительной реакционной способностью СН-связей кетона. Вместе с тем реакционная способность всех типов СН-связей конформации “ванна” оказалась выше таковой СН-связей конформации “кресло”, а в конформации “ванна” α-СН-связь активирована в большей степени по сравнению c β‑ и γ-СН-связями, чем в конформации “кресло”.
Как видно из табл. 2, для конформации “кресло” значения расчетных величин относительных реакционных способностей СН-связей (RRрасчет) ближе к экспериментальным значениям (RRэксп). Вероятно, это объясняется небольшим вкладом реакций СН-связей конформации “ванна” с пероксильными радикалами в процессе окисления циклогексанона ввиду малого содержания этой конформации.
ЗАКЛЮЧЕНИЕ
Повышенная реакционная способность α‑СН-связей циклогексанона обусловлена, в первую очередь, более низкой энергией разрыва связи и, наряду с этим, высокой электронодонорной способностью, малой величиной ΔЕSOMO, меньшей длиной разрываемой СН-связи в переходном состоянии, что указывает на низкую степень диполь-дипольного отталкивания образующегося углеродцентрированного радикала и гидропероксида. Пониженная по сравнению с α-СН-связями реакционная способность β- и γ‑СН-связей обусловлена повышенными значениями энергий разрыва этих связей, снижением их электронной плотности под действием индуктивного эффекта карбонильной группы, большей величиной ΔЕSOMO и длиной разрываемых СН-связей в переходном состоянии. Необходимо отметить, что энергия разрыва связи не является фактором, определяющим различие в реакционной способности β- и γ-СН-связей циклогексанона в реакциях с трет-бутилпероксильным радикалом.
Список литературы
Перкель А.Л., Воронина С.Г. // Изв. АН. Сер. хим. 2019. № 3. С. 480. (Perkel A.L, Voronina S.G // Russian Chemical Bulletin. 2019. V. 68. № 3. Р. 480.)
Перкель А.Л., Воронина С.Г. // Изв. АН. Сер. хим. 2019. № 8. С. 1478. (Perkel A.L., Voronina S.G. // Russian Chemical Bulletin. 2019. V. 68. № 8. Р. 1478.)
Перкель А.Л., Воронина С.Г. // Изв. АН. Сер. хим. 2019. № 10. С. 1803. (.Perkel A.L., Voronina S.G. // Russian Chemical Bulletin. 2019. V. 68. № 10. Р. 1803.)
Denisov E.T., Afanas’ev I.B. Oxidation and Antioxidants in Organic Chemistry and Biology. Boca Raton (FL): Taylor and Francis, 2005. 981 p.
Пучков С.В., Непомнящих Ю.В., Козлова Е.С., Перкель А.Л. // Кинетика и катализ. 2013. Т. 54. № 2. С. 148. (Puchkov S.V., Nepomnyashchikh Yu.V., Kozlova E.S., Perkel A.L. // Kinet. Catal. 2013. V. 54. № 2. Р. 139.)
Kosnik W., Bocian W., Chmielewski M., Tvaroska I. // Carbohyd. Res. 2008. V. 343. № 9. P. 1463.
Marianski M., Asensio A., Dannenberg J.J. // J. Chem. Phys. 2012. V. 137. № 4. P. 044109-1
Пучков С.В., Непомнящих Ю.В. // Вестник КузГТУ. 2017. № 4. С. 176.
Самаркина А.Б., Хурсан С.Л. // Вестник Башкирского университета. 2008. Т. 13. № 3(I). С. 780.
Ramachandran K.I., Gopakumar D., Namboori K. Computational Chemistry and Molecular Modeling: Principles and Applications. Springer-Verlag Berlin Heidelberg, 2008. 405 p.
Sarathy S.M., Vranckx S., Yasunaga K. // Combust. Flame. 2012. V. 159. P. 2028.
Gangadharan R.P., Krishnan S.S. // Acta Phys. Pol. A. 2015. V. 127. № 3. P. 748.
Груздев М.С., Вирзум Л.В., Крылов Е.Н. // Бутлеровские сообщения. 2015. Т. 41. № 2. С. 115.
Parr R.G., Yang W. Density-functional theory of atoms and molecules. New York: Oxford University Press, Oxford: Clarendon Press, 1989. 338 p.
Thanikaivelan P., Padmanabhan J., Subramanian V., Ramasami T. // Theor. Chem. Acc.: Theory, Computation, and Modeling. 2002. V. 107. № 6. P. 326.
Luo Yu-Ran. Handbook of bond dissociation energies in organic compounds. CRC PRESS, Boca Raton London New York Washington. 2003. 380 c.
Чиркина Е.А., Леванова Е.П., Кривдин Л.Б. // Журн. орг. химии. 2017. Т. 53. № 7. С. 974. (Chirkina E.A., Levanova E.P., Krivdin L.B. // Russ. J. Organic Chem. 2017. V. 53. № 7. Р. 986.)
Parr R.G., Szentpály L.v., Liu S. // J. Am. Chem. Soc. 1999. V. 121. № 9. P. 1922.
Pérez-González A., Rebollar-Zepeda A.M., León-Carmona J.R., Galano A. // J. Mex. Chem. Soc. 2012. V. 56. № 3. P. 241.
Shankar R., Senthilkumar K., Kolandaivel P. // Int. J. Quantum Chem. 2009. V. 109. P. 764.
De Vleeschouwer F., Speybroeck V.V., Waroquier M., Geerlings P., De Proft F. // Org. Lett. 2007. V. 9. № 14. P. 2721.
Padmanabhan J., Parthasarathi R., Sarkar U., Subramanian V., Chattaraj P.K. // Chem. Phys. Lett. 2004. V. 383. № 1–2. P. 122.
Chattaraj P.K., Giri S., Duley S. // Chem. Rev. 2011. V. 111. № 2. PR43.
Taskinen E. // J. Phys. Org. Chem. 2010. V. 23 P. 105.
Илиел Э., Вайлен С., Дойл М. Основы органической стереохимии, пер. с англ. Москва: БИНОМ. Лаборатория знаний, 2007. 703 с. (Eliel E.L., Wilen S.H., Doyle M.P. Basic organic stereochemistry. John Wiley and Sons, 2001. 688 р.)
Dillen J., Geise H.J. // J. Mol. Struct. 1980. V. 69. P. 137.
Shallard-Brown H.A., Watkin D.J., Cowley A.R. // Acta Crystallographica Section E Structure Reports Online. 2005. V. 61. № 8. P. 2424.
Fleming I. Molecular Orbitals And Organic Chemical Reactions. John Wiley and Sons, 2010. 378 p.
Пучков С.В., Непомнящих Ю.В. // Хим. физика. 2018. Т. 37. № 9. С. 21. (Puchkov S.V., Nepomnyashchikh Y.V. // Russian J. Physical Chemistry В. 2018. V. 12. № 5. Р. 904.)
Пучков С.В., Непомнящих Ю.В. // Хим. физика. 2020. Т. 39. № 3. С. 42. (Puchkov S.V., Nepomnyashchikh Y.V. // Russian J. Physical Chemistry В. 2020. V. 14. № 2. Р. 278.)
Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений. Таблицы спектральных данных. Москва: Мир; БИНОМ. Лаборатория знаний, 2006. 438 с. (Pretsch E., Bühlmann P., Affolter C. Structure determination of organic compounds – Tables of spectra data. Springer, Berlin. 2000. 421 p.)
Нонхибел Д., Уолтон Дж. Химия свободных радикалов. Москва: Мир, 1977. 606 с. (Nonhebel D.and Walton J. Free-Radical Chemistry: Structure and Mechanism (Cambridge Univ. Press, 1974. 572 p.)
Денисов Е.Т. Кинетика гомогенных химических реакций. Москва: Высшая школа, 1988. 391 с.
Santschi N., Nauser T. // ChemPhysChem. 2017. V. 18. № 21. P. 2973.
Héberger K., Lopata A. // J. Org. Chem. 1998. V. 63. № 24. P. 8646.
Кошель Г.Н., Смирнова Е.В., Курганова Е.А., Румянцева Ю.Б., Плахтинский В.В., Кошель С.Г. // Катализ в промышленности. 2012. № 1. С. 7.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ