Кинетика и катализ, 2021, T. 62, № 5, стр. 581-590
Повышение стабильности Ni/TiO2-катализаторов в реакции конденсации этанола Гербе: влияние второго металлического компонента
Shuaiqi Li a, Xiaoxu Han a, Hualiang An a, *, Xinqiang Zhao a, **, Yanji Wang a
a Hebei Provincial Key Lab of Green Chemical Technology and High Efficient Energy Saving, National-Local Joint Engineering Laboratory for Energy Conservation in Chemical Process Integration and Resources Utilization, School of Chemical Engineering and Technology, Hebei University of Technology
300000 Tianjin, China
* E-mail: anhl@hebut.edu.cn
** E-mail: zhaoxq@hebut.edu.cn
Поступила в редакцию 20.02.2021
После доработки 10.04.2021
Принята к публикации 19.04.2021
Аннотация
Конденсация этанола Гербе – это зеленый процесс получения н-бутанола. Разработка высокоэффективных твердых катализаторов для него по-прежнему является узким местом в реализации реакции. В настоящей работе методом совместной пропитки приготовлена серия многофункциональных катализаторов Ni–X/TiO2 (X = Ru, Pt, Ir, Au, Cu, Mn, Co, Fe) с целью улучшения их каталитических характеристик, в особенности стабильности. Обнаружено, что введение второго металлического компонента изменяет кислотность и оснóвность катализатора Ni/TiO2. Количество кислотных центров влияет на конверсию этанола, в то время как количество основных центров – на селективность по н-бутанолу. Среди катализаторов Ni–X/TiO2 наилучшими каталитическими характеристиками обладает Ni–Cu/TiO2. Исследована зависимость каталитических характеристик Ni–Cu/TiO2 от условий его приготовления. Найдены следующие оптимальные условия: массовое соотношение Ni/Cu = 59 : 1, загрузка Ni–Cu – 12.5 мас. %, температура прокаливания – 450°C, время прокаливания – 2 ч, температура восстановления – 400°C и время восстановления – 4 ч. В условиях реакции при загрузке 10 мас. % катализатора, температуре реакции 210°C и времени реакции 10 ч конверсия этанола и селективность по н-бутанолу составляли 47.9 и 44.4% соответственно. Катализатор Ni–Cu/TiO2 значительно стабильнее Ni/TiO2 за счет взаимодействия Ni с Cu. Каталитическая активность Ni–Cu/TiO2 существенно не снижалась после проведения трех каталитических циклов.
ВВЕДЕНИЕ
Уменьшение запасов сырой нефти и рост загрязнения окружающей среды побуждают научные круги и промышленность уделять больше внимания производству жидкого биотоплива. Биоэтанол часто добавляют в бензин, исходя из двух вышеупомянутых проблем. В отличие от этанола плотность энергии и теплота испарения н‑бутанола близки к таковым бензина, и его можно смешивать в любых пропорциях с бензином без необходимости замены двигателя автомобиля. По этой причине н-бутанол называют “усовершенствованным биотопливом” с хорошими экологическими преимуществами [1]. Традиционное промышленное производство н-бутанола основано на процессах карбонилирования при низком давлении и биологической ферментации, недостатком которых являются жесткие условия реакции и низкая производительность. Напротив, синтез н-бутанола конденсацией этанола Гербе (КЭГ) характеризуется короткой технологической схемой, чистым процессом реакции и низкими производственными затратами [2]. Кроме того, ряд производных, включая сложные и простые эфиры, имеют большую прикладную ценность и могут применяться в самых разных отраслях промышленности, включая нефтехимию, сельское хозяйство, медицину и косметику [3, 4].
Реакция КЭГ осуществляется в три этапа: дегидрирование этанола в ацетальдегид, альдольная самоконденсация ацетальдегида в 2-кротоновый альдегид и гидрирование 2-кротонового альдегида в н-бутанол [5]. Таким образом, катализаторы КЭГ должны обладать способностью катализировать реакции дегидрирования–гидрирования и альдольной конденсации, то есть они должны быть многофункциональными катализаторами. В работе [6] использовали M–CeO2/AC (M = Cu, Fe, Co, Ni, Pd) для катализа КЭГ и обнаружили, что Pd–CeO2/AC был наиболее эффективным. Кроме того, добавление Pd улучшало стабильность катализатора за счет уменьшения накопления углерода на поверхности катализатора. Чистяков и др. [7] изучали реакцию самоконденсации этанола на катализаторе Au–Ni/Al2O3. Было показано, что добавление небольшого количества Ni способствует диспергированию металлического Au. Синергетический эффект Au–Ni может ингибировать спекание зерен Au и улучшать стабильность катализатора. В работе [8] сравнивали характеристики Ni-, Cu- и Ni–Cu-катализаторов на носителе гидротальците (HT) в КЭГ и нашли, что Ni–Cu/HT обладает самой высокой каталитической активностью и стабильностью. В [8] предположили, что превосходные характеристики Ni–Cu/HT обусловлены однородным распределением Ni–Cu, образованием сплава Ni–Cu и меньшим, чем в катализаторах Ni/HT и Cu/HT, количеством кислотных центров. Авторы настоящей работы оценили каталитические характеристики катализатора Ni/TiO2 в КЭГ [9]. Селективность по спиртам C4–C8 достигала почти 70% (41.4% н-бутанола) при почти 50% конверсии этанола при 210°C за 10 ч. Однако при повторном использовании катализатора Ni/TiO2 конверсия этанола снижалась с 49.2 до 36.2%, а селективность по н-бутанолу уже в третьем цикле уменьшалась с 41.7 до 36.8%. Анализ катализатора методом масс-спектрометрии с индуктивно-связанной плазмой (ICP) до и после использования показал, что катализатор Ni/TiO2 дезактивировался из-за потери Ni в ходе реакции.
В настоящей работе серия многофункциональных катализаторов Ni–X/TiO2 (X = Ru, Pt, Ir, Au, Cu, Mn, Co, Fe) была приготовлена методом совместной пропитки с целью улучшения каталитических характеристик, а также возможности их повторного использования. Проанализировано влияние второго металлического компонента на каталитические свойства Ni/TiO2. После скрининга образец Ni–Cu/TiO2 был выбран для исследования зависимости его каталитических характеристик от условий приготовления, а затем определена стабильность работы Ni–Cu/TiO2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализаторов Ni–Х/TiO2
В качестве примера рассмотрим приготовление катализатора Ni–Cu/TiO2. Прекурсор TiO2 синтезировали золь–гель-методом с бутилтитанатом в качестве источника титана. TiO2 получали прокаливанием прекурсора при 450°C в течение 1 ч [10]. Катализатор Ni–Cu/TiO2 готовили методом совместной пропитки. Полученное твердое вещество прокаливали в муфельной печи при 450°C в течение 2 ч и восстанавливали при 400°C в течение 4 ч в смеси водорода и азота с объемным соотношением ${{V}_{{{{{\text{N}}}_{{\text{2}}}}}}}$ : ${{V}_{{{{{\text{H}}}_{{\text{2}}}}}}}$ = 60 : 40 [9]. Другие катализаторы Ni–Х/TiO2 синтезировали аналогичным способом.
Характеризация катализаторов
Удельную поверхность, объем пор и диаметр пор образцов измеряли на анализаторе удельной поверхности и пористости ASAP2020M + C (“Micromeritics”, США). Удельную поверхность рассчитывали методом БЭТ, а объем и диаметр пор образцов – методом BJH. Фазовый анализ образцов проводили на рентгеновском дифрактометре D/max-2500 (“Rigaku”, Япония). Содержание металлов в образцах анализировали с помощью атомно-эмиссионного спектрометра Optima 7300V (“PerkinElmer”, США) с индуктивно связанной плазмой. Определение кислотности (NH3-ТПД), щелочности (CO2-ТПД) и восстановительной способности (H2-ТПР) образцов выполняли на приборе для химической адсорбции AutoChem II-2920 (“Micromeritics”, США). Энергию связи электронов каждого элемента на поверхности катализатора измеряли на фотоэлектронном спектрометре Axis Ultra DLD (“Kratos”, Великобритания) и калибровали по стандартному значению Есв(C1s) = 284.6 эВ. Конкретные операции по определению характеристик катализатора описаны в наших предыдущих работах [10, 11].
Методика проведения реакции КЭГ
Реакцию КЭГ проводили в автоклаве из нержавеющей стали объемом 100 мл, футерованном тефлоном. Типичная методика работы описана в предыдущей публикации [9]. Жидкие продукты (конденсируемые компоненты) анализировали количественно с помощью газового хроматографа GC-2018 (“Shimazu”, Япония), оборудованного пламенно-ионизационным детектором (ПИД), работающим при 280°C. Компонентный состав рассчитывали количественно методом внутреннего стандарта (внутренний стандарт – толуол). Газовые продукты количественно анализировали на том же газовом хроматографе, оборудованном детектором по теплопроводности, при 150°C. Для количественного расчета использовали метод внешнего стандарта.
Конверсию этанола, выход и селективность по н-бутанолу находили следующим образом:
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Скрининг второго металлического компонента
Катализаторы Ni–X/TiO2 (X = Ru, Pt, Ir, Au, Cu, Mn, Co или Fe) с массовым соотношением Ni : X = 39 : 1 и содержанием Ni–X равным 12.0 мас. % были приготовлены прокаливанием при 450°C в течение 2 ч с последующим восстановлением при 400°C в течение 4 ч в атмосфере ${{V}_{{{{{\text{H}}}_{{\text{2}}}}}}}$ : ${{V}_{{{{{\text{N}}}_{{\text{2}}}}}}}$ = 40 : 60. Характеристики катализаторов Ni–X/TiO2 в КЭГ иллюстрирует рис. 1. Конверсия этанола на катализаторах Ni–X/TiO2 с благородным металлом (Ru, Pt, Ir, Au) выше, чем на катализаторах с неблагородным металлом (Cu, Mn, Co, Fe). Однако селективность по н-бутанолу и суммарная по спиртам в присутствии Ni–Pt/TiO2, Ni–Ir/TiO2, Ni–Au/TiO2, Ni–Co/TiO2, Ni–Fe/TiO2 и Ni–Mn/TiO2 ниже, чем на катализаторе Ni/TiO2. Автогенное давление в автоклаве было соответственно 4.2, 4.9, 4.2, 4.0 и 4.1 МПа, что больше, чем давление 3.6 МПа над катализатором Ni/TiO2. Данные указывают на то, что добавление этих шести металлов не только улучшает характеристики гидрирования, но также способствует разрыву связи C–C, что приводит к образованию большего количества побочных газообразных продуктов. В присутствии катализатора, полученного совместной пропиткой Ni и Cu, селективность по н-бутанолу и общая селективность по всем спиртам была самой высокой, поэтому в качестве второго металла был выбран Cu.
Рис. 1.
Характеристики катализаторов Ni–Х/TiO2 в КЭГ. Условия реакции: mкат : mэтанол = 1 : 10, T = 210°C, t = 10 ч.

Чтобы проанализировать влияние второго металлического компонента на каталитические характеристики Ni/TiO2, образцы Ni–X/TiO2 были исследованы методами CO2-ТПД и NH3-ТПД (рис. SI -1, дополнительные материалы). Данные по кислотно-оснóвным центрам приведены в табл. 1. Сильные кислотные центры обнаружены в катализаторах Ni–Ru/TiO2, Ni–Pt/TiO2, Ni–Ir/TiO2 и Ni–Au/TiO2, кислотные центры средней силы – в Ni–Ru/TiO2 и Ni–Au/TiO2, а слабые кислотные центры – только в образце Ni–Pt/TiO2. Отметим, что в других катализаторах присутствуют лишь кислотные центры средней силы. В образцах Ni–Cu/TiO2 и Ni–Ru/TiO2 имеются слабые, средне сильные и сильные оснóвные центры. В катализаторах Ni–Co/TiO2 и Ni–Ir/TiO2 найдены только слабые оснóвные центры. В других катализаторах существуют как сильные, так и средние оснóвные центры. Петролини (Petrolini) и др. [12] добавляли Cu в MgAlOx и CaAlOx для катализа КЭГ. Было обнаружено, что кислотные центры могут активировать этанол, в то время как оснóвные центры больше способствуют образованию н-бутанола, а синергический катализ на кислотно-оснóвных центрах благоприятствует КЭГ. В настоящей работе катализатор Ni–Pt/TiO2 с наибольшим количеством кислотных центров обеспечил самую высокую конверсию этанола, в присутствии Ni–Co/TiO2 и Ni–Fe/TiO2 с близким количеством кислотных центров значения конверсии этанола были тоже близки. Общее количество кислотных центров в катализаторах Ni–Pt/TiO2, Ni–Ir/TiO2, Ni–Ru/TiO2, Ni–Au/TiO2, Ni–Co/TiO2 и Ni–Fe/TiO2 больше, чем в Ni/TiO2 (234.4 мкмоль г–1), и конверсия этанола на этих образцах была относительно высокой. Таким образом, мы полагаем, что количество кислотных центров в основном влияет на конверсию этанола. Катализаторы Ni–Ru/TiO2 и Ni–Cu/TiO2 с большим количеством оснóвных центров характеризуются более высокой селективностью по н-бутанолу, в то время как Ni–Pt/TiO2, Ni–Ir/TiO2, Ni–Au/TiO2, Ni–Mn/TiO2, Ni–Co/TiO2 и Ni–Fe/TiO2 с меньшим числом оснóвных центров, чем в Ni/TiO2 (185.5 мкмоль г–1), демонстрируют относительно более низкую селективность по н-бутанолу, чем катализатор Ni/TiO2. Катализаторы Ni–Pt/TiO2, Ni–Au/TiO2 и Ni–Fe/TiO2 с одинаковым количеством оснóвных центров обладают одинаковой селективностью по н-бутанолу. Следовательно, можно полагать, что количество щелочных центров влияет на селективность по н-бутанолу.
Таблица 1.
Кислотные и оснóвные свойства катализаторов Ni–Х/TiO2
| Катализатор | Кол-во кислотных центров, мкмоль г−1 | Кол-во оснóвных центров, мкмоль г−1 | ||||||
|---|---|---|---|---|---|---|---|---|
| слабые (150–200°C) |
средние (200–300°C) |
сильные (300–450°C) |
всего кислотных центров | слабые (150–200°C) |
средние (200–300°C) |
сильные (300–450°C) | всего оснóвных центров | |
| Ni–Ru/TiO2 | – | 156.2 | 86.6 | 242.8 | 69.2 | 66.7 | 62.2 | 198.1 |
| Ni–Pt/TiO2 | 170.5 | – | 84.3 | 254.8 | – | 104.6 | 74.4 | 179.0 |
| Ni–Ir/TiO2 | – | – | 247.1 | 247.1 | 142.6 | – | – | 142.6 |
| Ni–Au/TiO2 | – | 208.9 | 31.7 | 240.6 | – | 105.7 | 74.1 | 179.8 |
| Ni–Cu/TiO2 | – | 191.6 | – | 191.6 | 80.0 | 74.1 | 49.1 | 203.2 |
| Ni–Mn/TiO2 | – | 203.3 | – | 203.3 | – | 92.9 | 31.1 | 124.0 |
| Ni–Co/TiO2 | – | 235.9 | – | 235.9 | 157.8 | – | – | 157.8 |
| Ni–Fe/TiO2 | – | 235.1 | – | 235.1 | – | 123.2 | 57.0 | 180.2 |
Влияние условий приготовления на каталитические свойства Ni–Cu/TiO2
Исследовано влияние условий приготовления (массовое соотношение Ni/Cu, загрузка Ni–Cu, температура прокаливания, время прокаливания, температура восстановления и время восстановления) на каталитические характеристики катализатора Ni–Cu/TiO2 (табл. 2). По мере сокращения массового отношения Ni/Cu конверсия этанола снижалась, но селективность по н-бутанолу возрастала, тогда как выход н-бутанола сначала падал, а затем стабилизировался. При увеличении содержания Ni–Cu конверсия этанола сначала была стабильной, а затем уменьшалась, селективность по н-бутанолу увеличивалась, а выход н-бутанола сначала рос, а затем снижался. С повышением температуры прокаливания конверсия этанола возрастала, в то время как селективность по н-бутанолу, выход н-бутанола и селективность по общему количеству спиртов сначала увеличивались, а затем уменьшалась. Влияние температуры прокаливания на селективность н-бутанола в целом было незначительным. При увеличении продолжительности прокаливания конверсия этанола, селективность по н-бутанолу, выход н-бутанола и селективность по всем спиртам сначала возрастали, а затем снижались. При повышении температуры восстановления конверсия этанола падала, в то время как селективность по н-бутанолу, выход н-бутанола и селективность по всем спиртам сначала росла, а затем уменьшались. Что касается побочных продуктов, то селективность по 2-этилбутанолу снижалась, в то время как селективность по н-гексанолу и 2-этилгексанолу сильно не изменялась. По мере увеличения времени восстановления конверсия этанола, селективность по н-бутанолу, выход н-бутанола и селективность по всем спиртам сначала повышалась, а затем снижалась. В результате для приготовления Ni–Cu/TiO2 были приняты следующие условия: массовое соотношение Ni/Cu = 59 : 1, загрузка Ni–Cu – 12.5 мас. %, температура прокаливания – 450°C, время прокаливания – 2 ч, температура восстановления – 400°C, время восстановления – 4 ч.
Таблица 2.
Влияние условий приготовления на каталитические характеристики Ni–Cu/TiO2
| Ni : Cu мас. : мас. | Загрузка металла, мас. % | Темпера-тура прокаливания, °C | Время прокали-вания, ч | Темпера-тура восстановления, °C | Время восстанов-ления, ч | XEO, % | YBO, % | S, % | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| BO | EB | HO | EH | Все спирты | ||||||||
| 119 : 1 | 12.0 | 450 | 2 | 400 | 4 | 50.9 | 21.9 | 43.1 | 16.0 | 7.2 | 3.8 | 70.1 |
| 59 : 1 | 12.0 | 450 | 2 | 400 | 4 | 50.0 | 21.5 | 43.7 | 16.3 | 7.0 | 3.3 | 70.3 |
| 39 : 1 | 12.0 | 450 | 2 | 400 | 4 | 39.0 | 17.5 | 44.7 | 18.0 | 7.0 | 4.1 | 73.8 |
| 29 : 1 | 12.0 | 450 | 2 | 400 | 4 | 37.4 | 16.9 | 46.5 | 14.9 | 6.2 | 3.5 | 71.1 |
| 19 : 1 | 12.0 | 450 | 2 | 400 | 4 | 37.0 | 17.0 | 46.6 | 15.8 | 5.6 | 3.0 | 71.0 |
| 59 : 1 | 11.5 | 450 | 2 | 400 | 4 | 49.6 | 20.6 | 41.5 | 15.1 | 6.5 | 2.9 | 66.0 |
| 59 : 1 | 12.5 | 450 | 2 | 400 | 4 | 47.9 | 21.3 | 44.4 | 15.9 | 6.6 | 3.0 | 69.9 |
| 59 : 1 | 13.0 | 450 | 2 | 400 | 4 | 46.9 | 20.9 | 44.6 | 16.6 | 6.6 | 2.9 | 70.7 |
| 59 : 1 | 12.5 | 400 | 2 | 400 | 4 | 47.7 | 19.1 | 40.1 | 15.8 | 7.0 | 3.5 | 66.4 |
| 59 : 1 | 12.5 | 500 | 2 | 400 | 4 | 48.8 | 21.2 | 43.4 | 15.6 | 6.5 | 3.2 | 68.7 |
| 59 : 1 | 12.5 | 450 | 1 | 400 | 4 | 46.7 | 18.6 | 39.8 | 16.6 | 6.5 | 4.3 | 67.2 |
| 59 : 1 | 12.5 | 450 | 3 | 400 | 4 | 48.2 | 20.4 | 42.3 | 16.3 | 6.7 | 3.5 | 68.8 |
| 59 : 1 | 12.5 | 450 | 2 | 350 | 4 | 50.0 | 20.9 | 41.7 | 16.3 | 6.6 | 2.9 | 67.5 |
| 59 : 1 | 12.5 | 450 | 2 | 450 | 4 | 38.8 | 16.9 | 43.5 | 14.2 | 6.4 | 3.0 | 67.1 |
| 59 : 1 | 12.5 | 450 | 2 | 400 | 3 | 44.6 | 19.8 | 44.3 | 15.4 | 6.3 | 2.8 | 68.8 |
| 59 : 1 | 12.5 | 450 | 2 | 400 | 5 | 43.5 | 19.1 | 43.9 | 15.3 | 6.4 | 2.9 | 68.5 |
На рис. SI -2 (дополнительные материалы) показаны рентгенограммы образцов Ni–Cu/TiO2 с различным массовым соотношением Ni/Cu. Как видно из рис. SI -2а, дифракционные пики анатаза TiO2 отчетливо видны при 2θ = 26.0°, 37.8°, 48.1°, 52.4° и 62.1°, а дифракционные пики рутилового TiO2 обнаружены не были. Кроме того, дифракционные пики Ni появляются при 2θ = 44.5° и 51.0°. Дифракционный пик Cu не найден из-за малого содержания элемента. Как видно из рис. SI -2б, положение и интенсивность дифракционного пика Ni (2θ = 44.5°) практически не изменяется для катализаторов с различным массовым соотношением Ni/Cu и соответствует стандартной карте PDF (04-0850) металлического Ni. Это указывает на то, что Ni и Cu не образуют фазу сплава.
Проведен РФЭС-анализ катализаторов Ni–Cu/TiO2 с различным массовым соотношением Ni/Cu (рис. SI -3, дополнительные материалы). Данные об энергии связи электронов каждого вида в катализаторах Ni–Cu/TiO2 представлены в табл. 3. Согласно литературным источникам [13–15] энергии связи электронов Ni02p3/2 и Ni02p1/2 составляют 852.4 и 869.4 эВ, энергии связи Ni2+2p3/2 и Ni2+2p1/2 – 853.8 эВ и 879.2 эВ. Энергии связи Cu02p3/2 и Cu02p1/2 равны 939.4 и 942.3 эВ соответственно. Пики с центрами при 852.0, 851.8, 851.6, 851.4 и 851.0 эВ были отнесены к характеристическому пику Ni02p3/2, в то время как другие пики в спектрах РФЭС Ni2р – к характеристическому пику Ni2+ (табл. 3). Появление характеристического пика Ni2+ указывает на присутствие NiO. Однако при рентгеноструктурном анализе NiO обнаружен не был. Поэтому мы предположили, что NiO образовался в результате окисления поверхности Ni при контакте с кислородом воздуха в процессе анализа. Пики при 933.3, 933.5, 933.8, 934.1 и 934.2 эВ отнесены к характеристическому пику Cu02p3/2, а пики при 952.7, 952.8 и 952.9 эВ – к характеристическому пику Cu02p1/2. Пик при 939.3 эВ соответствует характеристическому пику Cu+2p3/2, а пики при 941.7, 942.0 и 942.3 эВ – характеристическому пику Cu2+2p3/2. Таким образом, с увеличением массового отношения Ni/Cu энергия связи металлического Ni смещается в сторону меньших энергий связи на 0.4, 0.6, 0.8, 1.0 и 1.3 эВ, в то время как энергия связи металлической Cu сдвигается в сторону бóльших энергий связи на 0.4, 0.6, 0.9, 1.2 и 1.3 эВ по сравнению с литературными данными об энергии связи электронов Ni02p3/2 и Cu02p3/2. Это подтверждает наличие взаимодействия Ni и Cu, т.е. изменение энергии связи электронов Ni и Cu. С повышение массового отношения Ni/Cu взаимодействие между Ni и Cu усиливается.
Таблица 3.
Энергия связи электронов никеля и меди в катализаторах Ni–Cu/TiO2 с различным массовым соотношением Ni/Cu
| Ni : Cu/мас. : мас. | Энергия связи электронов, эВ | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ni2+ | Ni0 | Cu2+ | Cu+ | Cu0 | |||||
| 119 : 1 | 855.1 | 860.5 | 872.4 | 879.2 | 852.0 | 942.7 | – | 933.3 | 952.7 |
| 59 : 1 | 854.8 | 860.5 | 872.8 | 879.2 | 851.8 | – | 939.3 | 933.5 | 952.7 |
| 39 : 1 | 854.8 | 860.3 | 872.6 | 879.3 | 851.6 | 941.7 | – | 933.8 | 952.8 |
| 29 : 1 | 855.0 | 860.0 | 872.8 | 878.8 | 851.4 | 942.0 | – | 934.1 | 952.9 |
| 19 : 1 | 854.7 | 860.2 | 872.2 | 878.8 | 851.0 | 942.3 | – | 934.2 | 952.9 |
Текстурные свойства катализаторов Ni–Cu/TiO2 с различным содержанием Ni–Cu представлены в табл. SI -1 (дополнительные материалы). При увеличении загрузки Ni–Cu от 11.5 до 12.5 мас. % удельная поверхность и объем пор катализаторов возрастала, а диаметр пор уменьшался. Когда загрузка Ni–Cu составляла 12.5 и 13.0 мас. %, структура образцов и их каталитические характеристики были похожи.
На рис. SI -4 (дополнительные материалы) показаны рентгенограммы образцов Ni–Cu/TiO2, прокаленные при разной температуре. Как видно из этого рисунка, дифракционные пики анатаза TiO2 отчетливо видны при 2θ = 26.0°, 37.8°, 48.1°, 52.4°, 62.1° и 77.3°, но дифракционные пики рутила TiO2 не обнаружены. Это указывает на то, что повышение температуры прокаливания от 400 до 500°C мало влияет на кристаллическую форму TiO2. Обнаружены дифракционные пики Ni при 2θ = 44.5° и 51.0°. Интенсивность дифракционного пика Ni постепенно возрастала с ростом температуры прокаливания в диапазоне 400–450°C, что указывает на слияние и постепенное увеличение зерен Ni. При повышении температуры прокаливания >450°C дифракционные пики TiO2 и Ni существенно не менялись.
Текстурные свойства катализаторов Ni–Cu/TiO2, прокаленных в течение разного времени, приведены в табл. SI -2 (дополнительные материалы). С увеличением времени прокаливания удельная поверхность и объем пор катализаторов сначала повышались, а затем снижались, а диаметр пор сначала уменьшался, а затем увеличивался. Это указывает на то, что частицы Ni и Cu равномерно распределены при оптимальном времени прокаливания, но слишком длительное прокаливание приводит к постепенному накоплению и росту зерен Ni. Таким образом, поры блокируются, и эффективность дегидрирования/гидрирования снижается.
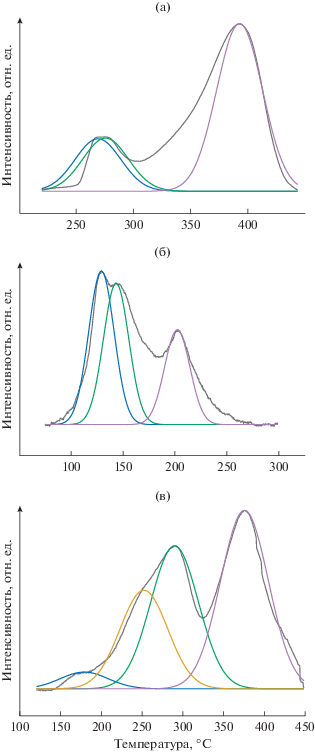
На рис. 2 показан профиль H2-ТПД образцов Ni–Cu/TiO2, восстановленных при различной температуре. Как видно из рис. 2а, для Ni/TiO2 наблюдались три различимых пика восстановления вблизи 268.9, 275.3 и 382.8°C. Пики низкотемпературного восстановления вблизи 268.9 и 275.3°C соответствуют восстановлению свободного NiO, а пик высокотемпературного восстановления около 382.8°C – восстановлению NiO, взаимодействующего с TiO2 [16]. В профиле Cu/TiO2 присутствуют три различимых пика восстановления вблизи 128.2, 141.7 и 206.5°C (рис. 2б). Пики ниже 200°C относятся к восстановлению дискретного и высокодисперсного CuO, тогда как пик восстановления около 206.5°C характеризует восстановление небольших объемных частиц CuO [17]. Как видно из рис. 2в, в случае Ni–Cu/TiO2 можно различить четыре пика восстановления вблизи 178.8, 252.1, 275.8 и 365.5°C. Пик вблизи 178.8°C соответствует восстановлению дискретного и высокодисперсного CuO, пик вблизи 252.1°C – восстановлению больших объемных частиц CuO, пик вблизи 275.8°C – восстановлению NiO в свободном состоянии и пик вблизи 365.5°C – восстановлению NiO, взаимодействующему с TiO2. Присутствие металлической Cu увеличивает восстанавливаемость частиц Ni из-за того, что на металлической меди молекула водорода способна диссоциировать на атомы, которые могут перетекать на поверхность соседнего NiO, что способствует снижению температуры восстановления NiO в Ni–Cu/TiO2 [18].
Текстурные свойства катализаторов Ni–Cu/TiO2 восстановленные в течение разного времени, приведены в табл. SI -3 (дополнительные материалы). При повышении времени восстановления удельная поверхность и объем пор катализатора сначала увеличивались, а затем уменьшались, а диаметр пор возрастал. Удельная поверхность и каталитическая активность катализатора достигали максимальных значений при времени восстановления 4 ч. При более длительном восстановлении (5 ч) удельная поверхность катализатора сокращалась, а доля крупных пор возрастала, что приводило к значительному увеличению среднего размера пор.
Повторное использование катализатора Ni–Cu/TiO2
Исследована эффективность Ni–Cu/TiO2 в реакции КЭГ (табл. SI -4, дополнительные материалы). Селективность по н-бутанолу достигала 44.4% при конверсии этанола 47.9% при загрузке катализатора 10 мас. %, температуре реакции 210°C и времени реакции 10 ч. По сравнению с катализатором Ni/TiO2 конверсия этанола снизилась с 49.2 до 47.9%, но селективность по н-бутанолу повысилась с 41.7 до 44.4%, а выход н-бутанола остался почти неизменным, что свидетельствует об увеличении полезности сырья.
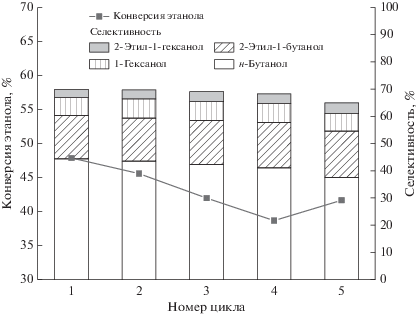
После завершения реакции катализатор Ni–Cu/TiO2 отделяли и трижды промывали безводным этанолом. Затем восстановленный катализатор сушили при 100°C и окончательно восстанавливали в течение 4 ч при 400°C в смеси водорода и азота с объемным соотношением ${{V}_{{{{{\text{H}}}_{{\text{2}}}}}}}$ : ${{V}_{{{{{\text{N}}}_{{\text{2}}}}}}}$ = 40 : 60. Регенерированный катализатор Ni–Cu/TiO2 повторно использовали в КЭГ в следующих условиях реакции: массовая доля катализатора – 10%, температура реакции – 210°C, время реакции – 10 ч (рис. 3). При повторном применении катализатора его характеристики постепенно ухудшались, но в меньшей степени, чем в случае Ni/TiO2. После трех каталитических циклов конверсия этанола снизилась с 47.9 до 42.0% (на 5.9%), а селективность по н-бутанолу – с 44.4 до 42.4% (на 2%). После трех циклов работы катализатора Ni/TiO2 конверсия этанола упала с 49.2 до 36.2% (на 13%), а селективность по н-бутанолу – с 41.7 до 36.8% (на 4.9%). Таким образом, стабильность при многократном использовании Ni–Cu/TiO2 была значительно улучшена по сравнению таковой для Ni/TiO2. Отметим, что после 5 циклов работы катализатора Ni–Cu/TiO2 конверсия этанола снизилась с 47.9 до 41.7% (на 6.2%), а селективность по н-бутанолу – с 44.4% до 37.6% (на 6.8%). Результаты анализа методом ICP, приведенные в табл. SI-5 (дополнительные материалы) , показали, что содержание металлического Ni в катализаторе Ni–Cu/TiO2 после 4‑кратного использования снизилось с 12.3 до 11.1% (на 1.2%), а в катализаторе Ni/TiO2 после третьего каталитического цикла уменьшилось с 12.0 до 9.8% (на 2.2%). Это указывает на то, что взаимодействие Cu с Ni может эффективно препятствовать потере металлического Ni и улучшать возможность многократного использования катализатора.
ЗАКЛЮЧЕНИЕ
Таким образом, среди биметаллических образцов Ni–Х/TiO2 (Х = Ru, Pt, Ir, Au, Cu, Mn, Co или Fe) катализатор Ni–Cu/TiO2 показал наилучшие каталитические характеристики. Результаты CO2-ТПД и NH3-ТПД указывают на то, что добавление второго металлического компонента изменяет кислотность и щелочность Ni/TiO2. Количество кислотных центров влияет на конверсию этанола, а количество щелочных центров – на селективность по н-бутанолу.
Приняты следующие условия приготовления Ni–Cu/TiO2: массовое соотношение Ni/Cu = 59 : 1, содержание Ni–Cu – 12.5 мас. %, температура прокаливания – 450°C, время прокаливания – 2 ч, температура восстановления – 400°C и время восстановления – 4 ч.
Селективность по н-бутанолу достигала 44.4% при конверсии этанола 47.9% при загрузке катализатора 10 мас. %, температуре реакции 210°C и времени реакции 10 ч. Благодаря взаимодействию Cu с Ni стабильность катализатора Ni–Cu/TiO2 при многократном использовании была значительно выше, чем таковая для Ni/TiO2.
Список литературы
Chatterjee A., Hu X., Lam L.Y. // Catal. Today. 2018. V. 314. P. 137.
Benito P., Vaccari A., Antonetti C., Licursi D., Schiarioli N., Rodriguez-Castellon E., Galletti A., Maria R. // J. Clean. Prod. 2019. V. 209. P. 1614.
Jiang D., Wu X., Mao J., Ni J., Li X. // Chem. Commun. 2016. V. 52. P. 13749.
Manojveer S., Salahi S., Wendt O.F., Johnson M.T. // J. Org. Chem. 2018. V. 83. P. 10864.
Quesadaa J., Arreola-Sáncheza R., Faba L., Diaz E., Renteria-Tapia V.M., Ordonez S. // Appl. Catal. A: Gen. 2018. V. 551. P. 23.
Wu X., Fang G., Liang Z., Leng W., Xu K., Jiang D., Ni J., Li X. // Catal. Commun. 2017. V. 100. P. 15.
Chistyakov A.V., Zharova P.A., Nikolaev S.A., Tsodikov M.V. // Catal. Today. 2017. V. 279. P. 124.
Zaccheria F., Scotti N., Ravasio N. // ChemCatChem. 2018. V. 10. P. 1526.
Li S.Q., Zhu X.H., An H.L., Zhao X.Q., Wang Y.J. // Chem. Select. 2020. V. 5. P. 8669.
Zhao L.L., Wang Y., An H.L., Zhao X.Q. // Ind. Eng. Chem. Res. 2016. V. 55. P. 12326.
Zhao L.L., An H.L., Zhao X.Q., Wang Y.J. // ACS. Catal. 2017. V. 7. P. 4451.
Petrolini D.D., Eagan N., Ball M.R., Burt S.P., Hermans I., Huber G.W., Dumesic J.A., Martins L. // Catal. Sci. Technol. 2019. V. 9. P. 2032.
Legrand J., Gota S., Guittet M.J., Petit C. // Langmuir. 2002. V. 18. P. 4131.
Velu S., Suzuki K., Vijayaraj M., Barman S., Gopinath C.S. // Appl. Catal. B: Environ. 2005. V. 55. P. 287.
Ghodselahi T., Vesaghi M.A., Shafiekhani A., Baghizadeh A., Lameii M. // Appl. Surf. Sci. 2008. V. 255. P. 2730.
Lazaro M.J., Echegoyen Y., Alegre C., Suelves L., Moliner R., Palacios J.M. // Int. J. Hydrogen. Energ. 2008. V. 33. P. 3320.
Roselin L.S., Chiu H.W. // J. Saudi Chem. Soc. 2018. V. 22. P. 692.
Shen Y., Lua A.C. // RSC. Adv. 2014. V. 4. P. 42159.
Дополнительные материалы
- скачать ESM.doc
- Рис. DI-1. Профили NH3-ТПД и CO2-ТПД катализаторов Ni–Х/TiO2.
Рис. SI-2. Рентгенограммы образцов Ni–Cu/TiO2 с различным массовым отношением Ni/Cu.
Рис. SI-3. РФЭС-спектры Ni2p и Cu2p катализаторов Ni–Cu/TiO2 с различным массовым отношением Ni/Cu.
Таблица SI-1. Текстурные свойства катализаторов Ni–Cu/TiO2 с различным содержанием металлов.
Рис. SI-4. Рентгенограммы образцов Ni–Cu/TiO2 с различной температурой прокаливания.
Таблица SI-2. Текстурные свойства катализаторов Ni–Cu/TiO2 с разным временем прокаливания.
Таблица SI-3. Текстурные свойства катализаторов Ni–Cu/TiO2 с разным временем восстановления.
Таблица SI-4. Катализируемая Ni–Cu/TiO2 этанольная реакция Гербе.
Таблица SI-5. Анализ методом ИСП содержания Ni и Cu в Ni–Cu/TiO22 до и после реакции.
Инструменты
Кинетика и катализ