Кинетика и катализ, 2021, T. 62, № 5, стр. 633-646
Особенности формирования активного компонента в нанесенных на алюмооксидный носитель медномолибдатных катализаторах горения сажи
Е. В. Романова a, *, А. В. Нам b, Т. С. Харламова a, **
a ФГАОУ ВО Национальный исследовательский Томский государственный университет
634050 Томск, просп. Ленина, 36, Россия
b ЗАО БИОКАД
198515 Санкт-Петербург, ул. Связи, 34, пос. Стрельна, Россия
* E-mail: evgenia.soltys@mail.ru
** E-mail: kharlamova83@gmail.com
Поступила в редакцию 17.01.2021
После доработки 12.04.2021
Принята к публикации 26.04.2021
Аннотация
Исследованы особенности формирования фазового состава медномолибдатных катализаторов, нанесенных на алюмооксидный носитель, и их реакционная способность в модельной реакции окисления сажи. Образцы катализаторов были получены методом пропитки по влагоемкости водными растворами предшественников наносимых компонентов. При приготовлении варьировали порядок введения компонентов, их мольное отношение и содержание. Катализаторы изучали методами РФА, ЭСДО и ТПВ-Н2. Показано, что на формирование фазового состава нанесенных образцов и, как следствие, их каталитическую активность существенное влияние оказывает порядок введения наносимых компонентов в результате их взаимодействия с носителем.
Графический реферат
ВВЕДЕНИЕ
Двигатели внутреннего сгорания – дизельные и бензиновые с прямым впрыском – находят широкое применение благодаря их высокой эффективности, долговечности и низкой концентрации выбросов CO и углеводородов. Тем не менее, выхлопные газы, образующиеся при работе дизельных двигателей и, в первую очередь, содержащиеся в них частицы сажи и оксиды азота, остаются основной проблемой с точки зрения окружающей среды и здоровья [1, 2]. Для эффективной очистки выхлопных газов от частиц сажи в современных автомобилях широко используют сажевые фильтры с каталитическим покрытием [3]. Ряд катализаторов на основе благородных металлов и оксидов неблагородных металлов, имеющих различный состав и структурные характеристики, были исследованы для окисления сажи [3].
Катализаторы окисления сажи наносят в виде слоя на поверхность пористого керамического блока, как правило, с сотовой структурой, образованной продольными параллельными каналами, действующего как фильтр твердых частиц [3, 4]. К одним из основных преимуществ керамических блоков по сравнению с обычными порошковыми или гранулированными катализаторами относится низкое сопротивление в газовом потоке из-за большой открытой фронтальной поверхности, которая может быть > 70%. В качестве материала блока используют материалы со значительной механической прочностью, стабильностью при высоких температурах и температурных скачках, низким коэффициентом теплового расширения. Наиболее предпочтительными материалами блока являются кордиерит (2MgO·2Al2O3·5SiO2), карбид кремния (SiC), муллит (Al2SiO5), титанат алюминия (Al2TiO5) [3, 4]. Один из недостатков монолитных блоков – их низкая удельная поверхность (менее 2 м2/г), что не позволяет обеспечить необходимую адгезию каталитического слоя, высокую дисперсность и как следствие развитую удельную поверхность наносимого катализатора, а также предотвратить спекание частиц катализатора в условиях эксплуатации сажевых фильтров. Для решения указанных проблем используют нанесение на поверхность монолита слоя пористого материала-носителя, например, оксида алюминия (удельная поверхность 100–300 м2/г) [3, 4].
Помимо высокой активности в окислении сажи катализатор должен быть устойчивым к дезактивации в условиях эксплуатации сажевых фильтров. Причинами дезактивации катализаторов в сажевых фильтрах являются их термическая нестабильность (температура внутри фильтра может подниматься до 1000–1100°C) и химическое отравление [3]. Химическое взаимодействие с соединениями серы, присутствующими в топливе, и фосфора, входящими в состав смазочных материалах, может вызвать серьезное отравляющее воздействие на катализатор. Дезактивация катализаторов на основе оксида церия, наиболее перспективных в качестве альтернативы дорогостоящим платиновым катализаторам, остается основным недостатком, препятствующим их применению в промышленных масштабах. В этой связи могут быть интересны катализаторы на основе молибдатов меди, проявляющих каталитическую активность в окислении как сажи [5–10], так и соединений серы, в частности, (CH3)2S2 и CH3SH [11, 12]. В работах [5–10] были исследованы массивные молибдаты меди, полученные различными способами, в том числе твердофазным синтезом, кристаллизацией из раствора, осаждением, золь–гель-синтезом и экстракционно-пиролитическим методом (ЭПМ). Во всех случаях наблюдается снижение температуры горения сажи в присутствии молибдатов меди по сравнению с некаталитическим горением на 130–230°C в зависимости от метода приготовления катализатора, типа модельной сажи и условий эксперимента. При этом отмечалось, что каталитическая активность молибдатов меди выше, чем индивидуальных оксидов меди и молибдена. Например, в работе [5] наблюдали снижение температуры горения модельной сажи Printex U при нагреве со скоростью 5 град/мин в потоке воздуха от 600 до 532°C для CuO, до 466°C – для MoO3 и до 438°C – для Cu3Mo2O9. В работе [8] температура горения модельной сажи ГОСТ 12222-78, марка Б, при нагреве со скоростью 5 град/мин в потоке воздуха падала с 630 до 425°C для MoO3 и до 404°C – для CuMoOx, полученных экстракционно-пиролитическим методом. Исследования массивных молибдатов меди позволили выявить, что формирование активного состояния катализаторов связано с образование фаз Cu4– xMo3O12 и Cu6Mo5O18 в результате фазовых и структурных превращений исходных молибдатов меди в условиях реакционной среды [7–10]. В то же время использование молибдатов меди в качестве катализаторов в сажевых фильтрах подразумевает их нанесение на поверхность слоя пористого материала-носителя, что требует проведения дополнительных исследований нанесенных систем.
В работах [13, 14] были изучены каталитические свойства молиблатов меди, нанесенных на базальтовое волокно. В работе [13] показана высокая активность медномолибдатных каталитических покрытий, сформированных на базальтовом волокне в окислении сажи, и их устойчивость к высокотемпературному воздействию SO2 и паров воды. Однако адгезия активной фазы к поверхности волокон зависела от метода приготовления: наблюдалось полное отслоение CuMoO4-покрытия, нанесенного ЭПМ, в то время как покрытие, сформированное с использованием полимерно-солевого геля (ПСГ) и состоящее из железомолибдатного промежуточного слоя и фаз CuMoO4, Сu3Мо2О9 и FeхCu3 –хMo2O9, обеспечивало высокую адгезию [13, 14].
В представленной работе исследовано формирование медномолибдатных катализаторов, нанесенных на модельный алюмооксидный носитель – более традиционный материал, применяемый в качестве пористого слоя в монолитных сажевых фильтрах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез катализаторов
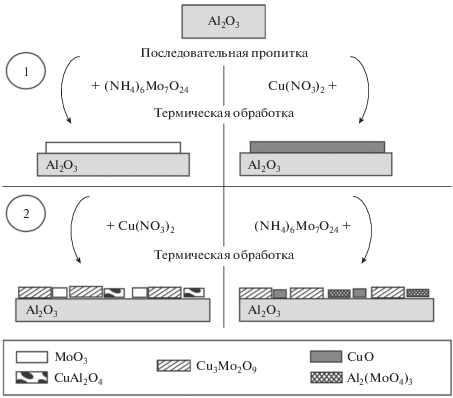
Нанесенные молибдаты меди с различным мольным соотношением Cu : Mo (1 : 1 и 3 : 2) синтезировали методом последовательной пропитки по влагоемкости алюмооксидного носителя водными растворами (NH4)6Mo7O24⋅4H2O и Cu(NO3)2⋅3H2O. В качестве носителя использовали оксид алюминия марки АОК-63-22 (АО СКТБ “Катализатор”), предварительно прокаленный при 700°C в течение 6 ч. Было получено две серии образцов, отличающиеся порядком введения активных компонентов. Промежуточные и конечные образцы сушили при 150°С в течение 12 ч, а затем прокаливали при 700°С в течение 4 ч. Минимальное содержание компонентов в пересчете на MoO3 соответствовало монослойному покрытию носителя оксидом молибдена (из расчета 4 атома Mo/нм2 [15]).
Исследование образцов
Изучение структурных характеристик полученных образцов проводили методом низкотемпературной адсорбции азота с помощью автоматического газо-адсорбционного анализатора удельной поверхности и пористости TriStar II 3020 (“Micromeritics”, США). Значения удельной поверхности определяли многоточечным методом БЭТ по спрямлению изотермы адсорбции в диапазоне Р/Р0 от 0.05 до 0.30. Перед началом экспериментов образцы подвергали дегазации в вакууме при 200°С в течении 2 ч с использованием дегазатора VacPrep 061 (“Micromeritics”, США).
Фазовый состав приготовленных образцов исследовали методом рентгенофазового анализа (РФА) на дифрактометре MiniFlex (“Rigaku”, Япония) с монохроматизиованным CuKα-излучением (λ = 1.5418 Å). Условия съемки: скорость сканирования – 2 град/мин, диапазон углов 2θ = = 10°–60°. Полученные дифрактограммы анализировали с применением базы данных PCPDFWIN.
Исследование химического состояния катионов меди в катализаторах проводили методом электронной спектроскопии диффузионного отражения (ЭСДО) с помощью спектрофотометра Agilent Cary 100 (“Agilent Technologies”, США) с использованием базовой линии стандарта отражения MgO.
Восстановление нанесенных CuO–MoO3-систем изучали методом температурно-программированного восстановления водородом (ТПВ-H2) на хемосорбционном анализаторе Chemisorb 2750 (“Micromeritics”, США) с детектором по теплопроводности. Эксперименты ТПВ-H2 осуществляли в смеси 10 об. % Н2 в аргоне со скоростью потока 20 мл/мин в температурном диапазоне от 25 до 700°С со скоростью нагрева 5 град/мин. Перед проведением опытов образцы подвергали предварительной окислительной обработке в потоке воздуха (20 мл/мин) в режиме температурно-программированного окисления со скоростью нагрева 10 град/мин до 700°С с последующей выдержкой при 700°С в течение 30 мин.
Каталитическую активность образцов исследовали в модельной реакции окисления сажи методом синхронного термического анализа (СТА) с помощью анализатора STA 449 F1 Jupiter (“NETZSCH”, Германия). Образцы, смешанные с модельной сажей (Carbon Black, “Micromeritics”, США) в соотношении 1 : 20, помещали в алюмооксидные тигли и нагревали в камере анализатора в атмосфере смеси аргона (20 мл/мин) и воздуха (50 мл/мин) в температурном интервале от 50 до 800°C со скоростью 10 град/мин. В ходе эксперимента проводили анализ изменения массы и тепловых потоков, а также выделяющихся газов (H2O, m/z = 18, CO2, m/z = 44) в потоке с применением совмещенного квадрупольного масс-спектрометра QMS 403 D Aёolos (“NETZSCH”, Германия). Полученные данные обрабатывали с помощью программного обеспечения NETZSCH Proteus® Sofraware.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЯ
Алюмооксидный носитель
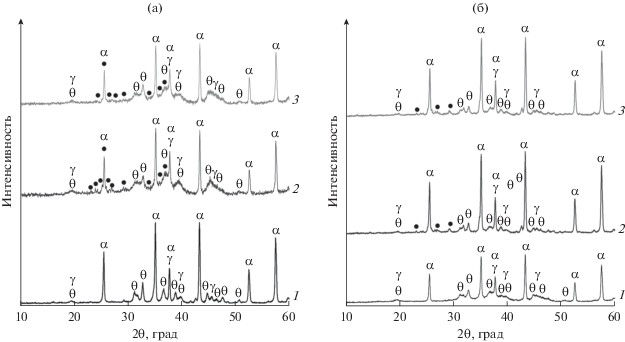
Алюмооксидный носитель, используемый для приготовления катализаторов, по данным РФА представляет собой смесь различных модификаций алюминия: дисперсных фаз γ- и θ-Al2O3 и хорошо окристаллизованной фазы α-Al2O3 (рентгенограмма аналогична рентгенограмме MoO3/Al2O3 образца на рис. 1, не приведена для краткости). Согласно результатам низкотемпературной адсорбции азота алюмооксидный носитель, прокаленный при 700°C в течение 6 ч, характеризуется площадью удельной поверхности в интервале 35.7–53.0 м2/г и объемом пор 0.168–0.193 см3/г. Относительно низкая удельная поверхность носителя на основе оксида алюминия марки АОК-63-22 обусловлена фазовым переходом метастабильных модификаций оксида алюминия, характеризующихся высокой дисперсностью, в термодинамически стабильный α-Al2O3 при длительном прокаливании при 700°C.
Рис. 1.
Рентгенограммы однокомпонентных и полученных на их основе двухкомпонентных образцов с различным отношением Cu : Mo: а – MoO3/Al2O3 (1), CuO/MoO3–Al2O3(3 : 2) (2), CuO/MoO3–Al2O3(1 : 1) (3); б – CuO/Al2O3 (1), MoO3/CuO-Al2O3(1 : 1) (2), MoO3/CuO–Al2O3(3 : 2) (3). Обозначения: ● – Cu3Mo2O9, α – α-Al2O3, γ – γ-Al2O3, θ – θ-Al2O3.
Влияние порядка введения компонентов и их соотношения на фазовый состав образцов
В табл. 1 представлены текстурные характеристики и фазовый состав поверхности по данным различных методов исследования для образцов катализаторов, отличающихся мольным отношением Cu : Mo и порядком введения компонентов при их приготовлении: 1) нанесение на первой стадии MoO3 с последующим введением CuO – CuO/MoO3–Al2O3(Cu : Mo); 2) введение на первой стадии CuO с последующим введением MoO3 – MoO3/CuO–Al2O3(Cu : Mo). Расхождения в содержании компонентов в образцах с одинаковым мольным отношением Cu : Mo, но полученных разными способами, обусловлены различием величины удельной поверхности (Sуд) носителя, используемого для синтеза соответствующих катализаторов. Введение компонентов сопровождается заметным снижением Sуд и объема пор (Vпор) образцов, особенно в случае последовательного нанесения сначала CuO, а затем MoO3.
Таблица 1.
Текстурные характеристики и состав образцов, полученных с использованием различного порядка введения компонентов
| Образец | Содержание, мас. % | Sуд, м2/г | Vпор, см3/г | Фазовый состав поверхности | |
|---|---|---|---|---|---|
| CuO | MoO3 | ||||
| Al2O3* | – | – | 49.1 | 0.193 | – |
| CuO/MoO3–Al2O3(1 : 1) | 2.5 | 4.6 | 16.4 | 0.164 | Cu3Mo2O9, Al2(MoO4)3, CuO |
| CuO/MoO3–Al2O3(3 : 2) | 3.6 | 4.3 | 16.5 | 0.170 | Cu3Mo2O9, Al2(MoO4)3, CuO |
| Al2O3* | – | – | 37.1 | 0.168 | – |
| MoO3/CuO–Al2O3(1 : 1) | 1.9 | 3.4 | 7.5 | 0.041 | Cu3Mo2O9, CuAl2O4, MoO3(сл.) |
| MoO3/CuO–Al2O3(3 : 2) | 2.8 | 3.4 | 7.6 | 0.040 | Cu3Mo2O9, CuAl2O4, MoO3(сл.) |
Фазовый состав и химическое состояние компонентов, нанесенных на поверхность алюмооксидного носителя, в промежуточных однокомпонентных и конечных двухкомпонентных образцах были исследованы методами РФА и ЭСДО. На рис. 1 представлены рентгенограммы промежуточных однокомпонентных образцов MoO3/Al2O3 и CuO/Al2O3 и полученных на их основе двухкомпонентных образцов CuO/MoO3–Al2O3(Cu : Mo) и MoO3/CuO–Al2O3(Cu : Mo). Для всех образцов характерно наличие рефлексов фаз носителя α-, γ- и θ-Al2O3. Отсутствие рефлексов кристаллических фаз соединений меди (оксида и/или алюмината меди) и молибдена (оксида молибдена и/или молибдата алюминия) на рентгенограммах соответствующих однокомпонентных образцов свидетельствует о том, что они находятся в высокодисперсном и/или рентгеноаморфном состояниях [16]. Введение второго компонента приводит к образованию кристаллической фазы молибдата меди Сu3Mo2O9 во всех двухкомпонентных образцах независимо от мольного отношения Cu : Mo и порядка введения компонентов, о чем говорят слабые рефлексы фазы Сu3Mo2O9 на рентгенограммах (рис. 1).
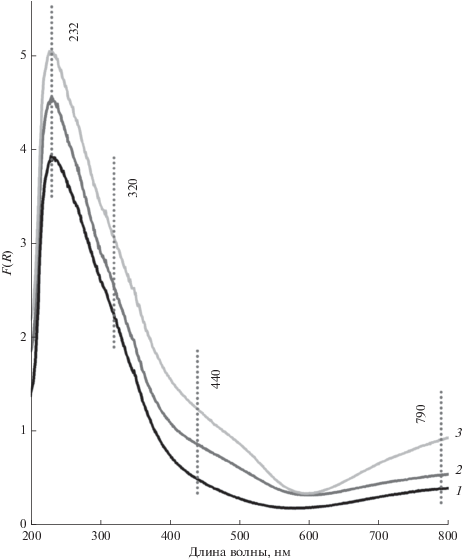
На рис. 2 показаны спектры ЭСДО однокомпонентных и двухкомпонентных образцов. В спектре ЭСДО промежуточного образца MoO3/Al2O3 (рис. 2а) присутствует ассиметричная полоса поглощения (п. п.) с максимумом при 240 нм, которая обусловлена электронным переходом O2– → Mo6+ с тетраэдрической координацией молибдена [15]. Подобную п. п. связывают с образованием поверхностных молибденоксидных структур [15] или дисперсного Al2(MoO4)3 [17, 18]. Ассиметричность полосы, вызванная слабым поглощением в диапазоне 300–350 нм, характерным для молибдена в октаэдрическом кислородном окружении, может быть связана с присутствием молибдена в виде дисперсного MoO3 или олигомерных поверхностных MoOx-фаз [15]. В спектрах промежуточных образцов CuO/Al2O3 (рис. 2б) видны полосы d–d-переходов Cu2+ в октаэдрической координации при 790 нм [19, 20], а также полосы переноса заряда O2– → Cu2+ при 240 [21], 307 и 420 нм. Полоса при 420 нм соответствует Cu2+ в октаэдрическом кислородном окружении в структуре шпинели CuAl2O4. Полоса при 307 нм характерна для Cu2+ в тетраэдрическом кислородном окружении в оксиде меди.
Рис. 2.
Cпектры ЭСДО промежуточных и полученных на их основе двухкомпонентных образцов с различным отношением Cu : Mo: а – MoO3/Al2O3 (1), CuO/MoO3–Al2O3(1 : 1) (2), CuO/MoO3–Al2O3(3 : 2) (3); б – CuO/Al2O3 (1), MoO3/CuO–Al2O3(3 : 2) (2), MoO3/CuO–Al2O3(1 : 1) (3).
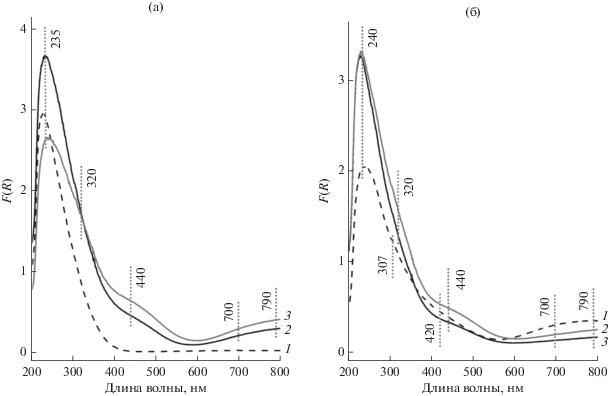
В спектрах ЭСДО двухкомпонентных образцов хорошо видны изменения по сравнению со спектрами соответствующих промежуточных образцов (рис. 2), что обусловлено взаимодействием наносимых компонентов. Полосы поглощения при 320 и 440 нм относятся к электронному переносу заряда O2– → Cu2+ или O2– → Mo6+ и Cu2+ → Mo6+ и связаны с образованием фазы молибдата меди Сu3Mo2O9 [22], что хорошо согласуется с данными РФА.
Таким образом, на основании данных РФА и ЭСДО можно сделать заключение, что независимо от соотношения Cu : Mo и порядка введения активного компонента на поверхности носителя происходит формирование кристаллической фазы Cu3Mo2O9. Кроме того нельзя исключить присутствие на поверхности двухкомпонентных образцов следов оксидов меди и молибдена, а также Al2(MoO4)3 и CuAl2O4, образующихся на стадии введения первого компонента.
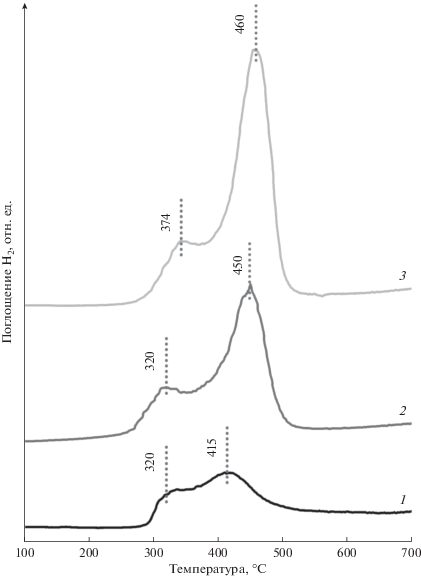
Особенности восстановления промежуточных и конечных образцов были исследованы методом ТПВ-H2 (рис. 3). На профиле ТПВ промежуточного образца MoO3/Al2O3 наблюдается поглощение водорода в диапазоне температур 340–700°C с максимумом при 487°С, что существенно ниже, чем температура восстановления массивного оксида молибдена. Согласно результатам работ [23, 24], а также учитывая данные ЭСДО образца, наблюдаемый пик поглощения водорода может быть отнесен к восстановлению молибдена из молибдата алюминия.
Рис. 3.
Профили ТПВ-H2 промежуточных образцов, полученных на их основе двухкомпонентных образцов, а также индивидуальных оксидов: 1 – MoO3/Al2O3, 2 – CuO/Al2O3, 3 – CuO/MoO3–Al2O3(3 : 2), 4 – CuO/MoO3–Al2O3(3 : 2), 5 – MoO3/CuO–Al2O3(1 : 1), 6 – MoO3/CuO–Al2O3(3 : 2), 7 – CuO, 8 –MoO3, 9 – Cu3Mo2O9.
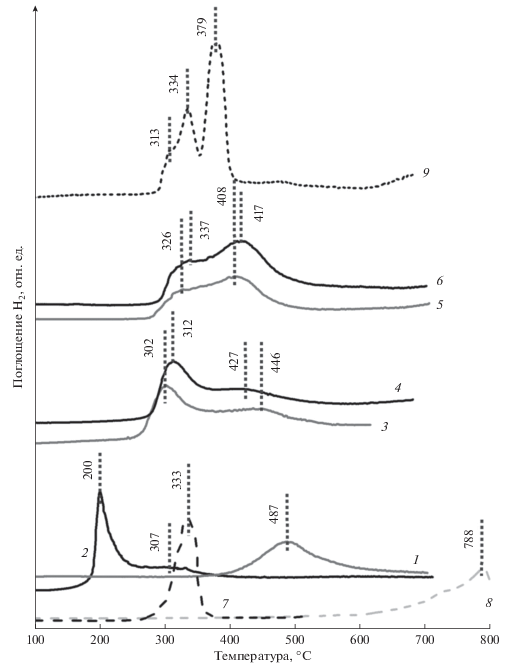
Восстановление промежуточного образца CuO/Al2O3 сопровождается появлением интенсивного пика поглощения водорода при 200°С с плечом при 307°С, и широкого неразрешенного пика в интервале 500–700°С (рис. 3), в то время как восстановление массивного оксида меди характеризуется одним пиком поглощения водорода с максимумом при 333°С. В работе [25] было показано, что восстановление CuO/Al2O3-катализаторов происходит в несколько стадий вследствие присутствия меди в образцах в различных фазах – CuO и CuAl2O4. Таким образом, поглощение водорода при 200–307°С может быть отнесено к восстановлению оксида меди разной дисперсности, а поглощение водорода в высокотемпературной области – к восстановлению меди из шпинели CuAl2O4.
ТПВ-профили двухкомпонентных образцов, отличающихся порядком введения Мо и Cu (рис. 3), несмотря на образования во всех случаях фазы молибдата меди Cu3Mo2O9, имеют существенные различия, что связано с разной глубиной взаимодействия наносимых компонентов между собой и с носителем и, как следствие, разным фазовым составом поверхности. Профили восстановления образцов, приготовленных при нанесении сначала оксида молибдена, а затем оксида меди, характеризуются поглощением водорода в интервале 250–600°С с максимумами при 302–312 и 427–446°С и неразрешенным плечом в области высоких температур. В профилях восстановления образцов, при получении которых сначала вводили оксид меди, а затем оксид молибдена, наблюдается поглощение водорода в интервале 280–600°С с выраженным пиком с максимумом при 408–417°С и плечом при 326–337°С и неразрешенным пиком при температурах выше 550°С. Из совокупности полученных данных можно заключить, что вид профилей ТПВ первой серии образцов обусловлен присутствием на поверхности носителя молибдена и меди в виде нескольких фаз – оксида меди и молибдата алюминия, а также молибдат меди. Профили ТПВ образцов второй серии характеризуют восстановление главным образом фазы Cu3Mo2O9, что хорошо согласуется с данными для соответствующего массивного образца (рис. 3). Небольшое поглощение водорода при высоких температурах может быть связано как с восстановлением меди из структуры шпинели, так и восстановлением молибдена из кристаллического оксида молибдена.
Влияние содержания активного компонента в MoO3/CuO–Al2O3(3 : 2)
В табл. 2 представлены текстурные характеристики и фазовый состав поверхности по данным различных методов исследования для образцов катализаторов с мольным отношением Cu : Mo = = 3 : 2, полученных с использованием последовательного нанесения на первой стадии CuO, а затем MoO3, с разным содержанием активного компонента.
Таблица 2.
Текстурные характеристики и состав образцов MoO3/CuO–Al2O3(3 : 2) с разным содержанием активного компонента
| Образец | Содержание, мас. % | Sуд, м2/г | V, см3/г | Фазовый состав поверхности | |
|---|---|---|---|---|---|
| CuO | MoO3 | ||||
| Al2O3 | – | – | 52.9 | 0.193 | – |
| MoO3/CuO–Al2O3(3 : 2) | 2.7 | 3.3 | 20.2 | 0.159 | Cu3Mo2O9, CuAl2O4, MoO3(сл.) |
| MoO3/CuO–Al2O3(3 : 2) | 4.7 | 6.8 | 9.9 | 0.078 | Cu3Mo2O9 |
| MoO3/CuO–Al2O3(3 : 2) | 7.6 | 10.7 | 11.0 | 0.093 | Cu3Mo2O9 |
На рис. 4 показаны рентгенограммы, а на рис. 5 – спектры ЭСДО образцов MoO3/CuO–Al2O3(3 : 2), отличающихся количеством введенных Mo и Cu. По данным РФА, при повышении массового содержания наносимых компонентов происходит увеличение количества молибдата меди Сu3Mo2O9. Других кристаллических фаз Cu и/или Mo обнаружено не было. В спектрах ЭСДО наблюдается рост интенсивности полос при 320 и 440 нм, обусловленных электронным переносом заряда O2– → → Cu2+ или O2– → Mo6+ и Cu2+ → Mo6+, и 790 нм, относящейся к d–d-переходам ионов Cu2+ в структуре Cu3Mo2O9, что согласуется с результатами РФА.
Рис. 4.
Рентгенограммы образцов MoO3/CuO–Al2O3(3 : 2), отличающихся количеством введенных компонентов в пересчете на MoO3: 1 – 3, 2 – 6, 3 – 10%.
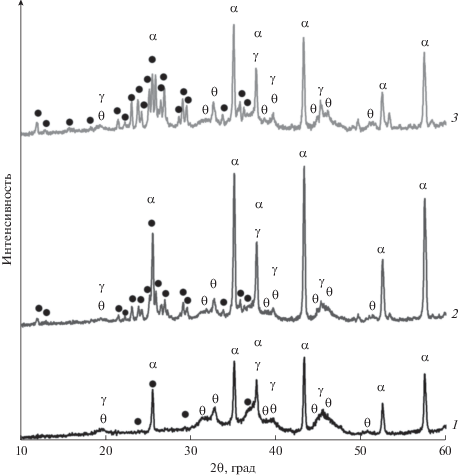
Рис. 5.
Спектры ЭСДО образцов MoO3/CuO–Al2O3(3 : 2), отличающихся количеством введенных компонентов в пересчете на MoO3: 1 – 3, 2 – 6, 3 – 10%.
На рис. 6 приведены профили ТПВ-H2 MoO3/CuO–Al2O3(3 : 2). Из данных ТПВ видно, что количество поглощенного водорода возрастает с увеличением количества нанесенных компонентов, при этом профили поглощения водорода в образцах, особенно с высоким содержанием нанесенных компонентов, соответствуют восстановлению фазы молибдата меди Сu3Mo2O9.
Исследование каталитических свойств
На рис. 7 представлены результаты исследования каталитической активности полученных двухкомпонентных образцов в модельной реакции горения сажи. По сравнению с некаталитическим горением, которое протекает в высокотемпературной области с максимумом скорости горения при 670°С, все образцы катализаторов снижают температуру реакции. Однако при близком содержании нанесенных компонентов фазовый состав поверхности образцов, определяемый порядком введения компонентов, оказывает существенное влияние на их каталитическую активность (рис. 7а). Так, в присутствии образцов серии CuO/MoO3–Al2O3(Cu : Mo) с соотношением Cu : Mo равным 1 : 1 и 3 : 2 окисление сажи начинается выше 450°С и протекает с максимальной скоростью при 555 и 539°С соответственно, в то время как на образцах серии MoO3/CuO–Al2O3(Cu : Mo) начало реакции отмечается выше 410°С, а максимальная скорость – при 519 и 530°С для катализаторов с Cu : Mo = 1 : 1 и 3 : 2 соответственно.
Рис. 7.
ТГ-кривые и данные масс-спектрометрического анализа газообразных продуктов окисления сажи без катализатора и в присутствии различных образцов. а – CuO/MoO3–Al2O3(1 : 1) (1), CuO/MoO3–Al2O3(3 : 2) (2); MoO3/CuO–Al2O3(3 : 2) (3), MoO3/CuO–Al2O3(1 : 1) (4), некаталитическое окисление (5). б – MoO3/CuO–Al2O3(3 : 2) с разным содержанием активного компонента в пересчете на MoO3: 3 (1), 6 (2) и 10% (3).
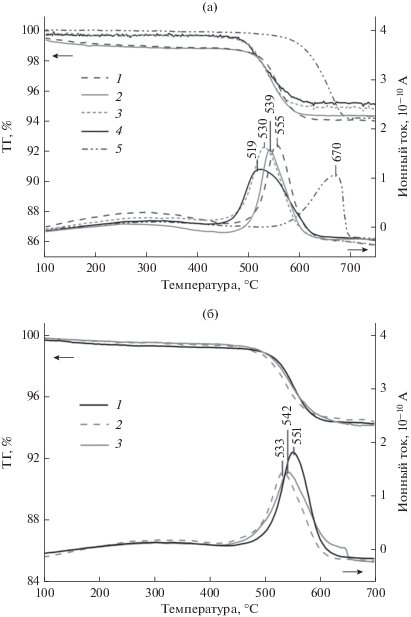
Наибольшее влияние на каталитическую активность исследуемых образцов оказывает взаимодействие MoO3 с поверхностью носителя с образованием молибдата алюминия, что препятствует появлению активной фазы в нанесенных бикомпонентных катализаторах. Наилучший результат показали образцы серии MoO3/CuO–Al2O3(Cu : Mo), полученные последовательным введением сначала CuO, а затем MoO3, что обеспечило преимущественное формирование на поверхности активной фазы молибдата меди. Возрастание процентного содержания наносимых компонентов в образцах MoO3/CuO–Al2O3(3 : 2) в целом приводит к повышению их каталитической активности, при этом наиболее оптимальным является введение 4.7 мас. % CuO и 6.8 мас. % MoO3. Дальнейшее увеличение количества активного компонента в катализаторе не сопровождается заметным ростом его активности, что может быть связано с низкой дисперсностью активной фазы и ее распределением в образце.
В табл. 3 приведены условия экспериментов и результаты исследования каталитических свойств массивных и нанесенных СuMoOx-катализаторов в реакции горения сажи по данным [5–10, 13, 14]. В большинстве работ окисление сажи протекало в одну стадию [5, 6, 8–10, 13, 14] от 350 до 550°C с наибольшей скоростью при температурах от 400 до 480°C в зависимости от метода приготовления образцов, типа используемой модельной сажи и условий эксперимента. В работе [7] на ТГ-кривых наблюдалось ступенчатое окисление сажи в диапазоне температур от 400 до 550°C с максимумами при 475 и 533°C для Cu3Mo2O9 и 477 и 528°C – для CuMoO4. Такое поведение обусловлено особенностями структурных и фазовых превращений исходных молибдатов с образованием каталитически активных фаз Cu4 –хMo3O12 и Cu6Mo5O18 в условиях реакционной среды при заданных условиях эксперимента.
Таблица 3.
Условия и результаты исследования каталитических свойств массивных и нанесенных катализаторов СuMoOx в реакции горения сажи методом термогравиметрии
| Катализатор/метод приготовления | Условия эксперимента | Tmax, °С/$T_{{\max }}^{^\circ },$ °С | Ссылка | ||
|---|---|---|---|---|---|
| марка сажи, mкат.: mсаж |
∆T/∆t, °C/мин | газ/$v{\text{,}}$ мл/мин | |||
| Cu3Mo2O9/Al2O3/ пропитка | “Micromeritics”, США, 20 : 1 | 10 | Ar/20 + воздух/50 | 533/670 | Здесь |
| Cu3Mo2O9/CVD | Printex U, “Degussa”, Германия, 3 : 1 | 5 | Воздух/н.у. | 438/600 | [5] |
| CuMoOx/ кристаллизация | Printex U, “Degussa”, Германия, 2 : 1 | 10 | Воздух/50 | 430/571 | [6] |
| CuMoO4/ золь–гель синтез |
“Micromeritics”, США, 20 : 1 | 10 | Ar/20 + воздух/50 | 477, 528/670 | [7] |
| Cu3Mo2O9/осаждение | “Micromeritics”, США, 20 : 1 | 10 | Ar/20 + воздух/50 | 475, 533/670 | [7] |
| CuMoO4/ЭПМ | ГОСТ 12222-78, марка Б, Россия, 10 : 1 | 5 | Воздух/50 | 404/630 | [8] |
| CuMoO4/ТФС | ГОСТ 12222-78, марка Б, Россия, 10 : 1 | 5 | Воздух/50 | 479/630 | [8] |
| CuMoO4/ЭПМ | ГОСТ 12222-78, марка Б, Россия, 24 : 1 | 5 | Воздух/50 | 412/н. у. | [9] |
| CuMoO4/ЭПМ | ГОСТ 12222-78, марка Б, Россия, 19 : 1 | 5 | Воздух/50 + Ar/10 | 405/н. у. | [10] |
| CuMoO4/ЭПМ | ГОСТ 12222-78, марка Б, Россия, 19 : 1 | 9 | воздух/50 + Ar/10 | 420/н. у. | [10] |
| CuMoO4/БВ/ЭПМ | ГОСТ 12222-78, марка Б, Россия, 20 : 1 | 5 | Воздух/50 | 403/н. у. | [13] |
| CuMoO4/БВ/ПСГ | ГОСТ 12222-78, марка Б, Россия, 20 : 1 | 5 | Воздух/50 | 412/н. у. | [13] |
| 5% CuMoO4/БВ/ПСГ | ГОСТ 12222-78, марка Б, Россия, 20 : 1 | 5 | Воздух/50 | 404/н. у. | [14] |
| 10% CuMoO4/БВ/ПСГ | ГОСТ 12222-78, марка Б, Россия, 20 : 1 | 5 | Воздух/50 | 400/н. у. | [14] |
| CuMoO4 | ГОСТ 12222-78, марка Б, Россия, 20 : 1 | 5 | Воздух/50 | 403/н. у. | [14] |
| Cu3Mo2O9 | ГОСТ 12222-78, марка Б, Россия, 20 : 1 | 5 | Воздух/50 | 382/н. у. | [14] |
Примечание: ∆T/∆t – скорость нагрева; $v$ – скорость потока газа; Tmax – температура максимальной скорости горения сажи в присутствие катализатора; $T_{{{\text{max}}}}^{^\circ }$ – температура максимальной скорости горения сажи без катализатора. ЭПМ – экстракционно-пиролитический метод; ТФС – твердофазный синтез; ПСГ – метод полимерно-солевого геля. БВ – базальтовое волокно. Сокращение н. у. – не указано.
Сравнение полученных результатов с литературными данными свидетельствует, что активность исследованных в настоящей работе нанесенных катализаторов Cu3Mo2O9/Al2O3 ниже, чем таковая для массивных, а также нанесенных на базальтовое волокно образцов. Однако анализ показал, что на наблюдаемую каталитическую активность молибдатов меди заметное влияние оказывают марка используемой сажи, скорость нагрева смеси катализатора и сажи, а также метод приготовления образца, при этом ее зависимость от соотношения масс катализатора и сажи слабая, что необходимо учитывать при сопоставлении результатов различных исследований. В этой связи наиболее корректно сравнивать активность нанесенных образцов Cu3Mo2O9/Al2O3 с таковой для массивных молибдатов меди, изученных нами ранее в аналогичных условиях [7]. В отличие от массивных образцов, окисление сажи на нанесенных катализаторах происходит в одну стадию, при этом горение сажи в их присутствии наблюдается при более высоких температурах. В работе [14] для исследованных в одинаковых условиях массивных и нанесенных на базальтовое волокно CuMoO4-образцов, характеризующихся низкой удельной поверхностью (~1 м2/г), повышения температуры горения сажи не зафиксировано. В тоже время для образцов, полученных механическим смешением базальтового волокна с молибдатными фазами СuMoO4, Сu3Мо2О9, горение сажи протекало при более высоких температурах, что было связано с различием в дисперсности молибдатов меди [14]. Наблюдаемый рост температуры и изменение характера горения сажи для нанесенных образцов по сравнению с массивными молибдатами меди в нашем случае может быть обусловлено их относительно высокими удельной поверхностью и пористостью (удельная поверхность массивных образцов составляла 1.2–2.5 м2/г [7]), что снижает контакт между частицами сажи и молибдата меди, распложенными в порах носителя.
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящей работе исследованы особенности формирования фазового состава поверхности медномолибдатных катализаторов, нанесенных на модельный алюмооксидный носитель на основе оксида алюминия марки АОК-63-22. Выявлено, что последовательность введения наносимых компонентов оказывает существенное влияние на фазовый состав поверхности вследствие их взаимодействия с носителем. Преимущественное образование фазы молибдата меди происходит при нанесении на первом этапе на носитель оксида меди, при этом независимо от соотношения меди и молибдена и порядка их введения на поверхности носителя формируется молибдат меди Сu3Mo2O9, обеспечивающий высокую каталитическую активность образца. При введении в носитель на первом этапе оксида молибдена его взаимодействие с поверхностью носителя с образованием молибдата алюминия препятствует формированию активной фазы в нанесенных бикомпонентных катализаторах.
Список литературы
Kozina A., Radica G., Nižetić S. // J. Clean. Prod. 2020. V. 262. P. 121105.
Wang J., Yang S., Sun H., Qiu J., Men Y. // J. Colloid Interface Sci. 2020. V. 577. P. 355.
Prasad R., Singh S.V. // J. Env. Chem. Eng. 2020. V. 8. № 4. P. 103945.
Meloni E., Palma V. // Catalysts. 2020. V. 10. № 7. P. 745.
Chu W.G., Wang H.F., Guo Y.J., Zhang L.N., Han Z.H., Li Q.Q., Fan S.S. // Inorg. Chem. 2009. V. 48. № 3. P. 1243.
Hasan M.A., Zaki M.I., Kumari K., Pasupulety L. // Thermochim. Acta. 1998. V. 320. P. 23.
Солтыс Е.В., Уразов Х.Х., Харламова Т.С., Водянкина О.В. // Кинетика и катализ. 2018. Т. 59. № 1. С. 79.
Лебухова Н.В., Карпович Н.Ф., Макаревич К.С., Чигрин П.Г. // Катализ в промышленности. 2008. № 6. С. 35.
Чигрин П.Г., Лебухова Н.В., Устинов А.Ю. // Кинетика и катализ. 2013. Т. 54. № 1. С. 79.
Chigrin P.G., Lebukhova N.V., Ustinov A.Yu. // Reac. Kinet. Mech. Cat. 2014. V. 113. P. 1.
Wang C.-H., Weng H.-S. // Ind. Eng. Chem. Res. 1997. V. 36. № 7. P. 2537.
Devulapelli V.G., Sahle-Demessie E. // Appl. Catal. A: Gen. 2008. V. 348. № 1. P. 86.
Лебухова Н.В., Кириченко Е.А., Чигрин П.Г. // Неорг. матер. 2015. Т. 51. № 5. С. 516.
Макаревич К.С., Кириченко Е.А., Лебухова Н.В., Карпович Н.Ф. // Катализ в промышленности. 2013. № 2. С. 33.
Chakrabarti A., Wachs I.E. // ACS Catalysis. 2018. V. 8. P. 949.
Wang B., Ding G., Shang Y., Lv J., Wang H., Wang E., Sun Q.//Appl. Catal. A: Gen. 2012. V. 431–432. P. 144.
Sankaranarayanan T.M., Pandurangan A., Banu M., Sivasanker S. // Appl. Catal. A: Gen. 2011. V. 409–410. P. 239.
Villarreal A., Garbarino G., Riani P., Gutiérrez-Alejandre A., Ramírez J. // J. Appl. Res. Technol. 2018. V. 16. № 6. P. 484.
Yoshida H., Hirakawa T., Oyama H., Nakashima R., Hinokuma S., Machida M. // J. Phys. Chem. C. 2019. V. 123. № 16. P. 10469.
Velu S., Suzuki K., Okazaki M., Kapoor M.P., Osaki T., Ohashi F. // J. Catal. 2000. V. 194. № 2. P. 373.
Gholami T., Salavati-Niasari M. // Int. J. Hydrogen Energy. 2016. V. 41. № 34. P. 15141.
Rahmani A., Farsi H. // RSC Advances. 2020. V. 10. № 64. P. 39037.
Rao T.V.M., Deo G. // AIChE J. 2007. V. 53. № 6. P. 1538.
Meng Y., Wang T., Chen S., Zhao Y., Ma X., Gong J. // Appl. Catal. B: Env. 2014. V. 160. P. 161.
Luo M.F., Fang P., He M., Xie Y.L. // J. Mol. Catal. A: Chem. 2005. V. 239. № 1–2. P. 243.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ