Кинетика и катализ, 2021, T. 62, № 6, стр. 657-665
Законы сохранения и диссипативные структуры для химических реакций в открытом реакторе с диффузией реагентов
Н. И. Кольцов *
ФГБОУ ВО Чувашский государственный университет им. И.Н. Ульянова, химико-фармацевтический факультет
428015 Чебоксары, Московский просп., 15, Россия
* E-mail: koltsovni@mail.ru
Поступила в редакцию 23.03.2021
После доработки 19.07.2021
Принята к публикации 19.07.2021
Аннотация
Изложен подход к определению законов сохранения для химических реакций с произвольной
кинетикой, протекающих стационарно в открытом изотермическом реакторе с продольной
и радиальной диффузией реагентов (реакторе неполного смешения, РНС). Исследованы следующие
из законов сохранения диссипативные структуры, описывающие распределение комплексов
концентраций реагентов в РНС в зависимости от соотношений между коэффициентами диффузии
реагентов. Приведены примеры определения и использования законов сохранения и диссипативных
структур при решении обратной задачи по идентификации механизмов реакций, протекающих
в открытом РНС.
Диффузионные диссипативные структуры
ВВЕДЕНИЕ
Законы сохранения (ЗС) веществ для химических реакций, протекающих в реакторах разного типа, выражаются через решения соответствующих кинетических моделей и представляют собой такие функции от концентраций реагентов и параметров реакции, которые остаются постоянными (инвариантными) относительно этих решений. В реакторах идеального смешения (РИС) эти функции описываются через решения алгебраических или обыкновенных дифференциальных уравнений и находятся относительно просто. В закрытых стационарных РИС ЗС выражаются точно и явно [1–4] линейными алгебраическими соотношениями вида ∑αmjAj(p) = $\Sigma {{\alpha }_{{mj}}}A_{j}^{0}$, где αmj – константы, определяемые стехиометрией механизма реакции; m − число различных атомов реагентов; j − номер реагента; Aj(p) – концентрации реагентов; p − вектор параметров, вид и число которых определяется структурой решений кинетической модели. В открытых стационарных РИС указанные функции зависят от скоростей потока в реакторе и описываются линейными алгебраическими соотношениями [4, 5] вида q∑jαmjAj = = ${{q}^{0}}{{\Sigma }_{j}}{{\alpha }_{{mj}}}A_{j}^{0}$, где q и q0 − скорости потока на входе и выходе реактора. В открытых нестационарных РИС эти функции зависят также от времени и выражаются нелинейными соотношениями [6–8] вида q∑jαmjAj = ${{\Sigma }_{j}}{{\alpha }_{{mj}}}A_{j}^{0}$[q0 + (q − q0)exp(−qt)], где t − время. Последние равенства в общей форме описывают стехиометрические ЗС для химических реакций, протекающих в стационарных и нестационарных режимах в закрытых и открытых РИС. Для химических реакций, происходящих в открытых изотермических реакторах с продольной и радиальной диффузией реагентов (реакторах неполного смешения, РНС), эти функции выражаются через решения дифференциальных уравнений в частных производных (уравнений математической физики) [9, 10]. Такие уравнения, как правило, не решаются аналитически [11], и соответствующие им ЗС не всегда можно установить точно. При численном решении таких уравнений для расчета концентраций реагентов требуется знание конкретного вида кинетического закона (КЗ) стадий, обычно это закон действующих масс (ЗДМ), а также величин констант скоростей элементарных стадий механизма реакции. Соответственно, рассчитанные теоретически распределения концентраций реагентов и ЗС тоже будут определяться только приближенно. В связи с этим представляет интерес исследовать ЗС для химических реакций с произвольной кинетикой, протекающих в открытом РНС с учетом диффузий реагентов. В настоящее время в литературе описаны точные ЗС для химических реакций на основе ЗДМ, протекающих в реакторах идеального смешения и вытеснения [4–8] без учета диффузии. Учет более общих (неидеальных) КЗ и влияния диффузии (модель РНС) на кинетические закономерности химических реакций представляет собой значительно более сложную задачу, связанную с существованием пространственно-неоднородных распределений концентраций реагентов (диссипативных структур, ДС), возможность возникновения которых отмечалось еще в первых работах по моделированию РНС [12, 13]. В монографиях [4, 9, 10, 14, 15] показано, что макрокинетические модели типа “реакция + диффузия” в виде дифференциальных уравнений в частных производных могут демонстрировать различные ДС (стоячие, бегущие, квазистохастические и др. волны). В трехмерном пространстве такие структуры представляют собой волнистые поверхности, напоминающие по форме горы, овраги, морскую рябь и др., а ЗС можно наблюдать в виде горизонтальных плоскостей (полный “штиль”), что удобно для их экспериментальной проверки. Опубликованные в последнее время работы [16−19 и др.] отражают неослабевающий интерес к проблемам неидеальной макрокинетики. Так, в [16] для химической реакции с двумя промежуточными веществами проанализирована роль неидеальности диффузионных потоков и показано, что в таких системах образуются новые типы ДС. В [17] исследована гидродинамическая устойчивость реакционной зоны восстановительного реактора. Обнаружено, что при фильтрации жидкости в дисперсном восстановителе формируются ДС, интенсифицирующее процессы тепломассопереноса, которые влияют на устойчивую работу реактора. В [18] проведены ударные испытания поликристаллической меди и установлено, что существует пороговая скорость деформации, выше которой формируются ДС в виде локализованных областей сетчатого вида, разделенных полосами пластического сдвига. В работе [19] разработан метод анализа ЗС для реакций, протекающих по ЗДМ в РНС с продольной и радиальной диффузией. Найдены приближенные соотношения между концентрациями реагентов, остающиеся практически постоянными во времени и пространстве (квазиинварианты). Такой метод развивает макрокинетические подходы Д.А. Франк-Каменецкого [9] для приближенного исследования временных и пространственных характеристик распределенных систем. Целью настоящей работы является дальнейшее развитие данного направления исследований с учетом возможного отклонения КЗ от ЗДМ и установление ЗС для химических реакций с произвольной кинетикой, протекающих в стационарном режиме в открытом изотермическом РНС, с учетом продольной и радиальной диффузий реагентов. В этом реакторе ЗС представляют собой ДС (многомерные функции от концентраций реагентов в разных точках реактора), зависящие от стехиометрии механизма реакции и коэффициентов диффузии реагентов. Такие ЗС и ДС могут быть использованы при решении обратной задачи (ОЗ) химической кинетики [20–22], связанной с идентификацией стадийных механизмов химических реакций.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Рассмотрим химическую реакцию, протекающую через элементарные стадии:
(I)
$\sum\limits_j^{} {{{a}_{{ij}}}{{{\mathbf{A}}}_{j}}} = \sum\limits_j^{} {{{b}_{{ij}}}{{{\mathbf{A}}}_{j}}} ,\,\,\,\,i = 1, \ldots ,s,\,\,\,\,j = {\text{ }}1, \ldots ,n,$(1)
$\begin{gathered} q(\partial {{A}_{j}}{\text{/}}\partial x + \partial {{A}_{j}}{\text{/}}\partial y) = \\ = \;\sum\limits_i^{} {({{b}_{{ij}}} - {{a}_{{ij}}}){{r}_{i}} + {{D}_{j}}({{\partial }^{2}}{{A}_{j}}{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}{{A}_{j}}{\text{/}}\partial {{y}^{2}})} , \\ j = {\text{ }}1, \ldots ,n, \\ \end{gathered} $Система уравнений (1), (2), назовем ее исходной, состоит из n взаимосвязанных нелинейных по концентрациям реагентов уравнений, каждое из которых зависит от стехиометрии стадий механизма реакции (I), скорости потока в реакторе, коэффициентов диффузии реагентов и, что особенно важно для решения обратной задачи по идентификации предполагаемых механизмов реакций − от вида КЗ их стадий. Решения этой системы описывают ДС (пространственные распределения концентраций) в открытом изотермическом стационарном РНС с двумерной диффузией реагентов. Непосредственное исследование такой системы сопряжено с математическими трудностями, и ее решение в общем случае не может быть найдено точно [11]. Воспользуемся для расчета ЗС более простыми уравнениями, которые следуют из исходной системы и выражают необходимые условия существования ЗС. Построим такие уравнения и найдем соответствующие пространственные распределения концентраций в зависимости от степени открытости реактора (скорости потока) и соотношений между коэффициентами диффузии реагентов.
Для закрытого реактора (q = 0) в отсутствие диффузии (Dj = 0) с учетом ЗС атомов реагентов и соотношений между скоростями стадий из уравнений (1), (2) следуют точные линейные алгебраические соотношения, связывающие различные независимые стехиометрические комплексы концентраций реагентов:
(3)
$\begin{gathered} {{K}_{m}}(x,y) \equiv \sum\limits_j^{} {{{\alpha }_{{mj}}}{{A}_{j}}(x,y) = \sum\limits_j^{} {{{\alpha }_{{mj}}}A_{j}^{0} \equiv K_{m}^{0}} } , \\ m = 1,2, \ldots ,N, \\ \end{gathered} $Для открытого реактора (q > 0) в отсутствие диффузии (Dj = 0) из исходных уравнений (1), (2) с учетом (3) следуют максимально “укороченные” уравнения относительно тех же комплексов (3) концентраций реагентов:
(4)
$\partial {{K}_{m}}{\text{/}}\partial x + \partial {{K}_{m}}{\text{/}}\partial y = 0,\,\,\,\,m = {\text{ }}1,2, \ldots ,N.$Эта система уравнений качественно отличается от (1) тем, что состоит из меньшего числа N < n, независимых друг от друга, и от вида КЗ стадий однотипных (подобных друг другу) уравнений относительно N неизвестных комплексов. Это означает, что порядок этой системы уравнений может быть понижен до минимума, и для ее решения достаточно решить только одно из них. Точное решение [4, 11] любого из них можно записать в виде Km(x, y) = $K_{m}^{0}$, откуда с учетом (3) следует ∑jαmjAj(x, y) = ${{\Sigma }_{j}}{{\alpha }_{{mj}}}A_{j}^{0}$, а решения остальных уравнений имеют такой же вид, т.е. совпадают с комплексами (3).
Для открытого реактора с равномерной диффузией (Dj = D ≠ 0) из (1)−(3) следуют более общие дифференциальные уравнения, связывающие те же комплексы (3):
(5)
$\begin{gathered} q(\partial {{K}_{m}}{\text{/}}\partial x + \partial {{K}_{m}}{\text{/}}\partial y) = D({{\partial }^{2}}{{K}_{m}}{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}{{K}_{m}}{\text{/}}\partial {{y}^{2}}), \\ m = 1,2, \ldots ,N. \\ \end{gathered} $Эта система тоже состоит из меньшего числа независимых друг от друга и от вида КЗ стадий однотипных уравнений, число которых равно числу неизвестных, и для ее решения достаточно решить одно из них. Анализ показал, что эти уравнения не решаются точно, но их приближенные численные решения, выражающие ЗС в открытом РНС с равномерной диффузией, практически совпадают с соответствующими точными решениями (3) в РНС без диффузии. Таким образом, в открытом РНС комплексы вида (3) сохраняются до тех пор, пока коэффициенты диффузии остаются равными. Далее комплексы вида (3) будем называть диффузионно-однородными.
Для открытого реактора с неравномерной диффузией (Dj ≠ D) из (1)−(3) следуют более общие дифференциальные уравнения, связывающие комплексы вида (3) с другим видом комплексов, зависящих от коэффициентов диффузии реагентов:
(6)
$\begin{gathered} q(\partial {{K}_{m}}{\text{/}}\partial x{\text{ }} + \partial {{K}_{m}}{\text{/}}\partial y) = {{\partial }^{2}}{{M}_{m}}{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}{{M}_{m}}{\text{/}}\partial {{y}^{2}}, \\ m = 1,2, \ldots ,N, \\ \end{gathered} $Приведенные выше соотношения показывают, что в открытом РНС с ростом дифференциации коэффициентов диффузии реагентов линейные стехиометрические законы и соответствующие им комплексы концентраций реагентов существенно изменяются. Диффузионно-однородные комплексы находятся точно, а диффузионно-неоднородные комплексы могут быть рассчитаны только приближенно. На трехмерных графиках зависимостей от длины и радиуса реактора однородные и неоднородные комплексы отражаются полностью и представляют собой ДС в виде горизонтальных плоскостей и кривых поверхностей, соприкасающиеся вблизи начала реактора. На двухмерных графиках зависимостей от длины или радиуса (соответственно при постоянном радиусе или длине) могут быть показаны только различные сечения (плоские проекции) этих структур, которые выглядят как горизонтальные или кривые линии, касающиеся друг друга вблизи начала реактора.
При решении ОЗ для проверки соответствия предполагаемого механизма реакции экспериментальным данным нужно измерить значения концентраций реагентов в любых точках или сечениях реактора (например, в начале и на выходе) и вычислить отклонения от теоретических значений, найденных с помощью ЗС при равномерной и неравномерной диффузии. Если все отклонения будут меньше ошибок измерений, то данный механизм согласуется с экспериментальными данными и адекватно описывает кинетические закономерности протекания реакции. В противном случае исследуемый механизм реакции не отвечает экспериментальным данным. При этом требуется рассмотреть другой механизм с установлением его ЗС, определением с помощью ЗС значений концентраций реагентов в любых точках или сечениях реактора и вычислением их отклонений от экспериментальных значений. Для повышения достоверности выводов рекомендуется проверять ЗС в различных точках реактора и при разных начальных условиях.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Рассмотрим реакцию вида А = С + D (реакцию распада, разложения, диссоциации и т.п.), которая предположительно может протекать по различным альтернативным механизмам. Пусть первый предполагаемый механизм имеет вид
(II)
${\text{i}})\,\,{\mathbf{A}} = {\mathbf{B}},~\,\,\,\,{\text{ii}})\,\,{\mathbf{B}} = {\mathbf{C}} + {\mathbf{D}}.$Запишем для этого механизма уравнения вида (1) для открытого изотермического РНС:
(1.1)
$\begin{gathered} q(\partial A{\text{/}}\partial x + \partial A{\text{/}}\partial y) = - {{r}_{1}} + {{D}_{A}}({{\partial }^{2}}A{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}A{\text{/}}\partial {{y}^{2}}), \\ q(\partial B{\text{/}}\partial x + \partial B{\text{/}}\partial y) = \\ = \,\,{{r}_{1}} - {{r}_{2}} + {{D}_{B}}({{\partial }^{2}}B{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}B{\text{/}}\partial {{y}^{2}}), \\ q(\partial C{\text{/}}\partial x + \partial C{\text{/}}\partial y) = {{r}_{2}} + {{D}_{C}}({{\partial }^{2}}C{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}C{\text{/}}\partial {{y}^{2}}), \\ q(\partial D{\text{/}}\partial x + \partial D{\text{/}}\partial y) = {{r}_{2}} + {{D}_{D}}({{\partial }^{2}}D{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}D{\text{/}}\partial {{y}^{2}}), \\ \end{gathered} $Из соотношений между скоростями стадий в исходных уравнениях (1.1) следует, что в закрытом РНС без диффузии для механизма (II) выполняются два (P = 2, N = 4 – 2 = 2) точных независимых ЗС вида (3), образующих два точных независимых диффузионно-однородных комплекса концентраций реагентов:
(1.2)
$\begin{gathered} {{K}_{1}}\left( {x,y} \right) \equiv A\left( {x,y} \right) + B\left( {x,y} \right) + C\left( {x,y} \right) = \\ = {{A}^{0}} + {{B}^{0}} + {{C}^{0}}, \\ {{K}_{2}}(x,y) \equiv С(x,y) - D(x,y) = {{C}^{0}} - {{D}^{0}}. \\ \end{gathered} $При естественных н. у. реакции A0 = 1, B0 = C0 = = D0 = 0 они принимают вид:
(1.3)
$\begin{gathered} {{K}_{1}}\left( {x,y} \right) \equiv A + B + C = {\text{ }}1, \\ {{K}_{2}}\left( {x,y} \right) \equiv C - D = {\text{ }}0. \\ \end{gathered} $В открытом РНС с равномерной диффузией из уравнений (1.1) следуют два уравнения вида (5), связывающие два эти диффузионно-однородных комплекса:
(1.4)
$\begin{gathered} q(\partial {{K}_{1}}{\text{/}}\partial x + \partial {{K}_{1}}{\text{/}}\partial y) = {{\partial }^{2}}{{K}_{1}}{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}{{K}_{1}}{\text{/}}\partial {{y}^{2}}, \hfill \\ q(\partial {{K}_{2}}{\text{/}}\partial x + \partial {{K}_{2}}{\text{/}}\partial y) = {{\partial }^{2}}{{K}_{2}}{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}{{K}_{2}}{\text{/}}\partial {{y}^{2}}. \hfill \\ \end{gathered} $Эта система отличается от (1.1) тем, что состоит из меньшего числа 2 < 4 независимых друг от друга и от вида КЗ стадий однотипных уравнений относительно двух неизвестных комплексов. Как было отмечено выше, для ее решения достаточно решить одно из них. Решим, например, первое K1(x, y) = $K_{1}^{0}$, откуда с учетом (1.2) следует K1(x, y) ≡ ≡ A(x, y) + B(x, y) + C(x, y) = A0 + B0 + C0. Тогда решение второго из уравнений (1.4) отличается только выражением для комплекса и имеет вид K2(x, y) ≡ С(x, y) − D(x, y) = C0− D0. Как видно, оба эти комплекса совпадают с (1.2), и соответствующие им ДС, полученные в результате решения уравнений (1.4), показаны на рис. 1а.
Рис. 1.
Распределение комплексов концентраций реагентов по длине и радиусу РНС для механизма (II) при q = 0.1: a − для равномерной диффузии DA = DB = DC = DD = 0.1, рассчитанных с по уравнениям (1.4); б–г − для неравномерной диффузии DA = 0.1, DB = 0.2, DC = 0.3, DD = 0.4, рассчитанных по уравнениям (1.1) по ЗДМ при различных скоростях стадий: б − k1 = 0.1, k−1 = 0, k2 = 0.3, k−2 = 0; в − k1 = 1, k−1 = 0, k2 = 3, k−2 = 0; г − k1 = 10, k−1 = 0, k2 = 30, k−2 = 0.
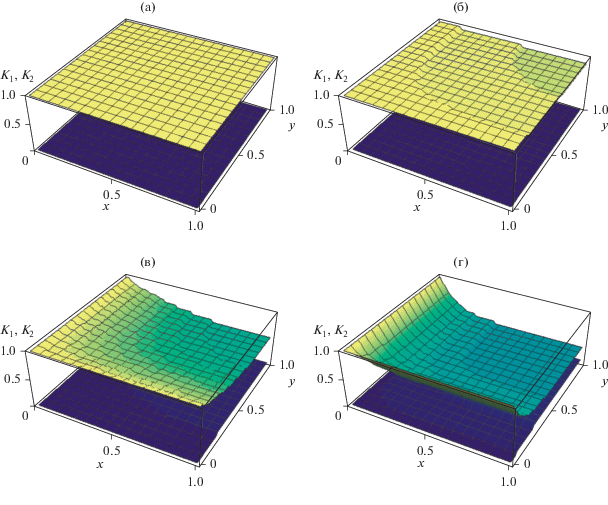
В открытом РНС с неравномерной диффузией из уравнений (1.1) следуют уравнения вида (6), связывающие соответствующие диффузионно-однородные и неоднородные комплексы:
(1.5)
$\begin{gathered} q(\partial {{K}_{1}}{\text{/}}\partial x + \partial {{K}_{1}}{\text{/}}\partial y) = {{\partial }^{2}}{{M}_{1}}{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}{{M}_{1}}{\text{/}}\partial {{y}^{2}}, \hfill \\ q(\partial {{K}_{2}}{\text{/}}\partial x + \partial {{K}_{2}}{\text{/}}\partial y) = {{\partial }^{2}}{{M}_{2}}{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}{{M}_{2}}{\text{/}}\partial {{y}^{2}}, \hfill \\ \end{gathered} $Сопоставим теоретические значения с экспериментальными (модельными) данными. Пусть на выходе реактора в его центральной точке (x = 1, y = 0) измерены концентрации реагентов A ≈ 0.90, B ≈ 0.06, C ≈ 0.01 и D ≈ 0.01 с ошибкой 10%. Подставим эти значения в выражения для однородных комплексов (1.3) и найдем отклонения экспериментальных значений K1 ≈ 0.97 и K2 ≈ 0.00 от теоретических ΔK1 ≈ 1 − 0.97 = 0.03 (3%) и ΔK2 ≈ 0 − 0.00 (0%). Уточним эти выводы с помощью неоднородных комплексов. Из рис. 1б видно, что в кинетической области комплекс K1 ≈ 1 определен с погрешностью ΔK1 ≈ 10%, а ΔK2 ≈ 0 найден практически точно. Среднее отклонение по четырем замерам составляет Δ = (3 + 0 + 10 + 0)/4 = 3.25%. Из рис. 1в, 1г видно, что в диффузионной области соответствующие отклонения достигают 50% и более, т.е. превышают ошибки измерений. Следовательно, механизм (II) согласуется с ЗС при любых соотношениях между коэффициентами диффузии и может адекватно описывать кинетику реакции (II) только в кинетической и близкой к ней областях при ошибках измерений концентраций реагентов, превышающих 10%.
Рассмотрим второй возможный механизм этой же реакции А = С + D:
(III)
${\text{i}})\,\,{\text{A}} = {\text{B}} + {\text{С}},~\,\,\,\,{\text{ii}})\,\,{\text{B}} = {\text{D}},$(2.1)
$\begin{gathered} q(\partial A{\text{/}}\partial x + \partial A{\text{/}}\partial y) = - {{r}_{1}} + {{D}_{A}}({{\partial }^{2}}A{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}A{\text{/}}\partial {{y}^{2}}),~ \\ q(\partial B{\text{/}}\partial x + \partial B{\text{/}}\partial y) = \\ = \,\,{{r}_{1}} - {{r}_{2}} + {{D}_{B}}({{\partial }^{2}}B{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}B{\text{/}}\partial {{y}^{2}}), \\ q(\partial C{\text{/}}\partial x + \partial C{\text{/}}\partial y) = {{r}_{1}} + {{D}_{C}}({{\partial }^{2}}C{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}C{\text{/}}\partial {{y}^{2}}), \\ q(\partial D{\text{/}}\partial x + \partial D{\text{/}}\partial y) = {{r}_{2}} + {{D}_{D}}({{\partial }^{2}}D{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}D{\text{/}}\partial {{y}^{2}}). \\ \end{gathered} $Эта система также включает четыре взаимосвязанных уравнения, которые зависят от вида КЗ стадий. Из соотношений между скоростями стадий в уравнениях (2.1) следует, что в закрытом РНС без диффузии для механизма (III) выполняются два (P = 2, N = 4 – 2 = 2) других точных независимых ЗС вида (3), представляющих собой точные независимые диффузионно-однородные комплекса концентраций реагентов:
(2.2)
$\begin{gathered} {{K}_{1}}\left( {x,y} \right) \equiv A\left( {x,y} \right) + B\left( {x,y} \right) + D\left( {x,y} \right) = \\ = {{A}^{0}} + {{B}^{0}} + {{D}^{0}},~~ \\ {{K}_{2}}\left( {x,y} \right) \equiv С\left( {x,y} \right) + A\left( {x,y} \right) = {{C}^{0}} + {{A}^{0}}.~~ \\ \end{gathered} $Эти комплексы при тех же н. у. A0 = 1, B0 = C0 = = D0 = 0 примут вид:
(2.3)
$\begin{gathered} {{K}_{1}}\left( {x,y,t} \right) \equiv A + B + D = 1, \\ {{K}_{2}}\left( {x,y,t} \right) \equiv C + A = 1. \\ \end{gathered} $В открытом РНС с равномерной диффузией реагентов из уравнений (2.1) следуют два уравнения вида (5), связывающие два эти однородные комплекса:
(2.4)
$\begin{gathered} q(\partial {{K}_{1}}{\text{/}}\partial x + \partial {{K}_{1}}{\text{/}}\partial y) = {{\partial }^{2}}{{K}_{1}}{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}{{K}_{1}}{\text{/}}\partial {{y}^{2}}, \hfill \\ q(\partial {{K}_{2}}{\text{/}}\partial x + \partial {{K}_{2}}{\text{/}}\partial y) = {{\partial }^{2}}{{K}_{2}}{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}{{K}_{2}}{\text{/}}\partial {{y}^{2}}. \hfill \\ \end{gathered} $Данная система совпадает по форме с (1.4), но отличается от нее значениями выражений для комплексов, которые определяются соотношениями (2.2). Ее решения на основе уравнений (2.4) совпадают с (2.2), и соответствующие ДС показаны на рис. 2а.
Рис. 2.
Распределение комплексов концентраций реагентов по длине и радиусу РНС для механизма (III) при q = 0.1: a − для равномерной диффузии DA = DB = DC = DD = 0.1, рассчитанных по уравнениям (2.4); б − для неравномерной диффузии DA = 0.1, DB = 0.2, DC = 0.3, DD = 0.4, рассчитанных по уравнениям (2.1) по ЗДМ при k1 = 1, k−1 = 0, k2 = 3, k−2 = 0.

В открытом РНС с неравномерной диффузией из уравнений (2.1) следует:
(2.5)
$\begin{gathered} q(\partial {{K}_{1}}{\text{/}}\partial x + \partial {{K}_{1}}{\text{/}}\partial y) = {{\partial }^{2}}{{M}_{1}}{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}{{M}_{1}}{\text{/}}\partial {{y}^{2}}, \hfill \\ q(\partial {{K}_{2}}{\text{/}}\partial x + \partial {{K}_{2}}{\text{/}}\partial y) = {{\partial }^{2}}{{M}_{2}}{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}{{M}_{2}}{\text{/}}\partial {{y}^{2}},~~~ \hfill \\ \end{gathered} $Из рис. 2 видно, что закономерности распределения концентраций для механизма (III) аналогичны механизму (II). Сопоставим теоретические значения концентраций с теми же экспериментальными данными A ≈ 0.90, B ≈ 0.06, C ≈ 0.01 и D ≈ 0.01. Подставим эти значения в выражения (2.3) и найдем отклонения экспериментальных значений K1 ≈ 0.97 и K2 ≈ 0.91 от теоретических ΔK1 ≈ 1 − 0.97 = 0.03 (3%) и ΔK2 ≈ 1 − 0.91 = 0.09 (9%). Уточним эти выводы с помощью рис. 2б, из которого видно, что комплекс K1 ≈ 1 определен с погрешностью ΔK1 ≈ 8%, а комплекс K2 ≈ 1 − с погрешностью ΔK2 ≈ 10%. Среднее отклонение по четырем замерам составляет Δ = (3 + 9 + 8 + 10)/4 = = 7.5%. Следовательно, механизм (III) тоже применим при любых соотношениях между коэффициентами диффузии и ошибках измерений концентраций реагентов, превышающих 10%, но с учетом бóльших отклонений теоретических и экспериментальных значений менее вероятен по сравнению с механизмом (II).
Рассмотрим третий возможный механизм этой же реакции А = С + D:
(IV)
${\text{i}})\,\,{\text{A}} = 2{\text{B}},~\,\,\,\,{\text{ii}})\,\,{\text{B}} = {\text{С}},~\,\,{\text{iii}})\,\,{\text{B}} = {\text{D}}.$Запишем для него исходные уравнения:
(3.1)
$\begin{gathered} q(\partial A{\text{/}}\partial x + \partial A{\text{/}}\partial y) = - {{r}_{1}} + {{D}_{A}}({{\partial }^{2}}A{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}A{\text{/}}\partial {{y}^{2}}), \\ q(\partial B{\text{/}}\partial x + \partial B{\text{/}}\partial y) = \\ = 2{{r}_{1}} - {{r}_{2}} - {{r}_{3}} + {{D}_{B}}({{\partial }^{2}}B{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}B{\text{/}}\partial {{y}^{2}}), \\ q(\partial C{\text{/}}\partial x + \partial C{\text{/}}\partial y) = {{r}_{2}} + {{D}_{C}}({{\partial }^{2}}C{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}C{\text{/}}\partial {{y}^{2}}), \\ q(\partial D{\text{/}}\partial x + \partial D{\text{/}}\partial y) = {{r}_{3}} + {{D}_{D}}({{\partial }^{2}}D{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}D{\text{/}}\partial {{y}^{2}}). \\ \end{gathered} $Из уравнений (3.1) следует, что в закрытом РНС без диффузии для механизма (IV) выполняется только один (P = 3, N = 4 – 3 = 1) независимый ЗС вида (3) и соответствующий ему один точный независимый диффузионно-однородный комплекс концентраций реагентов:
(3.2)
$\begin{gathered} K\left( {x,y} \right) \equiv 2A\left( {x,y} \right) + B\left( {x,y} \right) + С\left( {x,y} \right) + D\left( {x,y} \right) = \\ = {\text{ }}2{{A}^{0}} + {{B}^{0}} + {{С}^{0}} + {{D}^{0}}. \\ \end{gathered} $Это равенство при тех же начальных условиях A0 = 1, B0 = C0 = D0 = 0 принимает вид:
В открытом РНС с равномерной диффузией из уравнений (3.1) следует одно уравнение вида (5) относительно этого однородного комплекса
(3.4)
$q(\partial K{\text{/}}\partial x + \partial K{\text{/}}\partial y) = {{\partial }^{2}}K{\text{/}}\partial {{x}^{2}} + {{\partial }^{2}}K{\text{/}}\partial {{y}^{2}},$Рис. 3.
Распределение комплексов концентраций реагентов по длине и радиусу РНС для механизма (IV) при q = 0.1: a − для равномерной диффузии DA = DB = DC = DD = 0.1, рассчитанных по уравнениям (3.4); б – для неравномерной диффузии DA = 0.1, DB = 0.2, DC = 0.3, DD = 0.4, рассчитанных по уравнениям (3.1) по ЗДМ при k1 = 1, k−1 = 0, k2 = 3, k−2 = 0, k3 = 1; k−3 = 1.

Из рис. 3 видно, что закономерности распределения концентраций для механизма (IV) аналогичны механизмам (II) и (III). Сопоставим теоретические значения концентраций с теми же экспериментальными данными A ≈ 0.90, B ≈ 0.06, C ≈ 0.01 и D ≈ 0.01. Подставим эти значения в выражения (3.3) и найдем отклонения экспериментальных значений K ≈ 1.88 от теоретических ΔK ≈ 2 − 1.88 = = 0.12 (6%). Уточним эти выводы с помощью рис. 3б, из которого видно, что комплекс K отклоняется от теоретического значения K = 2 на ΔK ≈ ≈ 2 − 1.80 = 0.20 (10%). Среднее отклонение по двум замерам составляет (6 + 10)/2 = 8%. Следовательно, при любых коэффициентах диффузии механизм (IV) характеризуется средними отклонениями и менее вероятен, чем механизмы (II) и (III).
ЗАКЛЮЧЕНИЕ
Рассмотрены законы сохранения (ЗС) для химических реакций, протекающих стационарно с произвольными кинетическими законами стадий в открытом изотермическом стационарном трубчатом реакторе неполного смешения (РНС) с учетом влияния массопереноса реагентов в продольном и радиальном направлениях. Исследованы следующие из ЗС диссипативные структуры (ДС) − распределения комплексов концентраций реагентов при различной интенсивности диффузии в кинетической и диффузионной областях. Показано, что эти ДС отличаются от аналогичных ДС в закрытом РНС по мере удаления от начала реактора, но совпадают с ними в начале реактора. В кинетической области при неравномерной диффузии реагентов эти ДС практически не отличаются от ДС в закрытом РНС с равномерной диффузией реагентов. В диффузионной области с ростом значений констант скоростей стадий ДС в закрытом РНС все больше отклоняются от ДС с равномерной диффузией и стабилизируются в конце реактора. Для реакции, протекающей по трем разным механизмам, установлены ЗС и построены трехмерные ДС, описывающие зависимости комплексов концентраций реагентов от длины и радиуса открытого РНС. Найденные ЗС и ДС использованы для проверки корректности предполагаемого механизма реакции с учетом диффузии реагентов.
Список литературы
Корзухин М.Д. // Журн. физ. хим. 1972. Т. 46. № 7. С. 1845.
Яблонский Г.С., Быков В.И., Горбань А.Н. Кинетические модели каталитических реакций. Новосибирск: Наука, 1983. 320 с.
Алексеев Б.В., Кольцов Н.И., Федотов В.Х. // Журн. физ. хим. 1992. Т. 66. № 12. С. 3219.
Быков В.И., Цыбенова С.Б. Нелинейные модели химической кинетики. Москва: URSS, 2011. 400 с.
Кольцов Н.И. // Кинетика и катализ. 2021. Т. 62. № 1. С. 3.
Кольцов Н.И. // Кинетика и катализ. 2020. Т. 61. № 4. С. 482.
Кольцов Н.И. // Теор. основы хим. технол. 2021. Т. 55. № 2. С. 210.
Кольцов Н.И. // Кинетика и катализ. 2021. Т. 62. № 1. С. 8.
Франк-Каменецкий Д.А. Основы макрокинетики. Диффузия и теплопередача в химической кинетике. Москва: Интеллект, 2008. 408 с.
Ванаг В.К. Диссипативные структуры в реакционно-диффузионных системах. Москва-Ижевск: ИКИ-РХД, 2008. 300 с.
Полянин А.Д. Справочник по линейным уравнениям математической физики. Москва: Физматлит, 2001. 576 с.
Turing A.M. The Chemical Basis of Morphogenesis. Philosoph. Transact. Royal Soc. London. Ser. B. Biolog. Sci. 1952. V. 237. № 641. P. 37.
Жаботинский А.М. Концентрационные автоколебания. Москва: Наука, 1974. 180 с.
Быков В.И. Моделирование критических явлений в химической кинетике. Москва: URSS, 2014. 328 с.
Bykov V.I., Tsybenova S.B., Yablonsky G.S. Chemical complexity via simple models. Berlin. New York: Germany. De Gruyter, 2018. 240 c.
Красильников В.В., Савотченко С.Е. // Хим. физика. 2004. Т. 23. № 12. С. 53.
Панченко С.В., Панченко Д.С., Глебова Н.Б. // Теор. основы хим. технол. // 2005. Т. 39. № 2. С. 146.
Мещеряков Ю.И., Жигачева Н.И., Диваков А.К., Макаревич И.П., Барахтин Б.К. // Хим. физика. 2007. Т. 26. № 12. С. 57.
Кольцов Н.И. // Известия ВУЗов. Химия и хим. технол. 2021. № 1. С. 41.
Исмагилова А.С., Спивак С.И. Обратные задачи химической кинетики, Saarbrucken: Lap Lambert Academic Publishing, 2013. 117 с.
Ягола A.Г., Янфей В., Степанова И.Э., Титаренко В.Н. Обратные задачи и методы их решения. Москва: Бином. Лаборатория знаний, 2014. 216 с.
Леонов А.С. Решение некорректно поставленных обратных задач: очерк теории, практические методы и демонстрации в МАТЛАБ. Москва: Либроком, 2016. 360 с.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


