Кинетика и катализ, 2022, T. 63, № 5, стр. 543-549
Антиоксидантная активность метано- и циклопентенофуллеренов
Л. Р. Якупова a, *, Д. Р. Диниахметова a, И. М. Сахаутдинов a, Р. Л. Сафиуллин a
a Уфимский Институт химии – обособленное структурное подразделение ФГБУН ФИЦ РАН
450054 Уфа, просп. Октября, 69, Республика Башкортостан, Россия
* E-mail: stargar@inbox.ru
Поступила в редакцию 25.03.2022
После доработки 26.04.2022
Принята к публикации 24.05.2022
- EDN: OHSZYE
- DOI: 10.31857/S0453881122050185
Аннотация
В модельной системе радикально-цепного окисления этилбензола измерена константа скорости реакции производных метано- и циклопентенофуллеренов (С60R) с пероксильным радикалом (PhCH(OO•)CH3). Исследованы соединения, в которых заместителем является додеценоат сукцинимида, связанный с молекулой фуллерена посредством групп –С(О)(СН2)n– или –(СН2)n–, где n = 1–5. Показано, что реакционная способность С60R по отношению к пероксильному радикалу этилбензола повышается по сравнению с незамещенным фуллереном С60. Производные метанофуллерена активнее вступают в реакцию с пероксильным радикалом, чем циклопентенофуллерены. Обнаружено, что с увеличением числа метиленовых групп (n) константа скорости реакции С60R с PhCH(OO•)CH3 уменьшается. Методом квантовохимического моделирования установлено, что атомы заместителя образуют водородные связи с пероксильным радикалом в переходных состояниях присоединения по ближайшим к заместителю атомам фуллеренильной части метанофуллерена. В результате снижается энергетический барьер реакции присоединения пероксильного радикала к фуллерену. По мере удаления додеценоата сукцинимида от молекулы фуллерена реакционная способность исследованных метано- и циклопентенофуллеренов по отношению к пероксильному падает.
ВВЕДЕНИЕ
Интерес к производным фуллерена связан с тем, что они обладают различными видами биологической активности, в том числе антиоксидантным свойством [1–3]. Незамещенный фуллерен является слабым антиоксидантом, обрывающим цепь окисления. Константа скорости реакции (fk7) пероксильных радикалов кумола c C60 составляет 310 л моль–1 с–1 (303 К) [4]. В то же время обнаружено, что антиоксидантная активность эпоксида фуллерена в два раза выше по сравнению с исходным соединением [5, 6]. Введение в молекулу фуллерена заместителей также приводит к увеличению скорости реакции полученного соединения с пероксильными радикалам [2, 4–7]. Это наблюдалось не только для циклопентенофуллерена с заместителем, проявляющим антиоксидантную активность, например, ионолом [4], но и для фуллерена, содержащего малеопимароимидный фрагмент, который таким свойством не обладает [7]. Показано, что введение аминокислотного заместителя в молекулу фуллерена С60 способствует повышению его ингибирующей активности [2]. При этом механизм антиоксидантного действия не связан с переносом атома водорода от аминокислотных групп. Следовательно, заместитель каким-то образом влияет на свойства фуллерена, увеличивая скорость его реакции с пероксильным радикалом. В настоящей работе исследованы на наличие антиоксидантной активности новые соединения – метано- и циклопентенофуллерены, в которых заместителем является додеценоат сукцинимида, связанный с молекулой фуллерена посредством групп –С(О)(СН2)n– или –(СН2)n–, где n = 1–5. Рассмотрена зависимость константы скорости fk7 от того, как близко от молекулы фуллерена расположен заместитель, т.е. от параметра n.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Этилбензол (ЭБ) очищали по методике, описанной в работе [8]. 2,2'-Азо-бис-изобутиронитрил (АИБН) и хлорбензол очищали согласно [9]. Окисление этилбензола кислородом воздуха осуществляли при температуре 333 К. Кинетические опыты проводили в стеклянном реакторе, в который загружали этилбензол, термостатировали и затем добавляли раствор инициатора в хлорбензоле. Через ~10 мин вносили тестируемый образец в растворе хлорбензола. За поглощением кислорода следили с помощью универсальной манометрической дифференциальной установки. Скорость поглощения кислорода в жидкой фазе рассчитывали по методике, описанной в работе [10]. Объем газовой фазы составлял 33 мл, объем реакционной смеси – 3.2 мл.
В качестве инициатора окисления использовали 2,2'-азо-бис-изобутиронитрил (АИБН). Скорость инициирования рассчитывали по формуле: wi = 2ekр[АИБН], где kр – константа скорости распада инициатора, е – вероятность выхода радикалов в объем, [АИБН] – концентрация инициатора. Константа скорости распада АИБН в этилбензоле lgkр = = 15.4 – 130.5/θ [c–1], θ = 2.303RT × 10–3 кДж/моль, 2e = 1.2 [11]. Концентрация раствора АИБН в хлорбензоле составляла 6.2 × 10–2 моль/л, в реакционную смесь (3 мл) добавляли 0.2 мл раствора АИБН.
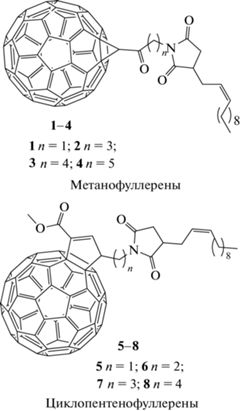
Исследована антиоксидантная активность метано- и циклопентенофуллеренов, в которых заместителем является додеценоат сукцинимида, связанный с молекулой фуллерена группой ‒С(О)(СН2)n– или –(СН2)n– (стуктурные формулы представлены на схеме 1. Соединения различаются количеством метиленовых групп: n = 1–5. Элементный анализ выполнен с помощью автоматического элементного анализатора CHNS/О Euro EA3000 (“Hekatech”, Германия) [12]. Метанофуллерен 1. Найдено, %: С 91.22; Н 2.80; N 1.33. C79H29NO3. Вычислено, %: C 91.23; H 2.81; N 1.35. Метанофуллерен 2. Найдено, %: С 91.10; Н 3.12; N 1.32. C81H33NO3. Вычислено, %: C 91.08; H 3.11; N 1.31. Метанофуллерен 3. Найдено, %: С 91.07; Н 3.28; N 1.29. C82H35NO3. Вычислено, %: C 91.01; H 3.26; N 1.29. Метанофуллерен 4. Найдено, %: С 90.96; Н 3.39; N 1.26. C83H37NO3. Вычислено, %: C 90.94; H 3.40; N 1.28. Циклопентенофуллерен 5. Найдено, %: С 89.85; H 3.02; N 1.30. C82H33NO4. Вычислено, %: С89.85; H 3.03; N 1.28. Циклопентенофуллерен 6. Найдено, %: С 89.82; H 3.19; N 1.28. C83H35NO4. Вычислено, %: С 89.80; H 3.18; N 1.26. Циклопентенофуллерен 7. Найдено, %: С 89.76; H 3.31; N 1.26. C84H37NO4. Вычислено, %: С 89.74; H 3.32; N 1.25. Циклопентенофуллерен 8. Найдено, %: С 89.71; H 3.46; N 1.24. C85H39NO4. Вычислено, %: С 89.69; H 3.45; N 1.23.
Схема 1. Структурные формулы метанофуллеренов и циклопентенофуллеренов.
Квантовохимические расчеты выполнены в программе Priroda 09 [13] методом PBE/3z [14]. Данный метод хорошо описывает как энергетические, так и геометрические характеристики фуллерена С60 и его производных, что было показано ранее в работах [15–18]. Оптимизацию строения исследуемых структур проводили без ограничения на симметрию. Тепловые эффекты реакций (ΔH°) и энтальпии активации реакций (ΔH≠) оценивали в виде разности абсолютных стандартных энтальпий H° продуктов реакции и исходных частиц. Все энергетические параметры рассчитывали для температуры 298 К. Тип стационарных точек на поверхности потенциальной энергии исследуемой системы (минимум, седловая точка) устанавливали на основании расчета матрицы Гессе. Спиновая плотность рассчитана по Хиршфильду.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Ингибированное производным фуллерена жидкофазное окисление этилбензола в условиях нашего эксперимента (333 K, wi = 4.1 × 10–8 моль л–1 с–1) протекает по радикально-цепному механизму [19] (схема 2):
(i)
${\text{АИБН}}~\xrightarrow{{{{k}_{I}}}}{{r}^{ \bullet }}\xrightarrow{{{\text{RH}}}}{\text{Ph}}{{{\text{C}}}^{ \bullet }}{\text{(H)C}}{{{\text{H}}}_{{\text{3}}}},$(I)
${\text{Ph}}{{{\text{C}}}^{ \bullet }}({\text{H)C}}{{{\text{H}}}_{3}} + {{{\text{O}}}_{{\text{2}}}}\xrightarrow{{{{k}_{1}}}}{\text{PhCH(O}}{{{\text{O}}}^{{{ \bullet }}}}{\text{)C}}{{{\text{H}}}_{{\text{3}}}},$(II)
$\begin{gathered} {\text{PhCH(O}}{{{\text{O}}}^{{{ \bullet }}}}{\text{)C}}{{{\text{H}}}_{{\text{3}}}} + {\text{PhC}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{{\text{3}}}} \to \\ \xrightarrow{{{{k}_{2}}}}{\text{PhCH}}\left( {{\text{OOH}}} \right){\text{C}}{{{\text{H}}}_{{\text{3}}}} + {\text{Ph}}{{{\text{C}}}^{{{ \bullet }}}}{\text{(H)C}}{{{\text{H}}}_{{\text{3}}}}, \\ \end{gathered} $(VI)
$\begin{gathered} {\text{PhCH(O}}{{{\text{O}}}^{{{ \bullet }}}}{\text{)C}}{{{\text{H}}}_{{\text{3}}}} + {\text{PhCH(O}}{{{\text{O}}}^{{{ \bullet }}}}{\text{)C}}{{{\text{H}}}_{{\text{3}}}} \to \\ \xrightarrow{{{{k}_{6}}}}{\text{молекулярные продукты,}} \\ \end{gathered} $(VII)
$\begin{gathered} {\text{PhCH(O}}{{{\text{O}}}^{{{ \bullet }}}}{\text{)C}}{{{\text{H}}}_{3}} + {{{\text{С}}}_{{{\text{60}}}}}{\text{R}} \to \\ \xrightarrow{{{{k}_{7}}}}{\text{PhCH(OO}}{{{\text{С}}}_{{{\text{60}}}}}^{{{ \bullet }}}{\text{R)C}}{{{\text{H}}}_{{\text{3}}}}, \\ \end{gathered} $(VIII)
$\begin{gathered} {\text{PhCH(OO}}{{{\text{С}}}_{{{\text{60}}}}}^{{{ \bullet }}}{\text{R)C}}{{{\text{H}}}_{3}} + {\text{PhCH(O}}{{{\text{O}}}^{{{ \bullet }}}}{\text{)C}}{{{\text{H}}}_{3}} \to \\ \xrightarrow{{{{k}_{8}}}}{\text{молекулярные продукты}}{\text{.}} \\ \end{gathered} $Схема 2. Механизм радикально-цепного окисления этилбензола на неглубоких стадиях.
На рис. 1 и 2 представлены типичные кинетические кривые поглощения кислорода при окислении этилбензола в присутствии исследуемых образцов. Для количественной оценки эффективности ингибирования была получена зависимость скорости окисления этилбензола (w) от концентрации исследуемого вещества. Установлено, что с увеличением концентрации исследуемых соединений w снижается (рис. 3, табл. 1 и 2). Константы скорости реакции (fk7) пероксильного радикала этилбензола с С60R находили при помощи уравнения (1) [20]:
(1)
$F = {{w}_{0}}{{w}^{{ - 1}}}--w{{\left( {{{w}_{0}}} \right)}^{{ - 1}}} = f{{k}_{7}}\left[ {{\text{InH}}} \right]{\text{ }}{{\left( {2{{k}_{6}}{{w}_{{\text{i}}}}} \right)}^{{ - 0.5}}},$Рис. 1.
Типичные кинетические кривые расходования кислорода, полученные при инициированном окислении этилбензола: 1 – без ингибитора, 2 – в присутствии метанофуллерена 3 (4.4 × 10–5 моль/л), 3 – в присутствии метанофуллерена 1 (4.6 × 10–5 моль/л). Условия реакции: [ЭБ] = 5.1 моль/л, wi = 4.1 × 10–8 моль л–1 с–1, 333 К.

Рис. 2.
Типичные кинетические кривые расходования кислорода, полученные при инициированном окислении этилбензола: 1 – без ингибитора, 2 – в присутствии циклопентенофуллерена 8 (4.2 × 10–4 моль/л), 3 – в присутствии циклопентенофуллерена 5 (4.4 × × 10–4 моль/л). Условия реакции: [ЭБ] = 5.1 моль/л, wi = 4.1 × 10–8 моль л–1 с–1, 333 К.

Рис. 3.
Зависимость начальной скорости окисления этилбензола от концентрации циклопентенофуллерена 5 (1) и ее преобразование в координатах уравнения (1) (2). Условия реакции: [ЭБ] = 5.1 моль/л, wi = = 4.1 × 10–8 моль л–1 с–1, 333 К.

Таблица 1.
Зависимость скорости окисления этилбензола от концентрации метанофуллерена и константы скорости реакции fk7*
| С60R | [С60R] × 10–4, моль/л | w × 10–7, моль л–1 с–1 | fk7, л моль–1 с–1 |
|---|---|---|---|
| ** | 0 | 5.1 | ** |
| 1 | 0.9 | 2.2 | (18.3 ± 2.9) × 103 |
| 1.4 | 2.0 | ||
| 1.8 | 1.6 | ||
| 2.3 | 1.6 | ||
| 4.6 | 1.5 | ||
| 2 | 0.4 | 4.5 | (11.0 ± 0.5) × 103 |
| 2.1 | 2.2 | ||
| 3.0 | 1.8 | ||
| 8.5 | 0.9 | ||
| 3 | 0.4 | 4.0 | (8.0 ± 0.7) × 103 |
| 1.3 | 3.2 | ||
| 2.2 | 2.8 | ||
| 3.1 | 2.2 | ||
| 3.5 | 1.0 | ||
| 4 | 0.4 | 5.2 | (5.8 ± 0.7) × 103 |
| 1.3 | 4.3 | ||
| 2.6 | 3.1 | ||
| 3.5 | 2.3 |
Таблица 2.
Зависимость скорости окисления этилбензола от концентрации циклопентенофуллерена и константы скорости реакции fk7*
| С60R | [С60R] × 10–4, моль/л | w 10–7, моль л–1 с–1 | fk7, л моль–1 с–1 |
|---|---|---|---|
| ** | 0 | 5.1 | ** |
| 5 | 1.3 | 2.6 | (9.9 ± 0.6) × 103 |
| 2.6 | 1.9 | ||
| 4.4 | 1.3 | ||
| 6.6 | 1.0 | ||
| 6 | 2.2 | 3.4 | (5.2 ± 1.5) × 103 |
| 3.0 | 2.4 | ||
| 4.3 | 2.6 | ||
| 8.6 | 2.0 | ||
| 12.9 | 1.8 | ||
| 7 | 0.4 | 4.5 | (5.8 ± 0.9) × 103 |
| 1.3 | 3.6 | ||
| 2.1 | 3.4 | ||
| 3.0 | 3.3 | ||
| 8 | 3.4 | 3.2 | (2.0 ± 0.2) × 103 |
| 4.2 | 3.1 | ||
| 8.4 | 3.0 | ||
| 21.1 | 1.4 |
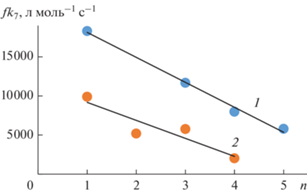
Зависимость скорости окисления этилбензола (w) от концентрации С60R преобразовывали в координатах уравнения (1). На рис. 3 представлен пример такой обработки. Полученные значения константы скорости ингибирования (fk7) приведены в табл. 1 и 2, из которых видно, что по мере увеличения количества метиленовых групп, разделяющих фуллерен и заместитель, величина fk7·снижается (рис. 4). Так как заместитель не является антиоксидантом, предполагается, что в обрыве цепи окисления принимает участие фуллерен. Известно, что незамещенный фуллерен взаимодействует с пероксильным радикалом этилбензола с константой скорости fk7 = 4.6 × × 103 л моль–1 с–1 [22]. Для большинства исследованных в настоящей работе соединений эта константа выше. Отсюда следует, что заместитель влияет на молекулу фуллерена и увеличивает его реакционную способность по отношению к пероксильному радикалу этилбензола. Ранее это было отмечено для фуллерена, содержащего малеопимаримидный заместитель [7].
Рис. 4.
Зависимость константы скорости ингибирования fk7 от числа метиленовых групп, разделяющих фуллерен и заместитель. 1 – метанофуллерены, 2 – циклопентенофуллерены.
По данным исследования [23] повышение реакционной способности фуллерена по отношению супероксид аниону кислорода связано с наличием малонильного заместителя. Образование водородной связи между супероксид анионом кислорода и протонами карбоксильных групп заместителя приводит к росту константы скорости гибели ${\text{О}}_{2}^{{ \bullet - }}$. В свете этого мы предполагаем, что и в нашем случае увеличение реакционной способности С60R по отношению к пероксильным радикалам связано с тем, что заместитель оказывает воздействие на реакцию PhCH(OO•)CH3 с производным фуллерена. По мере возрастания числа метиленовых групп, разделяющих заместитель и фуллерен, это влияние снижается.
Для выяснения причины влияния заместителя на антиоксидантную активность фуллерена были произведены квантово-химические расчеты присоединения пероксильного радикала этилбензола к метанофуллерену с числом метиленовых групп равным 1 и 5 (соединения 1 и 4).
Известно, что в фуллерене С60 все атомы углерода имеют одинаковую реакционную способность и пероксильные радикалы присоединяются с достаточно большими энергетическими барьерами (для Ph(CH3)2COO• энтальпия активации равна 21.6 кДж/моль и для tBuOO• – 25.6 кДж/моль [24], для этилбензольного пероксильного радикала – 14.4 кДж/моль). Однако в метанофуллерене происходит нарушение псевдоароматичности [25], поэтому реакционная способность атомов углерода в фуллеренильной части различна в зависимости от их удаленности от заместителя. Из литературных данных [26] известно, что присоединение радикалов к метанофуллеренам протекает с образованием не менее 7 изомеров. Методом ЭПР-спектроскопии было показано, что радикал присоединяется по ближайшим к заместителю двойным связям. Для определения строения аддуктов присоединения пероксильного радикала этилбензола к метанофуллерену, образование которых наиболее выгодно с энергетической точки зрения, было проведено моделирование присоединения PhCH(OO•)CH3 по 8 атомам углерода фуллереновой части метанофуллерена, которые в разной степени удалены от заместителя (на рис. 5 показано строение метанофуллерена 1 и указаны атомы, по которым велось присоединение; энергетические характеристики реакции присоединения приведены в табл. 3).
Рис. 5.
Строение метанофуллерена 1, расположение атомов, по которым велось присоединение этилбензольного пероксильного радикала (нумерация дана согласно ИЮПАК [27]).
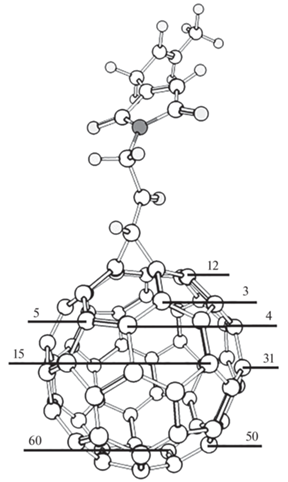
Таблица 3.
Энергетические характеристики присоединения этилбензольного пероксильного радикала к метанофуллеренам 1 и 4
| Атом | Метанофуллерен | |||
|---|---|---|---|---|
| 1 | 4 | |||
| ΔН, кДж/моль | ΔН≠, кДж/моль | ΔН, кДж/моль | ΔН≠, кДж/моль | |
| 3 | –37.1 | 2.9* | –37.1 | 2.8* |
| 4 | –16.9 | 12.3* | –23.7 | 12.2* |
| 5 | –27.8 | 9.2* | –23.5 | 12.7* |
| 12 | –34.7 | 7.2* | –32.7* | 6.5* |
| 15 | –25.8 | 11.6* | –24.4 | 15.2 |
| 31 | –22.9 | 14.0 | –23.0 | 14.1 |
| 50 | –21.5 | 14.8 | –21.2 | 17.6 |
| 60 | –15.3 | 17.1 | –14.4 | 20.3 |
Из табл. 3 видно, что присоединение по ближайшим к заместителю атомам (3, 4, 5, 12) имеет меньший барьер, чем по атомам, более отдаленным от заместителя (31, 50, 60). При этом присоединение по ближайшему к заместителю метанофуллеренов 1 и 4 атому 3 имеет барьер практически в 5 раз меньше, чем к С60. Данный факт объясняется образованием водородных связей между кислородом пероксильного радикала и атомами водорода заместителя, а также нарушением псевдоароматичности фуллеренильной части метанофуллеренов, особенно вблизи заместителя. Наибольшее значение энтальпии активации характерно для присоединения этилбензольного пероксильного радикала по самому отдаленному от заместителя атому углерода (60), причем барьер реакции выше, чем для присоединения к фуллерену С60.
Наблюдаются и различия в реакционной способности метанофуллеренов, отличающихся числом СН2-групп заместителя. Энтальпии активации присоединения пероксильного радикала к метанофуллерену с одной СН2-группой в основном меньше, чем к метанофуллерену с пятью СН2-группами, кроме присоединения: 1) по атому 12, где, наоборот, барьер для присоединения к 1 больше на 0.7 кДж/моль, чем к 4; 2) по атомам 3, 4, 31 – барьеры примерно равны. По-видимому, практически одинаковые барьеры по атомам 3 и 4 объясняются наличием водородных связей в переходных состояниях. Наиболее отчетливо различия видны для присоединения по отдаленным от заместителя атомам метанофуллеренов 1 и 4, где прослеживается лишь влияние числа СН2-групп. В данном случае образование водородных связей между пероксильным радикалом и заместителем невозможно. Как и ожидалось, среди рассмотренных метанофуллеренов бóльшую реакционную способность по отношению к PhCH(OO•)CH3 имеет метанофуллерен 1 по сравнению с 4. Этот факт подтверждается меньшими барьерами реакций присоединения, в том числе по отдаленным атомам (барьер присоединения по атому 60 метанофуллерена 1 на 3.2 кДж/моль меньше, чем к метанофуллерену 4). Различие барьеров присоединения по атому 15 объясняется наличием водородных связей при присоединении к 1. Однако для присоединения к метанофуллеренам по отдаленным от заместителя положениям появляется барьер больший, чем для присоединения к С60 (к 1 – для атомов 50 и 60, к 4 – для атомов 15, 50, 60). Так, в случае присоединения пероксильного радикала этилбензола к атому 60 метанофуллерена 1 энергетический барьер на 2.7 кДж/моль больше, чем для свободного фуллерена, а в случае метанофуллерена 4 это разница составляет 5.9 кДж/моль.
Таким образом, среди исследованных в настоящей работе соединений метанофуллерен 1 является самым реакционноспособным по отношению к пероксильному радикалу (характеризуется меньшими барьерами присоединения пероксильного радикала). По-видимому, данный факт обусловлен большим влиянием заместителя и нарушением псевдоароматичности. Присоединение радикалов вероятнее всего по ближайшим к заместителю атомам углерода фуллеренильной части.
ЗАКЛЮЧЕНИЕ
Измерена константа скорости реакции пероксильного радикала этилбензола с метано- и циклопентенофуллеренами. Показано, что введение заместителя увеличивает способность фуллерена присоединять пероксильный радикал. Производные метанофуллерена активнее вступают в реакцию с пероксильным радикалом, чем циклопентенофуллерены. По мере удаления заместителя (додеценоат сукцинимида) от молекулы фуллерена константа скорости реакции уменьшается. Предположено, что повышение реакционной способности фуллерена по отношению к пероксильным радикалам этилбензола связано с влиянием заместителя. На примере метанофуллерена методом квантовохимического моделирования установлено, что за счет образования водородных связей между кислородами пероксильного радикала и атомами водорода заместителя в переходных состояниях и нарушения псевдоароматичности фуллеренильной части, особенно вблизи заместителя, снижается энергетический барьер реакции. В результате облегчается присоединение пероксильного радикала к фуллерену. Заметнее всего это проявляется для производного метанофуллерена, в котором додеценоат сукцинимида наименее удален от фуллерена.
Список литературы
Grebowski J., Konopko A., Krokosz A., DiLabio G.A., Litwinienko G. // Free Rad. Biol. Med. 2020. V. 160. P. 734.
Волков В.А., Воронков М.В., Сажина Н.Н., Курилов Д.В., Вохмянина Д.В., Ямскова О.В., Мартиросян Ю.Ц., Атрошенко Д.Л., Мартиросян Л.Ю., Романова В.С. // Кинетика и катализ. 2021. Т. 62. № 3. P. 343.
Sharoyko V.V., Ageev S.V., Podolsky N.E., Petrov A.V., Litasova E.V., Vlasov T.D., Vasina L.V., Murin I.V., Piotrovskiy L.B., Semenov K.N. // J. Mol. Liq. 2021. V. 323. P. 114990.
Enes R.F., Tomé A.C., Cavaleiro J.A.S., Amorati R., Fumo M.G., Pedulli G.F., Valgimigli L. // Chem. Eur. J. 2006. V. 12. № 17. P. 4646.
Cataldo F. // Chem. Phys. Lipids. 2010. V. 163. № 6. P. 524.
Matsubayashi K., Goto T., Kyoko Togaya K., Kokubo K., Oshima T. // Nanoscale Res. Lett. 2008. V. 3. № 8. P. 237.
Якупова Л.Р., Сахаутдинов И.М., Маликова Р.Н., Сафиуллин Р.Л. // Кинетика и катализ. 2019. Т. 60. № 1. С. 25. (Yakupova L.R., Sakhautdinov I.M., Malikova R.N., Safiullin R.L. // Kinet. Catal. 2019, V. 60. № 1. P. 21.)
Якупова Л.Р., Сахаутдинова Р.А., Фаттахов А.Х., Гимадиева А.Р., Сафиуллин Р.Л. // Кинетика и катализ. 2013. Т. 54. № 3. С. 291. (Yakupova L.R., Fattakhov A.Kh., Gimadieva A.R., Safiullin R.L., Sakhautdinova R.A. // Kinet. Catal., 2013, V. 54. № 3. P. 279.)
Якупова Л.Р., Иванова А.В., Сафиуллин Р.Л., Гимадиева А.Р., Чернышенко Ю.Н., Мустафин А.Г., Абдрахманов И.Б. // Изв. Акад. наук. Сер. хим. 2010. № 3. С. 507. (Yakupova L.R., Ivanova A.V., Safiullin R.L., Gimadieva A.R., Chernyshenko Yu.N., Mustafin A.G., Abdrakhmanov I.B., Russ. Chem. Bull., 2010, V. 59. № 3. P. 517.)
Якупова Л.Р., Проскуряков С.Г., Зарипов Р.Н., Рамеев Ш.Р., Сафиуллин Р.Л. // Бутлеров. сообщ. 2011. Т. 28. № 19. С. 71. (Yakupova L.R., Proskuryakov S.G., Zaripov R.N., Rameev Sh.R., Safiullin R.L., Butlerov. Soobshch., 2011, V. 28. № 19. P. 71.)
Кулицки З.И., Терман Л.М., Цепалов В.Ф., Шляпинтох В.Я. // Изв. АН СССР. Сер. хим. 1963. № 2. С. 253. (Kulitski Z.I., Terman L.M., Tsepalov V.F., Shlyapintokh V.Ya., Izv. Akad. Nauk SSSR, Ser. Khim., 1963. № 2. P. 253.)
Исламова А.Ф. Дис … канд. хим. наук. Уфа: УфИХ УФИЦ РАН, 2022. ((Diss. … cand. chem. sciences. Ufa: UIC UFRS RAS, 2022).
Лайков Д.Н., Устынюк Ю.А. // Изв. Акад. наук. Сер. хим. 2005. № 3. С. 804.
Perdew J.P., Burke K., Ernzerhof M. // Phys. Rev. Lett. 1996. V. 77. P. 3865.
Diniakhmetova D.R., Friesen A.K., Kolesov S.V. // Int. J. Quant. Chem. 2020. V. 120. № 18. e26335.
Diniakhmetova D.R., Friesen A.K., Kolesov S.V. // Int. J. Quant. Chem. 2016. V. 116. № 7. P. 489.
Sabirov D.Sh., Bulgakov R.G. // Comput. Theor. Chem. 2011. V. 963. № 1. P. 185.
Sabirov D.Sh., Bulgakov R.G. // Chem. Phys. Lett. 2011. V. 506. № 1–3. P. 52.
Галимов Д.И., Газеева Д.Р., Мухамедьярова Р.К., Булгаков Р.Г. // Вестник БашГУ. 2012. Т. 17. № 4. С. 1671.
Денисов Е.Т., Азатян В.В. Ингибирование цепных реакций. Черноголовка: Изд-во РАН, 1997. 266 с.
Цепалов В.Ф., Шляпинтох В.Я. // Кинетика и катализ. 1962. Т. 3. № 6. С. 870. (Tsepalov V.F., Shlyapintokh V.Ya., Kinet. Katal., 1962, V. 3. № 6. P. 870.)
Сафарова И.В., Шарипова Г.М., Нугуманова Э.Ф., Герчиков А.Я. // Вестник БашГУ. 2016. Т. 21. № 1. P. 37.
Ali S.S., Hardt J.I., Quick K.L., Kim-Han J.S., Erlanger B.F., Huang T.T., Epstein C.J., Dugan L.L. // Free Rad. Biol. Med. 2004. V. 37. № 8. P. 1191.
Sabirov D.Sh., Garipova R.R., Bulgakov R.G. // Fuller. Nanotub. Car. N. 2015. V. 23. № 12. P. 1051.
Knight B., Martín N., Ohno T., Ortí E., Rovira C., Veciana J., Vidal-Gancedo J., Viruela P., Viruela R., Wudl F. // J. Am. Chem. Soc. 1997. V. 119. № 41. P. 9871.
Туманский Б.Л., Нефедова М.Н., Башилов В.В., Солодовников С.П., Бубнов Н.Н., Соколов В.И. // Изв. Акад. наук. Сер. хим. 1996. № 12. С. 3015.
Godly E.W., Taylor R. // Pure Appl. Chem. 1997. V. 69. P. 1411.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ