Коллоидный журнал, 2019, T. 81, № 2, стр. 175-184
Молекулярно-динамическое моделирование электрически индуцированных конформационных изменений полиамфолитных полипептидов на поверхности золотой наночастицы
Н. Ю. Кручинин 1, *, М. Г. Кучеренко 1
1 Центр лазерной и информационной биофизики
Оренбургского государственного университета
460018 Оренбург, проспект Победы, 13, Россия
* E-mail: kruchinin_56@mail.ru
Поступила в редакцию 08.10.2018
После доработки 08.11.2018
Принята к публикации 06.11.2018
Аннотация
Методом молекулярной динамики исследованы изменения конформации полиамфолитных полипептидов на поверхности сферической золотой наночастицы при разных значениях поверхностной плотности заряда, в том числе в присутствии анионов эозина Y, адсорбированных на макроцепях. Определены равновесные конформации полиамфолитных полипептидов, адсорбированных на сферической золотой наночастице. Построены радиальные распределения концентрации атомов полиамфолитных полипептидов с дифференциацией по типам звеньев, а также адсорбированных на макроцепях анионов красителя на золотой наночастице при разных значениях поверхностной плотности заряда. Полученные результаты могут быть востребованы при создании и модификации сенсоров с перестраиваемой конформационной структурой макроцепей, таких как люминесцентно-оптический измеритель концентрации молекулярного (в том числе синглетного) кислорода, химические сенсоры на основе эффектов поверхностного плазмонного резонанса и гигантского комбинационного рассеяния.
1. ВВЕДЕНИЕ
Золотые наночастицы (НЧ) с находящимися на их поверхности полимерными молекулами находят широкое применение во многих областях биомедицинских исследований и в качестве элементов устройств наноэлектроники [1–9]. При этом заряженные золотые НЧ могут быть использованы как сами по себе [6–9], так и для модификации поверхностей сенсоров и электродов [9–13]. Особый интерес вызывает явление электрически индуцированных изменений конформации пептидов, расположенных на поверхности золотых НЧ, применительно к созданию различных сенсоров. Например, в работе [9] исследовались индуцированные внешним электрическим полем изменения конформации додекапептидов, связанных с золотыми НЧ на наноструктурированной поверхности. Был предложен сенсор, с помощью которого протеинкиназа обнаруживалась по изменению интенсивности гигантского комбинационного рассеяния света из-за перестройки конформационной структуры фосфорилированного пептида, связанного с молекулой красителя, при различных значениях электрического поля [9].
Вызывает интерес использование золотых НЧ с адсорбированными на их поверхности макромолекулами полиамфолитов, связанных с молекулами органических красителей. Если изменять плотность электрического заряда на поверхности НЧ, то конформация полиамфолитов с разными законами распределения положительных и отрицательных звеньев в молекуле будет изменяться по-разному. Будет изменяться и характер расположения связанных с макроцепями молекул органических красителей. При этом заряженные звенья полиамфолита служат центрами адсорбции красителя, который находится в растворе в ионной форме [14, 15]. Такая гибридная наносистема может быть использована при создании люминесцентно-оптического измерителя концентрации молекулярного кислорода [16–18].
В люминесцентно-оптическом измерителе концентрации молекулярного (в том числе синглетного) кислорода в качестве рабочего элемента используется наносистема, представляющая собой макромолекулу, имеющую в своей структуре фотоактивные центры (связанные молекулы красителей) и адсорбированную на сферической НЧ, нанотрубке или в нанопоре [16–18].
Неоднородное распределение красителя, связанного с макромолекулой, оказывает существенное влияние на кинетику двухстадийных фотореакций с участием электронно-возбужденных молекул красителя и кислорода, которые могут протекать в слое полимера. При лазерной активации системы часть молекул красителей переходят в возбужденное триплетное состояние. В приповерхностном слое молекулярный кислород диффундирует относительно свободно. На первой стадии происходит тушение молекул в триплетном состоянии невозбужденным кислородом. В результате возникают электронно-возбужденные синглетные состояния молекул кислорода, при этом часть из них может вступать в реакцию с молекулами красителей в триплетном состоянии, избежавшими тушения на первой стадии. В результате на второй стадии молекулы красителя из триплетного состояния переходят в первое возбужденное синглетное состояние, поэтому эта стадия сопровождается замедленной флуоресценцией. В [16–18] было показано, что характер распределения молекул красителей будет оказывать существенное влияние на протекание двухстадийных реакций в такой наносистеме, и от этого будет зависеть форма импульсного сигнала замедленной флуоресценции.
В качестве элемента указанного люминесцентно-оптического сенсора можно использовать золотую НЧ, на поверхности которой адсорбирована полиамфолитная макромолекула, “несущая” молекулы красителя. При изменении плотности электрического заряда изменится конформация полиамфолита. Это приведет к существенному изменению характера протекания двухстадийных реакций в данной наносистеме и, как следствие, к изменению формы временнóй зависимости интенсивности замедленной флуоресценции.
Поэтому целью данной работы является исследование электрически индуцированной перестройки конформации полипептидов с разными законами распределения положительных и отрицательных звеньев, в том числе в присутствии органического красителя, на поверхности сферической золотой наночастицы.
2. РАСПРЕДЕЛЕНИЕ ЗВЕНЬЕВ МАКРОМОЛЕКУЛЫ НА ПОВЕРХНОСТИ НЕЗАРЯЖЕННОЙ СФЕРИЧЕСКОЙ НАНОЧАСТИЦЫ
Ранее было показано [14–18], что распределения концентрации атомов полипептида вблизи незаряженной поверхности адсорбента, полученные методом классической молекулярной динамики (полноатомная модель, включающая различные межатомные взаимодействия, в том числе электростатические), могут быть аппроксимированы зависимостями, полученными для идеальной макромолекулы с гауссовым распределением звеньев на основе специальной математической модели конформационной структуры полимера методами статистической теории макромолекул.
На поверхности адсорбента пространственное распределение звеньев идеальной макромолекулы в поле с потенциалом $V({\mathbf{r}})$ описывается следующим уравнением [19]:
(1)
$\left( {{{{{a}^{2}}} \mathord{\left/ {\vphantom {{{{a}^{2}}} 6}} \right. \kern-0em} 6}} \right){{\nabla }^{2}}{\psi }({\mathbf{r}}) = [{{(V({\mathbf{r}}) - {\lambda })} \mathord{\left/ {\vphantom {{(V({\mathbf{r}}) - {\lambda })} {kT}}} \right. \kern-0em} {kT}}]{\psi }({\mathbf{r}}),$На поверхности сферической НЧ радиальное распределение плотности звеньев макромолекулы находится из уравнения (1) в сферической системе координат [20]:
(3)
$\frac{{{{a}^{2}}}}{6}\frac{1}{{{{r}^{2}}}}\frac{\partial }{{\partial r}}{{r}^{2}}\frac{\partial }{{\partial r}}{\psi }(r) = \frac{{(V(r) - {\lambda })}}{{{{k}_{{\text{B}}}}T}}{\psi }(r),$В работе [20] было предложено использовать потенциал $V(r)$ в виде ${\delta }$ – функциональной ямы, моделирующей притяжение звеньев макромолекулы к поверхности НЧ, и с барьером в виде твердой стенки:
(4)
$V\left( r \right) = \left\{ \begin{gathered} - {\alpha \delta }\left( {r - {{r}_{0}}} \right),\,\,\,\,r > R \hfill \\ \infty ,\,\,\,\,r = R. \hfill \\ \end{gathered} \right.$Решение уравнения (3) с потенциалом (4) имеет вид
(5)
$\left\{ {\begin{array}{*{20}{c}} {{{{\psi }}_{{\text{I}}}} = A\frac{{{{e}^{{ - qr}}}({{e}^{{2qr}}} - {{e}^{{2qR}}})}}{{2qr}},\,\,\,\,R < r < {{r}_{0}}\,,} \\ {{{{\psi }}_{{{\text{II}}}}} = A\frac{{{{e}^{{ - qr}}}({{e}^{{2q{{r}_{0}}}}} - {{e}^{{2qR}}})}}{{2qr}},\,\,\,\,{{r}_{0}} < r < \infty ,} \end{array}} \right.$3. МОЛЕКУЛЯРНО-ДИНАМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
Были рассмотрены две следующие молекулярные системы:
1) полиамфолитный полипептид, расположенный на поверхности золотой НЧ,
2) полиамфолитный полипептид и 10 молекул (анионов) эозина Y, расположенные на поверхности золотой НЧ.
Молекулярно-динамическое моделирование (МД-моделирование) проводилось для этих молекулярных систем при различных значениях плотности заряда (σ) на поверхности золотой НЧ.
В стартовой конфигурации полиамфолитный полипептид располагался на небольшом расстоянии от поверхности НЧ. Макромолекула каждого полипептида была предварительно свернута в неравновесную клубковую структуру (рассматривались три разных стартовых клубка). Молекулы (анионы) красителя в начальный момент времени размещались вблизи полипептида. Вся система была помещена в куб со стороной 24 нм, заполненный молекулами воды.
Модель НЧ была получена путем вырезания шара радиусом 4 нм из кристалла золота (гранецентрированная кубическая решетка), аналогично [21]. Золотая НЧ заряжалась путем присваивания парциальных зарядов [22] ее поверхностным атомам. Были получены следующие значения поверхностной плотности заряда (индекс означает парциальный заряд одного атома на поверхности НЧ): ${{{\sigma }}_{0}} = 0,$ ${{{\sigma }}_{{ \pm 0.05}}} = \pm 0.9$ e/нм2, ${{{\sigma }}_{{ \pm 0.1}}} = \pm 1.8$ e/нм2, ${{{\sigma }}_{{ \pm 0.15}}} = \pm 2.7$ e/нм2.
Рассматривались три разных полиамфолитных полипептида, составленные из 100 аминокислотных остатков:
1) полипептид A90R5D5, состоящий из 90 аминокислотных остатков Ala (A, нейтральный), с равномерно распределенными 5 остатками Asp (D, заряд $ - 1e$) и 5 остатками Arg (R, заряд $ + 1e$) – AAAADAAAAAAAAARAAAAAAAAADAAAAAAA-AARAAAAAAAAADAAAAAAAAARAAAAAAAAA-DAAAAAAAAARAAAAAAAAADAAAAAAAAARA-AAAA,
2) полипептид A80R10D10, состоящий из 80 остатков Ala, с равномерно распределенными 10 остатками Asp и 10 остатками Arg – AADAAAARAAAADAAAARAAAADAAAARAAAA-DAAAARAAAADAAAARAAAADAAAARAAAADA-AAARAAAADAAAARAAAADAAAARAAAADAAA-ARAA,
3) полипептид A60R20D20, состоящий из 60 остатков Ala, с равномерно распределенными 10 парами (20 остатков) Asp и 10 парами (20 остатков) Arg – AADDAAARRAAADDAAARRAAADDAADAAARRAAADDAAARRAAADDAAARRAAADDAAARRAAADDAAARRAAADDAAARRA.
Анион красителя эозина Y $\left( {{{{\text{C}}}_{{{\text{20}}}}}{{{\text{H}}}_{{\text{6}}}}{\text{B}}{{{\text{r}}}_{{\text{4}}}}{\text{O}}_{{\text{5}}}^{{{\text{2--}}}}} \right)$ рассматривался без противоионов (противоионы нейтрализуют анионы эозина и препятствуют его адсорбции на заряженных звеньях макроцепи). Размер аниона эозина составляет примерно 1 нм; размеры аминокислотных остатков: Ala – около 0.4 нм, Arg – 0.9 нм, Asp – 0.5 нм.
В работе [14] было произведено МД-моделирование полипептидов в присутствии молекул родамина 6G (точнее – катионов ${{{\text{C}}}_{{{\text{28}}}}}{{{\text{H}}}_{{{\text{31}}}}}{{{\text{N}}}_{{\text{2}}}}{\text{O}}_{{\text{3}}}^{{\text{ + }}}$) на поверхности углеродной нанотрубки в вакууме и в воде. Было обнаружено, что при моделировании в вакууме катионы родамина 6G адсорбировались на макроцепях однородных полипептидов, состоящих как из отрицательно заряженных, так и нейтральных звеньев. Однако при МД-моделировании в воде в случае полипептида, состоящего из незаряженных аминокислотных остатков Ser, катионы родамина 6G адсорбировались непосредственно на углеродной нанотрубке, не связываясь с полипептидной цепью. Для того, чтобы получить наносистему, в которой краситель расположен на макроцепи, при МД-моделировании в воде использовали полипептиды, содержащие в цепи отрицательно заряженные звенья, на которых происходила адсорбция катионов родамина 6G [14]. Поэтому для исследования характера расположения полипептидов, в том числе связанных с красителем, на поверхности золотой НЧ необходимо проводить моделирование в воде.
МД-моделирование проводили с использованием программного комплекса NAMD 2.12 [23] при постоянной температуре 300 К (термостат Берендсена) с шагом по времени 0.001 пс в течение 15 нс. Данного времени было достаточно для получения равновесных конформаций полипептидов. Для контроля получения равновесных конформаций наблюдали за изменением среднеквадратичного расстояния между атомами полипептида в различных конформациях. Как правило, равновесие устанавливалось спустя 8–12 нс после начала моделирования. Атомы НЧ фиксировались. Использовали силовое поле CHARMM22 [24] для полипептидов и модель воды TIP3P [25]. Взаимодействие с золотой НЧ описывалось потенциалом Леннард-Джонса (потенциал 6–12) [21, 26], разработанным в работе [27]. Для эозина Y использовали силовое поле CHARMM General Force Field (CGenFF) [28, 29]. Потенциал Ван-дер-Ваальса обрезали на расстоянии 1.2 нм с помощью функции сглаживания между 1.0 и 1.2 нм. Электростатические взаимодействия рассчитывали непосредственно на расстоянии 1.2 нм, для бóльших расстояний использовали метод частица–сетка Эвальда (PME) [30] с шагом сетки 0.11 нм.
По результатам МД-моделирования на конечном стационарном участке траектории (в интервале от 12 до 15 нс с шагом 0.5 нс) рассчитывали среднее радиальное распределение атомов полипептида и красителя на поверхности НЧ:
где $dN(r,r + dr)$ – количество атомов на расстоянии $r$ от центра НЧ в слое $dr$. Для случая незаряженной золотой НЧ проводилась аппроксимация полученной средней на участке траектории радиальной концентрации атомов с помощью формул (2), (5), (6).4. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
4.1. МД-моделирование полиамфолитов на поверхности золотой наночастицы в отсутствие красителя при различных значениях поверхностной плотности заряда
МД-моделирование полипептидов A90R5D5, A80R10D10 и A60R20D20 (из трех разных стартовых клубков для каждого) на поверхности золотой НЧ в отсутствие красителя было проведено при разных значениях поверхностной плотности заряда: ${{{\sigma }}_{0}},$ ${{{\sigma }}_{{ \pm 0.05}}},$ ${{{\sigma }}_{{ \pm 0.1}}}$ и ${{{\sigma }}_{{ \pm 0.15}}}.$ На незаряженной поверхности НЧ [15] происходила адсорбция аминокислотных остатков полипептида вне зависимости от их типа. В случае заряженной поверхности НЧ по мере увеличения абсолютной величины плотности заряда для конечных конформаций наблюдалось перераспределение заряженных аминокислотных остатков полипептида: остатки, имеющие знак заряда одинаковый с поверхностью, удалялись от нее, а остатки с противоположным знаком адсорбировались на поверхности НЧ.
На рис. 1 представлены результаты МД-моделирования для одного варианта стартового клубка полипептида A80R10D10 при поверхностной плотности заряда, равной нулю (рис. 1а), и при ${{{\sigma }}_{{ + 0.15}}}$ (рис. 1б) и ${{{\sigma }}_{{ - 0.15}}}$ (рис. 1в).
Рис. 1.
Полипептид A80R10D10 (черным цветом изображены звенья ALA, темно-серым – ARG, светло-серым – ASP) на поверхности золотой НЧ после МД-моделирования при различных значениях поверхностной плотности заряда: (а) ${{{\sigma }}_{0}},$ (б) ${{{\sigma }}_{{ + 0.15}}},$ (в) ${{{\sigma }}_{{ - 0.15}}}.$
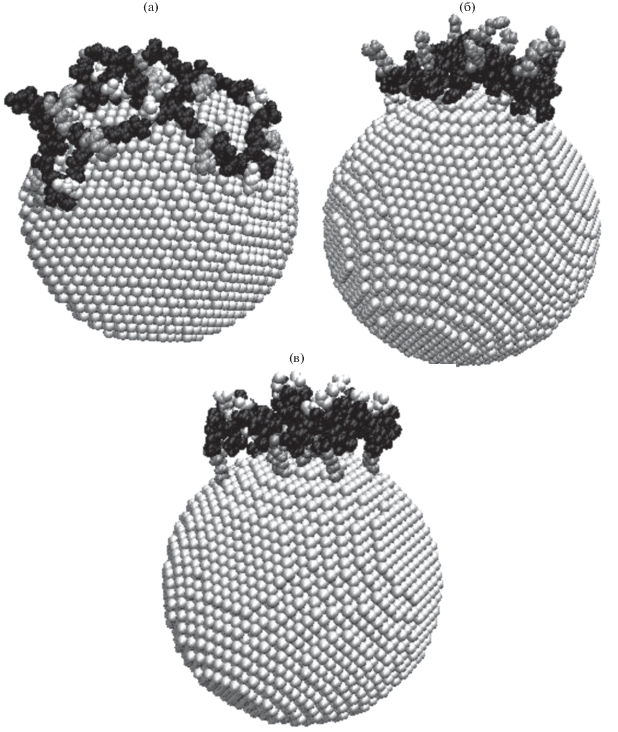
Были получены средние на участке траектории радиальные распределения концентрации атомов полипептида с дифференциацией по типам аминокислотных остатков (рис. 2). Для случая незаряженной НЧ с помощью формул (2), (5), (6) была построена кривая, аппроксимирующая радиальное распределение атомов полипептида без учета типа остатков (рис. 2а). Параметры аппроксимирующей кривой: ${{r}_{0}} = 4.3$ нм, $R = 4.0$ нм, $a = 0.5$ нм, $q = 1.61$ нм–1, ${\alpha } = 0.0056$ эВ нм. Как видно на рис. 2а, среднее радиальное распределение атомов полипептида хорошо аппроксимируется формулами (2), (5), (6), а средние радиальные распределения атомов звеньев разного типа в целом повторяют профиль радиальной концентрации атомов полипептида. Также можно отметить, что пик радиального распределения концентрации атомов аминокислотных остатков Arg выше, чем для того же количества остатков Asp. Это связано с тем, что остатки Arg состоят из вдвое большего количества атомов, чем остатки Asp (24 атома у Arg и 12 у Asp).
Рис. 2.
Средние на стационарном участке траектории радиальные распределения концентрации n(r) атомов полипептида A80R10D10 на поверхности золотой НЧ после МД-моделирования при различных значениях поверхностной плотности заряда: (а) ${{{\sigma }}_{0}},$ (б) ${{{\sigma }}_{{ + 0.15}}},$ (в) ${{{\sigma }}_{{ - 0.15}}}.$ Обозначения: pep – для атомов всего полипептида, ala, arg и asp – для атомов разных аминокислотных остатков; 1 – аппроксимирующая кривая, построенная по формулам (2), (5), (6) для n(r) полипептида.
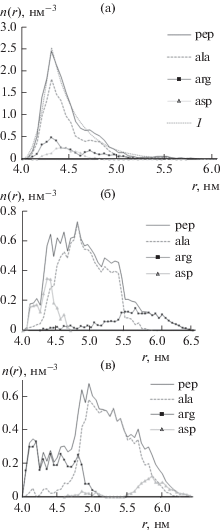
При МД-моделировании адсорбции полипептида A80R10D10 на заряженной НЧ по мере увеличения абсолютной величины поверхностной плотности заряда наблюдались существенные отличия от его адсорбции на незаряженной НЧ. При значениях плотности заряда, равных ${{{\sigma }}_{{ + 0.05}}}$ и ${{{\sigma }}_{{ - 0.05}}},$ профили радиальной концентрации атомов полипептида незначительно отличались от соответствующего профиля для нейтральной НЧ: пик концентрации находился на расстоянии 4.35 нм от центра НЧ. При значениях поверхностной плотности заряда ${{{\sigma }}_{{ \pm 0.1}}}$ и ${{{\sigma }}_{{ \pm 0.15}}}$ конформация полипептида значительно изменяется. При плотности заряда ${{{\sigma }}_{{ + 0.1}}}$ и ${{{\sigma }}_{{ + 0.15}}}$ (рис. 1б) все отрицательно заряженные звенья Asp находятся на поверхности НЧ, положительно заряженные звенья Arg максимально удалены от поверхности, а нейтральные звенья Ala располагаются между остатками Asp и Arg. На рис. 2б изображены профили средней радиальной концентрации атомов полипептида с дифференциацией по типам звеньев, которые соответствуют конформации, изображенной на рис. 1б. Эти зависимости значительно отличаются от полученных для случая незаряженной поверхности. Если поверхность золотой НЧ заряжена отрицательно, ${{{\sigma }}_{{ - 0.1}}}$ и ${{{\sigma }}_{{ - 0.15}}}$ (рис. 1в и 2в), то имеет место ситуация, зеркальная относительно положительно заряженной поверхности: остатки Arg находятся на поверхности НЧ, а остатки Asp максимально удалены от нее. При значениях поверхностной плотности заряда ${{{\sigma }}_{{ \pm 0.1}}}$ и ${{{\sigma }}_{{ \pm 0.15}}}$ профили радиальной концентрации сместились от поверхности НЧ и уже не имеют характерного максимума, как при адсорбции полипептида на незаряженной НЧ. Поэтому построить аппроксимирующие кривые согласно формулам (2), (5), (6) для распределений радиальной концентрации атомов полипептида при значениях плотности заряда ${{{\sigma }}_{{ \pm 0.1}}}$ и ${{{\sigma }}_{{ \pm 0.15}}}$ невозможно. При этих значениях σ толщина слоя полипептида A80R10D10 составила 2.5 нм.
Аналогичные результаты были получены в результате МД-моделирования полипептида A80R10D10 и при старте из других конформаций. Параметры кривой, аппроксимирующей радиальное распределение концентрации атомов полипептида вблизи незаряженной НЧ, усредненные по данным всех экспериментов, совпали с параметрами для случая первой стартовой конфигурации: ${{r}_{0}} = 4.3$ нм, $R = 4.0$ нм, $a = 0.5$ нм, $q = 1.61$ нм–1, ${\alpha } = 0.0056$ эВ нм [15]. Толщина макромолекулярного слоя при значениях поверхностной плотности заряда ${{{\sigma }}_{{ \pm 0.1}}}$ и ${{{\sigma }}_{{ \pm 0.15}}}$ в среднем равна 2.5 нм.
По результатам МД-моделирования адсорбции на незаряженной НЧ полипептида A90R5D5 исходя из трех его разных стартовых конформаций параметры кривой, аппроксимирующей усредненное по всем вариантам радиальное распределение атомов макроцепи, оказались такими же, как для полипептида A80R10D10: ${{r}_{0}} = 4.3$ нм, $R = 4.0$ нм, $a = 0.5$ нм, $q = 1.61$ нм–1, α = 0.0056 эВ нм. При моделировании адсорбции полипептида A90R5D5 на НЧ со значениями плотности заряда ${{{\sigma }}_{{ \pm 0.05}}}$ его конформация изменялась незначительно, а профили распределения концентрации атомов полипептида оказались сходными с профилями для случая незаряженной НЧ. Согласно данным моделирования, при значениях плотности заряда ${{{\sigma }}_{{ \pm 0.1}}}$ и ${{{\sigma }}_{{ \pm 0.15}}}$ все аминокислотные остатки A90R5D5 с противоположным поверхности знаком заряда находятся на НЧ, а с одноименным знаком заряда максимально удалены от нее. Толщина слоя полипептида A90R5D5 в среднем составила 3.5 нм.
Согласно результатам МД-моделирования адсорбции полипептида A60R20D20 из трех разных стартовых конформаций на незаряженной НЧ золота параметры кривой, аппроксимирующей усредненное по всем вариантам радиальное распределение атомов макроцепи, получились равными: ${{r}_{0}} = 4.3$ нм, $R = 4.0$ нм, $a = 0.5$ нм, $q = 1.02$ нм–1, ${\alpha } = 0.0048$ эВ нм. В случае заряженной НЧ, в отличие от полипептидов A80R10D10 и A90R5D5, перераспределение заряженных остатков A60R20D20 на поверхности НЧ начинается уже при ${{{\sigma }}_{{ \pm 0.05}}},$ что обусловлено значительно большим их числом в макромолекуле. Толщина слоя полипептида A60R20D20 на заряженной НЧ при значениях поверхностной плотности заряда, равных ${{{\sigma }}_{{ \pm 0.05}}},$ ${{{\sigma }}_{{ \pm 0.1}}}$ и ${{{\sigma }}_{{ \pm 0.15}}},$ составила 2.5 нм. Это значение совпадает с толщиной слоя полипептида A80R10D10, что объясняется одинаковым расстоянием между положительными и отрицательными аминокислотными остатками в их макроцепях.
4.2. МД-моделирование полиамфолитов в присутствии эозина Y на поверхности золотой наночастицы при различных значениях поверхностной плотности заряда
На втором этапе проводилось МД-моделирование полиамфолитных полипептидов A60R20D20 и A80R10D10 на золотой НЧ в присутствии 10 молекул (анионов) эозина при варьировании поверхностной плотности заряда НЧ. При этом использовались три разных стартовых клубка для каждого полипептида.
На рис. 3 изображены результаты моделирования полипептида A60R20D20 на поверхности золотой НЧ при старте из одной клубковой конформации при значениях поверхностной плотности заряда ${{{\sigma }}_{0}},$ ${{{\sigma }}_{{ + 0.15}}}$ и ${{{\sigma }}_{{ - 0.1}}}.$
Рис. 3.
Полипептид A60R20D20 (показан серым цветом) и анионы эозина (показаны черным цветом) на поверхности золотой НЧ после МД-моделирования при различной поверхностной плотности заряда: (а) ${{{\sigma }}_{0}},$ (б) ${{{\sigma }}_{{ + 0.15}}},$ (в) ${{{\sigma }}_{{ - 0.1}}}.$
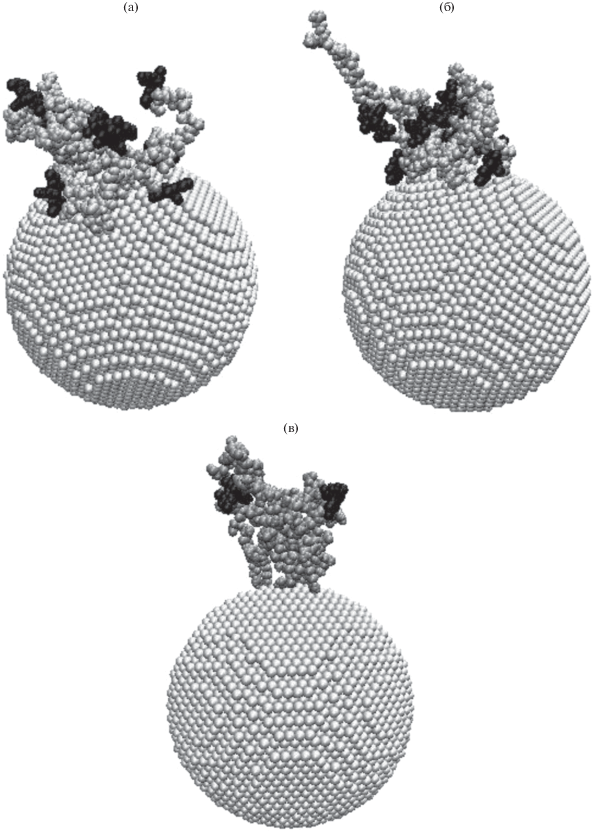
В случае незаряженной поверхности НЧ (рис. 3а) профиль радиальной концентрации атомов эозина схож с профилем радиальной концентрации атомов полипептида (рис. 4а) [15]. При этом анионы эозина в основном адсорбированы на макромолекуле вблизи положительно заряженных остатков Arg. Параметры кривой, аппроксимирующей распределение средней на участке траектории радиальной концентрации атомов полипептида на нейтральной поверхности НЧ (рис. 3а) без дифференциации по типам остатков равны: ${{r}_{0}} = 4.35$ нм, $R = 4.0$ нм, $a = 0.5$ нм, $q = 0.46$ нм–1, ${\alpha } = 0.0036$ эВ нм (рис. 4а), а при усреднении по всем проведенным МД-экспериментам получено, что ${{r}_{0}} = 4.35$ нм, $R = 4.0$ нм, $a = 0.5$ нм, $q = 0.7$ нм–1, ${\alpha } = 0.0039$ эВ нм.
Рис. 4.
Средние на стационарном участке траектории радиальные распределения концентрации n(r) атомов молекулы полипептида A60R20D20 и анионов эозина на поверхности золотой НЧ после МД-моделирования при различной поверхностной плотности заряда: (а) ${{{\sigma }}_{0}},$ (б) ${{{\sigma }}_{{ + 0.15}}},$ (в) ${{{\sigma }}_{{ - 0.1}}}.$ Обозначения: pep –для атомов всего полипептида, ala, arg и asp – для атомов разных аминокислотных остатков, eos – для атомов адсорбированных анионов эозина; 1 и 2 – аппроксимирующие кривые, построенные по формулам (2), (5), (6) для n(r) полипептида и красителя.
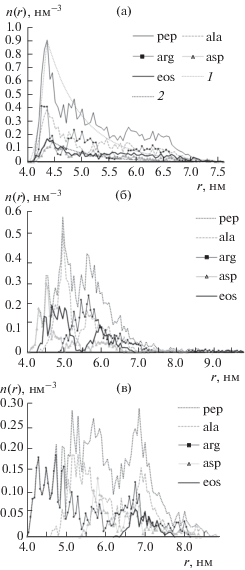
Параметры кривой, аппроксимирующей среднее на участке траектории радиальное распределение концентрации атомов эозина, адсорбированного на макроцепи (рис. 3а), равны: ${{r}_{0}} = 4.35$ нм, $R = 4.0$ нм, $a = 0.5$ нм, $q = 0.54$ нм–1, ${\alpha } = 0.0037$ эВ нм (рис. 4а), а усреднение результатов всех проведенных МД-экспериментов дает следующие значения: ${{r}_{0}} = 4.35$ нм, $R = 4.0$ нм, $a = 0.5$ нм, $q = 0.46$ нм–1, ${\alpha } = 0.0036$ эВ нм.
По мере роста абсолютного значения поверхностной плотности заряда НЧ изменялись конформация полипептида A60R20D20 и характер расположения анионов красителя.
В случае положительно заряженной НЧ (${{{\sigma }}_{{ + 0.05}}},$ ${{{\sigma }}_{{ + 0.1}}}$ и ${{{\sigma }}_{{ + 0.15}}}$) отрицательно заряженные аминокислотные остатки Asp смещаются к поверхности, а остатки Arg отдаляются от нее. Одна часть анионов эозина адсорбируется на поверхности НЧ, а другая находится рядом с остатками ARG (рис. 3б). В результате на кривых радиального распределения атомов красителя, адсорбированного на макроцепи, наблюдается формирование двух максимумов; при ${{{\sigma }}_{{ + 0.1}}}$ они находятся на расстоянии 4.95 и 6.05 нм от центра НЧ (рис. 4б), при ${{{\sigma }}_{{ + 0.15}}}$ – на расстоянии 4.65 и 5.95 нм.
Если НЧ заряжена отрицательно (${{{\sigma }}_{{ - 0.05}}},$ ${{{\sigma }}_{{ - 0.1}}}$ и ${{{\sigma }}_{{ - 0.15}}}$), остатки Asp отдаляются от ее поверхности. Часть звеньев Arg находится на поверхности, а другая часть, связанная с анионами эозина, удалена от нее (рис. 3в). При этом часть анионов эозина десорбировалась с макромолекулы (рис. 3в). В результате максимум радиального распределения концентрации атомов красителя, адсорбированного на макроцепи, расположился при ${{{\sigma }}_{{ - 0.1}}}$ на расстоянии 6.75 нм от центра НЧ (рис. 4в), а при ${{{\sigma }}_{{ - 0.15}}}$ – на расстоянии 7.4 нм.
При МД-моделировании адсорбции полипептида A60R20D20 из других стартовых клубков на поверхности золотой НЧ в присутствии эозина имеют место аналогичные изменения конформации макромолекулы и расположения анионов красителя.
В случае положительно заряженной поверхности НЧ наблюдаются два максимума на кривых распределения концентрации атомов анионов эозина, адсорбированных на макроцепи. Эти максимумы находятся в среднем на расстоянии 5.05 и 6 нм от центра НЧ при ${{{\sigma }}_{{ + 0.1}}},$ а при ${{{\sigma }}_{{ + 0.15}}}$ – на расстоянии 4.65 и 6 нм.
Когда поверхность НЧ заряжена отрицательно, на кривых распределения концентрации атомов эозина, адсорбированного на макроцепи, наблюдается один пик, который при ${{{\sigma }}_{{ - 0.1}}}$ в среднем находится на расстоянии 6.7 нм от центра НЧ, а при ${{{\sigma }}_{{ - 0.15}}}$ – на расстоянии 7 нм.
Аналогичные расчеты были проведены для полипептида A80R10D10 в присутствии эозина при различной плотности заряда на поверхности золотой НЧ. При этом, как правило, часть анионов эозина десорбировалась с макромолекулярной цепи в воду. Это связано с тем, что у A60R20D20 положительно заряженные звенья Arg, являющиеся центрами адсорбции, расположены попарно, а у A80R10D10 – по отдельности, и их в два раза меньше. При МД-моделировании совместного поведения A80R10D10 и красителя на нейтральной НЧ наблюдалось разбухание полипептида на поверхности и “выбрасывание” петель макроцепи из-за наличия на ней адсорбированных анионов эозина. Ширина профиля радиального распределения атомов полипептида в этом случае составила 4.45 нм, что значительно больше, чем в отсутствие красителя (2 нм, рис. 2а). Параметры кривой, аппроксимирующей среднее радиальное распределение концентрации атомов полипептида A80R10D10, значительно отличаются от полученных для аппроксимирующей кривой в отсутствие эозина: ${{r}_{0}} = 4.35$ нм, $R = 4.0$ нм, $a = 0.5$ нм, $q = 0.94$ нм–1, ${\alpha } = 0.0047$ эВ нм. При МД-моделировании системы A80R10D10–эозин–заряженная НЧ наблюдалась картина адсорбции, схожая с имевшей место в случае A60R20D20. Однако из-за более слабого связывания с макроцепью, бóльшая часть молекул эозина десорбировалась с полипептида. При этом в случае положительно заряженной поверхности НЧ они стремились адсорбироваться на ней, а в случае отрицательной – десорбировались в воду. Например, при ${{{\sigma }}_{{ - 0.15}}}$ анионы эозина полностью десорбировались с макроцепи.
ВЫВОДЫ
По результатам МД-моделирования полиамфолитных полипептидов на поверхности незаряженной наночастицы золота построены аппроксимирующие кривые для радиальных распределений концентрации атомов полипептида и красителя согласно выражениям (2), (5), (6), полученным методами статистической теории макромолекул. Распределения радиальной концентрации атомов отдельных аминокислотных остатков схожи с распределением концентрации атомов всей макроцепи.
В случае МД-моделирования полиамфолитов на заряженной НЧ по мере увеличения абсолютной величины поверхностной плотности заряда происходили значительные изменения конформации полиамфолита. Поэтому построение аппроксимирующих кривых для радиального распределения атомов макромолекулы на основе выражений (2), (5), (6) стало невозможным. По данным МД-моделирования полипептидов A80R10D10 и A90R5D5 при поверхностной плотности заряда ${{{\sigma }}_{{ \pm 0.05}}}$ конформация макромолекул изменялась незначительно по сравнению со случаем незаряженной поверхности. При значениях ${{{\sigma }}_{{ \pm 0.1}}}$ и ${{{\sigma }}_{{ \pm 0.15}}}$ происходила значительная перестройка конформационной структуры полиамфолита, при которой аминокислотные остатки со знаком заряда противоположным знаку заряда НЧ смещались к ее поверхности, а одноименно заряженные звенья максимально отдалялись от НЧ. Для полипептида A60R20D20 такая конформационная перестройка происходила уже при значениях ${{{\sigma }}_{{ \pm 0.05}}},$ что связано с большей линейной концентрацией заряженных аминокислотных остатков в макроцепи.
В результате МД-моделирования адсорбции полиамфолитов на незаряженной золотой НЧ в присутствии эозина установлено, что анионы красителя, как правило, адсорбировались на положительно заряженных звеньях полипептида (Arg). Профиль радиального распределения концентрации атомов эозина, адсорбированного на макроцепи, в этом случае был схож с профилем радиального распределения концентрации атомов полипептида. Параметры кривых, аппроксимирующих радиальное распределение концентрации атомов полипептида A60R20D20 в присутствии красителя и без него, практически совпадали. В то же время в случае полипептида A80R10D10 введение в моделируемую систему анионов эозина значительно изменило параметры аппроксимирующей кривой, что связано с меньшим содержанием заряженных звеньев в молекуле этого полипептида и влиянием адсорбированных на макроцепи анионов красителя.
При МД-моделировании систем полипептид–эозин по мере увеличения положительного заряда НЧ все большая часть анионов эозина смещалась к ее поверхности, а другая часть оставалась около положительно заряженных остатков Arg, которые удалены от одноименно заряженной НЧ. В этих случаях при значениях ${{{\sigma }}_{{ + 0.1}}}$ и ${{{\sigma }}_{{ + 0.15}}}$ формировались два пика на кривых радиального распределения атомов эозина, адсорбированного на макроцепи. Один из пиков соответствовал сместившимся к НЧ анионам красителя, а другой – его анионам, адсорбированным на остатках ARG. По мере увеличения абсолютного значения отрицательного заряда НЧ основная часть анионов эозина десорбировалась с макромолекулярной цепи в воду, а другая их часть максимально отдалялась от поверхности НЧ. При этом формировался один пик на кривой радиального распределения концентрации атомов эозина, который находился на большом расстоянии от НЧ.
Таким образом, под воздействием электрического поля зарядов на поверхности НЧ возможно изменение конформации полиамфолитов, а также характера расположения анионов красителя, адсорбированных на макроцепи. Такие структуры можно использовать при создании люминесцентно-оптического измерителя концентрации молекулярного (в том числе синглетного) кислорода с перестраиваемыми характеристиками. Кроме того, такие регулируемые макромолекулярные структуры могут найти применение в различных датчиках на основе эффектов поверхностного плазмонного резонанса и гигантского комбинационного рассеяния.
Список литературы
Yan X., Blacklock J., Li J., Möhwald H. // ACS Nano. 2012. V. 6. P. 111.
Monti S., Barcaro G., Sementa L., Carravetta V., Ågren H. // Nano Res. 2018. V. 11. P. 1757.
Schneider G., Decher G. // Langmuir. 2008. V. 24. P. 1778.
Bedford N.M., Hughes Z.E., Tang Z., Li Y., Briggs B.D., Ren Y., Swihart M.T., Petkov V.G., Naik R.R., Knecht M.R., Walsh T.R. // J. Am. Chem. Soc. 2016. V. 138. P. 540.
Kong F.-Y., Zhang J.-W., Li R.-F., Wang Z.-X., Wang W.-J., Wang W. // Molecules. 2017. V. 22. 1445.
Qiu T.A., Torelli M.D., Vartanian A.M., Rackstraw N.B., Buchman J.T., Jacob L.M., Murphy C.J., Hamers R.J., Haynes C.L. // Anal. Chem. 2017. V. 89. P. 1823.
Bajaj M., Pandey S.K., Nain T., Brar S.K., Singh P., Singh S., Wangoo N., Sharma R.K. // Colloids Surf. B. 2017. V. 158. P. 397.
Carnal F., Clavier A., Stoll S. // Polymers. 2016. V. 8. P. 203.
Chen Y., Cruz-Chu E.R., Woodard J., Gartia M.R., Schulten K., Liu L. // ACS Nano. 2012. V. 6. P. 8847.
Xu G., Wang G., Zhu Y., Chen L., He X., Wang L., Zhang X. // Biosens. Bioelectron. 2014. V. 59. P. 269.
You X., Lin W., Wu H., Dong Y., Chi Y. // Carbon. 2018. V. 127. P. 653.
Anraku Y., Takahashi Y., Kitano H., Hakari M. // Colloids Surf. B. 2007. V. 57. P. 61.
Diba F.S., Kim S., Lee H.J. // Catal. Today. 2017. V. 295. P. 41.
Кручинин Н.Ю., Кучеренко М.Г. // Хим. физика и мезоскопия. 2016. Т. 13. № 2. С. 225.
Кручинин Н.Ю., Кучеренко М.Г. // Сибирский физ. журн. 2018. Т. 13. № 2. С. 86.
Кучеренко М.Г., Измоденова С.В., Чмерева Т.М., Кручинин Н.Ю., Подрезова Н.С. // Вестник ОГУ. 2013. № 9. С. 100.
Kucherenko M.G., Izmodenova S.V., Kruchinin N.Yu., Chmereva T.M. // High Energy Chem. 2009. V. 43. P. 592.
Кучеренко М.Г., Русинов А.П., Чмерева Т.М., Игнатьев А.А., Кислов Д.А., Кручинин Н.Ю. // Оптика и спектроскопия. 2009. Т. 107. С. 510.
Гросберг А.Ю., Хохлов А.P. Статистическая физика макромолекул. М.: Наука, 1989.
Кучеренко М.Г., Чмерева Т.М. // Вестник ОГУ. 2008. № 9. С. 177.
Mhashal A.R., Roy S. // PLoS One. 2014. V. 9. 114152.
Shankla M., Aksimentiev A. // Nat. Commun. 2014. V. 5. P. 5171.
Phillips J.C., Braun R., Wang W., Gumbart J., Tajkhorshid E., Villa E., Chipot C., Skeel R.D., Kale L., Schulten K. // J. Comput. Chem. 2005. V. 26. P. 1781.
MacKerell A.D., Bashford D., Bellott M., Dunbrack R.L., Evanseck J.D., Field M.J., Fischer S., Gao J., Guo H., Ha S., Joseph-McCarthy D., Kuchnir L., Kuczera K., Lau F.T.K., Mattos C., Michnick S., Ngo T., Nguyen D.T., Prodhom B., Reiher W.E., Roux B., Schlenkrich M., Smith J.C., Stote R., Straub J., Watanabe M., Wiorkiewicz-Kuczera J., Yin D., Karplus M. // J. Phys. Chem. B. 1998. V. 102. P. 3586.
Jorgensen W.L., Chandrasekhar J., Madura J.D., Impey R.W., Klein M.L. // J. Chem. Phys. 1983. V. 79. P. 926.
Shao Q., Hall C.K. // Langmuir. 2016. V. 32. P. 7888.
Heinz H., Vaia R.A., Farmer B.L., Naik R.R. // J. Phys. Chem. C. 2008. V. 112. P. 17281.
Vanommeslaeghe K., Hatcher E., Acharya C., Kundu S., Zhong S., Shim J., Darian E., Guvench O., Lopes P., Vorobyov I., MacKerell A.D. // J. Comput. Chem. 2010. V. 31. P. 671.
Yu W., He X., Vanommeslaeghe K., MacKerell A.D. // J. Comput. Chem. 2012. V. 33. P. 2451.
Darden T., York D., Pedersen L. // J. Chem. Phys. 1993. V. 98. P. 10 089.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


