Коллоидный журнал, 2019, T. 81, № 2, стр. 263-267
Синтез монодисперсных наночастиц серебра в растворах хитозана
О. Я. Урюпина 1, Е. К. Уродкова 1, 2, Е. С. Жаворонок 2, В. В. Высоцкий 1, И. Н. Сенчихин 1, *
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, д. 31, корп. 4, Россия
2 РТУ МИРЭА (ИТХТ им. М.В. Ломоносова),
кафедра биотехнологии и промышленной фармации
119571 Москва, проспект Вернадского, д. 86, Россия
* E-mail: isenchikhin@gmail.com
Поступила в редакцию 20.09.2018
После доработки 06.11.2018
Принята к публикации 02.11.2018
Аннотация
Показана возможность получения монодисперсных наночастиц серебра в растворе хитозана. Подобраны температурный режим, время реакции и рН среды, при которых формируются монодисперсные НЧ серебра со средним диаметром 65 нм, имеющие в перспективе медицинское применение. Проведены спектральные исследования, и выявлен характер взаимодействия хитозана с солью серебра. Установлено, что в восстановлении ионов серебра и стабилизации образующихся наночастиц участвуют не только гидроксильные группы хитозана, но и его свободные первичные аминогруппы.
ВВЕДЕНИЕ
Интерес к полимерным композитам на основе хитозана (ХТЗ) сохраняется на протяжении нескольких десятилетий. Этот природный полисахарид обладает уникальным комплексом физических и химических свойств, хорошими фармакологическими характеристиками, нетоксичен, биосовместим и способен к биодеградации. Его используют для получения пленок, волокон и других материалов, широко применяемых в биологии и медицине. К настоящему времени значительное число исследований посвящено созданию композитов из наночастиц (НЧ) золота и серебра в матрице ХТЗ и карбоксиметилхитина [1–10]. В подавляющем большинстве этих работ синтез НЧ металла проводился в обращенных мицеллах [7, 8] с введением дополнительных восстановителей и стабилизаторов [9] или с применением радиационного и УФ-облучения [10, 11]. Как правило, размер синтезируемых таким образом НЧ составляет от 2–5 до 15–30 нм, в то время как для некоторых медицинских применений, например для импульсной лазерной гипертермии [12–16], требуются НЧ серебра бóльших размеров. Поэтому цель настоящей работы − анализ возможности получения таких НЧ серебра в растворах ХТЗ без введения каких-либо дополнительных восстановителей. При этом мы руководствовались тем фактом, что звено ХТЗ, представляющее собой β-D-глюкозу, может выполнять функцию не только стабилизатора НЧ, но и их восстановителя [4].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе был использован хитозан производства “ООО Биопрогресс” (Россия) со среднемассовой молекулярной массой Mw = 311 ± 54 кДа, оцененной нами с использованием в режиме статического рассеяния света прибора Zetasizer Nano ZS (Malvern, Великобритания), в программном обеспечении которого уже заложена стандартная процедура определения Mw по уравнению Дебая.
Степень деацетилирования ХТЗ, рассчитанная из спектральных данных по методу [17], составила 0.80. В качестве прекурсора был использован AgNO3 (≥99.9%, Aldrich). pH раствора регулировали за счет введения 0.5 мас. % раствора Na2CO3 (“ч. д. а.”). Растворы готовили в день синтеза в свежеперегнанной деионизованной воде с удельным сопротивлением 18.4 МОм/см (установка Milli-Q).
Основная проблема получения НЧ металлов в водных растворах ХТЗ заключается в том, что сам полимер хорошо растворим в кислых средах, тогда как восстановление ионов металлов большинством реагентов происходит в щелочных и иногда в нейтральных водных растворах.
Нами была проведена серия экспериментов по определению узкого диапазона значений рН растворов и температурного режима реакции, при которых ионы серебра в растворе ХТЗ уже начинают восстанавливаться и в то же время сам полимер не осаждается. В результате синтез осуществляли следующим образом: в бидистиллят при комнатной температуре вводили при постоянном перемешивании раствор ХТЗ, реакционную смесь при интенсивном перемешивании нагревали до 75°C в течение 20–30 мин и вводили последовательно растворы AgNO3 и Na2CO3. Время, за которое первоначально прозрачный раствор становился сначала желтым, а потом постепенно красновато-коричневым, изменялось от 1 ч для реакционной смеси с самым низким содержанием карбоната натрия (то есть с низким значением рН) до 20 мин для системы, содержащей 0.9 мл раствора Na2CO3.
Распределение числа НЧ по размеру определяли методом динамического рассеяния света (длина волны излучения лазера 633 нм) на приборе Zetasizer Nano ZS при 25°C.
ИК-спектры измеряли в режиме пропускания на спектрометре Nicolet 6700 с разрешением 2 см–1 и усреднением 128 сканирований в диапазоне волновых чисел 400–4000 см–1 при комнатной температуре на воздухе. Для этого из образцов формировали пленки на окнах из смешанного бромида/йодида таллия (KRS-5) по стандартной методике.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Наилучшие результаты с точки зрения степени полидисперсности частиц по размерам и стабильности нанодисперсий наблюдаются при соотношениях концентраций реагентов, приведенных в табл. 1. Кроме того, из представленных в ней данных следует, что даже в растворе ХТЗ достаточно низкой концентрации (образец № 1) можно получить НЧ серебра без использования каких-либо дополнительных восстановителей. Образец № 2 с такой же концентрацией ХТЗ оказался неустойчивым, вероятно, в силу кинетических факторов – при увеличении рН реакционной смеси увеличивается скорость реакции. В образцах № 3–5 концентрация ХТЗ увеличена в два раза по сравнению с предыдущими, и при повышении pH системы от 6.9 до 7.3 и, далее, до 7.9 уже образуются устойчивые дисперсии серебра со среднечисловыми размерами НЧ 58, 65 и 61 нм соответственно. Однако явной связи размеров частиц с pH реакционной системы в этом концентрационном интервале реагентов не наблюдается.
Таблица 1.
Зависимость среднего размера НЧ серебра от соотношения компонентов в реакционной системе
| Номер образца |
Объем раствора AgNO3, мл |
Объем раствора ХТЗ, мл |
Объем H2O, мл |
Объем раствора Na2CO3, мл |
рН | Размер частиц | |
|---|---|---|---|---|---|---|---|
| диаметр d, нм | коэффициент вариации, % | ||||||
| 1 | 4.0 | 5.0 | 34.7 | 0.3 | 6.5 | 63 | 4.5 |
| 2 | 4.0 | 5.0 | 34.5 | 0.5 | 6.8 | Осадок | |
| 3 | 4.0 | 10.0 | 29.7 | 0.3 | 6.9 | 58 | 7.1 |
| 4 | 4.0 | 10.0 | 29.5 | 0.5 | 7.3 | 65 | 6.3 |
| 5 | 4.0 | 10.0 | 29.1 | 0.9 | 7.9 | 61 | 4.2 |
| 6 | 8.0 | 10.0 | 25.7 | 0.3 | 6.5 | 69 | 3.0 |
| 7 | 8.0 | 10.0 | 25.5 | 0.5 | 7.1 | 56 | 5.3 |
| 8 | 8.0 | 10.0 | 25.1 | 0.9 | 7.7 | 43 | 10.1 |
| 9 | – | 10.0 | 34.0 | – | 5.3 | 276 | 10.3 |
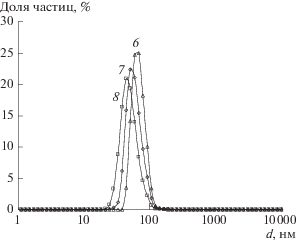
При увеличении концентрации прекурсора (образцы № 6–8) при подобном варьировании рН реакционной смеси наблюдается выраженная тенденция к уменьшению среднего размера частиц от 69 до 43 нм (рис. 1). Отметим, что подобную зависимость наблюдали авторы работы [8] при получении НЧ серебра радиационно-химическим способом с использованием карбоксиметилхитина.
Рис. 1.
Распределение числа НЧ серебра, синтезированных в водных растворах ХТЗ при различных значениях pH, по размеру. Номера у кривых соответствуют номерам образцов в табл. 1.
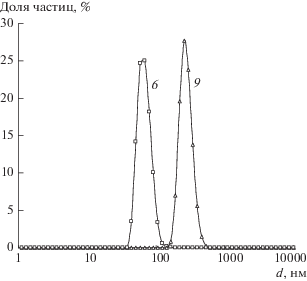
Известно [18], что в разбавленных растворах конформация макромолекул ХТЗ адекватно описывается моделью сильно вытянутого эллипсоида вращения. Поэтому мы предприняли попытку измерить размеры частиц исследуемого ХТЗ в растворах с концентрацией, соответствующей его содержанию в большинстве опытов, – в табл. 1 этот раствор ХТЗ обозначен как образец № 9. Оказалось, что “клубки” ХТЗ имеют очень узкое распределение по размерам с максимумом при 276 нм. С другой стороны, средний размер частиц в реакционной системе после синтеза составляет примерно 40–70 нм (рис. 2). Это означает, что в процессе синтеза НЧ конформация макромолекул ХТЗ изменяется. Вероятным объяснением наблюдаемого эффекта является множественное взаимодействие молекулы ХТЗ с поверхностью НЧ серебра.
Рис. 2.
Распределение числа рассеивающих лазерное излучение частиц по размеру в растворе ХТЗ (9) и в дисперсии НЧ серебра (6). Номера у кривых соответствуют номерам образцов в табл. 1.
Характер взаимодействия ХТЗ с азотнокислым серебром и образующимися НЧ металла исследовали методом ИК-спектроскопии. На рис. 3 приведены ИК-спектры пленок, сформированных из раствора ХТЗ (образец № 9, кривая 1) и из дисперсии НЧ серебра (образец № 3, кривая 3), в диапазоне волновых чисел 400–4000 см–1. Изменения pH среды и температуры могут привести к изменениям конформации макромолекул ХТЗ, что по-разному будет влиять на устойчивость формирующихся нанодисперсий серебра [8]. Поэтому дополнительно был измерен ИК-спектр пленки ХТЗ, полученной из его раствора, который содержал то же количество карбоната натрия (pH 6.9) и был подвергнут той же термообработке, что и образец № 3. Этот спектр изображает кривая 2.
Рис. 3.
ИК-спектры пленок, полученных из водного раствора ХТЗ (1), раствора ХТЗ в присутствии карбоната натрия (2) и дисперсии НЧ серебра, содержащей ХТЗ (3).
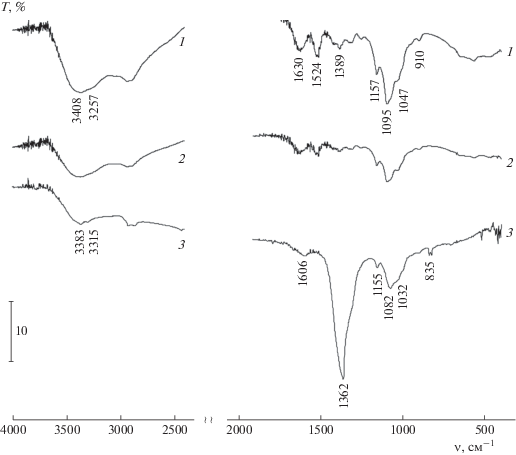
Отнесение полос в ИК-спектрах ХТЗ было сделано на основании имеющихся в литературе данных [19]. Очевидно, что большинство полос поглощения не могут быть отнесены к колебаниям конкретных функциональных групп в молекуле ХТЗ, что характерно для природных полимеров. В частности, в высокочастотной области спектра наблюдается широкая полоса поглощения с максимумом при 3408 см–1, отвечающая гидроксильным группам, участвующим в водородной связи, с едва заметным плечом 3257 см–1, которое характеризует колебания групп NH и NН2, также связанных водородными связями. В области колебаний Амид I и Амид II проявляются полосы со сложным контуром с максимумами при 1630 и 1524 см–1, интенсивность второй полосы заметно выше. В интервале 1200–1000 см–1 наблюдается широкая область поглощения, причем можно выделить полосы с максимумами при 1157 (колебание мостиковой связи C–O в пиранозном кольце молекулы), 1095 и 1047 см–1. Последние две полосы соответствуют колебаниям ν(C–O) в первичных и вторичных гидроксильных группах молекулы. Спектр пленки ХТЗ, полученной из раствора с pH 6.9 и подвергнутой термообработке, представлен кривой 2. Видно, что все полосы поглощения ХТЗ сохраняются и в этом спектре. Из соотношения интенсивностей полос поглощения валентных колебаний C–H и C–O и Амид I и Амид II следует, что ни конформационных изменений, ни деструкции макромолекул такая мягкая обработка не вызывает.
ИК-спектр пленки, сформированной из полученной нанодисперсии серебра, представлен кривой 3. Предполагается [20], что при восстановлении ионов серебра имеет место окисление вторичной гидроксильной группы моносахаридного звена ХТЗ до карбонильной. При этом не исключается возможность участия в редокс-процессе и первичной гидроксильной группы. Действительно, сравнивая спектр полученной дисперсии со спектром ХТЗ, можно заметить, что интенсивность полосы валентных колебаний OH-групп уменьшилась (примерно в 3 раза) и ее максимум заметно сдвинулся в сторону низких частот, до 3383 см–1. Это свидетельствует об образовании более сильных водородных связей с участием гидроксильных групп. Синхронно уменьшаются интенсивности полос поглощения, соответствующих колебаниям ν(C–O) первичных и вторичных гидроксильных групп биополимера. Эти изменения однозначно указывают на участие гидроксильных групп ХТЗ в восстановлении ионов серебра. В то же время уширение и “размывание” полос колебаний ν(C–O) свидетельствует о конформационных изменениях макромолекул ХТЗ в этом образце. При этом в спектре не наблюдается поглощения, присущего свободным карбоксильным группам, до которых окисляются гидроксильные группы ХТЗ в процессе восстановления ионов металла, так как в щелочной среде они ионизированы и их поглощение маскируется интенсивной полосой при 1372 см–1 анионов ${\text{NO}}_{{\text{3}}}^{{\text{--}}}{\text{.}}$
Очень интересны изменения полос поглощения групп NH и NН2 в спектре 3 по сравнению со спектром ХТЗ. Точно так же, как и в случае гидроксильных групп, интенсивность полосы валентных колебаний NН2-групп существенно (в 3–4 раза) уменьшилась, что указывает на участие NН2-групп в восстановлении ионов серебра. Известно [8, 10], что первичные аминогруппы в ХТЗ обладают высокой комплексообразующей способностью по отношению к катионам переходных металлов. Не исключено, что именно такое взаимодействие между катионами серебра и аминогруппами ХТЗ является движущей силой образования и стабилизации НЧ серебра. С другой стороны, авторы [21] считают, что стабилизирующее действие ХТЗ связано с образованием ионных пар между его аминогруппами и анионами на поверхности металла, в нашем случае – анионами ${\text{NO}}_{3}^{ - }$ прекурсора. В любом случае, NН2-группы активно вовлечены в процессы формирования НЧ серебра и стабилизации образующихся дисперсий. Интересно отметить, что на спектре 3 полностью исчезла полоса Амид II, обусловленная составными частотами деформационных колебаний N–H и колебаний C–N в ацетамидной группе, но при этом полоса Амид I присутствует, хотя ее интенсивность и сильно уменьшилась. Отметим, что исчезновение полосы Амид II дипептида при его использовании в качестве восстановителя для синтеза НЧ серебра наблюдали в работе [22]. Этот эффект объяснен авторами переходом транс-конфигурации амидной группы дипептида в цис-конфигурацию. В нашем случае подобные изменения в спектре также могут свидетельствовать о значительных изменениях конфигурации ацетамидных групп в молекуле ХТЗ, вызванных их взаимодействием с поверхностью НЧ.
ЗАКЛЮЧЕНИЕ
Проведенная серия экспериментов показала возможность получения устойчивых дисперсий серебра со средним размером НЧ 40–70 нм и мономодальным распределением по размерам в водном растворе хитозана, используемого не только в качестве биополимерного стабилизатора, но и восстановителя ионов металла. Спектральными исследованиями показано, что в процессе восстановления ионов серебра и стабилизации образующихся НЧ участвуют как гидроксильные группы ХТЗ, так и его NH2-группы.
Часть экспериментальной работы была выполнена с использованием оборудования “Центра коллективного пользования физическими методами исследования” Института физической химии и электрохимии им. А.Н. Фрумкина РАН.
Список литературы
Yang K.H., Liu Y.C., Hsu T.C. // Mater. Res. Bull. 2010. V. 45. P. 63.
Esumi K., Takei N., Yoshimura T. // Colloids Surf. B. 2003. V. 32. P.11.
Jin S., Ye K. // Biotechnol. Prog. 2007. V. 23. P. 32.
Di Carlo G., Curulli A., Toro R.G. // Langmuir. 2012. V. 28. P. 5471.
D’Souza S.F., Bhainsa K.C. // Colloids Surf. B. 2006. V. 47. P. 160.
Lengke M.F., Fleet M.E., Southam C. // Langmuir. 2007. V. 23. P. 2694.
Александрова В.А., Широкова Л.Н., Бондаренко Г.Н., Петросян А.С. // Высокомолек. соед. А. 2013. Т. 55. С. 176.
Широкова Л.Н., Александрова В.А. // Докл. АН. 2015. Т. 464. С. 440.
Tiwari A.D., Mishra A.K., Arotiba O.A. // Int. J. Biol. Macromol. 2011. V. 48. P. 682.
Апрятина К.В., Мочалова А.Е., Грачева Т.А., Смирнова Л.А. // Высокомолек. соед. Б. 2015. Т. 57. С. 154.
Biswal J., Ramnami S.P., Shirolikar S., Sabharwal S. // J. Appl. Polym. Sci. 2009. V. 114. P. 2348.
Boca S.C., Potara M., Gabudean A.-M., Juhem A., Baldeck P.L., Astilean S. // Cancer Lett. 2011. V. 311. P. 131.
Nombona N., Maduray K., Antunes E., Karsten A., Nyokong T. // J. Photochem. Photobiol. B. 2012. V. 107. P. 35.
Дементьева О.В., Мальковский А.В., Филиппенко М.А., Рудой В.М. // Коллоид. журн. 2008. Т. 70. С. 607.
Дементьева О.В., Филиппенко М.А., Карцева М.Е., Рудой В.М. // Коллоид. журн. 2009. Т. 71. С. 569.
Карцева М.Е., Дементьева О.В., Филиппенко М.А., Рудой В.М. // Коллоид. журн. 2011. Т. 73. С. 334.
Duarte M.L., Ferreira M.C., Marvao M.R., Rocha J. // Int. J. Biol. Macromol. 2002. V. 31. P. 1.
Colfen H., Berth G., Dautzenberg H. // Carbohydr. Polym. 2001. V. 45. P. 373.
Shigemasa Y., Matsuura H., Sashiwa H., Saimoto H. // Int. J. Biol. Macromol. 1996. V. 18. P. 237.
Wei D., Qian W. // Colloid Surf. B. 2008. V. 62. P. 136.
Mayer A.B.R., Mark J.E. // Eur. Polym. J. 1998. V. 34. P. 103.
Loskutov A.I., Guskova O.A., Grigoriev S.N., Oshurko V.B., Tarasiuk A.V., Uryupina O.Ya. // J. Nanopart. Res. 2016. V. 18. P. 239.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


