Коллоидный журнал, 2019, T. 81, № 3, стр. 306-316
Структурные и электроповерхностные свойства железосодержащих пористых стекол в растворах NaCl. II. Поверхностный заряд и электрокинетический потенциал пористых стекол
Л. Э. Ермакова 1, *, **, Е. А. Гринкевич 1, А. В. Волкова 1, А. С. Кузнецова 1, Л. Н. Куриленко 2, Т. В. Антропова 2
1 Санкт-Петербургский государственный университет,
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
2 Институт химии силикатов им. И.В. Гребенщикова РАН,
199034 Санкт-Петербург, наб. Адмирала Макарова, 2, Россия
* E-mail: l.ermakova@spbu.ru
** E-mail: ermakova3182@yandex.ru
Поступила в редакцию 17.11.2018
После доработки 23.11.2018
Принята к публикации 03.12.2018
Аннотация
Для пористых стекол различного состава (содержащих и не содержащих магнетит) определены их равновесные электроповерхностные характеристики (поверхностный заряд и электрокинетический потенциал) на фоне растворов индифферентного электролита (NaCl). Обнаружено, что введение оксида железа в матрицу стекла приводит к росту абсолютной величины поверхностного заряда композитного материала по сравнению с высококремнеземным пористым стеклом, полученным из базового натриевоборосиликатного стекла. Проведен анализ величин электрокинетических потенциалов, найденных с использованием комплекса экспериментальных данных о потенциале течения, электрофоретической подвижности частиц пористых стекол, их удельной электропроводности, структуре порового пространства. Обнаружено различие электрокинетических характеристик образцов железосодержащих пористых стекол непосредственно после их получения и находившихся длительное время в контакте с растворами электролита.
ВВЕДЕНИЕ
В первой части работы [1] было проанализировано влияние введения оксидов железа в матрицу натриевоборосиликатного стекла на свойства микро- и макропористых стекол (МИП и МАП, соответственно) – их структуру (объемную пористость, коэффициент структурного сопротивления, средний радиус пор) и транспортные характеристики (коэффициент фильтрации, удельную электропроводность, числа переноса противоионов) в растворах хлорида натрия. Анализ экспериментальных результатов показал [1], что более заметные изменения структурных и транспортных свойств пористых стекол (ПС) в растворах индифферентного электролита наблюдались для содержащих магнетит МАП стекол, изготовленных из монолитного стекла Fe-4-5 (состав, мол. %: 5.10 Na2O, 13.69 B2O3, 70.05 SiO2, 11.16 Fe3O4), по сравнению с ПС, полученными из базового натриевоборосиликатного стекла 8В-НТ (состав, мол. %: 6.73 Na2O, 18.28 B2O3, 74.93 SiO2, 0.06 Al2O3).
Помимо изучения транспортных характеристик мембран из ПС, не содержащих и содержащих магнетит, интерес представляет сопоставление их равновесных электроповерхностных характеристик – поверхностного заряда и электрокинетического потенциала, чему и посвящена вторая часть работы, результаты которой представлены в настоящей статье.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования являлись пористые мембраны на основе двухфазных стекол 8В-НТ, Fe4-4 и Fe4-5, процедура получения и составы которых приведены в [1].
Электрокинетический потенциал ПС определяли методами электрофореза и потенциала течения (ES). Электрофоретическую подвижность частиц ПС (Ue) в зависимости от pH на фоне растворов NaCl (0.1–10−3 М) измеряли методом лазерного допплеровского электрофореза (Zetasizer Nano ZS, Malvern). Для каждой концентрации фонового электролита проводили несколько серий измерений, и полученные результаты графически усредняли. Величины потенциалов течения (Ag/AgCl-электроды, мультиметр Fluke 8846A/Su) измеряли в нейтральной области pH при различных концентрациях хлорида натрия (0.1–10−4 М). Для МАП стекол погрешность определения значений ES составляла 3–5%. Для МИП стекол в самом разбавленном и самом концентрированном растворах погрешность определения ES возрастала до 10–15%, тем не менее, это не оказывало существенного влияния на характер концентрационных зависимостей электрокинетических потенциалов, найденных с учетом поверхностной проводимости и перекрывания двойных электрических слоев (ДЭС).
При измерениях электрофоретической подвижности использовали дисперсные частицы ПС, полученные растиранием в агатовой ступке свежеполученных образцов стекол 8В-НТ МИП (мол. %: 0.48 Na2O, 1.98 B2O3, 97.47 SiO2), 8В-НТ МАП (мол. %: 0.66 Na2O, 0.50 K2O, 4.21 B2O3, 94.51 SiO2, 0.12 Al2O3) и Fe-4-4 МИП (мол. %: 0.97 Na2O, 4.79 B2O3, 89.18 SiO2, 2.35 Fe2O3, 2.71 FeO). Частицы микро- и макропористого ПС Fe-4-5 были получены из мембран, на которых проводили измерения характеристик ПС в растворах хлорида натрия. После проведения измерений мембраны отмывали 0.1 М соляной кислотой (сутки) и бидистиллированной водой (с контролем pH и удельной электропроводности) и высушивали в течение 1 ч при 120°C. Высушенные мембраны также растирали в агатовой ступке.
Частицы ПС приводили в равновесие с электролитами в течение 30–40 мин, для измерений электрофоретической подвижности отбирали верхнюю часть равновесной суспензии. Средние размеры частиц ПС при электрофоретических измерениях, найденные методом динамического рассеяния света, составляли 1–2 мкм.
Дисперсные частицы микро- и макропористого стекла 8В-НТ и свежеполученного микропористого стекла Fe-4-5 были использованы для определения поверхностного заряда образцов методом непрерывного потенциометрического титрования [2] на фоне растворов хлорида натрия (10−3–1.0 М). Отметим, что для железосодержащих ПС, обладающих магнитными свойствами, титрование проводили, используя механическую мешалку.
Для частиц микропористых стекол Fe-4-4 и Fe-4-5 (свежеполученные образцы) была также определена концентрация ионов железа, вышедших из ПС в раствор за время, близкое к временам измерений поверхностного заряда и электрофоретической подвижности (атомно-абсорбционный спектрометр iCE 3000, Thermo Scientific). Пробы готовили следующим образом: к 40 мл раствора NaCl (10−3–1 М) добавляли кислоту (0.036 М HCl) или щелочь (0.034 М NaOH) и 100 мг ПС. Пробы встряхивали в течение 30 мин, затем центрифугировали для отделения осадка ПС и в равновесном растворе определяли концентрацию ионов железа.
В методе потенциала течения были использованы мембраны (диски диаметром 30 мм и толщиной около 1 мм) из стекол 8В-НТ МИП и 8В-НТ МАП, а также Fe-4-5 МИП и Fe-4-5 МАП, для которых перед измерениями значений ES определяли удельную электропроводность и рассчитывали удельную электропроводность порового раствора $\kappa = \alpha {{\kappa }_{{\text{V}}}}$ (α – коэффициент эффективности, ${{\kappa }_{{\text{V}}}}$ – удельная электропроводность свободного равновесного раствора) [1]. Измерения начинали с 0.1 М раствора NaCl, а затем мембраны приводили в равновесие (в течение 2–3 суток) с более разбавленными растворами.
Измерения pH растворов проводили с помощью pH-метра Seven S-80K (Mettler Toledo). Растворы электролитов готовили с использованием стандарт-титров и реактивов марки “ос. ч.” или “х. ч.” и деионизованной воды (установка для получения очищенной воды УВОИ-“М-Ф”, ${{\kappa }_{{\text{V}}}} \leqslant $ ≤ 1.5 × 10−6 Ом−1 см−1).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Содержание ионов железа в растворах, контактировавших с пористым стеклом
Известно, что положение изоэлектрической точки (ИЭТ) и точки нулевого заряда поверхности оксидов зависит от присутствия в растворе специфически сорбирующихся ионов, к которым относятся и ионы железа [3, 4]. Поэтому представляло интерес определить концентрацию ионов железа в растворах хлорида натрия, находившихся в контакте с железосодержащими ПС Fe-4-4 и Fe-4-5. Результаты измерений количества железа, содержащегося в растворе после выдержки в нем образцов железосодержащих ПС, представлены в табл. 1. Из полученных данных видно, что в щелочной области pH содержание железа либо очень мало (3.8 × 10–7 моль/л), либо его совсем не обнаружено (н/о), т.е. ионы железа практически не переходили из ПС в раствор. В кислой области pH концентрация ионов железа для исследованных систем лежала в интервале (2.1–3.9) × 10–6 моль/л, т.е. в кислой среде переход ионов железа в раствор происходил значительно интенсивнее, чем в щелочной. Можно также отметить, что выход ионов железа из матрицы стекла в раствор хлорида натрия практически не зависел ни от партии стекла, ни от концентрации электролита.
Таблица 1.
Концентрация ионов железа в растворах, контактировавших с железосодержащими ПС в течение 30 мин
| Система | pH | ${{C}_{{{\text{F}}{{{\text{e}}}^{{3 + }}}}}}$, моль/л |
|---|---|---|
| 40 мл 0.1 M NaCl + 2 мл 0.036 M HCl + 0.1 г Fe 4-4 | 2.89 | 2.1 × 10−6 |
| 40 мл 0.1 M NaCl + 0.4 мл 0.0355 M NaOH + 0.1 г Fe-4-4 | 9.50 | н/o |
| 40 мл 0.01 M NaCl + 2 мл 0.036 M HCl + 0.1 г Fe-4-4 | 2.83 | 3.9 × 10−6 |
| 40 мл 0.01 M NaCl + 0.6 мл 0.0355 M NaOH + 0.0905 г Fe-4-4 | 9.40 | 3.8 × 10−7 |
| 40 мл 0.001 M NaCl + 2 мл 0.036 M HCl + 0.1 г Fe-4-5 | 2.81 | 3.8 × 10−6 |
| 40 мл 0.001 M NaCl + 0.2 мл 0.034 M NaOH + 0.1 г Fe-4-5 | 9.35 | н/о |
| 40 мл 1 M NaCl + 1.4 мл 0.036 M HCl + 0.1 г Fe-4-5 | 3.04 | 3.1 × 10−6 |
| 40 мл 1 M NaCl + 0.6 мл 0.033 M NaOH + 0.1 г Fe-4-5 | 9.24 | н/о |
Если говорить об условиях измерений электрофоретической подвижности частиц ПС, то при объеме пробы, равном 100 мл, навеска стекла не превышала 15–20 мг, и, следовательно, концентрация ионов железа в пробах была примерно на порядок меньше, чем значения концентрации, приведенные в табл. 1. Таким образом, данные о растворимости железосодержащих ПС и их сопоставление с результатами исследования свойств ПС в растворах хлорида железа [4] показывают, что присутствие следовых количеств ионов железа в равновесных растворах хлорида натрия практически не могло оказывать заметного влияния на электрофоретическую подвижность частиц даже в кислой области pH. Поэтому можно с достаточным основанием считать, что измерения проводили в растворах индифферентного электролита.
При измерениях электропроводности мембран и потенциала течения две железосодержащие мембраны, суммарная масса которых не превышала 2.2 г, приводили в равновесие с 1 л раствора. Если пересчитать это соотношение твердой и жидкой фаз применительно к условиям измерения растворимости ПС, то получится не более 88 мг на 40 мл жидкости. Следовательно, концентрация ионов железа в равновесных растворах с учетом того, что измерения проводили в нейтральной области pH, также были существенно меньшими, чем представленные в табл. 1 для кислой области pH.
Поверхностный заряд
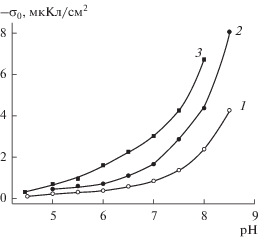
Результаты измерений поверхностного заряда (σо) исследованных ПС на фоне 10−3–1 М растворов NaCl представлены на рис. 1–3. Следует отметить, что для всех исследованных ПС наблюдаются только отрицательная область заряда поверхности и обычные зависимости величин |σо| от pH – абсолютная величина поверхностного заряда возрастает с увеличением pH вследствие роста степени диссоциации поверхностных силанольных групп. Анализ величин поверхностного заряда микро- и макропористых ПС 8В-НТ показал (рис. 1, 2), что увеличение концентрации фонового электролита при pH = const приводит к росту значений |σо| в соответствии с теоретическими представлениями о заряжении поверхностей оксидов в водных растворах [3].
Рис. 1.
Зависимости поверхностного заряда частиц стекла 8В-НТ МИП от pH при варьируемой концентрации фонового раствора NaCl: 1 – 10−3, 2 – 10−2, 3 – 10−1, 4 – 1 М.
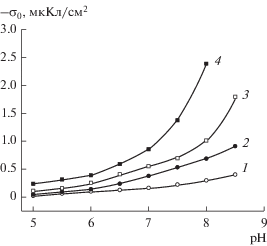
Рис. 2.
Зависимости поверхностного заряда частиц стекла 8В-НТ МАП от pH при варьируемой концентрации фонового раствора NaCl: 1 – 10−3, 2 – 10−2, 3 – 10−1, 4 – 1 М.
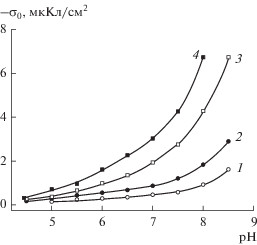
Рис. 3.
Зависимости поверхностного заряда частиц ПС от pH на фоне 1 М раствора NaCl: 1 – 8В-НТ МИП, 2 – Fe-4-5 МИП, 3 – 8В-НТ МАП.
Увеличение среднего радиуса пор при переходе от ПС 8В-НТ МИП к 8В-НТ МАП также приводит к росту величин |σо| во всей исследованной области pH и концентраций фонового электролита (пример зависимостей σо–pH для микро- и макропористого стекол приведен на рис. 3, кривые 1 и 3). Полученные результаты согласуются с данными, полученными ранее для аналогичных ПС [5, 6]. Сопоставление зависимостей σо–pH для стекол различного состава (рис. 3) показывает, что для стекол с близкими радиусами поровых каналов (1.3 нм для 8В-НТ МИП и 1.8 нм для Fe-4-5 МИП) введение ионов железа в базовое натриевоборосиликатное стекло приводит к увеличению абсолютных значений поверхностного заряда.
Электрокинетический потенциал
Метод потенциала течения. Результаты измерений потенциалов течения были использованы для расчета электрокинетических потенциалов по уравнению Гельмгольца–Смолуховского
(1)
${{\zeta }^{0}} = {{\eta {{\kappa }_{{\text{V}}}}{{E}_{{\text{S}}}}} \mathord{\left/ {\vphantom {{\eta {{\kappa }_{{\text{V}}}}{{E}_{{\text{S}}}}} {\varepsilon {{\varepsilon }_{0}}P}}} \right. \kern-0em} {\varepsilon {{\varepsilon }_{0}}P}},$(2)
$\zeta _{{\alpha }}^{ * } = {{{\text{(}}{{{\eta }\kappa {{E}_{{\text{S}}}}} \mathord{\left/ {\vphantom {{{\eta }\kappa {{E}_{{\text{S}}}}} {{\varepsilon }{{{\varepsilon }}_{{\text{0}}}}P}}} \right. \kern-0em} {{\varepsilon }{{{\varepsilon }}_{{\text{0}}}}P}}{\text{)}}} \mathord{\left/ {\vphantom {{{\text{(}}{{{\eta }\kappa {{E}_{{\text{S}}}}} \mathord{\left/ {\vphantom {{{\eta }\kappa {{E}_{{\text{S}}}}} {{\varepsilon }{{{\varepsilon }}_{{\text{0}}}}P}}} \right. \kern-0em} {{\varepsilon }{{{\varepsilon }}_{{\text{0}}}}P}}{\text{)}}} {f(k{{r}_{{\beta }}}{\text{,}}\zeta _{{\alpha }}^{ * }{,\beta *})}}} \right. \kern-0em} {f(k{{r}_{{\beta }}}{\text{,}}\zeta _{{\alpha }}^{ * }{,\beta *})}}{\text{,}}$Анализ величин электрокинетических потенциалов (ζi), рассчитанных по различным уравнениям (рис. 4–7), показывает, что для микро- и макропористых стекол различного состава наблюдается одинаковый характер зависимостей ζi–lg C.
Рис. 4.
Зависимости электрокинетического потенциала мембран 8В-НТ МИП от концентрации раствора NaCl: 1 – ζ0, 2 – ζ0α, 3 – ζ*, 4 – $\zeta _{\alpha }^{*}.$
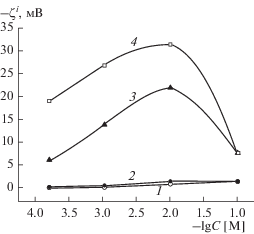
Рис. 5.
Зависимости электрокинетического потенциала мембран Fe-4-5 МИП от концентрации раствора NaCl: 1 – ζ0, 2 – ζ0α, 3 – ζ*, 4 – $\zeta _{\alpha }^{*}.$
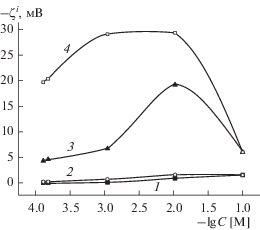
Рис. 6.
Зависимости электрокинетического потенциала мембран 8В-НТ МАП от концентрации раствора NaCl: 1 – ζ0, 2 – ζ0α, 3 – ζ*, 4 – $\zeta _{\alpha }^{*}.$
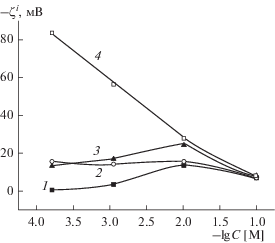
Рис. 7.
Зависимости электрокинетического потенциала мембран Fe-4-5 МАП от концентрации раствора NaCl: 1 – ζ0, 2 – ζ0α, 3 – ζ*, 4 – $\zeta _{\alpha }^{*}.$
Для микропористых стекол и для мембран Fe-4-5 МАП учет поверхностной проводимости практически не сказывается на виде кривых: значения |ζ0α|, так же как и величины |ζ0|, несколько уменьшаются с разбавлением электролита (кривые 1, 2 на рис. 4, 5). Для мембраны 8В-НТ МАП при C ≤ 10−2 М электрокинетический потенциал ζ0α от концентрации практически не зависит (кривые 1, 2 на рис. 6).
Таким образом, видно, что для всех исследованных ПС при расчете величин электрокинетического потенциала необходимо учитывать перекрывание ДЭС во всей области концентраций электролита. Учет перекрывания ДЭС приводит к росту величин |ζ*| с разбавлением раствора NaCl от 0.1 до 0.01 М. Дальнейшее разбавление электролита приводит к более или менее заметному уменьшению значений электрокинетического потенциала. Только одновременный учет перекрывания ДЭС и электропроводности порового раствора при расчете величин электрокинетических потенциалов для макропористых стекол позволяет получить предсказываемые классическими теориями ДЭС зависимости $\zeta _{\alpha }^{*}$–lg C − электрокинетические потенциалы возрастают по абсолютной величине с разбавлением раствора электролита (рис. 6 и 7, зависимости 4), причем при C < 10−2 М практически линейно. Зависимости $\zeta _{\alpha }^{*}$–lg C для микропористых стекол остаются экстремальными: значения |$\zeta _{\alpha }^{*}$| возрастают только при переходе от децимолярного раствора к сантимолярному, а затем наблюдается уменьшение абсолютных значений электрокинетического потенциала. Такое снижение величин |$\zeta _{\alpha }^{*}$| может быть обусловлено как недостатками теории электрокинетических явлений при радиусах капилляров 1.5 ± 0.3 нм, так и тем, что с разбавлением раствора изменяется структура порового пространства микропористых мембран, содержащих значительные количества вторичного кремнезема. При разбавлении электролита степень набухания вторичного кремнезема в поровых каналах будет возрастать, что приведет к смещению границы скольжения от твердой поверхности поры к центру порового канала и, следовательно, к уменьшению значений |$\zeta _{\alpha }^{*}$|.
О том, что электрокинетические характеристики исследованных микропористых стекол (особенно в разбавленных растворах) определяются наличием вторичного кремнезема в поровом пространстве, свидетельствовали и результаты расчета коэффициентов эффективности, для которых наблюдалась обратная теоретической зависимость от размера пор [1]. Таким образом, мы видим, что результаты измерений различных транспортных характеристик микропористых мембран (удельной электропроводности и потенциала течения) согласуются между собой.
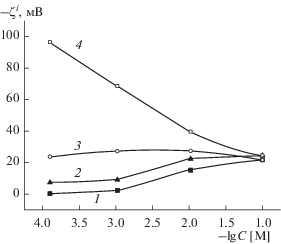
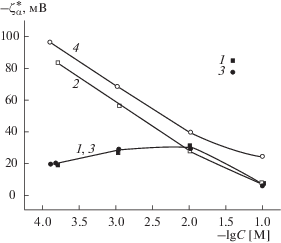
Сопоставление концентрационных зависимостей электрокинетического потенциала для всех исследованных мембран (рис. 8) показывает, что состав стекла практически не влияет на величины $\zeta _{\alpha }^{*}$-потенциала в случае микропористых стекол (кривые 1, 3). В то же время введение оксида железа в натриевоборосиликатное стекло приводит (при C = const) к росту абсолютных величин электрокинетического потенциала макропористых мембран, что, в первую очередь, может быть обусловлено увеличением поверхностного заряда ПС. Увеличение |$\zeta _{\alpha }^{*}$| содержащего магнетит макропористого стекла также может быть связано с различным положением границы скольжения в поровых каналах ПС различного состава. Для ПС Fe-4-5 МАП средний радиус пор составляет 17.2 нм, а для ПС 8В-НТ МАП – 13.9 нм [1], что свидетельствует о более полном удалении вторичного кремнезема из порового пространства железосодержащего стекла. Следовательно, в порах ПС Fe-4-5 МАП граница скольжения может быть ближе к поверхности порового канала, чем в порах мембран 8В-НТ МАП, что вызывает рост значений |$\zeta _{\alpha }^{*}$| при прочих равных условиях.
Рис. 8.
Зависимости электрокинетического потенциала $\zeta _{\alpha }^{*}$ ПС от концентрации растворов NaCl: 1 – 8В-НТ МИП, 2 – 8В-НТ МАП, 3 – Fe4-5 МИП, 4 – Fe4-5 МАП.
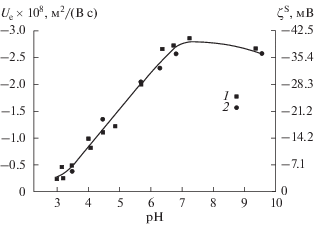
Метод лазерного доплеровского электрофореза. Пример экспериментальной зависимости электрофоретической подвижности частиц Ue для ПС 8В-НТ от pH на фоне 10−3 М раствора NaCl и найденные из значений Ue по уравнению Смолуховского
(3)
${{\zeta }^{{\text{S}}}} = \frac{{\eta }}{{{\varepsilon }{{{\varepsilon }}_{{\text{0}}}}}}{{U}_{{\text{e}}}},$Рис. 9.
Зависимости электрофоретической подвижности и электрокинетического потенциала ζS частиц ПС от pH на фоне 10−3 М раствора NaCl: 1 – 8В-НТ МИП, 2 – 8В-НТ МАП.
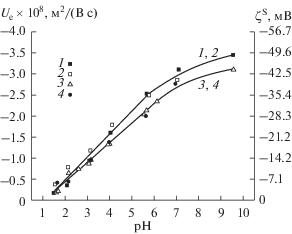
Для всех исследованных нами пористых частиц были получены экспериментальные зависимости, аналогичные представленной на рис. 9. Пример экспериментальных данных для частиц стекла Fe-4-4 МИП на фоне 10−2 М раствора NaCl и в растворах соляной кислоты приведен на рис. 10. На рис. 11 приведены результаты измерений электрофоретической подвижности частиц микро- и макропористых стекол Fe-4-5 на фоне 10−3 М и 10−2 М растворов NaCl. В дальнейшем, для удобства сопоставления полученных результатов, будем использовать величины Ue, найденные при фиксированных значениях из графически усредненных экспериментальных данных.
Рис. 10.
Зависимости электрофоретической подвижности и электрокинетического потенциала ζS частиц стекла Fe-4-4 МИП от pH: 1 – 10−3 М NaCl [11], 2 –HCl.
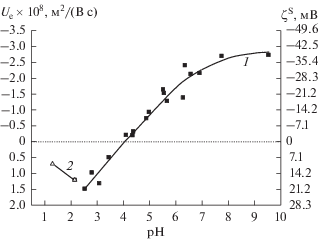
Рис. 11.
Зависимости электрофоретической подвижности и электрокинетического потенциала ζS частиц ПС от pH: 1 – Fe4-5 МИП и 2 – Fe4-5 МАП на фоне 10−3 М раствора NaCl, 3 – Fe4-5 МИП и 4 – Fe4-5 МАП на фоне раствора 10−2 М NaCl.
Анализ полученных результатов показывает, что для ПС 8В-НТ наблюдаются характерные для натриевоборосиликатных стекол зависимости электрофоретической подвижности и электрокинетического потенциала ζS от pH равновесного раствора, и ИЭТ для ПС 8В-НТ лежит в кислой области, при pH < 1.5 (рис. 12, кривые 1, 2). Отметим, что для исследованных образцов ПС, изготовленных из двухфазного натриевоборосиликатного стекла, значения ИЭТ соответствуют более кислой области pH, чем ИЭТ, найденные методом электрофореза в присутствии фосфатного и ацетатного буферов для аналогичных ПС [9] и частиц боросиликатного стекла [10] (pHИЭТ 1.8–2.0). Также обращает на себя внимание тот факт, что величины электрофоретической подвижности частиц микро- и макропористого стекол 8В-НТ практически не зависят от концентрации фонового электролита в исследованной области CNaCl. В растворах соляной кислоты с концентрацией 10−2 и 0.1 М значения Ue для частиц стекла 8В-НТ МАП составляли (–0.11…–0.08) × 10−8 м2/(В с) соответственно (точки 4 на рис. 12); для частиц стекла 8В-НТ МИП в сантимолярном растворе HCl электрокинетический потенциал был отрицательным (Ue = –0.26 × 10−8 м2/(В с)), а в децимолярном растворе наблюдались небольшие положительные значения ζS (Ue = (0.08 ± 0.06) × × 10−8 м2/(В с), точки 3 на рис. 12). Положительные величины электрокинетического потенциала в области точки нулевого заряда в растворе HCl могут быть связаны со специфической адсорбцией потенциалопределяющих ионов H+ на вторичном кремнеземе, содержащемся в порах МИП стекол и отсутствующем в МАП стеклах.
Рис. 12.
Зависимости электрофоретической подвижности и электрокинетического потенциала ζS частиц ПС от pH: 1 – 8В МИП и 8В МАП на фоне 10−3 М раствора NaCl, 2 – 8В МИП и 8В МАП на фоне 10−2 М раствора NaCl, 3 – 8В МИП, HCl, 4 – 8В МАП, HCl.
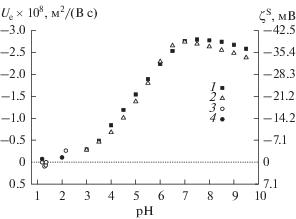
Результаты измерений электрофоретической подвижности частиц, полученных из свежеприготовленного стекла Fe-4-4 МИП, показали [11], что введение около 5% оксида железа в базовое натриевоборосиликатное стекло привело к смещению ИЭТ до pH 4.1 ± 0.1, т.е. к появлению области положительных значений электрокинетического потенциала при pH < 4.1. Установлено также, что для частиц этого стекла при pH = const наблюдается обычная зависимость электрофоретической подвижности от концентрации фонового электролита – абсолютные величины Ue и ζS растут с разбавлением раствора. Значения электрокинетического потенциала ζS частиц Fe-4-4 МИП в растворах HCl были положительными (рис. 10, кривая 2).
Анализ зависимостей электрофоретической подвижности частиц от pH для железосодержащих ПС Fe-4-5, длительное время (более 3 нед.) находившихся в контакте с растворами хлорида натрия, показал, что значения Ue на фоне 10−2 и 10−2 М растворов NaCl для микро- и макропористого стекол совпадают в пределах погрешности эксперимента (рис. 11). При этом, в отличие от ПС Fe-4-4, значения электрофоретической подвижности частиц остаются отрицательными вплоть до pH 1.5.
Характер зависимости величин электрофоретической подвижности частиц ПС Fe-4-5 от концентрации электролита при pH = const остается таким же, как и для частиц ПС Fe-4-4.
Сопоставление экспериментальных данных для ПС различного состава (рис. 13, 14) показывает, что на фоне 10−3 М раствора NaCl (рис. 13) электрофоретические характеристики стекол 8В-НТ и Fe-4-4 МИП при значении pH около 6 сближаются. При увеличении концентрации хлорида натрия до 10−2 М (рис. 14) электрофоретическая подвижность частиц ПС 8В-НТ по абсолютной величине становится больше, чем частиц Fe-4-4 МИП, в интервале pH 4–8. Наибольшие по абсолютной величине значения Ue наблюдались для частиц Fe-4-5 практически во всей исследованной области составов жидкой фазы, за исключением области pH 6–7 на фоне 10−2 М раствора NaCl.
Рис. 13.
Зависимости электрофоретической подвижности и электрокинетического потенциала ζS частиц ПС от pH на фоне 10−3 М раствора NaCl: 1 – 8В МИП и 8В МАП, 2 – Fe-4-4 МИП [11], 3 – Fe-4-5 МИП и Fe-4-5 МАП.
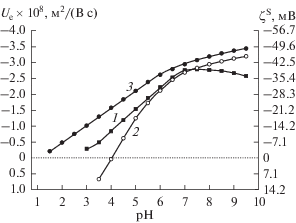
Рис. 14.
Зависимости электрофоретической подвижности и электрокинетического потенциала ζS частиц ПС от pH на фоне 10−2 М раствора NaCl: 1 – 8В МИП, 2 – Fe-4-4 МИП [11], 3 – Fe-4-5 МИП и Fe-4-5 МАП.
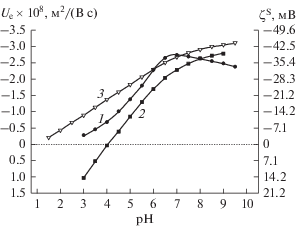
Различие в электрокинетическом поведении двух образцов железосодержащего стекла может быть связано с тем, что находившиеся на поверхности поровых каналов стекол Fe-4-5 агломераты частиц магнетита полностью растворились при длительном контакте мембран с растворами хлорида натрия, и продукты растворения были удалены из порового пространства в ходе приведения ПС в равновесие с растворами NaCl различной концентрации. При измельчении такой мембраны количество магнетита как на поверхности частиц, так и в их порах может быть меньше, чем у частиц ПС, полученных из свежеприготовленных образцов ПС Fe-4-4.
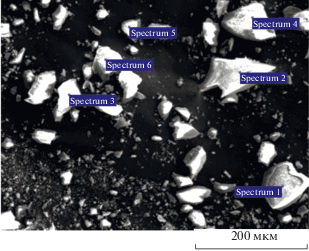
Косвенным подтверждением такого предположения являются результаты растровой электронной микроскопии (РЭМ) образцов пористых стекол. Рентгеновский энергодисперсионный микроанализ (сканирующий электронный микроскоп Zeiss Merlin с приставкой для микроанализа Oxford Instruments INCAx-act) был выполнен как для свежеприготовленных микро- и макропористых образцов стекла Fe-4-5, так и для мембраны Fe-4-5 МИП и частиц микро- и макропористого стекол после длительного их контакта с электролитом. РЭМ-снимки частиц ПС с указанием точек микроанализа представлены на рис. 15, 16.
Полученные методом рентгеновского энергодисперсионного микроанализа (усредненные по спектрам для каждого образца ПС) данные приведены в табл. 2. Видно, что в свежеприготовленных МИП и МАП стеклах содержание железа примерно одинаково. Полученные результаты также показали, что распределение железа по объему ПС достаточно равномерно. Для микропористых мембран Fe-4-5 наблюдалось заметное снижение количества железа после длительного контакта с растворами NaCl, еще более выраженное для пористых частиц Fe-4-5 МИП и Fe-4-5 МАП. Высказанное выше предположение требует дальнейшей экспериментальной проверки.
Таблица 2.
Содержание железа в образцах пористого стекла
| Содержание железа | Свежеприготовленные мембраны |
Мембрана после электрокинетических измерений | Пористые частицы после электрокинетических измерений | ||
|---|---|---|---|---|---|
| Fe-4-5 МИП | Fe-4-5 МАП | Fe-4-5 | Fe-4-5 МИП | Fe-4-5 МАП | |
| Массовые % | 23.1 | 21.1 | 15.6 | 7.4 | 7.5 |
| Атомные % | 9.0 | 8.5 | 5.9 | 2.8 | 3.0 |
Представляло также интерес использовать данные электрофоретических измерений для расчета электрокинетического потенциала с учетом того, что частицы ПС обладают электролитической проводимостью и что в порах частиц ПС происходит электроосмотический перенос жидкости при ее движении во внешнем электрическом поле.
Для оценки величины электрокинетического потенциала из электрофоретической подвижности частиц (предполагая, что удельная электропроводность проводящей частицы с большим, по сравнению с приведенной толщиной ДЭС, радиусом равна удельной электропроводности мембраны κM, измельчением которой получены пористые частицы) можно использовать уравнение Генри в следующем виде [2, 12–15]:
(4)
${{\zeta }^{{\text{H}}}} = \frac{{\eta }}{{{\varepsilon }{{{\varepsilon }}_{{\text{0}}}}}}{{U}_{{\text{e}}}}\left( {{\text{1}} + \frac{{{{\kappa }_{{\text{M}}}}}}{{{\text{2}}{{\kappa }_{{\text{V}}}}}}} \right) = {{\zeta }^{{\text{S}}}}\left( {{\text{1}} + \frac{{\alpha }}{{{\text{2}}{{{\beta }}_{{{\text{к о н }}}}}}}} \right),$В работе [2] с использованием предложенного в [16] подхода к описанию электрофоретического движения пористых частиц было получено уравнение, позволяющее рассчитать электрокинетический потенциал пористой частицы, размеры которой намного больше, чем размеры поровых каналов, с учетом электроосмоса в порах:
(5)
$\zeta = \frac{{\eta }}{{{\varepsilon }{{{\varepsilon }}_{{\text{0}}}}}}\left[ {\frac{{{\text{3}}{{U}_{{\text{e}}}}}}{{{\text{(3}} - {{W}_{{{\text{к о н }}}}}{\text{)}}}} - \frac{{{{E}_{{\text{S}}}}\kappa }}{{{\text{2}}P}}} \right],$Таблица 3.
Электрокинетические потенциалы пористых стекол в растворах NaCl в нейтральной области pH
| Пористое стекло* | C, М | − ζS, мВ | − ζH, мВ | − ζ, мВ | − $\zeta _{\alpha }^{*},$ мВ |
|---|---|---|---|---|---|
| 8В-НТ МИП ${{{r}_{{{{{\text{S}}}_{{\text{0}}}},{\text{к о н }}}}}}$= 2.1–2.3 нм Wкон = 0.29, βкон = 24.0 |
10−3 | 30 | 34 | 33 | 27 |
| 10−2 | 30 | 31 | 33 | 31 | |
| 8В-НТ МАП rβ,кон = 13.9 нм Wкон = 0.56, βкон = 3.0 |
10−3 | 30 | 50 | 29 | 56 |
| 10−2 | 30 | 35 | 28 | 28 | |
| Fe-4-5 МИП ${{{r}_{{{{{\text{S}}}_{{\text{0}}}},{\text{к о н }}}}}}$= 2.3–2.4 нм Wкон = 0.23, βкон = 42.5 |
10−3 | 36 | 39 | 38 | 29 |
| 10−2 | 34 | 35 | 36 | 29 | |
| Fe-4-5 МАП rβ,кон = 17.2 нм Wкон = 0.49, βкон = 5.0 |
10−3 | 36 | 70 | 30 | 69 |
| 10−2 | 32 | 38 | 24 | 40 |
* ${{{r}_{{{{{\text{S}}}_{{\text{0}}}},{\text{к о н }}}}}}$ и rβ,кон – средние радиусы пор, найденные из величин удельной поверхности и коэффициентов фильтрации после проведения измерений электрокинетических характеристик мембран [1].
Видно, что учет собственной проводимости частицы заметно сказывается на величинах электрокинетического потенциала ζH только для макропористых стекол 8В-НТ и Fe-4-5, электропроводность которых в несколько раз больше, чем микропористых стекол. Отметим, что для микропористых стекол обоих составов величины электрокинетических потенциалов, рассчитанные из электрофоретической подвижности частиц в рамках использованных приближений, практически одинаковы, т.е. учет электроосмотического переноса жидкости в поровых каналах также практически не влияет на значения ζ вследствие того, что значения объемной пористости МИП мембран невелики и высока степень перекрывания ДЭС.
Сопоставление полученных результатов показывает также, что при обеих концентрациях фонового электролита абсолютные величины электрокинетического потенциала микропористых стекол 8В-НТ и Fe-4-5, найденные из электрофоретических измерений по уравнению (5), несколько больше, чем значения |$\zeta _{\alpha }^{*}$|, найденные из измерений потенциала течения. Это, по-видимому, связано с различным положением границы скольжения на поверхности частицы и в поровом канале.
Для макропористых стекол 8В-НТ и Fe-4-5 наиболее близкими к величинам $\zeta _{\alpha }^{*}$ оказались значения ζH, рассчитанные с учетом электропроводности частиц. Учет влияния электроосмоса в поровых каналах частиц на их электрофоретическую подвижность дает существенно меньшие, чем |$\zeta _{\alpha }^{*}$|, величины |ζ| в более разбавленном растворе NaCl. Возможно, такое несоответствие связано в первую очередь с тем, что уравнение (5) получено при условии малых потенциалов. Кроме того, при высоких значениях объемной пористости усредненное по поверхности пористой частицы значение потенциала может отличаться от потенциала у поверхности порового канала, что также в большей степени будет проявляться в разбавленном растворе.
ЗАКЛЮЧЕНИЕ
Анализ результатов определения равновесных электроповерхностных характеристик пористых стекол показал, что введение оксида железа в матрицу стекла приводит к росту абсолютной величины поверхностного заряда композитного материала, по сравнению с высококремнеземным ПС, полученным из базового натриевоборосиликатного стекла. Увеличение значений |σо|, в свою очередь, приводит к росту абсолютных величин электрокинетического потенциала, найденного методом потенциала течения, для железосодержащих макропористых стекол по сравнению с базовыми ПС.
Анализ величин электрокинетических потенциалов, найденных с использованием комплекса экспериментальных данных о потенциале течения, электрофоретической подвижности частиц ПС, удельной электропроводности ПС, структуре порового пространства, показал, что для микропористых стекол различия в рассчитанных с использованием разных моделей значениях |ζi| не превышают 10–15% от средней величины. Это связано как с небольшой удельной электропроводностью частиц при малых значениях объемной пористости, так и с высокой степенью перекрывания ДЭС в поровых каналах, что приводит к уменьшению влияния “вторичных” эффектов (электролитической проводимости частиц ПС, электроосмоса в поровых каналах) на электрофоретическую подвижность. Сопоставление величин электрокинетических потенциалов, найденных различными методами для макропористых стекол, свидетельствует, по-видимому, о разных условиях течения жидкости вдоль заряженной поверхности пористой частицы и в поровом канале такой частицы.
Обнаружено также различное положение изоэлектрической точки для свежеприготовленных железосодержащих ПС и аналогичных ПС, длительное время контактировавших с индифферентным электролитом.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований, проект 17-03-01011а.
Образцы двухфазных стекол изготовлены в ИХС РАН в рамках госзадания (номер госрегистрации темы АААА-А16-116020210284-7). Исследования проведены с использованием оборудования Научного парка СПбГУ (Междисциплинарный ресурсный центр по направлению “Нанотехнологии”, ресурсные центры “Рентгенодифракционные методы исследования” и “Криогенный отдел”). Авторы благодарят И.Н. Анфимову за помощь в изготовлении образцов двухфазных и пористых стекол.
Список литературы
Ермакова Л.Э., Гринкевич Е.А., Волкова А.В., Антропова Т.В. // Коллоид. журн. 2018. Т. 80. С. 518.
Ермакова Л.Э., Волкова А.В., Антропова Т.В., Жуков А.Н. // Коллоид. журн. 2015. Т. 77. С. 302.
Lyklema J. Fundamentals of Interface and Colloid Science. V. 2. San Diego: Academic Press, 2001.
Ермакова Л.Э., Волкова А.В., Кузнецова А.С., Гринкевич Е.А., Антропова Т.В. // Коллоид. журн. 2018. Т. 80. С. 272.
Волкова А.В., Ермакова Л.Э., Антропова Т.В., Сидорова М.П. // Коллоид. журн. 2010. Т. 72. С. 8.
Ермакова Л.Э., Волкова А.В., Фараонова В.В., Антропова Т.В. // Коллоид. журн. 2016. Т. 78. С. 722.
Levine S., Marriott J.R., Neale G., Epstein N. // J. Colloid Interface Sci. 1975. V. 52. P. 136.
Ермакова Л.Э., Волкова А.В., Антропова Т.В., Муртузалиева Ф.Г. // Коллоид. журн. 2014. Т. 76. С. 594.
Barz D.P.J., Vogel M.J., Steen P.H. // Langmuir. 2009. V. 25. P. 1842.
Mathes J., Friess W. // Eur. J. Pharm. Biopharm. 2011. V. 78. P. 239.
Волкова А.В., Ермакова Л.Э., Кашпурина Е.А., Пшенко О.А., Антропова Т.В. // Физика и химия стекла. 2016. Т. 42. С. 446.
Ermakova L., Sidorova M., Jura N., Savina I. // J. Membr. Sci. 1997. V. 131. P. 125.
Ermakova L., Bogdanova N., Sidorova M., Lyklema J. // Nanoscience. Colloidal and Interfacial Aspects. Surfactant Sci. Series. V. 147 / Ed. by Starov V.M. New York: CRC Press, 2010. P. 193.
Духин С.С., Дерягин Б.В. Электрофорез. М.: Наука, 1976.
Volkova A., Ermakova L., Volkova M., Antropova T. // Opt. Appl. 2010. V. 40. P. 341.
Chen G., Tallarek U. // Langmuir. 2003. V. 19. P. 10 901.
Miller N.P., Berg J.C., O’Brien R.W. // J. Colloid Interface. Sci. 1992. V. 153. P. 237.
Levine S., Neale G.H. // J. Colloid Interface. Sci. 1974. V. 47. P. 520.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал