Коллоидный журнал, 2019, T. 81, № 3, стр. 296-305
Наночастицы Ag(0), стабилизированные полиэтиленгликолями, модифицированными аминогруппами: формирование и свойства в растворах
А. С. Губарев 1, А. А. Лезов 1, М. Е. Михайлова 1, А. С. Сеньчукова 1, Е. В. Убыйвовк 1, Т. Н. Некрасова 2, Н. В. Гирбасова 3, А. Ю. Билибин 3, Н. В. Цветков 1, *
1 Санкт-Петербургский государственный университет, физический факультет
199034 Санкт-Петербург, Россия
2 Институт высокомолекулярных соединений РАН
199004 Санкт-Петербург, Россия
3 Санкт-Петербургский государственный университет, Институт химии
199034 Санкт-Петербург, Россия
* E-mail: n.tsvetkov@spbu.ru
Поступила в редакцию 23.11.2018
После доработки 29.11.2018
Принята к публикации 03.12.2018
Аннотация
Исследованы восстановительная и стабилизирующая способности трех образцов полиэтиленгликоля, модифицированного первичными аминогруппами по одному либо двум концам полимерной цепи, а также дендронами на основе L-аспарагиновой кислоты по обоим концам полимерной цепи. При комнатной температуре в водных растворах AgNO3 в присутствии модифицированных полиэтиленгликолей образуются устойчивые дисперсии серебряных наночастиц в отсутствие дополнительных восстановителей. Методом спектрофотометрии показано, что увеличение числа аминогрупп, приходящихся на одну полимерную молекулу, приводит к возрастанию скорости формирования наночастиц и улучшению стабилизирующей способности модифицированных полиэтиленгликолей. C привлечением методов молекулярной гидродинамики (аналитическое ультрацентрифугирование и динамическое рассеяние света) определены абсолютные значения молекулярной массы наночастиц серебра, стабилизированных дендронизированным ПЭГ, и их гидродинамические размеры. Результаты, полученные методами молекулярной гидродинамики и электронной микроскопии, приводят к взаимосогласованным оценкам размеров наночастиц серебра.
ВВЕДЕНИЕ
Исследование металлических наночастиц (НЧ) является одним из наиболее эффективно развивающихся направлений современной науки о наноматериалах. Это связано с тем, что металлические НЧ занимают промежуточное положение между атомарным и конденсированным состоянием вещества, что придает им необычные, а в ряде случаев и уникальные свойства. В частности, системы, содержащие металлические НЧ, имеют перспективы использования в качестве компонентов композиционных наноматериалов [1], в микроэлектронике [2, 3], при разработке оптических приборов [4, 5] и селективных катализаторов [6]. Особое место среди НЧ металлов занимают серебряные НЧ, которые, например, уже с успехом применяются для борьбы с биологическим обрастанием мембран [7, 8] или в системах фильтрации воды [9]. Кроме того, благодаря своей антибактериальной активности, НЧ серебра широко используются в медицине [10].
Диспергирование НЧ в растворе зачастую является необходимым условием их дальнейшего практического применения. В связи с этим получение и изучение серебряных НЧ в растворе представляет несомненный научный и практический интерес [11–15]. Однако стабилизация НЧ в растворах биосовместимыми лигандами остается сложной и актуальной проблемой. Нестабилизированные НЧ серебра подвергаются быстрому окислению и легко агрегируют в растворе, что делает невозможным проведение “мокрого” синтеза без введения стабилизаторов. В качестве веществ, контролирующих образование НЧ в растворах с использованием “мокрого” химического синтеза, применяют поверхностно-активные вещества [16], линейные и разветвленные полимерные молекулы [17, 18], а также дендримеры [19, 20]. Как правило, серебряные НЧ в растворе получают путем восстановления ионов серебра в присутствии органических стабилизаторов, аналогично известному методу Бруста синтеза НЧ золота [21]. Ионы Ag+ восстанавливают до металлического серебра Ag(0) борогидридом натрия [22], цитратом натрия [23, 24], аскорбиновой кислотой [25], газообразным водородом [26] и другими соединениями.
Таким образом, в большинстве случаев при получении нанодисперсного серебра полимер выполняет функцию стабилизатора. Вместе с тем обнаружены полимеры, проявляющие не только стабилизирующие, но и восстановительные свойства [27, 28], применение которых, очевидно, предпочтительно [29]. Одним из таких полимеров является полиэтиленгликоль (ПЭГ), обладающий рядом достоинств, таких как хорошая растворимость в воде, биосовместимость и т.д. Однако при использовании ПЭГ реакция восстановления протекает только при повышенной температуре. Также следует отметить, что при увеличении молекулярной массы ПЭГ наблюдается существенное улучшение его восстанавливающей способности по отношению к ионам серебра, однако при этом понижается стабилизирующая способность полимера, что приводит к агрегированию НЧ и выпадению агрегатов в осадок [30].
Аминогруппы различных типов (первичные, вторичные, третичные) обладают способностью восстанавливать ионы серебра и стабилизировать образующиеся НЧ при комнатной температуре и естественном освещении [31–34]. Следовательно, одним из путей преодоления трудностей при использовании ПЭГ в качестве восстановителя и стабилизатора может являться модификация макромолекул ПЭГ по их концам аминогруппами. Также молекулы ПЭГ могут быть модифицированы концевыми дендритными фрагментами на основе природной аминокислоты. Это позволит, как мы полагаем, улучшить восстановительные и стабилизирующие свойства этих биосовместимых макромолекул.
Таким образом, целью настоящей работы являлось изучение процесса формирования и стабилизации НЧ серебра в водных растворах AgNO3 в присутствии ПЭГ, модифицированного первичными аминогруппами или дендритными фрагментами на основе природной аминокислоты, а также исследование характеристик полученных композитных НЧ в растворах методами молекулярной гидродинамики и электронной микроскопии.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
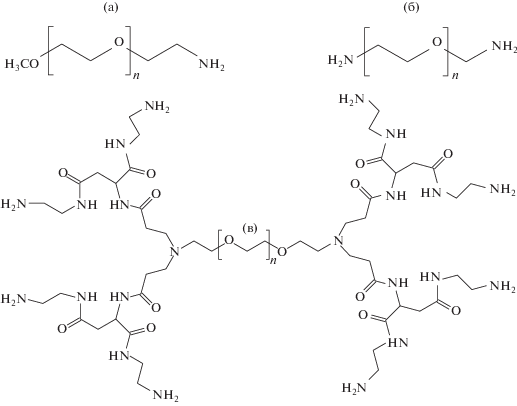
Были синтезированы образцы ПЭГ близкой молекулярной массы (2 кДа), модифицированные первичными аминогруппами по одному (мПЭГ-NН2) и двум (NH2-ПЭГ-NH2) концам, на основе исходных полимеров – метоксиПЭГ (мПЭГ) и ПЭГ (Sigma-Aldrich) соответственно (рис. 1). Полимер NH2-ПЭГ-NH2 являлся основой для последующего синтеза дендронизованного ПЭГ (Д-ПЭГ-Д) с использованием N-акрилоильного производного дендрона 2-ой генерации на основе L-аспарагиновой кислоты с последующей обработкой избытком этилендиамина [35].
Методы исследования
Абсорбционная спектрофотометрия. В качестве метода, позволяющего регистрировать наличие НЧ в растворе и проследить за динамикой их формирования, была использована абсорбционная спектрофотометрия (спектрофотометр UV-1800, Shimadzu Corp, Япония). Спектры поглощения измеряли с шагом 1 нм в диапазоне длин волн λ ∈ [190–1100] нм в кварцевых кюветах с длиной оптического пути 1 см.
Аналитическое ультрацентрифугирование (АУЦ). Поступательное трение макромолекул образцов ПЭГ изучали на аналитической ультрацентрифуге ProteomeLab XLI Protein Characterization System (Beckman Coulter, США). В экспериментах по скоростной седиментации использовали четырехячеечный титановый ротор, позволяющий наблюдать одновременно седиментацию трех образцов. Образцы загружали в двухсекторную алюминиевую ячейку с оптическим ходом 12 мм. Движение седиментационной границы наблюдали при температуре 25°С и скорости ротора 30 000 об./мин с привлечением интерференционной и абсорбционной оптических систем. Полученные данные анализировали с помощью программного обеспечения Sedfit [36, 37], в котором использовали модель “c(s)” (непрерывного распределения по коэффициентам седиментации) и модель “ls-g*(s)” прямого моделирования движения седиментационной границы в среднеквадратичном приближении. Значения коэффициентов седиментации s0, соответствующих пределу бесконечного разбавления, определяли для предельно малых концентраций c, в области значений параметра разбавления Дебая с[η], близких к 0.
Динамическое рассеяние света (ДРС). Исследование методом ДРС производили с помощью установки Photocor Complex (Photocor Instruments Inc., Россия), снабженной коррелятором реального времени (288 каналов, 10 нс), стандартным гониометром и термостатом (точность поддержания температуры составляла ±0.05°C). Источником света служил одномодовый твердотельный лазер (λ0 = 654 нм). Эксперименты проводили в диапазоне углов рассеяния θ от 30° до 130°. Автокорреляционные функции интенсивности рассеянного света были обработаны с использованием программы DynaLS, которая дает распределение ρ(τ) интенсивности рассеянного света по временам релаксации τ. Зависимость 1/τ, где τ отвечает максимуму распределения ρ(τ), от квадрата вектора рассеяния q2 = [(4πn0/λ0)sin(θ/2)]2 (n0 – показатель преломления раствора) для всех исследованных образцов представляла собой прямую, проходящую через начало координат, что указывает на диффузионный характер наблюдаемого процесса: 1/τ = Dq2, D – коэффициент поступательной диффузии. Гидродинамический диаметр был рассчитан по формуле Стокса–Эйнштейна из значения коэффициента поступательной диффузии D0, определенного путем экстраполяции экспериментальных величин D к бесконечному разбавлению:
(1)
${{d}_{{{\text{Д Р С }}}}} = {{{{k}_{{\text{B}}}}T} \mathord{\left/ {\vphantom {{{{k}_{{\text{B}}}}T} {\left( {3\pi {{\eta }_{0}}{{D}_{0}}} \right),}}} \right. \kern-0em} {\left( {3\pi {{\eta }_{0}}{{D}_{0}}} \right),}}$Вискозиметрия. Значения характеристической вязкости [η] определяли из зависимостей приведенной вязкости ηsp/c растворов ПЭГ от концентрации (рис. 2а), используя уравнения Хаггинса и Кремера [38, 39]. Измерения проводили в капиллярном микровискозиметре LOVIS 2000М (Anton Paar GmbH, Австрия), работающем на основе принципа Гепплера.
Рис. 2.
(а) Концентрационные зависимости приведенной вязкости для растворов мПЭГ (1), мПЭГ-NH2 (2), ПЭГ (3), NH2-ПЭГ-NH2 (4), Д-ПЭГ-Д (5); (б) зависимости Δρ = (ρ – ρ0) от концентрации с водных растворов мПЭГ-NH2 (1), NH2-ПЭГ-NH2 (2) и Д-ПЭГ-Д (3) при 25°C; ρ и ρ0 – значения плотности раствора и растворителя.
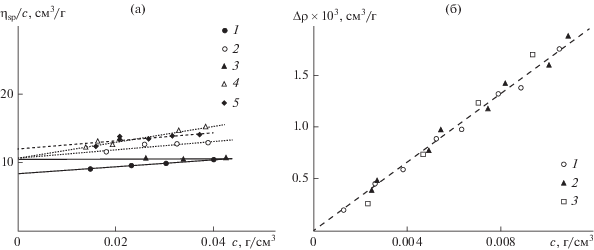
Денситометрия. Концентрационную зависимость плотности растворов ПЭГ изучали на денситометре Anton Paar DMA-5000 в интервале концентраций (0.1–1.1) × 10–2 г/см3 (рис. 2б) [40]. В результате анализа экспериментальных данных было получено среднее значение удельного парциального объема υ = (0.84 ± 0.01) см3/г для трех изученных образцов ПЭГ: мПЭГ-NН2, NH2-ПЭГ-NH2 и Д-ПЭГ-Д. Следует отметить, что данная величина совпадает со значением, известным для линейного незамещенного ПЭГ [41], с точностью, соответствующей экспериментальной методике.
Характеристики использованных растворителей (H2O и MeOH) при 25°C были следующими: плотность 0.9971 и 0.7920 г/см3, динамическая вязкость 0.890 и 0.545 сПз соответственно.
Просвечивающая электронная микроскопия (ПЭМ). Методом аналитической ПЭМ были исследованы размеры, форма, а также химический состав кристаллических частиц, образующихся в процессе синтеза. Каплю дисперсии в метаноле, наносили на медную сетку-держатель с углеродной пленкой. Для удаления излишков полимера образец дополнительно подвергали плазменной обработке в смеси кислорода и аргона. ПЭМ-исследования проводили на микроскопе Zeiss Libra 200 при ускоряющем напряжении 200 кВ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез наночастиц серебра, спектрофотометрия
Процесс синтеза НЧ в случае использования мПЭГ-NH2 и NH2-ПЭГ-NH2 осуществляли путем смешения водных растворов полимера с c = = 4.77 г/дл (мПЭГ-NH2) или с = 2.47 г/дл (NH2-ПЭГ-NH2) и AgNO3 (с = 4.83 г/дл) при комнатной температуре и постоянном перемешивании. Итоговые концентрации полимера и AgNO3 в растворе были следующими: c = 4.72 г/дл (мПЭГ-NH2), c = 2.45 г/дл (NH2-ПЭГ-NH2), c = 0.05 г/дл (AgNO3); соотношение NH2 : AgNO3 = 8.8.
Различающиеся в два раза концентрации мПЭГ-NH2 и NH2-ПЭГ-NH2 были выбраны с целью провести эксперименты при одинаковой концентрации аминогрупп в реакционных смесях и, таким образом, проследить за влиянием их числа в макромолекуле (1 группа в случае мПЭГ-NH2, 2 группы в случае NH2-ПЭГ-NH2) на способность полимера восстанавливать ионы Ag+ и стабилизировать НЧ.
Следует отметить, что в присутствии не содержащих аминогруппы мПЭГ и ПЭГ соответствующих молекулярных масс формирования НЧ не наблюдается в течение длительного времени при сходных концентрациях полимеров и AgNO3. Зависимости поглощения в максимумах поверхностного плазмонного резонанса (ППР) от времени для систем, содержащих NH2-ПЭГ-NH2 (рис. 3а, кривая 1) и мПЭГ-NH2 (кривые 2, 3), демонстрируют не только существенное возрастание скорости роста НЧ при увеличении числа аминогрупп в молекуле ПЭГ, но и различный характер этого процесса.
Рис. 3.
(а) Временны́е зависимости поглощения в максимумах ППР НЧ серебра, синтезируемых в водных растворах NH2-ПЭГ-NH2 (1) и мПЭГ-NH2 (2, 3). Сплошные линии – измеренные значения, пунктир – значения, полученные пересчетом в соответствии с законом Бугера–Ламберта–Бера. (б) Спектры поглощения водных растворов NH2-ПЭГ-NH2/AgNO3 (слева) и мПЭГ-NH2/AgNO3 (справа) спустя разное время после смешения реагентов.
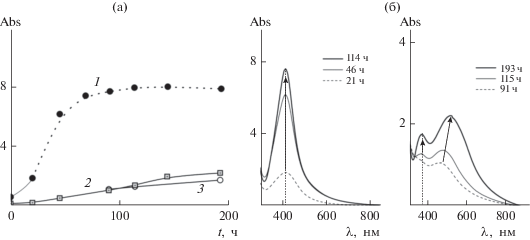
Для измерения спектра поглощения системы, содержащей NH2-ПЭГ-NH2, через 46 ч после смешения реагентов часть раствора была разбавлена в 3 раза. В дальнейшем это разбавление учитывалось при пересчете (с использованием закона Бугера–Ламберта–Бера) измеренного спектра поглощения к концентрации полимера в анализируемой смеси (c = 2.45 г/дл) для удобства сопоставления. Аналогичную процедуру проводили при измерениях во все последующие моменты времени; соответствующие спектры поглощения представлены на рис. 3б. При построении представленных зависимостей измеренные при разных концентрациях спектры приводили к концентрации с = 2.50 г/дл для системы с NH2-ПЭГ-NН2, используя закон Бугера–Ламберта–Бера.
При использовании в качестве восстановителя и стабилизатора NH2-ПЭГ-NH2 регистрируется один возрастающий по интенсивности пик (λ = = 420 нм), свидетельствующий о формировании НЧ. По прошествии двух дней система приходит к равновесию, формирование НЧ прекращается. Далее система остается стабильной: в течение последующих 2-х мес. имеет место лишь незначительное падение величины поглощения (не более чем на 14%) без изменения формы спектра и существенного изменения ширины пика ППР на полувысоте (full width at half-maximum, fwhm), fwhm = 100 нм.
В случае мПЭГ-NH2 наблюдается иной характер формирования и стабилизации НЧ: кроме пика ППР при λ = 376 нм, наблюдается пик в более длинноволновой области, который может быть связан как с полидисперсностью образующихся НЧ, так и с присутствием асимметричных по форме наноструктур за счет частичного агрегирования НЧ (см. рис. 3).
Исходя из всего сказанного выше, можно заключить, что модификация ПЭГ первичными аминогруппами приводит (при добавлении в реакционную систему раствора AgNO3) к формированию и стабилизации НЧ серебра в отсутствие дополнительных восстановителей. Увеличение числа первичных аминогрупп в макромолекулах ПЭГ путем их модификации по двум концам улучшает восстановительную и стабилизирующую способности полимера.
Модифицированный дендронами на основе L-аспарагиновой кислоты по обоим концам полимерной цепи и содержащий 22 аминогруппы (8 – первичных, 12 – вторичных и 2 – третичных) Д-ПЭГ-Д представляется хорошим кандидатом на роль стабилизирующего агента для НЧ серебра с возможностью получения НЧ без введения дополнительных восстановителей.
Стабилизированные НЧ получали смешением водных растворов Д-ПЭГ-Д (с = 2.0 г/дл) и AgNO3 (с = 5.0 г/дл) при комнатной температуре и постоянном перемешивании. Итоговые концентрации полимера и AgNO3 в растворе были равны 1.79 и 0.53 г/дл соответственно; соотношение NH2 : AgNO3 = 1.56 (ΣNHi : AgNO3 = 4.28, i = 0–2). Через 2 ч после смешения бесцветный исходный раствор становился интенсивно окрашенным (красно-коричневым). Одновременно в спектрах поглощения проявлялась полоса ППР в области 400–600 нм с λmax ≈ 470 нм, характерная для НЧ серебра (рис. 4). Спектр поглощения 1, представленный на рис. 4, был получен через 24 ч после смешения реагентов. Для измерения спектра часть раствора была разбавлена в 10 раз. Практически совпадающий спектр был получен аналогичным способом спустя месяц, перед тем как раствор был лиофильно высушен. Для спектра 1 на рис. 4 приведена общая концентрация составляющих компонентов в смеси. Положение максимума полосы поглощения (469 нм) и значение fwhm = 244 нм позволяют предположить, что в растворе образуются НЧ достаточно больших размеров, характеризующиеся высокой степенью полидисперсности. Растворы стабильны во времени (положение максимума полосы поглощения и ее интенсивность не изменяются, по крайней мере, в течение 1 мес.). Таким образом, Д-ПЭГ-Д является и восстановителем ионов серебра, и стабилизатором образующихся НЧ серебра. Высокая степень полидисперсности может быть вызвана как широким распределением образовавшихся НЧ по размерам, так и их агрегированием.
Рис. 4.
Спектры поглощения дисперсий НЧ, стабилизированных Д-ПЭГ-Д: 1 – в водной среде (с = 0.23 г/дл), 2 – в метаноле (с = 0.04 г/дл).
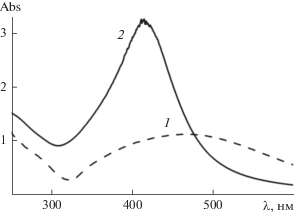
Для дальнейших гидродинамических исследований водные растворы Д-ПЭГ-Д + НЧ были лиофильно высушены, а осадки переведены в метанол (концентрация после редиспергирования составляла с = 0.04 г/дл). Представленный на том же рис. 4 спектр поглощения 2 дисперсии лиофилизованных композитных НЧ в метаноле характеризуется положением максимума ППР на длине волны 415 нм и fwhm = 100 нм (т.е. полоса ППР заметно уже, чем в случае водной дисперсии). Полученный результат подтверждает предположение о том, что агрегирование НЧ в воде вносит существенный вклад в полидисперсность полученной системы.
Далее был проведен комплексный анализ образцов модифицированных ПЭГ и дисперсий НЧ серебра, полученных с их помощью, с привлечением методов молекулярной гидродинамики и микроскопии.
Молекулярная гидродинамика
На рис. 2а представлены зависимости приведенной вязкости от концентрации для образцов исходных и модифицированных ПЭГ в воде при 25°C. Все зависимости носят линейный характер. Экстраполяция к бесконечно разбавленному раствору позволила определить значения характеристической вязкости и постоянные Хаггинса для образцов исходных и модифицированных ПЭГ (табл. 1), использованных в качестве восстановителей ионов серебра и стабилизаторов образующихся НЧ.
Таблица 1.
Коэффициенты характеристической вязкости [η], коэффициенты Хаггинса k' и молекулярные массы М для исходных и модифицированных ПЭГ в водных растворах при 25°C
| Образец | [η], дл/г | k' | M, г/моль |
|---|---|---|---|
| мПЭГ | 0.08 | 0.76 | 1900 |
| мПЭГ-NH2 | 0.11 | 0.52 | – |
| ПЭГ | 0.09 | 0.04 | 2400 |
| NH2-ПЭГ-NH2 | 0.13 | 0.96 | – |
| Д-ПЭГ-Д | 0.12 | 0.51 | 3100* |
Известно, что в предполагаемом диапазоне молекулярных масс коэффициенты в уравнении Марка–Куна–Хаувинка для ПЭГ не могут быть определены однозначно [42, 43]. В табл. 1 представлены значения молекулярной массы образцов ПЭГ, рассчитанные из соотношений, установленных в работе [42]. Незначительной рост характеристической вязкости при модификации ПЭГ аминогруппами может быть связан с частичной ассоциацией макромолекул в водной среде. Чтобы исключить возможное влияние ассоциации на характеристики Д-ПЭГ-Д и Д-ПЭГ-Д + НЧ в растворах, дальнейшие исследования гидродинамическими и оптическими методами были проведены в среде метанола.
В результате изучения процессов поступательного трения (АУЦ и ДРС) макромолекул Д-ПЭГ-Д и стабилизированных им НЧ были определены коэффициенты седиментации s0 и диффузии D0, характеризующие изучаемые системы в условиях приближения к бесконечному разбавлению. При этом в методе АУЦ, как отмечалось выше, были задействованы обе оптические системы: абсорбционная и интерференционная. Использование первой оптической системы позволило получить данные о скорости движения седиментационной границы НЧ, а второй системы – комплекс данных для несвязанных макромолекул Д-ПЭГ-Д и Д-ПЭГ-Д + НЧ (рис. 5, табл. 2).
Рис. 5.
Нормированные распределения величин c(s) (1, 2) и ls-g*(s) (3) по значениям диаметра dsf, полученные для Д-ПЭГ-Д (1) и Д-ПЭГ-Д + НЧ (2, 3) в MeOH.
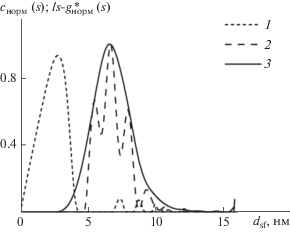
Таблица 2.
Гидродинамические характеристики и молекулярные массы Д-ПЭГ-Д и Д-ПЭГ-Д + НЧ в метанольных растворах при 25°C
| Образец | D0 × 107, см2/c |
s0, Св | (f/fsph)0 | A0, г см2 с–2 К–1 моль–1/3 |
МsD/Msf*, г/моль |
dДРС, нм | dsf, нм | dПЭМ, нм |
|---|---|---|---|---|---|---|---|---|
| Д-ПЭГ-Д | 17.4 | 1.5 | 1.2 | 2.9 | 6400/3200* | 4.6 | 2.6 ± 0.3 | – |
| Д-ПЭГ-Д + НЧ | 4.7 | 22.7 | 1.0 | 3.0** | 360 000/160 000* | 17.0 | 7.5 ± 0.2 | 3.6 |
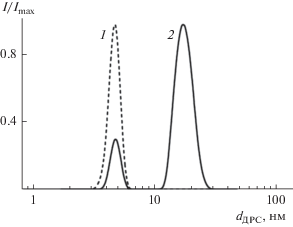
Также методом ДРС были исследованы растворы Д-ПЭГ-Д и Д-ПЭГ-Д + НЧ в метаноле. Результаты, представлены на рис. 6 и в табл. 2. Видно, что в растворах Д-ПЭГ-Д + НЧ присутствуют частицы двух размеров, соответствующих Д-ПЭГ-Д и НЧ Ag, стабилизированным этим полимером.
Рис. 6.
Нормированные распределения интенсивности рассеянного света I/Imax по гидродинамическим радиусам частиц, полученные для Д-ПЭГ-Д (1) и Д‑ПЭГ-Д + НЧ (2) в MeOH.
Сопоставление гидродинамических характеристик [η], D0, s0 позволяет рассчитать гидродинамический инвариант [44]
(2)
${{A}_{0}} = {{\left( {R{{{\left[ D \right]}}^{2}}\left[ s \right]\left[ \eta \right]} \right)}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}},$(3)
${{M}_{{{\text{sD}}}}} = \left( {{{RT} \mathord{\left/ {\vphantom {{RT} {\left( {1{\text{ }}--\upsilon {{\rho }_{0}}} \right)}}} \right. \kern-0em} {\left( {1{\text{ }}--\upsilon {{\rho }_{0}}} \right)}}} \right)\left( {{{{{s}_{0}}} \mathord{\left/ {\vphantom {{{{s}_{0}}} {{{D}_{0}}}}} \right. \kern-0em} {{{D}_{0}}}}} \right) = R{{\left[ s \right]} \mathord{\left/ {\vphantom {{\left[ s \right]} {\left[ D \right]}}} \right. \kern-0em} {\left[ D \right]}},$(4)
${{M}_{{{\text{sf}}}}} = 9\pi {{2}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{N}_{{\text{A}}}}{{\left( {\left[ s \right]{{{\left( {{f \mathord{\left/ {\vphantom {f {{{f}_{{{\text{sph}}}}}}}} \right. \kern-0em} {{{f}_{{{\text{sph}}}}}}}} \right)}}_{0}}} \right)}^{{{3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}}}}{{\upsilon }^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$(5)
${{d}_{{{\text{sf}}}}} = 3{{\left( {2\left[ s \right]\upsilon \left( {{f \mathord{\left/ {\vphantom {f {{{f}_{{{\text{sph}}}}}}}} \right. \kern-0em} {{{f}_{{{\text{sph}}}}}}}} \right)_{0}^{3}} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}.$Результаты, полученные с помощью соотношений (3)–(5), приведены в табл. 2. Таким образом, средний размер “свободных” макромолекул Д-ПЭГ-Д в растворе равен 3.6 ± 1 нм, тогда как композитные частицы Д-ПЭГ-Д + НЧ имеют больший характерный размер – 7–17 нм. Различие в значениях MsD и Msf, не является критичным и в основном связано со сложностью изучаемых систем: нижним пределом по разрешению размеров и заметной полидисперсностью изучаемых объектов. Кроме того, нужно отметить, что значения Msf носят, скорее, оценочный характер в связи с известными и ранее описанными сложностями определения коэффициента диффузии Dsf по значениям (f/fsph)0 [45–47].
Просвечивающая электронная микроскопия
Результаты, полученные методом ПЭМ, представлены на рис. 7–9. Согласно данным ПЭМ образуется большое количество кристаллических НЧ округлой формы (рис. 7) со средним диаметром 3.6 нм (рис. 8), частицы менее 1.5 нм не анализировались из-за слабого контраста. Также на ПЭМ-изображениях обнаружены крупные асимметричные образования, диаметр круга эквивалентной площади для них составляет 20–50 нм. Численная доля таких асимметричных структур не превышает нескольких процентов (рис. 8).
Рис. 7.
(а) ПЭМ-изображение серебряных НЧ; (б) изображение серебряной НЧ, полученное при высоком разрешении.

Рис. 8.
Нормированная гистограмма распределения НЧ Ag по размерам, полученная в результате анализа данных ПЭМ.
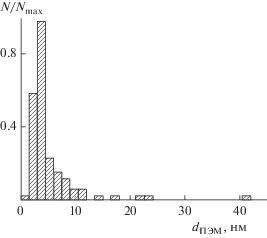
Рис. 9.
ПЭМ-изображение (слева) и спектры, полученные методом энергодисперсионного рентгеновского микроанализа, малых НЧ (А), крупных образований (Б) и подложки (В). Пунктиром обведены анализируемые области.
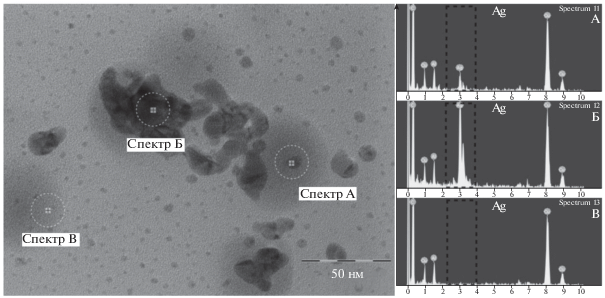
На рис. 9 представлены ПЭМ-изображение НЧ, а также спектры, полученные методом энергодисперсионного рентгеновского микроанализа. Первый спектр (А) был измерен в центре малой НЧ, второй (Б) – в центре крупного образования, кроме того был измерен спектр В подложки в том месте, где НЧ отсутствуют. Сигналы от серебра присутствуют только на первых двух спектрах. Это свидетельствует о том, что образования, наблюдаемые на подложке, действительно представляют собой НЧ серебра. Отметим, что дополнительные линии на спектрах НЧ совпадают с линиями на спектре подложки.
Как уже было сказано, средний размер индивидуальных НЧ серебра по данным ПЭМ составляет dПЭМ = 3.6 нм, т.е. он заметно меньше, чем гидродинамические размеры композитных частиц Д-ПЭГ-Д + НЧ, полученные методами ДРС и АУЦ. Это не удивительно, так как гидродинамический радиус композитной частицы обусловлен не только размерами самой НЧ Ag, но и окружающими ее макромолекулами стабилизатора – дендронизованного ПЭГ. Используя значение dПЭМ = 3.6 нм (и плотность серебра ρAg ≈ 10 г/см3) для НЧ Аg, по данным ПЭМ можно оценить ее молярную массу:
(6)
${{M}_{{{\text{П Э М }}}}} = \pi d_{{{\text{П Э М }}}}^{3}{{\rho }_{{{\text{Ag}}}}}{{{{N}_{{\text{A}}}}} \mathord{\left/ {\vphantom {{{{N}_{{\text{A}}}}} 6}} \right. \kern-0em} 6},$ЗАКЛЮЧЕНИЕ
В работе показано, что модификация макромолекул ПЭГ аминогруппами приводит к возможности формирования и стабилизации НЧ серебра в водных растворах AgNO3 при комнатной температуре без введения дополнительных восстановителей. Этот факт имеет большое практическое значение применительно к разработке водорастворимых биосовместимых препаратов, содержащих стабильные серебряные НЧ заданного размера.
Проведены исследования трех образцов модифицированного ПЭГ близкой степени полимеризации с целью изучения влияния числа аминогрупп в макромолекуле на восстановительную и стабилизирующую способности ПЭГ. Показано, что увеличение числа аминогрупп, а также модификация аминосодержащими фрагментами по обоих концов полимерной цепи приводят к возрастанию скорости формирования НЧ и улучшению стабилизирующих свойств макромолекул.
Методами аналитического ультрацентрифугирования и динамического рассеяния света получены абсолютные значения молекулярной массы серебряных НЧ, стабилизированных дендронизированным ПЭГ.
Гидродинамические размеры НЧ, определенные методами молекулярной гидродинамики, хорошо коррелируют с оценкой размеров НЧ из данных ПЭМ.
Исследование выполнено за счет гранта Российского научного фонда (проект № 16-13-10 148).
Список литературы
Qureshi Z.A., Ali H.M., Khushnood S. // Int. J. Heat Mass Transfer. 2018. V. 127. P. 838.
Khan R., Zulfiqar, Levartoski de Araujo C.I., Khan T., Rahman M.U., Rehman Z.U., Khan A., Ullah B., Fashu S. // J. Mater. Sci.: Mater. Electron. 2018. V. 29. P. 9785.
Kim E., Park S., Han Y.S., Kim T.H. // Polymer. 2018. V. 150. P. 214.
Zor E. // Talanta. 2018. V. 184. P. 149.
Zhou Y., Zhao Y., Reed J.M., Gomez P.M., Zou S. // J. Phys. Chem. C. 2018. V. 122. P. 12428.
Sharma N., Ojha H., Bharadwaj A., Pathak D.P., Sharma R.K. // RSC Adv. 2015. V. 5. P. 53381.
Zodrow K., Brunet L., Mahendra S., Li D., Zhang A., Li Q., Alvarez P.J.J. // Water Res. 2009. V. 43. P. 715.
Basri H., Ismail A.F., Aziz M. // Membr. Water Treat. 2011. V. 2. P. 25.
Maharubin S., Zhou Y., Tan G.Z. // Sep. Purif. Technol. 2019. V. 212. P. 57.
Feizi S., Taghipour E., Ghadam P., Mohammadi P. // Microb. Pathog. 2018. V. 125. P. 33.
Высоцкий В.В., Урюпина О.Я., Ролдугин В.И., Плачев Ю.А. // Коллоид. журн. 2009. Т. 71. С. 164.
Сенчихин И.Н., Урюпина О.Я., Жаворонок Е.С., Высоцкий В.В., Ролдугин В.И. // Коллоид. журн. 2016. Т. 78. С. 479.
Дементьева О.В., Мальковский А.В., Филиппенко М.А., Рудой В.М. // Коллоид. журн. 2008. Т. 70. С. 607.
Абхалимов Е.В., Ершов Б.Г. // Коллоид. журн. 2007. Т. 69. С. 620.
Абхалимов Е.В., Парсаев А.А., Ершов Б.Г. // Колло-ид. журн. 2011. Т. 73. С. 3.
Pillai Z.S., Kamat P.V. // J. Phys. Chem. B. 2004. V. 108. P. 945.
Dai Y., Zhang X. // Macromol. Mater. Eng. 2018. V. 303. P. 1 800 105.
Garamus V.M., Maksimova T., Richtering W., Aymonier C., Thomann R., Antonietti L., Mecking S. // Macromolecules. 2004. V. 37. P. 7893.
Esumi K., Houdatsu H., Yoshimura T. // Langmuir. 2004. V. 20. P. 2536.
Yu Y., Lin C., Li B., Zhao P., Zhang S. // Green Chem. 2016. V. 18. P. 3647.
Brust M., Fink J., Bethell D., Schiffrin D.J., Kiely C. // J. Chem. Soc. Chem. Commun. 1995. P. 1655.
Zhang J., Yan Z., Fu L., Zhang Y., Yang H., Ouyang J., Chen D. // Appl. Clay Sci. 2018. V. 166. P. 166.
Turkevich J., Stevenson P.C., Hillier J. // Discuss. Faraday Soc. 1951. V. 11. P. 55.
Wang L.P., Huang Y.B., Lai Y.H. // Appl. Surf. Sci. 2018. V. 435. P. 290.
Velikov K.P., Zegers G.E., Van Blaaderen A. // Langmuir. 2003. V. 19. P. 1384.
Evanoff Jr. D.D., Chumanov G. // J. Phys. Chem. B. 2004. V. 108. P. 13948.
de Souza V.C., Barros C.H.N., Tasic L., Gimenez I.F., Teixeira Camargo Z. // Carbohydr. Polym. 2018. V. 202. P. 11.
Ortega-Munoz M., Blanco V., Hernandez-Mateo F., Lopez-Jaramillo F.J., Santoyo-Gonzalez F. // ChemCatChem. 2017. V. 9. P. 3965.
Fereshteh Z., Rojaee R., Sharifnabi A. // Superlattices Microstruct. 2016. V. 98. P. 267.
Luo C., Zhang Y., Zeng X., Zeng Y., Wang Y. // J. Colloid Interface Sci. 2005. V. 288. P. 444.
Некрасова Т.Н., Золотова Ю.И., Назарова О.В., Левит М.Л., Суворова Е.И., Сироткин А.К., Баклагина Ю.Г., Диденко Е.В., Паутов В.Д., Панарин Е.Ф. // Докл. АН. 2012. Т. 446. С. 527.
Некрасова Т.Н., Андреева Л.Н., Лезов А.А., Безрукова М.А., Назарова О.В., Золотова Ю.И., Цветков Н.В., Панарин Е.Ф. // Высокомолек. соед. А. 2015. Т. 57. С. 99.
Золотова Ю.И., Назарова О.В., Некрасова Т.Н., Безрукова М.А., Мелентьев А.В., Добродумов А.В., Панарин Е.Ф. // Журн. прикл. химии. 2018. Т. 91. С. 554.
Chen M., Feng Y.G., Wang X., Li T.C., Zhang J.Y., Qian D.J. // Langmuir. 2007. V. 23. P. 5296.
Гирбасова Н.В., Мигунова Н.В., Распопова И.Р., Билибин А.Ю. // Высокомолек. соед. А. 2003. Т. 45. С. 550.
Schuck P. // Biophys. J. 2000. V. 78. P. 1606.
http://www.analyticalultracentrifugation.com/.
Huggins M.L. // J. Phys. Chem. 1938. V. 42. P. 911.
Kraemer E.O. // Ind. Eng. Chem. 1938. V. 30. P. 1200.
Kratky O., Leopold H., Stabinger H. // Meth. Enzymol. 1973. V. 27. P. 98.
Wohlfarth C. // Polymer Solutions: Physical Properties and Their Relations I (Thermodynamic Properties: pVT data and miscellaneous properties of polymer solutions) / Ed. by Lechner M.D., Arndt K.F. Berlin: Springer, 2010. P. 461.
Kawaguchi S., Imai G., Suzuki J., Miyahara A., Kitano T., Ito K. // Polymer 1997. V. 38. P. 2885.
Grube M., Leiske M.N., Schubert U.S., Nischang I. // Macromolecules. 2018. V. 51. P. 1905.
Tsvetkov V.N. Rigid-Chain Polymers. London: Consult. Bureau. Plenum, 1989. P. 490.
Pavlov G.M., Perevyazko I.Y., Okatova O.V., Schubert U.S. // Methods. 2011. V. 54. P. 124.
Perevyazko I., Gubarev A.S., Tauhardt L., Dobrodumov A., Pavlov G.M., Schubert U.S. // Polym. Chem. 2017. V. 8. P. 7169.
Gubarev A.S., Monnery B.D., Lezov A.A., Sedlacek O., Tsvetkov N.V., Hoogenboom R., Filippov S.K. // Polym. Chem. 2018. V. 9. P. 2232.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал