Коллоидный журнал, 2019, T. 81, № 3, стр. 401-408
Кислотно-основные свойства и биологическая активность фосфата крахмала в форме микрогелей
Т. Л. Юркштович 1, Н. В. Голуб 1, С. О. Соломевич 1, *, Р. И. Костерова 1, Н. К. Юркштович 1, В. А. Алиновская 1, П. М. Бычковский 2
1 Учреждение Белорусского государственного университета
“Научно-исследовательский институт физико-химических проблем”
220030 Минск, ул. Ленинградская, 14, Белоруссия
2 Учебно-научно-производственное республиканское унитарное предприятие “УНИТЕХПРОМ БГУ”
220045 Минск, ул. Курчатова, 1, Белоруссия
* E-mail: sergeysolomevich@gmail.com
Поступила в редакцию 04.10.2018
После доработки 04.10.2018
Принята к публикации 19.12.2018
Аннотация
Определены показатели кажущихся констант ионизации фосфатных групп фосфорилированного крахмала в виде микрогелей с размерами в диапазоне значений 300–500 мкм. Показано, что в кислотно-основных равновесиях крахмала, фосфорилированного в системе ортофосфорная кислота−мочевина, существенную роль играют водородные связи с участием фосфатных и карбаматных групп. Установлено, что кислотные свойства микрогелей фосфата крахмала практически не зависят от ионной силы раствора (0.05–0.5), концентрации фосфатных групп (2.0–3.8 ммоль/г). В опытах in vitro на культуре клеток HeLa выявлена цитостатическая активность микрогелей фосфата крахмала.
ВВЕДЕНИЕ
В последние годы интенсивно развиваются исследования в области разработки нано- и микроразмерных систем доставки лекарственных веществ (ЛВ) в организм. Это обусловлено способностью таких систем преодолевать биологические барьеры и осуществлять направленный транспорт ЛВ в орган-мишень, обеспечивать пролонгацию его действия при одновременной минимизации побочных эффектов, увеличивать биодоступность и т.д. Определенные преимущества имеют нано- и микроразмерные системы доставки ЛВ на основе полисахаридов, заключающиеся в их биосовместимости с тканями организма, высокой гидрофильности, биодеградируемости, отсутствии структурных единиц, способных оказывать токсическое воздействие на организм.
Одним из наиболее перспективных полисахаридов для создания нано- и микроразмерных систем адресной доставки ЛВ в организм является крахмал, макромолекулы которого состоят из остатков α-D-глюкопиранозы, связанных между собой α-1,4- и α-1,6-глюкозидными связями. Крахмал представляет собой смесь двух структурно различных гомополисахаридов (D-глюканов) – амилозы и амилопектина, различающихся степенью полимеризации и степенью разветвленности.
Полидисперсии микрогелей сшитого крахмала, полученные посредством взаимодействия полисахарида с эпихлоргидрином, стали применяться в фармакологии уже с 1994 г. [1]. Вместе с тем, низкая степень набухания и сравнительно быстрое высвобождение ЛВ из фазы сетчатого полисахарида ограничивает использование микрогелей в качестве высокомолекулярного носителя. В этой связи совершенствуются способы введения в состав микро- и наночастиц крахмала различных функциональных групп: ацетатных, альдегидных, карбоксильных, фосфатных и др. [2–5], позволяющих регулировать такие свойства гидрогелей как скорость биодеградации, сорбционная емкость, скорость высвобождения ЛВ.
Фосфорилирование крахмала является одним из путей придания ему гелеобразующих, ионообменных, комплексообразующих свойств, а также собственной биологической активности [5]. Имеется достаточно много публикаций, посвященных изучению физико-химических свойств фосфатов крахмала (ФК) методами 13С, 1Н, 31Р ЯМР-спектроскопии, элементного анализа, ИК-спектроскопии, рентгенофазового анализа, электронной микроскопии [5, 6]. В то же время практически полностью отсутствуют сведения о влиянии обменной емкости и степени набухания образующихся ФК в форме микрогелей на их кислотно-основные свойства, реакционную способность при взаимодействии с низко- и высокомолекулярными ионами биологически активных веществ.
В работе приведены результаты исследования кислотно-основных свойств и противоопухолевой активности фосфата крахмала в форме микрогелей, полученных этерификацией крахмала ортофосфорной кислотой в расплаве мочевины и характеризующихся различным содержанием функционально-активных групп и разной степенью набухания.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объекта исследования использовали картофельный крахмал (содержание амилозы – 23.8 мас. %), ортофосфорную кислоту (${\rho }_{4}^{{20}}$ = = 1.698 г/мл, с = 85.4%) и мочевину (ГОСТ 6691-77).
Na-форму ФК получали в соответствии с [7]. Для этерификации крахмала использовали смеси ортофосфорной кислоты и мочевины при мольных соотношениях глюкопиранозное звено (ГПЗ) : Н3РО4 : (NH2)2CO, равных 1.0 : (0.4–0.8) : 4.0. Для полученных образцов ФК разной степени замещения (СЗ) определяли содержание фосфора [8], азота [9], степень набухания в воде [5, 7]. Кислотные свойства образцов ФК оценивали методом потенциометрического титрования. Для этого Na-соль ФК переводили в Н-форму обработкой 0.2 н. водно-спиртовым (мольная доля этанола 0.7) раствором соляной кислоты в течение 0.5 ч с последующей фильтрацией на фильтре Шотта с размером пор 100 мкм. Отмывку и сушку полученных образцов ФК в Н-форме проводили одним из способов:
1) отмывка 70%-ным этиловым спиртом в аппарате Сокслета, сушка при 293 К и атмосферном давлении,
2) пятикратная обработка при механическом перемешивании в течение 1 ч 50%-ным этиловым спиртом (массовый модуль 1 : 10) с последующим отделением твердой фазы на фильтре Шотта и сушкой при 293 К и атмосферном давлении.
Полноту отмывки контролировали определением хлорид-ионов в промывных растворах. Высушенные образцы Н-формы ФК измельчали и просеивали через сито для получения частиц размером 1.0–2.0 мкм. Потенциометрическое титрование образцов Н-формы ФК проводили методом одной навески на фоне ионной силы I = 0.05 и 0.5 [10]. В качестве титранта использовали 0.05 н. раствор гидроксида натрия, содержащего фиксированное количество NaCl в качестве фонового электролита. Отношение массы образца ФК к объему раствора составляло 1 : 250. Результаты потенциометрического титрования представлены в виде зависимости pH–m, а также дифференциальных кривых в координатах dpH/dm–m (m – количество гидроксида натрия в каждой точке титрования, мг-экв/г). Для определения кажущихся констант диссоциации фосфатных групп ФК (pKi) использовали графический способ решения уравнения Гендерсона–Гассельбаха
где n – коэффициент кооперативности процесса ионизации, αi – степень ионизации фосфатных групп по первой ступени,ИК-спектры ФК записывали при комнатной температуре на фурье-спектрофотометре Thermo Nicolet FT-IR Nexus. Образцы получали методом прессования ФК с бромидом калия.
Противоопухолевое действие гидрогелей Na-формы ФК было исследовано в условиях in vitro на монослойной культуре опухолевых клеток HeLa (эпителиоидная карцинома шейки матки человека, клон М). Противоопухолевый эффект оценивали по уменьшению количества опухолевых клеток в присутствии ФК (опытная группа) по отношению к контролю (100%):
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Продукты, получаемые при этерификации крахмала ортофосфорной кислотой в расплаве мочевины, представляют собой макропористые микрогели, средний размер которых в набухшем состоянии лежит в интервале от 300 до 500 мкм.
Результаты элементного анализа (табл. 1) показывают, что с ростом концентрации ортофосфорной кислоты в этерифицирующей смеси в продуктах реакции увеличивается содержание фосфора (CP) и азота (CN), входящих в состав фосфатных и карбаматных групп, присутствие которых подтверждено ИК-спектроскопически.
Таблица 1.
Физико-химические свойства образцов ФК, полученных этерификацией крахмала ортофосфорной кислотой в расплаве мочевины. Продолжительность процесса – 4 ч, температура 408 К, давление 0.005−0.1 МПа, мольное соотношение ГПЗ : мочевина = 1 : 4
| Образец | Мольное соотношение ГПЗ : Н3РО4 | СЗ | CN, ммоль/г | CР, ммоль/г | Q, г/г | ОЕ1, мг-экв/г | pK1 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Na-форма | Н-форма | Na-форма | Н-форма | ионная сила | |||||||
| 0.05 | 0.5 | 0.05 | 0.5 | ||||||||
| ФК1 | 1 : 0.4 | 0.43 | 1.9 | 2.0 | 2.0 | 30.8 | 16.6 | 1.9 | 1.9 | 2.9 | 2.9 |
| ФК2 | 1 : 0.6 | 0.83 | 1.9 | 3.1 | 3.3 | 23.5 | 9.3 | 3.3 | 3.3 | 2.7 | 2.7 |
| ФК3 | 1 : 0.8 | 1.04 | 1.7 | 3.6 | 3.9 | 11.7 | 5.1 | 3.7 | 3.7 | 2.7 | 2.7 |
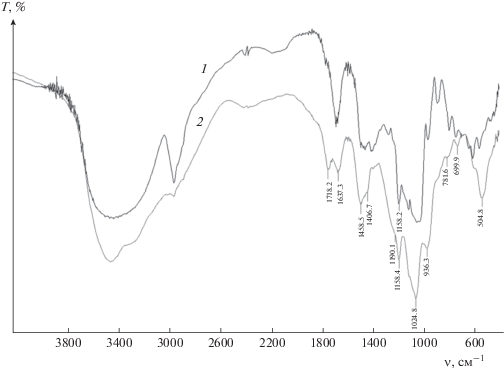
В спектрах продуктов этерификации крахмала по сравнению со спектром исходного полисахарида (рис. 1) появляются новые полосы поглощения: 504 см–1 – деформационные колебания группы Р–О, 936 см–1 – валентные колебания групп Р–ОН, 1718 см–1 – асимметричные валентные колебания C=O карбаматных групп, плечо 1190 см–1 – валентные колебания фосфорильных групп P=O. Максимум полосы поглощения при 1019 см–1, характерной для ИК-спектра исходного крахмала, смещается в высокочастотную область до 1024 см–1 с одновременным увеличением ее интенсивности, что может быть связано с наложением полос поглощения исходного полисахарида и фосфорсодержащих групп (групп –C–O–P–) [5, 11, 12].
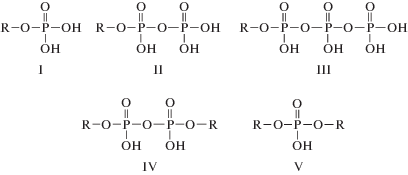
Согласно [7, 13] при этерификации полисахаридов ортофосфорной кислотой в расплаве мочевины возможны следующие продукты реакции (R – макромолекула крахмала):
т.е. каждый атом фосфора в микрогелях ФК имеет одну сильнокислотную гидроксильную группу, а концевые фосфаты – дополнительно слабокислотную группу. Авторы [11] указывают на возможность образования и трехзамещенных эфиров не обладающих кислотными свойствами. Структуры IV, V и VI обуславливают сшивку макромолекул полисахарида, степень которой оценивали опосредованно, по степени набухания (Q) образцов в воде (табл. 1). Видно, что с ростом содержания фосфора степень набухания в воде образцов ФК существенно уменьшается за счет образования пространственной сетки с большим числом сшивок.На основании сопоставления приведенных в литературе [8] численных значений констант ионизации сильно- и слабокислотных групп ортофосфорной, пирофосфорной и триполифосфорной кислот можно сделать вывод, что экспериментально возможно определить только две усредненные константы ионизации ФК, характеризующие либо сильнокислотные, либо слабокислотные группы различных фосфатов. При этом соотношение значений обменной емкости сильно- и слабокислотных групп при фиксированном содержании фосфора в составе ФК зависит от структуры фосфорсодержащих групп. Если в фосфорилированных образцах присутствуют только двухосновные фосфатные группы, соответствующие структуре I, обменная емкость (ОЕ) ФК до первой точки эквивалентности (ОЕ1) будет соответствовать обменной емкости от первой до второй точки эквивалентности (ОЕ2), т.е. CР = = ОЕ1 = ОЕ2. Это соотношение не будет соблюдаться в случае наличия в образцах ФК двухзамещенных фосфатов, полифосфатов (CР = ОЕ1 > ОЕ2), а также трехзамещенных фосфатов (CР > ОЕ1).
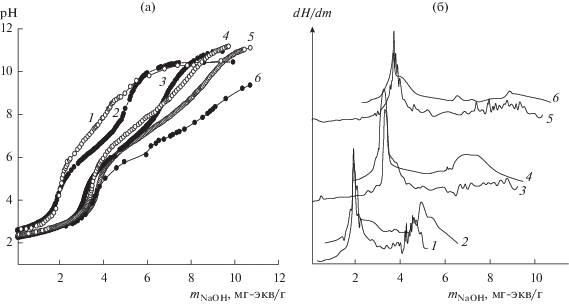
На рис. 2 представлены результаты потенциометрического титрования ФК с разным содержанием фосфора при ионной силе 0.05 и 0.5. Один, ярко выраженный перегиб относится к титрованию сильнокислотной гидроксильной группы по первой ступени и находится для всех изученных образцов ФК в области pH 3.5–4.8. При более высоких значениях pH кривые титрования (1, 3, 5, I = 0.05) имеют практически постоянный наклон, т.е. для второго участка характерно наличие нескольких не явно выраженных ступеней нейтрализации, которые относятся к титрованию слабокислотных фосфорсодержащих групп с близкими значениями pK. Повышение ионной силы на порядок способствует более четкому проявлению скачков на кривых титрования вблизи не только первой, но и второй точки эквивалентности катионитов (рис. 2а, кривые 2, 4, 6). Однако определить полную обменную емкость, рассчитать показатели констант ионизации слабоосновных групп (pK2) гидрогелей ФК в указанном интервале изменения ионной силы невозможно. Так, из дифференциальных кривых титрования (рис. 2б) низкозамещенного образца ФК1 следует, что количество щелочи, пошедшее на титрование слабокислотных групп, больше, чем слабокислотных. Этот факт не согласуется с представленными выше структурными формулами фосфатов и может быть объяснен частичным перекрыванием процессов титрования сильно- и слабокислотных групп. Кроме того, на дифференциальных кривых ФК с высоким содержанием фосфатов (3.1−3.8 ммоль/г) имеется только один ярко выраженный пик, соответствующий обменной емкости по первой ступени (ОЕ1), в более щелочной области pH максимум либо размыт, либо отсутствует.
Рис. 2.
Интегральные (а) и дифференциальные (б) кривые потенциометрического титрования образцов ФК1 (1, 2), ФК2 (3, 4) и ФК3 (5, 6). Ионная сила равна 0.05 (1, 3, 5) и 0.5 (2, 4, 6).
Согласно [10, 14], вероятной причиной неравноценности кислотных свойств слабокислотных гидроксильных групп могут быть не только различия в химической природе входящих в состав крахмала фосфатов, но и наличие водородных связей между фосфатными, фосфатными и карбаматными группами, фосфатными, карбаматными и гидроксильными группами.
Подтверждением образования в составе ФК прочных водородных связей между фосфатами являются данные ИК-спектроскопии. В ИК-спектрах образцов ФК (рис. 1), в отличие от спектра исходного полисахарида, имеется полоса поглощения при 2346 см–1, которая относится к валентным колебаниям OH-групп фосфатов, связанных между собой сильными водородными связями [9]. Кроме того, для ФК, так же как и для нативного крахмала, наблюдается широкая полоса поглощения в области 3650−3100 см–1, которая соответствует гидроксильным группам, участвующим в меж- и внутримолекулярных водородных связях. Видно, что при переходе от исходного полисахарида к ФК максимум полосы поглощения OH-групп смещается в область более высоких частот, наблюдается изменение формы полосы, увеличивается интенсивность поглощения в области более низких частот. Такой характер изменения полосы поглощения свидетельствует о том, что с увеличением содержания фосфора в полисахариде растет доля гидроксилов, включенных в более сильные водородные связи [15]. Очевидно, это может быть связано с тем, что в этом же направлении увеличивается количество гидроксильных групп, участвующих в образовании межмолекулярных водородных связей с фосфорсодержащими и карбаматными группами. При этом локальная прочность системы водородных связей будет зависеть как от локальной концентрации функциональных групп, так и от числа сшивок между макромолекулами полисахарида, образующих полимерную сетку. Различия в локальной прочности системы водородных связей могут являться причиной неоднородности кислотно-основных свойств слабокислотных групп.
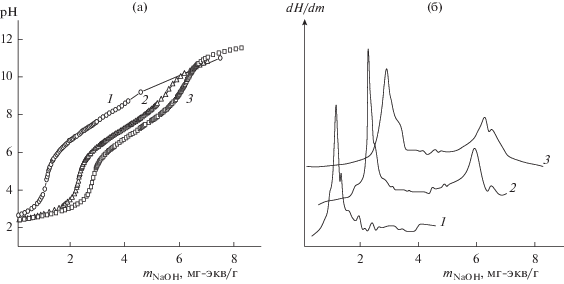
Полученные экспериментальные данные свидетельствуют о влиянии прочных водородных связей между функциональными группами на кислотность не только слабокислотных, но и сильнокислотных групп. Так, при сопоставлении рис. 2 и 3 видно, что обменная емкость по первой ступени (ОЕ1) высокозамещенных гидрогелей ФК3 в значительной степени зависит от способа отмывки образцов после их перевода в Н-форму: ОЕ1, рассчитанная на основании кривой потенциометрического титрования Н-формы ФК3, отмывка которой проводилась 70%-ным этанолом в аппарате Сокслета (рис. 3, кривая 1), приблизительно в три раза меньше содержания фосфора по данным элементного анализа, т.е. часть сильнокислотных групп ФК3 ведет себя как слабокислотные. Вероятно, обезвоживание гидрогелей в результате данного способа отмывки, приводит к росту объемной плотности функциональных групп и образованию прочных водородных связей между ними. За счет этого происходит уплотнение структуры ФК, уменьшение удельной площади поверхности микрогелей, затруднение диффузии противоионов натрия в полимерную сетку. Аналогичные факты резкого ослабления кислотности части сильнокислотных фосфиновых групп для высокозамещенных водорастворимых фосфатов полисахаридов приводятся в работах [16, 17], авторы которых объясняют это неравноценностью катионообменных групп в зависимости от их положения в глюкопиранозном цикле.
Рис. 3.
Интегральные (а) и дифференциальные (б) кривые потенциометрического титрования образцов ФК3, отмытых после перевода в Н-форму первым способом, до (1) и после выдерживания в фосфатном буферном растворе с pH 7.4 в течение 1 (2) и 3 сут (3) (I = 0.05).
Гидрогели ФК, отмытые от избытка кислоты согласно второму режиму (рис. 2, кривая 5), имеют гораздо более высокое значение обменной емкости по первой ступени, соответствующее концентрации функциональных групп в ионите. Вероятно, при механическом воздействии происходит частичное нарушение системы водородных связей в конгломератах и сравнительно рыхло упакованных агрегатах, разрыхление более плотных агрегатов. Протекание этого процесса приводит к разрушению связанной структуры микрогелей, увеличению их удельной поверхности, т.е. способствует увеличению доступности фосфатных групп.
Следует отметить, что ослабление кислотности части сильнокислотных групп высокозамещенных образцов ФК3, обусловленное существованием между ними водородных связей, является обратимым. Из рис. 3 следует, что выдерживание гидрогелей в фосфатном буферном растворе с последующим отделением от избытка раствора методом диализа, переводом в H-форму и отмывкой в аппарате Сокслета приводит к росту обменной емкости по первой точке титрования: за одни сутки в 2 раза, а за 3 сут – в 2.5 раза. Кроме того, на дифференциальных кривых титрования образцов ФК3, инкубированных в буферном растворе, появляются максимумы, соответствующие точке эквивалентности слабокислотных групп. В то же время анализ состава микрогелей ФК3 показывает, что содержание фосфора в фазе катионита после выдерживания в буферном растворе не изменяется. Кроме того, литературные данные свидетельствуют о том, что процесс фосфорилирования полисахаридов самыми различными методами не сопровождается заметным накоплением трехзамещенных эфиров [5, 13]. Следовательно, изменение кислотно-основных свойств высокозамещенных ФК3 может быть связано со способностью буферного раствора (I = 0.4) разрушать меж- и внутримолекулярные водородные связи. В результате нарушения системы водородных связей происходит изменение структуры полимерной сетки гидрогелей [18] и увеличение доступности функциональных групп ФК3 для титранта. Этот факт может свидетельствовать о том, что в составе ФК содержатся преимущественно двухосновные фосфорнокислые группы (структура I) несмотря на то, что кривые титрования имеет вид, характерный для полифункциональных катионитов. При выбранных условиях потенциометрического титрования концентрация фосфорсодержащих групп другой природы недостаточна для их определения.
В отличие от сильносшитых для менее сшитых ФК (содержание фосфора 2.0−3.1 ммоль/г) система водородных связей оказывает гораздо менее существенное влияние на электролитические свойства. Для этих образцов форма кривых титрования не зависит от способа их перевода в H-форму, а инкубация в буферном растворе в течение 21 суток не влияет на значения обменной емкости и константы ионизации по первой ступени. Скорее всего, это обусловлено тем, что в данном случае количество водородных связей значительно уменьшается, поскольку плотность функциональных групп ниже и расстояние между ними больше.
Результаты потенциометрического титрования образцов ФК по первой ступени ионизации в координатах уравнения Гендерсона–Гассельбаха приведены на рис. 4. Видно, что зависимость между pH раствора и величиной lg((1 – α/)α) выражается не одной, а двумя прямыми с разной степенью наклона. Согласно литературным данным [10, 14] такой характер зависимости pH = = f[(lg((1 – α)/α)] связан с эффектом конформационных превращений макромолекул полиэлектролитов. Сущность его заключается в том, что при добавлении щелочи увеличивается степень ионизации фосфатных групп, возрастает электростатический потенциал матрицы, который становится соизмеримым с энергией межмолекулярного взаимодействия. Это приводит к разрушению системы водородных связей, в результате чего компактные конформации в виде клубков переходят в развернутые, характерные для заряженных макромолекулярных цепей. Для изученных ФК степень ионизации, необходимая для осуществления конформационных превращений, находится в области α ≈ 0.35−0.50. Из рис. 4 следует, что по мере уменьшения степени набухания микрогелей ФК степень ионизации фосфатов, необходимая для конформационных переходов, увеличивается.
Рис. 4.
Результаты потенциометрического титрования ФК1 (1), ФК2 (2) и ФК3 (3) в координатах модифицированного уравнения Гендерсона–Гассельбаха (I = 0.05).
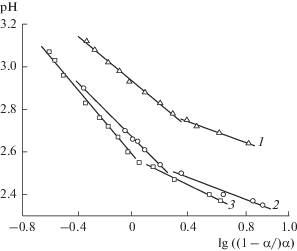
В табл. 1 приведены значения pK1 и ОЕ1 ФК с разным содержанием фосфора, полученные на основании кривых потенциометрического титрования. Данные таблицы показывают, что константы ионизации микрогелей слабо зависят от ионной силы раствора и концентрации фосфорсодержащих групп в фазе ФК, и свидетельствуют о том, что ФК являются более сильным катионитом по сравнению с синтетическими катионитами [19, 20]. Как отмечено в работе [21], повышение силы кислотности фосфатов полисахаридов связано с отрицательным индукционным эффектом глюкопиранозного цикла макромолекул, способного оттягивать электронную плотность от фосфорнокислых групп.
Значения pK1 ≤ 2.9 для ФК с разной степенью замещения показывают, что в среде, близкой к нейтральной (pH 7.5−8.0), фосфатные группы находятся практически полностью в ионизированном состоянии. Это определяет высокую селективность сорбции низко- и высокомолекулярных биологически активных веществ микрогелями в данной области pH не только за счет диффузии в трехмерную полимерную сетку, но и путем многоточечного кооперативного взаимодействия с фосфатами с образованием полиэлектролитных комплексов. Существенное влияние при этом имеет полифункциональный характер ФК и наличие системы прочных водородных связей в полимерной сетке.
Одной из наиболее перспективных областей применения микрогелей ФК в качестве систем доставки ЛВ в организм может являться онкология, где особую актуальность приобретает обеспечение направленного транспорта ЛВ в орган-мишень, пролонгация его действия, минимизация побочных эффектов, повышение биодоступности и т.д. В связи с тем, что в литературе [22, 23] имеется ряд публикаций, подтверждающих наличие противоопухолевых свойств у некоторых модификаций полисахаридов, содержащих функциональные группы кислотного характера, представляло интерес изучить антипролиферативную активность образцов ФК.
Исследование антипролиферативной активности образцов ФК в опытах in vitro было проведено на монослойной культуре опухолевых клеток HeLa. Из данных, представленных в табл. 2, следует, что микрогели ФК обладают собственной противоопухолевой активностью, которая увеличивается по мере роста в их составе содержания фосфорнокислых групп. Видно, что противоопухолевый эффект всех препаратов являлся дозозависимым: с увеличением концентрации микрогелей ФК (CФК) количество опухолевых клеток уменьшается.
Таблица 2.
Влияние исходных и модифицированных полисахаридов на рост культуры опухолевых клеток (Nк − Nисх = 625) в течение 72 ч
| Образец | CФК, мг/мл | Число клеток (×106) | Прирост к контролю, % | |||
|---|---|---|---|---|---|---|
| Nисх | Nк | Nоп | Nоп – Nисх | |||
| Контроль | − | 180 ± 60 | 805 ± 45 | − | − | 100 |
| ФК1 | 1 | 460 ± 35 | 280 | 45 | ||
| 2 | 420 ± 25 | 240 | 38 | |||
| ФК2 | 1 | 465 ± 30 | 285 | 46 | ||
| 2 | 365 ± 30 | 185 | 30 | |||
| ФК3 | 1 | 460 ± 30 | 280 | 45 | ||
| 2 | 215 ± 20 | 35 | 6 | |||
ЗАКЛЮЧЕНИЕ
Таким образом, на основании экспериментальных данных сделано предположение о наличии в гидрогелях фосфорилированного крахмала преимущественно двухосновных фосфорнокислых групп.
Показано, что межмолекулярные взаимодействия в фазе микрогелей, обусловленные водородными связями как между фосфатными группами, так и между фосфатными и карбаматными группами, карбаматными и гидроксильными, фосфатными и гидроксильными группами, являются причиной неоднородности кислотно-основных свойств слабокислотных групп и приводят к тому, что кривые потенциометрического титрования имеют вид, характерный для полифункциональных катионитов.
В опытах in vitro на модели клеток HeLa установлено наличие собственной противоопухолевой активности микрогелей ФК.
Список литературы
Saboktakin M.R. // Modern Trends in Chemistry and Chemical Engineering / Ed. by Haghi A.K. Oakville: Apple Academic Press, 2011. P. 48.
Chowdary K.P.R., Veeraiah E., Sandhya R.A. // Int. J. Chem. Sci. 2011. V. 9. 2. P. 889.
Tuovinen L., Ruhanen E., Kinnarinen T. et al. // J. Control Release. 2004. V. 98. P. 407.
Bagheri S., Hassani S.M., Mahdizaden S.J. // Int. J. Pharm. Pharm. Sci. 2012. V. 4. P. 640.
Heinze U., Klemm D., Under E., Pieschel F. // Starch/Stärke. 2003. V. 55. P. 55.
Sang Y., Prakash O., Seib P. // Carbohydr. Polym. 2007. V. 67. P. 201.
Голуб Н.В., Костерова Р.И., Алиновская В.А. и др. // Вестн. БГУ. Сер. 2. 2008. № 3. С. 29.
Corbridge D.E.C. Phosphorus: Chemistry, Biochemistry and Technology. London: Boca Raton, 2013.
Губен-Вейль А. Методы органической химии. М.: Химия, 1967.
Либинсон Г.С. Физико-химические свойства карбоксильных катионитов. М.: Наука, 1969.
Ермоленко И.Н., Буглов Е.Д., Люблинер И.П., Довгалев С.И. Новые волокнистые сорбенты медицинского назначения. Минск: Наука и техника, 1978.
Granja P.L., Pouységu L., Pétraud M. et al. // J. Appl. Polym. Sci. 2001. Vol. 82. P. 3341.
Sacco D., Klett-Zygmunt D., Dellacherie E. // Carbohydr. Res. 1988. V. 184. P. 193.
Зареченский В.М., Хорошевский Ю.М., Суров Ю.Н. // Журн. прикл. химии. 1989. Т. 62. С. 1724.
Петропавловский Г.А. Гидрофильные частично замещенные эфиры целлюлозы и их модификация путем химического сшивания. Л.: Наука, 1988.
Suflet D.M., Nicolescu A., Popescu I., Chitanu G.C. // Carbohydr. Polym. 2011. V. 84. P. 1176.
Suflet D.M., Chitanu G.C., Desbrieres J. // Carbohydr. Polym. 2010. V. 82. P. 1271.
Юркштович Т.Л., Голуб Н.В., Юркштович Н.К. и др. // Биотехнология. 2016. Т. 32. С. 67.
Алосманов Р.М., Мамедов Г. Г., Азизов А.А., Магеррамов А.М. // Изв. вузов. Химия и хим. технология. 2008. Т. 51. Вып. 2. С. 121.
Демин А.А., Чернова И.А., Шатаева Л.К. Ионообменная сорбция биологически активных веществ. СПб.: Изд-во СПбГУ, 2008.
Белая А.В. Исследование сорбции аминокислот монокарбоксилцеллюлозой. Дис. … канд. хим. наук. Минск: НИИ физико-химических проблем, 1982.
Petreus T., Stoica B.A., Petreus O. et al. // J. Mater. Sci: Mater Med. 2014. V. 25. P. 1115.
Huang Q., Zhang L. // Carbohydr. Polym. 2011. V. 83. P. 1363.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал