Коллоидный журнал, 2019, T. 81, № 4, стр. 493-500
Взаимодействие S,N-производных алкилгидразинов с углеродными сорбентами
К. Е. Полунин 1, Д. Д. Матюшин 1, А. В. Ульянов 1, И. А. Полунина 1, А. К. Буряк 1, *
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, Россия
* E-mail: akburyak@mail.ru
Поступила в редакцию 15.11.2018
После доработки 23.11.2018
Принята к публикации 03.12.2018
Аннотация
Синтезированы S,N-производные алкилгидразинов, в том числе 1,1-диметилгидразина, для количественного анализа микропримесей гидразинов в объектах окружающей среды. Молекулярно-статистическим методом рассчитаны значения термодинамических характеристик их адсорбции на графитированной термической саже. Обнаружена зависимость значений термодинамических функций S,N-производных алкилгидразинов от их молекулярной массы и стереохимических особенностей углеводородных радикалов. Полученные результаты сопоставлены с экспериментальными данными, полученными методом жидкостной хроматографии при исследовании взаимодействия S,N-производных 1,1-диметилгидразина с графитированным углеродным сорбентом Hypercarb.
ВВЕДЕНИЕ
Производные гидразина широко используются в тонком органическом синтезе, при производстве лекарственных средств и полупроводников, являются компонентом ракетных топлив, образуются при разложении ядохимикатов и регуляторов роста растений. Среди гидразинов особое место занимает 1,1-диметилгидразин, или несимметричный диметилгидразин (НДМГ), – чрезвычайно токсичное физиологически активное соединение, которое характеризуется крайней неустойчивостью на воздухе и быстрым превращением в многочисленные более или менее токсичные соединения [1, 2].
В настоящее время задача идентификации НДМГ, а также продуктов его трансформации в объектах окружающей среды является весьма актуальной, так как существующие физико-химические методы анализа гидразинов имеют ряд недостатков – низкую чувствительность и селективность, необходимость долгой и трудоемкой пробоподготовки [3, 4]. Современная жидкостная хроматография является одним из наиболее высокочувствительных и селективных методов анализа гидразинов и НДМГ в природных объектах [5]. Среди различных вариантов анализа гидразинов особо выделяется вариант реакционной жидкостной хроматографии – обращенно-фазовая высокоэффективная жидкостная хроматография (ОФ ВЭЖХ) с предварительной дериватизацией аналита. Цель дериватизации состоит в повышении фактора удерживания гидразинов, эффективности и селективности разделения их смесей путем превращения полярных соединений в гидрофобные производные (дериваты). В качестве дериватизатора для НДМГ чаще всего применяют ароматические альдегиды, ацетон, пентафторбензоилхлорид и другие соединения [6]. Для повышения чувствительности методов определения аминосоединений и гидразинов предложено использовать соединения с изотиоцианатной группой [7, 8]. Преимуществом дериватизации гидразинов с помощью изотиоцианатов по сравнению с другими типами дериватизирующих реагентов является отсутствие элиминирования воды или галогеноводородов, осложняющих последующее проведение хроматографического анализа [3–7].
Целью работы являлось теоретическое и экспериментальное определение термодинамических характеристик адсорбции (ТХА) изотиоцианатных производных алкилгидразинов на углеродных сорбентах для создания физико-химических основ количественного анализа микропримеси НДМГ в объектах окружающей среды. Для проведения теоретических расчетов ТХА будут использованы различные варианты молекулярно-статистического метода, основанного на полуэмпирической молекулярно-статистической теории адсорбции, разработанной Киселевым и Пошкусом [9]. Этот метод позволяет предсказать ТХА ряда химических веществ на однородной поверхности графитированной термической сажи (ГТС). Экспериментальные исследования будут выполнены методом ВЭЖХ с неподвижными фазами на основе пористого графитированного углерода (ПГУ) – сорбента, поверхность которого образована кристаллическими слоями графита и является однородной в химическом и фазовом отношениях [10]. Этот углеродный сорбент сочетает в себе свойства сорбентов как для обращенно-фазовой, так и нормально-фазовой ВЭЖХ. Он характеризуется высокой чувствительностью к особенностям электронного строения молекул адсорбатов, что значительно увеличивает диапазон его селективности в отношении представителей различных классов органических соединений [10–14].
ЭКПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали 1,1-диметилгидразин (ГОСТ В 17 803-72, Нефтеоргсинтез, РФ), который был дополнительно перегнан над гидроксидом натрия перед использованием. Чистые S,N-дериваты алкилгидразинов (4-R-1,1-R1,R2-тиосемикарбазиды) были получены по методике [8] путем добавления 75 мкл свежеперегнанного НДМГ к раствору 150 мкл изотиоцианата в 10 мл дихлорметана. Смесь выдерживали 1 ч при 20°C без доступа воздуха до завершения реакции. Использовались реагенты 99%-ной чистоты от фирмы Aldrich (США): этилизотиоцианат, аллилизотиоцианат, фенилизотиоцианат, 2,4-толуилендиизоцианат, метилгидразин, 1,1-метилэтилгидразин, дихлорметан.
Сорбентом служил ПГУ, упакованный в колонку Hypercarb (Thermo Scientific, США), с размером зерна 5 мкм, диаметром пор 250 Å и объемом пор 0.7 м2/г. Удельная поверхность сорбента, определенная по низкотемпературной адсорбции азота, составляла 120 м2/г (расчет по методу БЭТ).
Анализ S,N-производных гидразинов проводили с помощью жидкостного хроматографа Agilent 1200 (Agilent, США), оснащенного диодно-матричным УФ-детектором Agilent G1315B. Для хроматографического разделения смесей применяли колонку Hypercarb размером 2.1 × × 100 мм, заполненную ПГУ. Режим разделения смесей – изократический, элюент – раствор метанола в воде (50 об. %), скорость потока элюента – 0.5 мл/мин.
Молекулярно-статистические расчеты констант Генри и ТХА на идеальном графитоподобном сорбенте проводили в двух вариантах посредством вычисления конфигурационных интегралов в адсорбированном и свободном состояниях. Потенциальная функция Ф межмолекулярного взаимодействия молекул адсорбата с адсорбентом представляется в виде суммы атом-атомных потенциалов (ААП) межмолекулярного взаимодействия атомов C, Н, N и S в молекулах S,N-производных алкилгидразинов с атомами C базисной грани ГТС. В первом варианте молекулярно-статистического расчета (метод 1) молекула адсорбата рассматривается как жесткая структура, имеющая фиксированную геометрию. Для расчета параметров ААП используют потенциал в форме Бакингема–Корнера [9, 14]. Этот метод хорошо известен и широко применяется [9, 14–16]. При расчетах ТХА использовали программу, разработанную авторами [15]; значения поляризуемости α атомов N и S были получены из экспериментальных данных по молекулярной рефракции молекул первичных аминов, карбоновых кислот и тиолов [17]; величины диамагнитной восприимчивости χ атомов N, О и S взяты из справочника [18], а геометрические параметры рассматриваемых молекул получены из электронографических данных или на основании закономерностей изменения длин связей и углов для соединений этих классов [16, 19].
Молекулярно-статистический расчет ТХА во втором варианте (метод 2) выполнялся в приближении нежестких молекул, т.е. молекул, способных изменять конформацию при взаимодействии с поверхностью ГТС. Для расчета параметров ААП взаимодействия адсорбат–адсорбент использовали потенциал Леннард-Джонса [20, 21]; параметры для атомов адсорбата были взяты из работы [22]. Для каждого типа атомов молекулы деривата минимум потенциальной энергии принимался равным ${\varepsilon } = \sqrt {{{{\varepsilon }}_{{{\text{а т о м }}}}}{{{\varepsilon }}_{{{\text{С }},{\text{г р а ф и т }}}}}} ,$ а равновесное расстояние r равным сумме ван-дер-ваальсовых радиусов атомов. Для атомов углерода на поверхности ГТС, по данным [20], ε = 0.295 кДж/моль, r = 1.908 Å.
Внутреннюю энергию рассчитывали в приближении, обычном для молекулярно-статистического метода: поверхность предполагалась плоской, однородной и равномерно заполненной атомами графита. Потенциал взаимодействия адсорбат–адсорбент рассчитывался в форме потенциала Леннард-Джонса, аналитически проинтегрированного по бесконечной двумерной поверхности:
Константа Генри K1 для каждой конформации записывалась в виде
Здесь Φ – энергия взаимодействия адсорбат–адсорбент, Θ, Ψ – углы Эйлера вращения молекулы по отношению к поверхности адсорбента, T – температура. Для молекулы с n углами внутреннего вращения это выражение запишется в виде
Перебор конформаций выполнялся посредством алгоритма Метрополиса [20]. Произвольные шаги включали в себя поворот молекулы вокруг произвольной связи, перемещение произвольного атома (до 0.1 Å) и изменение длины произвольной связи (до 0.1 Å) с вероятностями 0.25, 0.5 и 0.25 соответственно. Вращению подвергались все одинарные связи кроме связей N–H и C–H.
Интегрирование по углам Эйлера внутреннего вращения и координатам относительно центра масс молекулы выполнялось методом Монте-Карло с равномерным распределением значений переменных от –π до π. Таким образом, константа Генри записывалась как
Внутренняя энергия конформаций, необходимая для применения алгоритма Метрополиса, рассчитывалась с использованием параметров взаимодействий MMFF94 [23] и соответствующих правил. Все расчеты выполняли при помощи собственного программного обеспечения и собственной имплементации MMFF94, которая была предварительно протестирована с помощью тестового набора MMFF94 Validation Suite [24]. Для каждой молекулы выполнялось 106 шагов алгоритма Метрополиса; изменения результата при дальнейшем увеличении числа шагов составляли не более 0.05 в единицах логарифма константы Генри адсорбции.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 приведена схема дериватизации алкилгидразинов 2 избытком изотиоцианатов 1, которая приводит к образованию 4-R-1,1-R1,R2-тиосемикарбазидов (3а–3ж). Данная реакция протекает до конца, а ее продукты относительно стабильны [6]. Соединения 3а–3в являются S,N-дериватами НДМГ, в которых заместитель R в положении N-4 представлен этильным, аллильным или фенильным радикалом – Et, All и Ph соответственно. Соединения 3г и 3е являются S,N-дериватами метилгидразина с аллильным и фенильным заместителем в положении N-4, а соединения 3д и 3ж – S,N-дериватами 1,1-метилэтилгидразина с аллильным и фенильным заместителем в положении N-4.
Рис. 1.
Схема получения S,N-дериватов НДМГ (3а–3в) и других алкилгидразинов (3г–3ж) с помощью изотиоцианатов.
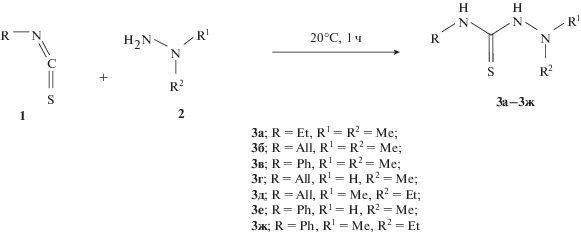
Отметим, что по данным [6–8], алкильные заместители в изотиоцианатах обеспечивают их более высокую летучесть по сравнению с ароматическими аналогами.
Важным методом оценки хроматографического поведения веществ является молекулярно-статистический расчет ТХА. Ранее было показано, что этот метод, разработанный для газовой хроматографии и не учитывающий взаимодействие элюента с сорбентом и сорбатом, можно использовать для предварительной оценки удерживания аналитов на углеродных сорбентах в условиях ВЭЖХ [13, 14]. Хроматографические колонки на основе ПГУ обладают характеристиками удерживания и селективности, отличными от аналогичных характеристик колонок на основе гидрофобизованного силикагеля и полимерных фаз [10]. Это затрудняет идентификацию соединений, основанную на известных закономерностях удерживания веществ на неполярных сорбентах [15]. Молекулярно-статистические расчеты упрощают планирование эксперимента, позволяют оценить возможность разделения компонентов смеси.
В табл. 1 приведены результаты расчетов ТХА S,N-производных алкилгидразинов на однородной поверхности идеального графитоподобного сорбента при температуре 298 К. Расчет параметров ААП межмолекулярного взаимодействия был выполнен методом 1 для жестких молекул адсорбата и методом 2 для нежестких молекул с учетом внутреннего вращения.
Таблица 1.
Расчетные значения термодинамических характеристик адсорбции S,N-производных алкилгидразинов при 298 К на однородной графитоподобной поверхности ГТС, полученные без учета (1) и с учетом внутреннего вращения (2)
| Термодинамические функции | S,N-производные алкилгидразинов* | ||||||
|---|---|---|---|---|---|---|---|
| 3а | 3б | 3в | 3г | 3д | 3е | 3ж | |
| –ΔH°, кДж/моль (1) | 72.7 | 78.9 | 85.5 | 78.0 | 93.3 | 85.2 | 97.2 |
| –ΔH°, кДж/моль (2) | 54.1 | 57.7 | 84.7 | 63.3 | 63.3 | 90.5 | 90.4 |
| –ΔS°, (Дж моль)/К (1) | 129.4 | 131.2 | 135.0 | 134.1 | 144.4 | 136.9 | 140.9 |
| –ΔS°, (Дж моль)/К (2) | 115.2 | 117.9 | 136.0 | 122.7 | 122.2 | 139.2 | 142.1 |
| –ΔG°, кДж/моль (1) | 34.2 | 39.8 | 45.3 | 38.0 | 50.3 | 44.3 | 55.2 |
| –ΔG°, кДж/моль (2) | 19.8 | 22.6 | 44.1 | 26.7 | 26.9 | 49.0 | 48.0 |
* Данные приведены в соответствии с обозначениями этих производных на рис. 1.
Приведенные в табл. 1 значения энергии Гиббса, рассчитанные с учетом внутреннего вращения (2), почти для всех веществ несколько меньше, чем при расчетах по методу 1. Это связано с тем, что в методах 1 и 2 используются разные параметры ААП из-за особенностей программного обеспечения. Это отличие не представляется существенным, т.к. данные величины ТХА используются лишь для качественного предсказания возможности разделения аналитов и порядка их элюирования. Однако при расчете по методу 2 значения ТХА для соединений 3а, 3б, 3г, 3д оказываются сильно переоцененными по сравнению со значениями ТХА для соединений 3в, 3е, 3ж, содержащих фенильную группу.
Сравнение значений ΔG°, ΔН° и ΔS° для S,N-производных алкилгидразинов, приведенных в табл. 1, позволяет установить, что по мере увеличения молекулярной массы соединений значения ТХА увеличиваются. Например, для S,N-дериватов НДМГ 3а, 3б и 3в заместитель R в положении N-4 (рис. 1) увеличивается от С2Н5 до С3Н5 и С6Н5. Соединения с фенильным радикалом (3в, 3е–3ж) адсорбируются достаточно сильно, даже если заместитель R1 представлен только атомом водорода. Однако важна и стереохимия заместителя; так, разветвленное производное 3д (4-аллил-1,1-метилэтилтиосемикарбазид) взаимодействует с углеродным сорбентом сильнее, чем имеющее ту же молекулярную массу, но менее разветвленное производное 3в (4-фенил-1,1-диметилтиосемикарбазид).
Известно, что в состоянии sp2-гибридизации в аллильном и фенильном радикалах атом углерода и связанные с ним заместители лежат в одной плоскости, тогда как алкильный радикал (sp3-гибридизация) имеет “трехмерное” строение. Различие в стереохимии заместителей S,N-производных НДМГ должно сказаться на способности соединений 3а, 3б и 3в вплотную подходить к поверхности углеродного сорбента, что при прочих равных условиях энергетически более выгодно.
Исследования хроматографического поведения S,N-дериватов НДМГ в условиях ВЭЖХ проводили, как сказано выше, на сорбенте ПГУ, упакованном в колонку Hypercarb. В УФ-спектрах S,N-дериватов НДМГ (рис. 2) наблюдается интенсивная полоса поглощения в области 240–250 нм, которая использовалась для определения целевых компонентов на хроматограмме. Максимумы поглощения дериватов в этой области сдвинуты относительно поглощения реагента-дериватизатора в длинноволновую область [5], поэтому даже большой избыток реагента не мешает определению целевых компонентов.
Рис. 2.
УФ-спектры поглощения дериватов НДМГ: 1 – 4-этил-1,1-диметилтиосемикарбазид 3а, 2 – 4-аллил-1,1-диметилтиосемикарбазид 3б, 3 – 4-фенил-1,1-диметилтиосемикарбазид 3в.
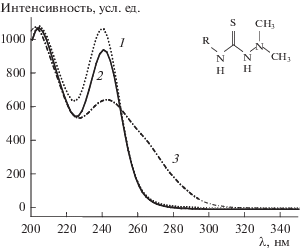
Как видно на рис. 3, наблюдается увеличение логарифма коэффициента удерживания k' S,N-дериватов НДМГ на ПГУ при увеличении числа атомов углерода nC в заместителе R от 3 до 6. То есть усиление удерживания S,N-производных НДМГ на ПГУ происходит в последовательности, предсказанной теоретически: 3а → 3б → 3в. Наблюдаемая на рис. 3 линейная зависимость может быть описана уравнением y = 0.6178x – 1.2832 с высокой степенью корреляции, r 2 = 0.9996.
Рис. 3.
Зависимость логарифма коэффициента удерживания ln k' (ВЭЖХ, ПГУ) S,N-дериватов НДМГ (3а–3в) от числа атомов углерода nC в них.
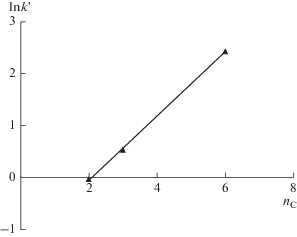
На рис. 4, приведена корреляционная зависимость логарифма коэффициента удерживания ln k' дериватов НДМГ от константы Генри ln K1 адсорбции из газовой фазы, рассчитанной молекулярно-статистическим методом в вариантах 1 и 2. Наблюдаемые линейные зависимости могут быть описаны следующими уравнениями: y = –0.2213x – – 7.8187 с коэффициентом детерминации r 2 = = 0.9095 (вариант расчета 1 без учета внутреннего вращения) и y = –0.0958x – 1.7844 с коэффициентом детерминации r2 = 0.9861 (вариант расчета 2 с учетом внутреннего вращения молекулы). Данные зависимости позволяют найти экспериментальные значения ln k' по числу атомов углерода и рассчитанной константе Генри адсорбции ln K1.
Рис. 4.
Зависимость логарифма коэффициента удерживания ln k' (ВЭЖХ, ПГУ) дериватов НДМГ от констант Генри ln K1 адсорбции из газовой фазы, рассчитанных без учета внутреннего вращения (1) и с его учетом (2).
Как отмечается в [6], основной вклад в удерживание на ПГУ вносят неспецифические межмолекулярные взаимодействия молекул адсорбатов с плоской поверхностью графита. Вместе с тем, имеются сведения о реализации на поверхности ПГУ дополнительных к дисперсионным специфических межмолекулярных взаимодействий молекул адсорбатов с базисной гранью графита [6]. В силу этого поверхность ПГУ характеризуется высокой чувствительностью к особенностям электронного строения молекул S,N-дериватов НДМГ с различной стереохимией. Кроме того, аллильный и фенильный заместители влияют на распределение электронной плотности в молекуле в гораздо большей степени, чем этильный заместитель.
Таким образом, установлено, что хроматографическое удерживание S,N-производных НДМГ на углеродных сорбентах зависит от их молекулярной массы и стереохимических особенностей.
На рис. 5 и 6 приведены теоретически рассчитанные и экспериментально полученные методом ВЭЖХ температурные зависимости значений константы Генри и их коэффициента удерживания адсорбции различных дериватов НДМГ на углеродных сорбентах. Видно, что для всех соединений в широком температурном диапазоне, 298–318 K, эти зависимости линейны (для варианта ВЭЖХ коэффициент детерминации r 2 = 0.9874–0.9993). При повышении температуры удерживание соединений закономерно снижается, но изменения селективности процесса не наблюдается.
Рис. 5.
Зависимости теоретически рассчитанных значений ln K1 от обратной температуры для адсорбции S,N-дериватов НДМГ на ГТС из газовой фазы: 1 – 3а, 2 – 3б, 3 – 3в, 4 – 3г, 5 – 3д, 6 – 3е, 7 – 3ж.
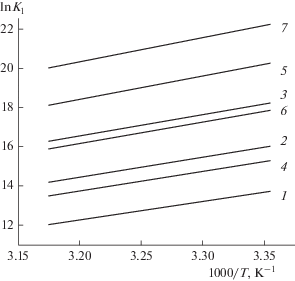
Рис. 6.
Зависимости экспериментально полученных значений ln k' от обратной температуры для адсорбции S,N-дериватов НДМГ на ПГУ: 1 – 3а, 2 – 3б, 3 – 3в.
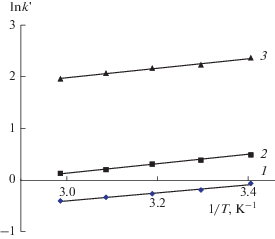
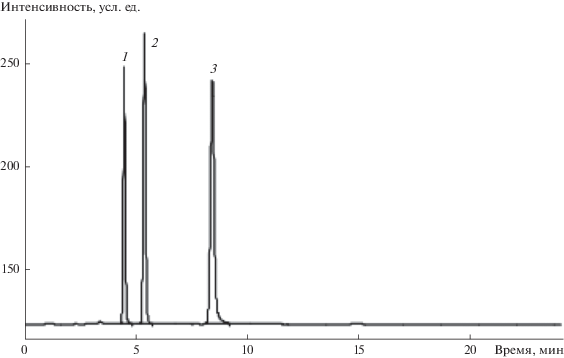
Ввиду значительных различий в значениях ln K1 смесь дериватов НДМГ (3а–3ж), как предсказывают расчеты, может быть разделена на углеродном сорбенте во всем исследованном диапазоне температуры. Это было подтверждено экспериментально (рис. 6, 7).
Рис. 7.
Хроматограмма разделения смеси S,N-дериватов НДМГ на колонке Hypercarb с ПГУ (элюент: водный раствор метанола, 50 об. %): 1 – 3а, 2 – 3б, 3 – 3в.
В табл. 2 приведены экспериментально определенные значения ТХА S,N-дериватов НДМГ на сорбенте ПГУ. Для оценки влияния температуры на удерживание дериватов НДМГ 3а–3в в условиях ВЭЖХ был использован температурный коэффициент V = [($k_{1}^{'}$ – $k_{2}^{'}$) – 1]/(T2 – T1), позволяющий определить изменение коэффициента емкости при изменении температуры на 1 К. Минимальное влияние температура оказывает на удерживание 4-этил-1,1-диметилтиосемикарбазида 3а на колонке Hypercarb с ПГУ, максимальное – на удерживание 4-фенил-1,1-диметилтиосемикарбазида 3в. В первом случае воспроизводимость времен удерживания будет наилучшей, что важно для качественного анализа образца.
Таблица 2.
Экспериментально определенные значения ТХА S,N-дериватов НДМГ на сорбенте ПГУ колонки Hypercarb
| Дериват НДМГ | ТХА | ||
|---|---|---|---|
| –ΔH°, кДж/моль | –ΔS°/R + ln φ* | V × 103, К–1 | |
| 3а | 13.3 | 5.5 | 21 |
| 3б | 14.5 | 5.4 | 23 |
| 3в | 16.0 | 4.1 | 26 |
Сравнение данных, приведенных в табл. 1 и 2, показывает, что вычисленные для адсорбции из газовой фазы значения теплот адсорбции дериватов НДМГ в 8–10 раз превышают экспериментально определенные значения их теплот адсорбции на сорбенте ПГУ в условиях ВЭЖХ. Необходимо отметить, что значения ТХА, полученные молекулярно-статистическим методом, при температуре 298 К являются лишь условными характеристиками применительно к методу ВЭЖХ. В газовой фазе, рассматриваемой в молекулярно-статистическом методе, учитываются только взаимодействия сорбат–сорбент и внутримолекулярные взаимодействия. Молекулярно-статистический метод позволяет дать качественную оценку возможности разделения данных соединений на углеродном сорбенте и предсказать порядок их элюирования. Однако он не учитывает влияния элюента на адсорбцию в условиях ВЭЖХ, когда наблюдается конкуренция между взаимодействиями сорбата с сорбентом и элюента с сорбатом и сорбентом. Поэтому теоретически рассчитанные значения ТХА количественно не связаны с характеристиками удерживания в условиях жидкостной хроматографии, однако в некоторых случаях это обстоятельство (наличие элюента) может не влиять на качественные закономерности, установленные для гомологических рядов соединений одного класса [13, 14, 19, 21].
Для выявления причины наблюдаемого различия в значениях ТХА, полученных теоретически и экспериментально, была рассчитана зависимость логарифма константы Генри от углов внутреннего вращения исходно выбранной конформации S,N-деривата НДМГ 3а (метод 1). Варьирование углов внутреннего вращения 4-этил-1,1-диметилтиосемикарбазида приводит к изменению ln K1 в диапазоне 12–19 единиц (мкм). С одной стороны, такое изменение весьма существенно при определении структуры молекулы, а с другой стороны, этих изменений недостаточно для объяснения значительного различия в значениях теплот адсорбции деривата НДМГ, полученных экспериментально и рассчитанных теоретически. В варианте жидкостной хроматографии на сорбенте ПГУ возможно неплоское расположение молекул деривата на поверхности твердой фазы за счет его взаимодействия с элюентом. В связи с этим можно утверждать, что для молекул, не содержащих бензольного кольца, влияние внутреннего вращения не очень велико. Наиболее существенный вклад в величину адсорбции на углеродной поверхности вносит не конформация молекулы, а ее ориентация как целого относительно поверхности, а наблюдаемое расхождение результатов расчетов связано только с выбором различных параметров ААП при использовании программного обеспечения.
В то же время для молекул, содержащих в своем составе бензольное кольцо, наблюдается значительно меньшее различие в значениях ТХА, рассчитанных методами 1 и 2. Это свидетельствует о том, что вблизи плоской поверхности сорбента стабилизируются конформации с меньшим углом между бензольным кольцом и плоским фрагментом, образуемым атомом серы и двумя атомами азота, соединенными с одним и тем же атомом углерода. Равновесный угол в газовой фазе может существенно отличаться от такового вблизи поверхности, так как чем ближе расположение плоских фрагментов молекулы к копланарному, тем сильнее потенциальная энергия взаимодействия сорбат–сорбент.
Проведенные теоретические и экспериментальные исследования взаимодействия S,N-дериватов различных алкилгидразинов позволили дать адекватную оценку возможности использования углеродных сорбентов для анализа, идентификации и разделения алкилгидразинов. Молекулярно-статистические расчеты термодинамических характеристик адсорбции S,N-дериватов алкилгидразинов на модельном углеродном сорбенте, проведенные методами 1 и 2, удовлетворительно предсказали хроматографическое поведение дериватов в реальных условиях ВЭЖХ. Таким образом, созданы физико-химические основы методики идентификации и количественного анализа микропримеси токсичного НДМГ в объектах окружающей среды в виде его изотиоцианатных производных в условиях жидкостной хроматографии с углеродными сорбентами.
ВЫВОДЫ
Синтезированы S,N-производные алкилгидразинов, в том числе 1,1-диметилгидразина, для количественного анализа микропримесей гидразинов в объектах окружающей среды.
Молекулярно-статистическим методом рассчитаны значения термодинамических характеристик их адсорбции на графитированной термической саже. Обнаружена зависимость значений термодинамических функций S,N-производных алкилгидразинов от их молекулярной массы и стереохимических особенностей углеводородных радикалов. Результаты расчетов сопоставлены с экспериментальными данными, полученными методом ВЭЖХ при исследовании взаимодействия S,N-производных НДМГ с пористым графитированным углеродом колонки Hypercarb.
Работа выполнена в рамках Государственного задания ИФХЭ РАН при частичной финансовой поддержке Российского фонда фундаментальных исследований (проект № 18-08-01224).
Список литературы
Schmidt W.E. Hydrazine and Its Derivatives. 2nd Ed. New York: Wiley, 2001.
Ульянов А.В., Полунина И.А., Полунин К.Е., Буряк А.К. // Коллоид. журн. 2018. Т. 80. С. 102.
Смоленков А.Д., Родин И.А., Шпигун О.А. // Журн. аналит. химии. 2012. Т. 67. С. 133.
Brinkman G.H.W., Dijk A.G., Wagenaar R. // J. Chromatogr. A. 1996. V. 723. P. 355.
Smolenkov A.D., Shpigun O.K. // Talanta. 2012. V. 102. P. 93.
Blau K., Halket J.M. Handbook of Derivatives for Chromatography. Chichester: Wiley, 1993.
Савельев Ю.В., Храновский В.А., Веселов В.Я., Греков А.П., Савельева О.А.// Журн. орг. химии. 2003. Т. 39. С. 105.
Парамонов С.А., Ульянов А.В., Буряк А.К. // Изв. АН. Сер. хим. 2010. Т. 59. С. 517.
Авгуль Н.Н., Киселев А.В., Пошкус Д.П. Адсорбция газов и паров на однородных поверхностях. М.: Химия, 1975.
West C., Elfakir C., Lafosse M. // J. Chromatogr. A. 2010. V. 1217. P. 3201.
Pereira L. // J. Liq. Chromatogr. Relat. Technol. 2008. V. 31 P. 1687.
Милюшкин А.Л., Лактюшина А.А., Буряк А.К. // Изв. АН. Сер. хим. 2017. С. 56.
Kuznetsova E.S., Buryak A.K. // Colloids Surf. A. 2011. V. 383. P. 73.
Киселев А.В. Межмолекулярные взаимодействия в адсорбции и хроматографии. М.: Высшая школа, 1986.
Киселев А.В., Пошкус Д.П., Афреймович А.Я. // Журн. физ. химии. 1968. Т. 42. С. 2553.
Буряк А.К. // Успехи химии. 2002. Т. 71. С. 788.
Иоффе Б.В. Рефрактометрические методы химии. Л.: Химия, 1974.
Краткий справочник физико-химических величин / Под ред. Равделя А.А., Пономаревой А.М. СПб.: Специальная литература. 1999.
Буряк А.К. // Изв. АН. Сер. хим. 2000. С. 681.
Матюшин Д.Д., Буряк А.К. // Сорбционные и хроматографические процессы. 2017. Т. 17. С. 204.
Матюшин Д.Д., Буряк А.К. // Журн. аналит. химии. 2019. Т. 73. (в печати).
Wang J., Wolf R.M., Caldwell J.W., Kollman P.A., Case D.A. // J. Comput. Chem. 2004. V. 25. P. 1157.
Halgren T.A. // J. Comput. Chem. 1996. V. 17. P. 490.
http://www.ccl.net/cca/data/MMFF94.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


