Коллоидный журнал, 2019, T. 81, № 4, стр. 478-486
Солюбилизация как способ создания гибридных мицеллярных темплатов для синтеза многофункциональных мезопористых частиц-контейнеров
К. А. Наумова 1, 2, О. В. Дементьева 1, *, А. В. Зайцева 1, В. М. Рудой 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, Россия
2 Московский государственный университет им. М.В. Ломоносова, химический факультет
119992 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: dema_ol@mail.ru
Поступила в редакцию 08.02.2019
После доработки 25.02.2019
Принята к публикации 26.02.2019
Аннотация
Исследована солюбилизация водонерастворимого биологически активного соединения куркумина в мицеллах дифильных противомикробных препаратов − мирамистина, этония и цеталкония, и определены термодинамические характеристики этого процесса. Продемонстрирована возможность золь–гель синтеза многофункциональных мезопористых частиц-контейнеров из кремнезема на “гибридных” темплатах, представляющих собой мицеллы этих ПАВ, содержащие солюбилизированный куркумин.
ВВЕДЕНИЕ
Капсулирование лекарственных препаратов в мезопористых частицах кремнезема (МЧК) представляет собой один из наиболее перспективных подходов к обеспечению адресной доставки и контролируемого высвобождения лекарств, позволяющих существенно повысить их эффективность [1–3].
МЧК получают темплатным золь−гель методом. В классическом подходе в качестве темплатов используют мицеллы инертных (т.е. не несущих никакой дополнительной функции) поверхностно-активных веществ (ПАВ), которые удаляют из частиц по окончании синтеза [2]. Полученные МЧК, характеризующиеся упорядоченной пористой структурой и большой удельной поверхностью, загружают целевым лекарственным препаратом путем его сорбции из раствора. Однако емкость таких МЧК оказывается довольно низкой. Кроме того, возникают трудности с обеспечением контролируемого и достаточно пролонгированного выхода препарата из МЧК в окружающую среду.
В этой связи все большее внимание исследователей привлекает новый подход к созданию МЧК. Его отличием от классического является использование в качестве темплата мицелл не инертного ПАВ, а целевого функционального соединения, например, дифильного лекарственного препарата [4–9] или ингибитора коррозии [10–13]. Такой подход позволяет не только совместить стадии синтеза и загрузки МЧК, но и обеспечить их высокую емкость по целевому соединению.
Так, нами была продемонстрирована возможность синтеза МЧК на темплатах из ассоциатов дифильных противомикробных лекарственных препаратов [4–7]. Показано, что полученные частицы характеризуются высоким содержанием целевого препарата (до 1 г в расчете на 1 г SiO2), выходом которого из частиц можно управлять, варьируя pH дисперсионной среды [5, 6, 14].
Следующий логический шаг в развитии указанного подхода − создание МЧК на бинарных (“гибридных”) темплатах, представляющих собой мицеллы функционального ПАВ с солюбилизированным в них гидрофобным соединением. О его перспективности свидетельствуют, в частности, результаты работы [15], посвященной синтезу МЧК на мицеллах инертного ПАВ − цетил-триметиламмония бромида (ЦТАБ), содержащих солюбилизированный цитостатик доксорубицин. Согласно данным [15], катионы ЦТАБ не только позволяют регулировать скорость десорбции капсулированного в МЧК цитостатика, но и оказывают дополнительное терапевтическое действие.
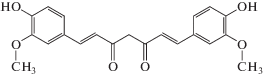
На наш взгляд, предлагаемый подход представляет существенный интерес с точки зрения капсулирования куркумина − природного полифенольного соединения, получаемого из корня куркумы (Curcuma longa). Его молекула (рис. 1) содержит две орто-метоксифенольные группы, симметрично соединенные α,β-ненасыщенным β-дикетонным фрагментом, находящимся в равновесии с енольной формой. Проведенные исследования показали, что куркумин является эффективным природным антиоксидантом, обладает противомикробным и противовоспалительным действием, а также может найти применение в борьбе с раковыми опухолями, болезнью Альцгеймера и ВИЧ [16–21]. Основным препятствием на пути к активному использованию этого соединения в медицине является его ограниченная биодоступность, обусловленная низкой растворимостью в воде [22].
Одним из возможных решений обозначенной проблемы является солюбилизация куркумина в мицеллах ПАВ [23–28]. Чаще всего в качестве солюбилизатора выбирают такие “модельные” ПАВ, как ЦТАБ [23, 24], додецилтриметиламмония бромид [24], а также додецилсульфат натрия [24, 28]. Согласно литературным данным, такой подход действительно позволяет существенно увеличить растворимость куркумина в воде. Следует, однако, подчеркнуть, что возможности применения получаемых мицеллярных наноконтейнеров для решения биомедицинских задач весьма ограничены, поскольку все перечисленные ПАВ характеризуются высокой цитотоксичностью. Кроме того, априори ясно, что использовать такие структуры для внутривенного введения практически невозможно вследствие их быстрого разрушения в кровотоке.
В данной работе мы преследуем две цели. Первая из них − изучить особенности солюбилизации куркумина в мицеллах ряда дифильных лекарственных препаратов, вторая − исследовать возможность золь−гель синтеза бифункциональных МЧК на таких гибридных темплатах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и методы исследования
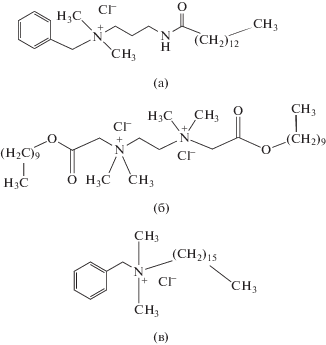
В работе использовали куркумин, тетраэтоксисилан (ТЭОС), водный раствор аммиака с концентрацией 28 мас. %, (все реагенты − марки ACS Reagent, Sigma-Aldrich), абсолютированный этанол, 37%-ную соляную кислоту (оба − квалификации “х. ч.”, Компонент-Реактив, Россия), а также дифильные лекарственные препараты хлорид гексадецилдиметилбензиламмония (цеталконий, ACS Reagent, Sigma-Aldrich), хлорид N-бензил-N,N-диметил-3-тетра-деканамидопропан-1-аммония (мирамистин, “х. ч.”, Инфамед, Россия) и дихлорид N1,N2-бис(2-децил-окси)-2-оксоэтил)-N1,N1,N2,N2-тетраметилэтан-1,2-диаммония (этоний).
Растворителями служили свежеперегнанный 96%-ный этанол и дистиллированная вода, дополнительно деионизированная на установке Arium 611 (Sartorius, Германия).
Всю химическую посуду перед проведением экспериментов обрабатывали хромовой смесью, а затем многократно ополаскивали дистиллированной водой.
Размеры ассоциатов ПАВ до и после солюбилизации ими куркумина определяли с помощью спектрометра динамического рассеяния света (ДРС) Zetasizer Nano ZS (Malvern, Великобритания).
Синтезированные частицы осаждали в центрифуге 320R (Hettich, Германия); их редиспергирование проводили в ультразвуковой ванне.
Размеры и структуру МЧК определяли методом просвечивающей электронной микроскопии высокого разрешения (ПЭМВР) с использованием прибора Leo-912 AB Omega (K. Zeiss, Германия) при ускоряющем напряжении 100 кВ. Для этого каплю водной дисперсии МЧК помещали на медную сеточку, покрытую формваром, выдерживали ее в течение 1 мин, а затем удаляли фильтровальной бумагой.
Качественный анализ встраивания куркумина и мирамистина в SiO2-контейнеры проводили с помощью ИК-фурье-спектрометра Nicolet 380 (Thermo Electron Corp., США). Спектры регистрировали в режиме диффузного отражения в диапазоне волновых чисел 400–4000 см–1; число сканов равнялось 64.
Кроме того, наличие куркумина в синтезированных МЧК подтверждали методом флуоресцентной спектроскопии. Спектры регистрировали на приборе Cary Eclipse (Agilent, США) в кварцевых кюветах толщиной 1 см при длине волны возбуждения 430 нм.
Спектры поглощения растворов чистого и солюбилизированного в мицеллах ПАВ куркумина измеряли с помощью двухлучевого спектрофотометра Evolution 300 (Thermo Electron Corp., США) в диапазоне длин волн 250−800 нм, используя пластиковые кюветы с длиной оптического пути 1 см. В луч сравнения помещали кювету с этанолом.
Исследование растворимости куркумина
Навеску куркумина массой 5.0 мг помещали в 4.0 мл дистиллированной воды или гексана и перемешивали жидкость при комнатной температуре в течение длительного времени. Периодически отбирали пробу раствора, центрифугировали ее, полученную надосадочную жидкость разбавляли этанолом в 10 раз и регистрировали спектр поглощения. С помощью калибровочной зависимости определяли концентрацию куркумина в растворе.
Солюбилизация куркумина в мицеллах функциональных ПАВ
Для количественного определения растворимости куркумина и солюбилизационной емкости мицелл функциональных ПАВ строили калибровочную зависимость оптической плотности растворов куркумина в этаноле от их концентрации в диапазоне 2.8−44.0 мкМ.
Исследование солюбилизации куркумина проводили по следующей методике. Готовили серию водных растворов ПАВ объемом 4.0 мл с концентрацией 1−9 ККМ, где ККМ − критическая концентрация мицеллообразования, равная примерно 1.0, 2.0 и 0.5 мМ для мирамистина, этония и цеталкония соответственно [29–31]. К этим растворам добавляли избыток куркумина (5.0 мг) и перемешивали их при комнатной температуре. Через определенные промежутки времени (1−24 ч) отбирали порцию смеси объемом 500 мкл и подвергали ее центрифугированию для отделения нерастворившегося куркумина. Надосадочную жидкость отделяли, разбавляли этанолом в 100 раз и регистрировали спектр ее поглощения. По калибровочной зависимости определяли количество солюбилизированного куркумина.
Изучение гидролитической стабильности солюбилизированного в мицеллах ПАВ куркумина в кислой и щелочной средах
При проведении экспериментов в качестве модельного солюбилизатора использовали мирамистин. Раствор ПАВ объемом 4.0 мл с концентрацией 3 ККМ с солюбилизированным в мицеллах куркумином разделяли на 4 части объемом 1.0 мл каждая. К двум из них добавляли NH3 ⋅ H2O в количестве, необходимом для достижения pH, равного 10 и 11, а к оставшимся двум частям − 0.01 М раствор HCl до pH 3 и 4. Выдерживали растворы при комнатной температуре, отбирая через определенные промежутки времени (от 5 мин до 2 ч) пробы объемом 20 мкл, разбавляя их этанолом в 100 раз и регистрируя спектры поглощения.
Темплатный синтез МЧК
Синтез МЧК проводили по схеме, описанной в [5]. Для этого к 25.0 мл 3 мМ раствора мирамистина с солюбилизированным в его мицеллах куркумином добавляли 1.2 мл NH3 ⋅ H2O и 1.12 мл 0.7 М раствора ТЭОС в абсолютированном этаноле. Полученную систему перемешивали при комнатной температуре (23°C) в течение суток.
По окончании синтеза частицы SiO2 осаждали центрифугированием (14 000 об./мин, 45 мин). Надосадочную жидкость отделяли, а осадок редиспергировали в деионизированной воде. Процедуру осаждения/редиспергирования проводили 3 раза. На заключительном этапе осадок разделяли на две части. Одну из них сушили в вакуумном шкафу до постоянной массы и анализировали методом ИК-спектроскопии, вторую редиспергировали в воде для исследования методами ПЭМВР и флуоресцентной спектроскопии.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
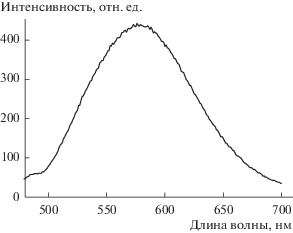
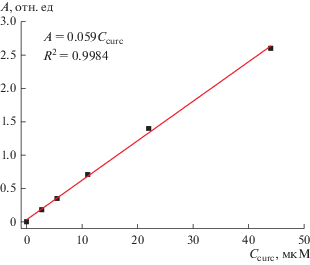
Как отмечено выше, куркумин характеризуется очень низкой растворимостью в воде, но при этом достаточно хорошо растворяется в этаноле с образованием ярко-желтого раствора, имеющего максимум поглощения на длине волны 424 нм [32]. Это позволяет использовать этанольные растворы куркумина для построения калибровочной зависимости оптической плотности растворов от их концентрации в диапазоне 2.8−44.0 мкМ. Эта зависимость описывается линейным уравнением (рис. 2). Из него была получена формула для расчета содержания куркумина в растворах с учетом их 100-кратного разбавления этанолом:
(1)
${{C}_{{{\text{curc}}}}} = ({A \mathord{\left/ {\vphantom {A {0.0592}}} \right. \kern-0em} {0.0592}}) \times 100,$Рис. 2.
Калибровочная зависимость оптической плотности растворов куркумина в этаноле на длине волны 424 нм от их концентрации.
Эксперименты по определению растворимости куркумина в воде показали, что ее максимальное значение достигается за 5 сут и составляет примерно 3 мкг/мл (8 мкМ). Это значение несколько меньше указанного в работе [24], что может быть обусловлено как погрешностью метода определения, так и различием в температуре проведения экспериментов.
Изучение солюбилизации куркумина в мицеллах функциональных ПАВ
Одним из наиболее успешных подходов к увеличению биодоступности куркумина является солюбилизация его в мицеллах ПАВ. В нашей работе с этой целью использованы дифильные лекарственные препараты мирамистин, этоний и цеталконий, характеризующиеся ярко выраженным противомикробным и антимикотическим действием. Их мицеллы способны, как было показано в работах [5, 8], выступать в качестве темплатов при синтезе МЧК. Структурные формулы этих соединений приведены на рис. 3.
В ходе экспериментов водные растворы дифильных лекарственных препаратов с концентрацией 1−9 ККМ насыщали куркумином длительное время. Через заданные промежутки времени регистрировали спектры поглощения надосадочных жидкостей и определяли содержание в них куркумина по формуле (1).
На рис. 4 представлены кинетические кривые солюбилизации куркумина в растворах функциональных ПАВ с концентрацией 9 ККМ. Как можно видеть, с течением времени концентрация куркумина в мицеллярных растворах увеличивается, достигая некоторого равновесного значения. Быстрее всего равновесие устанавливается в растворах этония (5 ч). В случае мирамистина максимальное содержание куркумина в мицеллах достигается за 24 ч, а для цеталкония это время составляет примерно 70 ч. При этом с увеличением концентрации ПАВ количество перешедшего в раствор куркумина закономерно возрастает (рис. 5).
Рис. 4.
Кинетические кривые солюбилизации куркумина в растворах этония (1), цеталкония (2) и мирамистина (3) с концентрацией 9 ККМ.
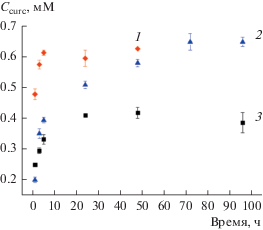
Рис. 5.
Спектры поглощения надосадочных жидкостей, отобранных после насыщения куркумином в течение двух суток растворов этония с концентрацией 1 (1), 3 (2), 6 (3) и 9 ККМ (4).
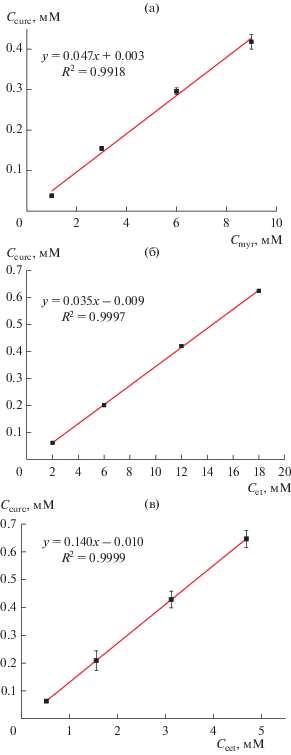
Изотермы солюбилизации приведены на рис. 6. Все они достаточно хорошо описываются линейным уравнением вида: y = ax + b. Линейность изотермы указывает на то, что форма мицелл в ходе солюбилизации не изменяется [33, 34]. Параметр a характеризует значение солюбилизационной емкости мицелл (Е) − отношения числа молекул солюбилизата (в нашем случае куркумина, Ncurc) и солюбилизатора (Nsurf) в мицелле [33]:
Мольные доли куркумина в мицелле (χm) и в водной фазе (χw) рассчитаны по следующим формулам:
Коэффициент распределения (Kd) солюбилизата между мицеллярной псевдофазой и водой и стандартную энергию Гиббса солюбилизации определяли по формулам
Параметры солюбилизации для всех трех ПАВ приведены в табл. 1. Видно, что б'ольшая часть куркумина, присутствующего в растворе, солюбилизирована в мицеллах функционального ПАВ. Об этом свидетельствуют довольно высокие коэффициенты распределения, а также большие отрицательные значения стандартной энергии Гиббса солюбилизации. Таким образом, в мицеллярные растворы функциональных ПАВ переходит примерно в 80 раз больше куркумина, чем в воду.
Таблица 1.
Термодинамические параметры солюбилизации куркумина в мицеллах использованных функциональных ПАВ
| ПАВ | E | Kd | ΔG °, кДж/моль |
|---|---|---|---|
| Мирамистин | 0.047 | 3.1 × 105 | −31.0 |
| Этоний | 0.035 | 2.3 × 105 | −30.1 |
| Цеталконий | 0.140 | 8.6 × 105 | −34.1 |
Сравнивая значения солюбилизационной емкости мицелл каждого из трех использованных солюбилизаторов по куркумину, можно отметить, что термодинамически наиболее выгодным является процесс встраивания куркумина в мицеллы цеталкония. Это может быть обусловлено природой ПАВ и, как следствие, особенностями упаковки молекул солюбилизированного куркумина в его мицеллах.
Согласно данным ДРС солюбилизация куркумина в мицеллах использованных функциональных ПАВ слабо влияет на их размер. Заметные изменения наблюдаются только в случае мирамистина, для которого диаметр мицелл увеличивается от 3 до 5 нм.
Как правило, выделяют три возможных области локализации солюбилизата в мицелле: гидрофобное углеводородное ядро, гидрофильную корону и промежуточный палисадный слой. Наиболее вероятное место встраивания того или иного солюбилизата определяется его полярностью, а также природой солюбилизирующего ПАВ. В молекуле куркумина присутствуют как полярные фенольные и кето-группы, так и неполярные углеводородные и ароматические фрагменты. Отметим, однако, что его растворимость в гексане, моделирующем углеводородное ядро мицеллы, весьма невысока. Это позволяет говорить о преимущественной локализации куркумина в палисадном слое мицеллы. К аналогичному выводу пришли и авторы работ [26, 35], посвященных изучению солюбилизации слабополярных ароматических соединений, в том числе и куркумина, в мицеллах ряда катионных ПАВ.
Золь–гель синтез МЧК
Следующим этапом нашей работы было изучение возможности синтеза мезопористых частиц диоксида кремния на темплате из мицелл функциональных ПАВ, содержащих солюбилизированный куркумин.
Синтез МЧК на темплатах из ассоциатов катионных ПАВ ведут, как правило, в щелочной среде. При этом обеспечивается эффективное взаимодействие между мицеллами катионного ПАВ и депротонированными при высоком значении pH олигомерами кремниевой кислоты.
Куркумин проявляет очень слабые кислотные свойства и характеризуется тремя значениями pKa, равными 8.38, 9.88 и 10.51 [36] и отвечающими диссоциации двух фенольных и одной гидроксильной (енольной) групп. Однако депротонированные формы куркумина нестабильны и гидролизуются с образованием ванилина, феруловой кислоты и ферулоилметана [22]. Как было показано в работе [24], солюбилизация куркумина в мицеллах ПАВ способствует подавлению его щелочного гидролиза. Поэтому, прежде чем проводить синтез МЧК, требовалось убедиться в том, что солюбилизированный в мицеллах ПАВ куркумин будет устойчив в реакционной среде.
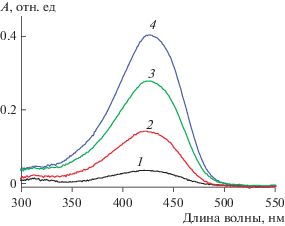
Для этого к раствору мирамистина с концентрацией 3 ККМ, содержащему солюбилизированный куркумин, добавляли водный раствор аммиака до pH 10–11 и через определенные промежутки времени проводили анализ системы на содержание в ней куркумина. Спектры поглощения, полученные после разбавления анализируемого раствора этанолом в 100 раз, приведены на рис. 7а. Видно, что в течение двух часов после добавления к раствору NH3 · H2O значение оптической плотности раствора в максимуме поглощения не претерпевает существенных изменений, а вблизи 500 нм появляется небольшое плечо, свидетельствующее об образовании полностью депротонированной формы куркумина [36]. Через 4 сут оптическая плотность таких щелочных растворов убывает примерно вдвое. Полученный результат свидетельствует об очень медленном гидролизе куркумина, солюбилизированного в мицеллах мирамистина, что позволяет вести золь–гель синтез МЧК на таких мицеллах в щелочной среде.
Рис. 7.
Спектры поглощения нейтрального раствора мирамистина (Cmyr = 3 ККМ) с солюбилизированным куркумином (1), а также измеренные через 2 ч (2) и 4 сут (3) после добавления к нему раствора NH3\ ∙ H2O (pH 11) (а) или раствора HCl (pH 3) (б).
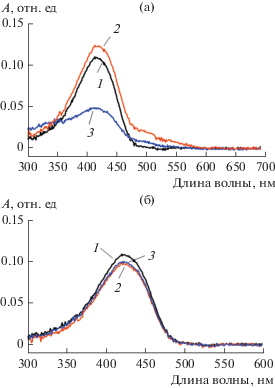
Отметим, что при pH 3–4 солюбилизированный в мицеллах мирамистина куркумин устойчив в течение гораздо более длительного времени (рис. 7б).
Добавление к раствору мирамистина с солюбилизированным куркумином аммиачной воды и ТЭОС приводит к помутнению системы, а затем и к выпадению оранжево-бурого осадка, что свидетельствует о формировании МЧК с капсулированным в них куркумином.
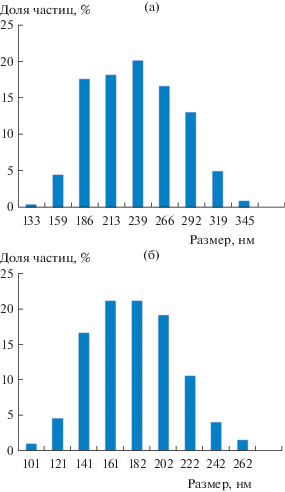
Полученные МЧК были проанализированы методом ПЭМВР. Как видно на микрофотографиях (рис. 8), частицы имеют продолговатую форму; средние длины их главных осей составляют 230 и 170 нм, а осевое отношение равно 1.35 (рис. 9). МЧК характеризуются гексагонально упорядоченной пористой структурой со средним диаметром пор 3−4 нм.
Рис. 8.
Микрофотографии МЧК, полученных на темплате из мицелл мирамистина с солюбилизированным куркумином.

Включение мирамистина и куркумина в SiO2-матрицу подтверждают данные ИК-спектроскопии. На спектре (рис. 10) видны интенсивные полосы колебаний Si–O–Si вблизи 1100 и 780 см–1, а также полосы при 2925 и 1657 см–1, отвечающие соответственно валентным колебаниям C–H и C=O в молекулах мирамистина и куркумина [37, 38]. Это свидетельствует о встраивании в МЧК достаточно больших количеств обоих соединений.
Рис. 10.
ИК-спектр МЧК, синтезированных на темплате из мицелл мирамистина с солюбилизированным куркумином.

Кроме того, анализ дисперсии, полученной осаждением синтезированных МЧК и их редиспергированием в воде, показал (рис. 11), что она характеризуется достаточно интенсивной флуоресценцией на длине волны 520 нм, отвечающей эмиссии куркумина [39].
ЗАКЛЮЧЕНИЕ
Определены количественные характеристики процесса солюбилизации водонерастворимого биологически активного соединения куркумина в мицеллах трех дифильных лекарственных препаратов: мирамистина, этония и цеталкония.
На примере мирамистина продемонстрирована возможность синтеза мезопористых частиц-контейнеров из диоксида кремния на гибридных темплатах из мицелл функционального ПАВ с солюбилизированным в них куркумином. В результате оказывается возможным совмещение стадий синтеза частиц-контейнеров и загрузки в них сразу двух лекарственных препаратов. Показано, что такие субмикронные “бинарные” МЧК-контейнеры имеют упорядоченную мезопористую структуру и содержат достаточно большие количества обоих капсулированных соединений.
Полученные результаты могут быть использованы при решении ряда биомедицинских задач. В частности, они открывают возможность создания новых, более эффективных лекарственных форм куркумина, способных обеспечить не только его высокую растворимость в воде (а значит и биодоступность), но и направленную доставку. Следует также отметить, что сочетанное действие двух лекарственных препаратов может привести к значительному повышению их эффективности.
Подчеркнем в заключение, что предложенный в данной работе подход может быть применен к широкому кругу гидрофобных веществ, включающему, помимо лекарств, например, ингибиторы коррозии. При этом, на наш взгляд, наибольший интерес представляют МЧК, синтезированные на мицеллах биологически активного соединения с солюбилизированным в них антибиотиком или противораковым препаратом. Такие структуры могут стать эффективным средством борьбы с устойчивыми к лекарственной терапии типами бактериальных или опухолевых клеток.
БЛАГОДАРНОСТИ
Авторы искренне благодарны канд. хим. наук В.Н. Барвинченко (Институт химии поверхности НАНУ, Киев, Украина), любезно предоставившей образец этония. Мы также признательны докт. хим. наук Н.М. Задымовой (химический факультет МГУ им. Ломоносова) за полезные советы при обсуждении работы.
Список литературы
Argyo C., Weiss M., Bräuchle C., Bein T. // Chem. Mater. 2014. V. 26. P. 435.
Maleki A., Kettiger H., Schoubben A., Rosenholm J.M., Ambrogi V., Hamidi M. // J. Control. Release. 2017. V. 262. P. 329.
Karaman D.Ş., Manner S., Rosenholm J.M. // Ther. Deliv. 2018. V. 9. P. 241.
Дементьева О.В., Румянцева Т.Б., Рудой В.М. // Коллоид. журн. 2016. Т. 78. С. 265.
Дементьева О.В., Сенчихин И.Н., Карцева М.Е., Огарев В.А., Зайцева А.В., Матушкина Н.Н., Рудой В.М. // Коллоид. журн. 2016. Т. 78. С. 539.
Дементьева О.В., Наумова К.А., Сенчихин И.Н., Румянцева Т.Б., Рудой В.М. // Коллоид. журн. 2017. Т. 79. С. 402.
Dement’eva O.V., Naumova K.A., Zhigletsova S.K., Klykova M.V., Somov A.N., Dunaytsev I.A., Senchikhin I.N., Volkov V.V., Rudoy V.M. // Colloids Surf. B. (в пeчaти).
Dubovoy V., Ganti A., Zhang T., Al-Tameemi H., Cerezo J.D., Boyd J.M., Asefa T. // J. Am. Chem. Soc. 2018. V. 140. P. 13534.
Hao N., Chen X., Jayawardana K.W., Wu B., Sundhoro M., Yan M. // Biomater. Sci. 2016. V. 4. P. 87.
Дементьева О.В., Виноградова М.М., Фролова Л.В., Огарев В.А., Кузнецов Ю.И., Рудой В.М. // Коллоид. журн. 2014. Т. 76. С. 22.
Xu J.-B., Cao Y.-Q., Fang L., Hu J.-M. // Corros. Sci. 2018. V. 140. P. 349.
Дементьева О.В., Фролова Л.В., Рудой В.М., Кузнецов Ю.И. // Коллоид. журн., 2016. Т. 78. С. 550.
Дементьева О.В., Семилетов А.М., Чиркунов А.А., Рудой В.М., Кузнецов Ю.И. // Коллоид. журн. 2018. Т. 80. С. 498.
Дементьева О.В., Сенчихин И.Н., Седых Э.М., Громяк И.Н., Огарев В.А., Рудой В.М. // Коллоид. журн. 2016. Т. 78. С. 35.
He Q., Gao Y., Zhang L., Zhang Z., Gao F., Ji X., Li Y., Shi J. // Biomaterials. 2011. V. 32. P. 7711.
Lantz R.C., Chen G.J., Solyom A.M., Jolad S.D., Timmermann B.N. // Phytomedicine. 2005. V. 12. P. 445.
Sharma O.P. // Biochem. Pharmacol. 1976. V. 25. P. 1811.
Yallapu M.M., Jaggi M., Chauhan S.C. // Drug Discov. Today. 2012. V. 17. P. 71.
Cashman J.R., Ghirmai S., Abel K.J., Fiala M. // BMC Neurosci. 2008. V. 9. № 2. P. 1.
Piper J.T., Singhal S.S., Salameh M.S., Torman R.T., Awasthi Y.C., Awasthi S. // Int. J. Biochem. Cell Biol. 1998. V. 30. P. 445.
Ruby A.J., Kuttan G., Babu K.D., Rajasekharan K.N., Kuttan R. // Cancer Lett. 1995. V. 94. P. 79.
Wang Y.-J., Pan M.-H., Cheng A.-L., Lin L.-I., Ho Y.-S., Hsieh C.-Y., Lin J.-K. // J. Pharm. Biomed. Anal. 1997. V. 15. P. 1867.
Iwunze M.O. // J. Mol. Liq. 2004. V. 111. P. 161.
Leung M.H.M., Colangelo H., Kee T.W. // Langmuir. 2008. V. 24. P. 5672.
Kumar A., Kaur G., Kansal S.K., Chaudhary G.R., Mehta S.K. // Food Chem. 2016. V. 199. P. 660.
Wan Z., Ke D., Hong J., Ran Q., Wang X., Chen Z., An X., Shen W. // Colloids Surf. A. 2012. V. 414. P. 267.
Sahu A., Kasoju N., Goswami P., Bora U. // J. Biomater. Appl. 2011. V. 25. P. 619.
Tønnesen H.H. // Pharmazie. 2002. V. 57. P. 820.
Барвинченко В.Н., Липковская Н.А., Федянина Т.В., Ругаль А.А. // Коллоид. журн. 2014. Т. 76. С. 157.
Fisicaro E., Compari C., Duce E., Donofrio G., Różycka-Roszak B., Woźniak E. // Biochim. Biophys. Acta. 2005. V. 1722. P. 224.
Farías T., de Ménorval L.C., Zajac J., Rivera A. // Colloids Surf. A. 2009. V. 345. P. 51.
Mondal S., Ghosh S., Moulik S.P. // J. Photochem. Photobiol. B. 2016. V. 158. P. 212.
Задымова Н.М., Цикурина Н.Н., Потешнова М.В. // Коллоид. журн. 2003. Т. 65. С. 347.
Ekwall P., Passinen K. // Acta Chem. Scand. 1953. V. 7. P. 1098.
Patel V., Dharaiya N., Ray D., Aswal V.K., Bahadur P. // Colloids Surf. A. 2014. V. 455. P. 67.
Bernabé-Pineda M., Ramírez-Silva M.T., Romero-Romo M., González-Vergaran E., Rojas-Hernández A. // Spectrochim. Acta. A. 2004. V. 60. P. 1091.
Benassi R., Ferrari E., Lazzari S., Spagnolo F., Saladini M. // J. Mol. Struct. 2008. V. 892. P. 168.
Kolev M., Velcheva E.A., Stamboliyska B.A., Spiteller M. // Int. J. Quantum Chem. 2005. V. 102. P. 1069.
Patra D., Barakat C. // Spectrochim. Acta. A. 2011. V. 79. P. 1034.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал