Коллоидный журнал, 2019, T. 81, № 4, стр. 508-516
Изменение проницаемости оболочек полиэлектролитных капсул посредством их модификации гематином
С. С. Румянцева 1, Т. В. Букреева 1, 2, *
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
119333 Москва, Ленинский проспект, 59, Россия
2 НИЦ “Курчатовский институт”
123182 Москва, пл. Академика Курчатова, 1, Россия
* E-mail: bukreeva@crys.ras.ru
Поступила в редакцию 17.01.2019
После доработки 04.02.2019
Принята к публикации 06.02.2019
Аннотация
Для того чтобы регулировать проницаемость оболочек полиэлектролитных капсул, в их состав включали природный гидрофобный пигмент гематин адсорбцией из водно-аммиачного раствора. Модификация капсул красителем подтверждена результатами комбинационного рассеяния света и измерений ζ-потенциала. Капсулы с гематином в составе оболочки охарактеризованы методами спектрофотометрии, атомно-силовой и сканирующей электронной микроскопии. Обнаружены изменения поверхностного заряда, морфологии и толщины оболочек капсул со временем. Также показано снижение проницаемости оболочки модифицированных капсул по отношению к родамину 6G. Получены полиэлектролитные капсулы с доксорубицином внутри и гематином в составе оболочки, из которых лекарственное соединение самопроизвольно не выходит со временем в водную среду.
ВВЕДЕНИЕ
Развитие прецизионной медицины тесным образом связано с созданием и совершенствованием функциональных микро- и наноструктур, сочетающих в себе средства анализа, контроля и доставки лекарственного препарата в нужную точку организма. Значительные успехи в этой области достигнуты благодаря использованию органических и неорганических наночастиц, конъюгатов молекул лекарственных веществ с наночастицами, полимерами, белками. Однако функциональная емкость таких систем ограничена. Для решения этой проблемы используют нано- и микрокапсулы. Эти объекты также перспективны для создания средств комплексного назначения, так как позволяют вводить те или иные функции в объем и на поверхность капсулы и в состав оболочки.
В настоящее время во всем мире активно ведутся разработки в области создания средств доставки лекарств на основе капсул из полиэлектролитных слоев [1]. Такое внимание исследователей обусловлено рядом преимуществ полиэлектролитных капсул перед другими подобными системами: монодисперсностью при широком диапазоне задаваемых размеров, температурной и химической устойчивостью, разнообразием материалов оболочки. Полиэлектролитные капсулы формируют путем последовательной адсорбции полиионов на поверхности коллоидных частиц с последующим растворением ядра [2]. Процесс полиионной сборки осуществляется за счет электростатических взаимодействий противоположно заряженных функциональных групп в составе молекул и физического взаимопроникновения петель полимеров соседних слоев. При этом образуются неупорядоченные пористые структуры. Они хорошо проницаемы для низкомолекулярных соединений, что позволяет удалять ядро с получением полых оболочек.
С использованием послойной адсорбции полиэлектролитов разработан ряд методик инкапсулирования высокомолекулярных лекарственных препаратов (белков, нуклеозидов и т.п.) с хорошими количественными показателями [3]. Однако загрузка в капсулы низкомолекулярных соединений требует особых подходов. Полноценное использование внутренней полости полиэлектролитных капсул для удерживания низкомолекулярных веществ возможно при управлении проницаемостью оболочек путем изменения внешних условий, например, pH среды [4], ионной силы раствора [5], полярности растворителя [6]. Кроме того, проницаемость полиэлектролитной мембраны оболочки может быть снижена за счет ее направленной модификации, например, нанесением на поверхность липидных бислоев [7].
В данной работе для инкапсулирования низкомолекулярных веществ предложено регулировать проницаемость оболочек полиэлектролитных капсул путем их модификации нерастворимым в воде красителем. Ранее методом послойного нанесения были получены капсулы с оболочками из полиэлектролитов и водонерастворимых красителей, адсорбированных из спиртовых растворов [8]. При этом устойчивость капсул была выше при включении красителей в виде молекулярных агрегатов. Такие композитные капсулы оставались проницаемыми для продуктов разложения меламинформальдегидного ядра под действием раствора соляной кислоты [8].
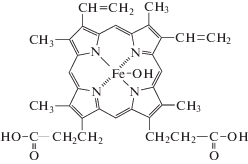
В настоящей работе в качестве модификатора оболочек полиэлектролитных капсул предложено использовать гематин (рис. 1) – гидрофобный пигмент, кофактор ряда ферментов, нековалентно закрепленный в углублении полипептидной цепи между доменами и удерживаемый там за счет гидрофобных взаимодействий [9].
Существуют работы, в которых гематин служит сенсибилизатором для повышения фотоэлектрических свойств полупроводниковых элементов [10–12]. Также возможно применение этого порфирина в качестве фотосенсибилизатора в фотодинамической противоопухолевой терапии. Кроме того, было показано, что молекулы гематина перспективны для адресного нацеливания наноконтейнеров с лекарством на раковые клетки [13]. В нашей работе адсорбция выбранного красителя на полых оболочках полиэлектролитных капсул привела к снижению их проницаемости и инкапсулированию модельного низкомолекулярного лекарственного вещества – известного противоопухолевого препарата доксорубицина. Комплексная система на основе полиэлектролитных капсул, несущих доксорубицин во внутренней полости и гематин в составе оболочки, может стать основой мультифункционального антиракового препарата, сочетающего возможности фотодинамической и химиотерапии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и реактивы
Использовались следующие химические реактивы: полистиролсульфонат натрия (ПСС, 70 кДа), хлорид полидиаллилдиметиламмония (ПДАДМА, 200–300 кДа), гематин (свиной), родамин 6G, тринатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА) (все – Sigma-Aldrich), хлорида кальция дигидрат, карбонат натрия, хлорид натрия, гидроксид аммония (25%-ный водный раствор) (все – Acros Organics), доксорубицин (Доксорубицин-Тева, Фармахеми Б.В., Нидерланды; вспомогательное вещество – моногидрат лактозы).
Воду очищали с помощью системы Millipore Direct-Q 3 UV.
Получение полиэлектролитных капсул
Полиэлектролитную оболочку формировали на пористых сферических микрочастицах ватерита, которые получали по известной методике [14] реакцией карбоната натрия с хлоридом кальция. На поверхность ватерита последовательно наносили поликатион (ПДАДМА) и полианион (ПСС) из растворов с концентрацией 2 мг/мл в 0.15 М водном растворе хлорида натрия. Для этого частицы выдерживали в растворе полимера, затем осадок отделяли центрифугированием и трижды промывали деионизированной водой [2]. Для предотвращения агрегации частиц в процессе полиионной сборки использовали периодическое перемешивание суспензии ультразвуком. После последовательной адсорбции полиэлектролитных слоев и формирования оболочки состава (ПСС/ПДАДМА)4 или (ПСС/ПДАДМА)4ПСС ядра СаСО3 растворяли с помощью 0.2 М водного раствора соли ЭДТА и промывали деионизированной водой.
Модификация капсул гематином
Так как гематин практически не растворим в воде, для модификации полиэлектролитных капсул использовали 5 × 10–4 М водно-аммиачный раствор гематина с рН 8. Раствор гематина готовили путем добавления к навеске вещества аликвоты 0.1 М раствора гидроксида аммония и дальнейшего разбавления деионизированной водой. Полиэлектролитные капсулы, полученные по описанной выше методике, заливали раствором гематина на 30 мин, затем трижды промывали деионизированной водой, отделяя капсулы от супернатанта центрифугированием.
Для приготовления капсул с доксорубицином микрокапсулы сначала заливали водным раствором доксорубицина с концентрацией 1 мг/мл и выдерживали 30 мин на шейкере. Затем суспензию центрифугировали, отбирали супернатант, а к капсулам приливали водно-аммиачный раствор гематина с концентрацией 0.32 мг/мл. Смесь выдерживали 30 мин на шейкере, затем центрифугировали и осадок 3 раза промывали деионизированной водой, также используя центрифугирование.
Методы исследования
Концентрацию капсул в образцах определяли с помощью камеры Горяева. ζ-потенциал частиц измеряли на анализаторе Malvern Zetasizer Nano ZS. Морфологию поверхности оболочек капсул исследовали методом сканирующей электронной микроскопии (СЭМ, микроскоп Jeol 7401F). Толщину оболочек капсул оценивали по изображениям, полученным методом атомно-силовой микроскопии (АСМ) (микроскоп NT-MDT Ntegra Prima, полуконтактный режим). Рамановские спектры регистрировали с помощью конфокального микроспектрометра Renishaw inVia Qontor. Для получения спектрохимического изображения спектры записывали с шагом 1 мкм2 при времени накопления сигнала в каждой точке 5 с. Микрокапсулы визуализировали с использованием конфокального флуоресцентного лазерного сканирующего микроскопа Leica TSC SPE. Для возбуждения флуоресценции родамина 6G использовали лазер с длиной волны 532 нм, для доксорубицина – 488 нм.
Проницаемость капсул оценивали следующим образом: 5 мкл суспензии капсул смешивали с 5 мкл раствора родамина 6G на предметном стекле, накрывали покровным стеклом и исследовали в конфокальном микроскопе. Через 15 мин после смешивания производили замену среды вокруг капсул за счет капиллярного эффекта. Для этого с одной стороны покровного стекла накапывали деионизированную воду и избыток жидкости собирали фильтровальной бумагой с другой стороны покровного стекла.
Спектры поглощения растворов гематина, доксорубицина и суспензий капсул записывали на спектрофотометре Lambda PerkinElmer в диапазоне длин волн 250–700 нм с использованием кварцевых кювет (длина оптического пути 1 см). Количественные определения проводили с помощью градуировочного графика в области линейной зависимости поглощения от концентрации раствора. Для анализа растворов гематина использовали поглощение на длине волны 386 нм, растворов доксорубицина – 488 нм в обычных условиях и 540 нм в щелочной среде.
Супернатант при адсорбции гематина на капсулах с доксорубицином содержит и гематин, и доксорубицин. Спектры поглощения этих веществ перекрываются, при этом действуют закон Бугера–Ламберта–Бера и принцип аддитивности оптической плотности. Для количественного определения концентраций использовали метод Фирордта, согласно которому
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Молекула гематина содержит две карбоксильные группы (рис. 1), и можно предположить ее электростатическое взаимодействие с поликатионом (для ПДАДМА pKa > 8 [15]). Кроме того, возможно возникновение водородных связей, наличие ван-дер-ваальсовых, гидрофобных и других взаимодействий, способствующих устойчивости комплекса полиэлектролит/гематин.
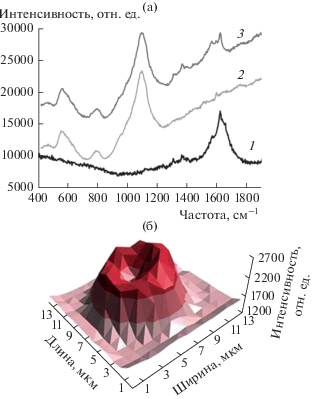
После выдержки капсул (ПСС/ПДАДМА)4 в растворе гематина выводы о вхождении этого соединения в состав оболочек делали на основании данных рамановской микроспектрометрии (рис. 2). Методом картирования спектров комбинационного рассеяния было проведено сканирование квадратной области, описанной вокруг модифицированной капсулы. Для значений интенсивности характеристической полосы гематина при 1624 см–1 (рис. 2а) построена диаграмма типа “поверхность” (рис. 2б). Форма поверхности с учетом толщины участка, захватываемого при сканировании, свидетельствует о включении гематина в состав оболочки капсулы.
Рис. 2.
(а) Спектры комбинационного рассеяния раствора гематина (1), полиэлектролитных капсул (ПСС/ПДАДМА)4 (2) и этих капсул после модификации гематином (3). (б) Распределение высот характеристического пика гематина на частоте 1624 см–1 при сканировании области с модифицированной капсулой.
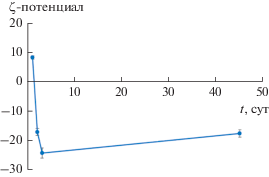
Адсорбцию гематина на оболочке капсул подтверждают также изменения величины ζ-потенциала. Капсулы с верхним слоем ПДАДМА имеют значение ζ-потенциала +27 мВ. Непосредственно после обработки капсул раствором гематина ζ-потенциал частиц составил около +8 мВ. Такая частичная нейтрализация заряда поверхности свидетельствует об адсорбции гематина на оболочке капсулы как низкомолекулярного соединения. Однако для капсул с гематином в деионизированной воде величина и знак ζ-потенциала изменяются со временем (рис. 3). Возникающий уже на вторые сутки отрицательный заряд оболочки можно объяснить тем, что связь гематина с поликатионом – слабая и при замене щелочной среды на нейтральную молекулы красителя начинают образовывать ассоциаты. Отрицательный заряд поверхности таких образований подтверждается отрицательным ζ-потенциалом частиц гематина в нейтральной среде (ζ ≈ –12 мВ). Однако методом спектрофотометрии не было обнаружено упорядоченных агрегатов гематина на оболочках капсул – спектры поглощения модифицированных капсул в нейтральной среде имеют практически те же полосы, что и щелочной раствор гематина.
Спектрофотометрически было определено, что на одном образце капсул (ПСС/ПДАДМА)4, полученных с использованием 0.02 г микрочастиц ватерита в качестве ядер, в выбранных условиях адсорбируется ≈70% исходного количества гематина в растворе. Это соответствует адсорбции 6.7 × 10–15 г гематина на 1 капсуле. Для оболочек состава (ПСС/ПДАДМА)4ПСС в тех же условиях на 1 капсуле адсорбируется около 3.0 × 10–16 г гематина (менее 4% на образец от исходного количества в растворе). Таким образом, как и предполагалось, капсулы с верхним слоем из поликатиона лучше адсорбируют гематин. По-видимому, это обусловлено в основном электростатическим взаимодействием красителя с ПДАДМА. Капсулы с верхним слоем полианиона в щелочной среде заряжены отрицательно (ПСС является сильным полиэлектролитом), следовательно, возникает электростатический барьер для вхождения в оболочку отрицательно заряженного в щелочной среде гематина.
Плохая растворимость гематина в водных растворах при нейтральном значении pH дает основание предполагать изменение проницаемости капсул, модифицированных этим соединением. Для исследования проницаемости в качестве модельного низкомолекулярного вещества был взят флуоресцентный краситель родамин 6G. При смешивании аликвоты суспензии микрокапсул (ПСС/ПДАДМА)4 с раствором этого красителя наблюдается равномерное окрашивание поля зрения, на котором едва различимы контуры микрокапсул (рис. 4а). Это свидетельствует о хорошей проницаемости капсул для родамина 6G. После вытеснения раствора красителя деионизированной водой капсулы превращаются в равномерно слабосветящиеся сферы (рис. 4б) за счет оставшихся молекул красителя, взаимодействующих с полиэлектролитами. Из-за пористой структуры микрочастиц ватерита сформированные на их поверхности полиэлектролитные кап-сулы после растворения ядра представляют собой оболочки с внутренней матрицей из полиэлектролитного комплекса [14]. Поэтому родамин 6G остается практически во всем объеме капсул.
Рис. 4.
Изображения в конфокальном флуоресцентном микроскопе капсул (ПСС/ПДАДМА)4 до (а, б) и после модификации гематином и выдержки в течение 3 (в, г) и 24 сут (д, е). Слева – капсулы, помещенные в раствор родамина 6G, справа – после вытеснения раствора красителя водой.

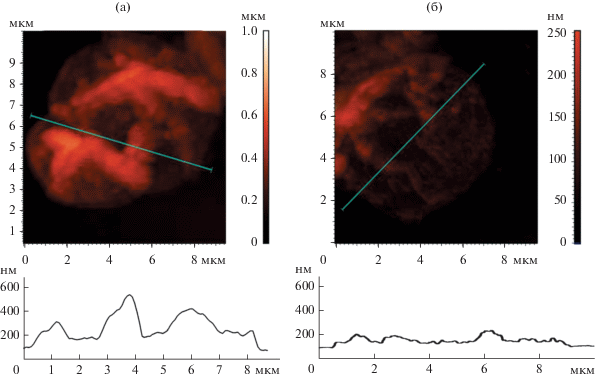
В случае капсул с гематином при смешивании суспензии с раствором красителя на окрашенном фоне наблюдаются четкие контуры оболочек (рис. 4в, 4д). При этом через 24 сут после модификации гематином при добавлении родамина 6G капсулы становятся менее окрашенными (рис. 4д) по сравнению с капсулами через 3 сут (рис. 4в), что подтверждает предположение о существенном снижении проницаемости модифицированных оболочек со временем. После замены раствора родамина 6G на воду на поверхности капсул с гематином остается тонкий слабо окрашенный слой (рис. 4г, 4е). Это свидетельствует об изменении структуры оболочки при вхождении в ее состав гематина. По-видимому, происходит уплотнение оболочки без существенного изменения размера капсул. Этот вывод подтверждают данные, полученные методом АСМ (рис. 5). Толщина участка без складок высохшей капсулы, определенная из высоты профиля, соответствует удвоенной толщине оболочки [14]. Капсулы (ПСС/ПДАДМА)4 имеют толщину оболочек около 40 нм (рис. 5а), в то время как толщина оболочек капсул с гематином через 45 сут после модификации составляет 25–32 нм (рис. 5б).
Рис. 5.
АСМ-изображения (сверху) и профили поверхности (снизу) вдоль проведенных на этих изображениях линий для немодифицированных капсул (ПСС/ПДАДМА)4 (а) и капсул через 45 сут после модификации гематином (б).
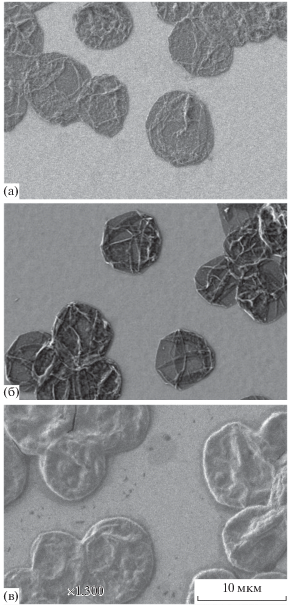
Исследование капсул методом СЭМ не показало существенного изменения морфологии капсул с гематином после 7 сут хранения водной суспензии (рис. 6а, 6б). Можно отметить лишь более четкие контуры складок и предположить увеличение жесткости оболочки. Спустя 45 сут оболочки выглядят более плотными, при высыхании формируется меньше складок (рис. 6в). Размер капсул при старении практически не изменяется.
Рис. 6.
СЭМ-изображения капсул (ПСС/ПДАДМА)4 до (а) и после модификации гематином и выдержки в течение 7 (б) и 45 сут (в).
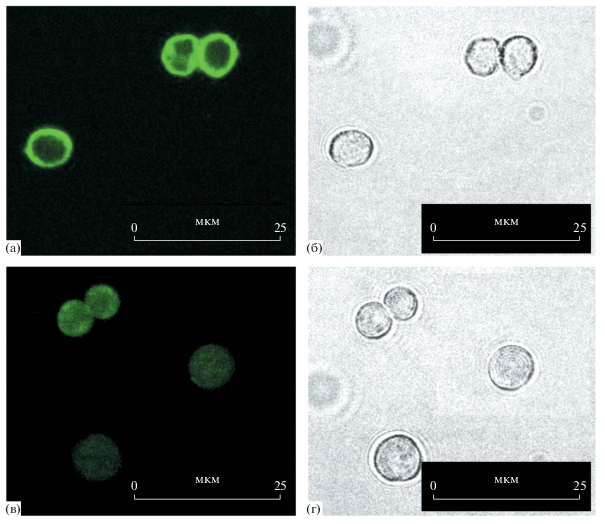
Мы предположили, что изменение проницаемости оболочки в результате модификации полиэлектролитных капсул гематином можно использовать для инкапсулирования низкомолекулярных лекарственных веществ. Для загрузки доксорубицином капсулы выдерживали в его растворе, а затем инкубировали в растворе гематина. Для доксорубицина pKa = 8.6 [16], следовательно, в нейтральной среде его молекулы заряжены в основном положительно. Исследование методом конфокальной микроскопии показало непроницаемость полых капсул (ПСС/ПДАДМА)4 для доксорубицина, что можно объяснить существованием электростатического барьера в случае капсул с верхним слоем из поликатиона. Тогда для загрузки были взяты капсулы с составом оболочки (ПСС/ПДАДМА)4ПСС. Из данных конфокальной микроскопии (рис. 7) следует, что в результате обработки таких полиэлектролитных капсул раствором доксорубицина флуоресцирующее вещество располагается преимущественно в области оболочки (рис. 7а). Последующая модификация оболочки гематином приводит к вытеснению доксорубицина в полость микрокапсулы, в результате чего начинает равномерно светиться весь объем капсулы (рис. 7в).
Рис. 7.
Капсулы (ПСС/ПДАДМА)4ПСС с доксорубицином до (а, б) и после (в, г) модификации оболочки гематином. Слева (а, в) представлены изображения капсул, полученные в конфокальном микроскопе во флуоресцентном режиме, справа (б, г) – в просвечивающем режиме.
После выдержки оболочек состава (ПСС/ ПДАДМА)4ПСС в растворе доксорубицина загрузка этим лекарственным веществом, определенная по убыли его концентрации в исходном растворе, составила 0.43 мг на образец (4.3 × 10–14 г на капсулу). После четырех промывок деионизированной водой на одну капсулу приходится 2.9 × × 10–14 г доксорубицина. В результате модификации капсул, содержащих доксорубицин, гематином и четырех промывок водой загрузка лекарством составила 3.4 × 10–14 г на капсулу. Следует отметить, что на капсулах с доксорубицином адсорбируется такое же количество гематина, как и на не загруженных лекарством капсулах.
Таким образом, модификация оболочек гематином практически не увеличивает загрузку капсул доксорубицином. Однако было обнаружено, что, несмотря на небольшой процент включения гематина в состав оболочек капсул от исходного в растворе (около 3.5%), он препятствует выходу лекарственного вещества из капсул. После 45 сут выдержки капсул в деионизированной воде в спектре поглощения супернатанта практически не наблюдается пика доксорубицина. В отличие от этого, из образца капсул без гематина (≈1010 капсул) в 2 мл деионизированной воды выходит 0.02–0.03 мг лекарственного вещества.
ЗАКЛЮЧЕНИЕ
Гематин может быть включен в состав оболочек полиэлектролитных капсул из водно-аммиачного раствора. При этом на капсулах (ПСС/ ПДАДМА)4 адсорбируется на порядок больше красителя, чем на капсулах (ПСС/ПДАДМА)4ПСС, что можно объяснить электростатическим взаимодействием отрицательно заряженного в щелочной среде гематина с поликатионом и электростатическим отталкиванием от верхнего слоя полианиона.
Со временем хранения водной суспензии модифицированных капсул наблюдаются изменения оболочек: 1) слабоположительный заряд их поверхности становится отрицательным, 2) снижается проницаемость для родамина 6G, 3) уменьшается толщина оболочки и наблюдается ее уплотнение. Средний диаметр оболочек капсул с гематином соответствует диаметру немодифицированных капсул и со временем не изменяется. Спектрофотометрические исследования не показывают формирования упорядоченных агрегатов гематина в оболочке капсул. По-видимому, наблюдаемые эффекты обусловлены медленной перестройкой внутренней структуры модифицированных оболочек.
Получены полиэлектролитные капсулы с доксорубицином внутри и гематином в составе оболочки. Снижение проницаемости оболочек капсул, вызванное включением гематина в их состав, предотвращает выход доксорубицина из капсул в окружающую водную среду. Такое инкапсулирование лекарственного вещества может обеспечить безопасность препарата для транзитных тканей организма и снижение общей токсической нагрузки на организм, что делает предложенную систему перспективной для дальнейших исследований, ориентированных на биомедицинское применение.
БЛАГОДАРНОСТИ
Работа выполнена с использованием оборудования ЦКП ФНИЦ “Кристаллография и фотоника” РАН.
Авторы благодарят В.В. Артемова и А.М. Опол-ченцева за исследования капсул методами СЭМ и АСМ. Также авторы выражают благодарность ООО “Ренишоу” и лично руководителю направления рамановской спектроскопии К.В. Понкратову за практическую и методическую помощь в проведении анализов на рамановском спектрометре inVia Qontor.
Список литературы
Xuan M., Zhao J., Shao J. et al. // J. Colloid Interface Sci. 2017. V. 487. P. 107.
Donath E., Sukhorukov G.B., Caruso F. et al. // Angew. Chem. Int. Ed. 1998. V. 37. P. 2201.
De Cock L.J., De Koker S., De Geest B.G. et al. // Angew. Chem. Int. Ed. 2010. V. 49. P. 6954.
Sukhorukov G.B., Antipov A.A., Voigt A. et al. // Macromol. Rapid Commun. 2001. V. 22. P. 44.
Ibarz G., Dahne L., Donath E., Mohwald H. // Adv. Mater. 2001. V. 13. P. 1324.
Lvov Y., Antipov A.A., Mamedov A. et al. // Nano Lett. 2001. V. 1. P. 125.
Moya S., Donath E., Sukhorukov G.B. et al. // Macromolecules. 2000. V. 33. P. 4538.
Dai Z., Voigt A., Leporatti S. et al. // Adv. Mater. 2001. V. 13. P. 1339.
Maehly A.C. // Biochem. Biophys. Acta. 1952. V. 8. P. 1.
Yu Y., Zou S., Wang K. et al. // J. Biomed. Nanotechnol. 2018. V. 14. P. 1568.
Dai H., Gong L., Xu G. et al. // Sens. Actuators B. 2015. V. 215. P. 45.
Tang J., Kong B., Wang Y. et al. // Nano Lett. 2013. V. 13. P. 5350.
Amin M.L., Kim D., Kim S. // Eur. J. Pharm. Sci. 2016. V. 91. P. 138.
Volodkin D.V., Petrov A.I., Prevot M., Sukhorukov G.B. // Langmuir. 2004. V. 20. P. 3398.
Dickhaus B.N., Priefer R. // Colloids Surf. A. 2016. V. 488. P. 15.
Zhao Q., Han B., Wang Z. et al. // Nanomedicine. 2007. V. 3. P. 63.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал