Коллоидный журнал, 2019, T. 81, № 4, стр. 441-452
Физико-химическая механика бактериальной целлюлозы
З. Н. Скворцова 1, *, Т. И. Громовых 2, В. С. Грачев 1, В. Ю. Траскин 1
1 Московский государственный университет им. М.В. Ломоносова, химический факультет
119991 Москва,
Ленинские горы, Россия
2 Первый московский государственный медицинский университет им. И.М. Сеченова
119146 Москва, Большая Пироговская ул., 19, Россия
* E-mail: zskvor@yahoo.com
Поступила в редакцию 03.01.2019
После доработки 15.01.2019
Принята к публикации 19.01.2019
Аннотация
Бактериальная целлюлоза является продуктом жизнедеятельности некоторых видов бактерий и, в отличие от растительной целлюлозы, характеризуется высокой чистотой, прочностью и эластичностью. Эти свойства, а также нетоксичность и биосовместимость, обусловливают применение бактериальной целлюлозы в биотехнологии, медицине и при создании композитных материалов в качестве армирующего компонента. Наноразмеры структурных элементов бактериальной целлюлозы обеспечивают большую удельную поверхность и, как следствие, ярко выраженную зависимость многих свойств материала от поверхностных взаимодействий со средой. В обзоре обсуждаются структура и механические свойства бактериальной целлюлозы; особое внимание уделено ее поведению в присутствии воды и водных растворов.
“Бактерии не ошибаются …” С. Гандлевский
1. ВВЕДЕНИЕ
Бактериальная целлюлоза (БЦ) – новый материал, привлекающий в последнее время внимание исследователей благодаря своим уникальным физико-химическим и механическим свойствам, а также биосовместимости и биоразлагаемости. БЦ является наиболее перспективным видом наноцеллюлозных материалов, к которым относятся также нанофибрильная и нанокристаллическая целлюлоза [1]. Все подобные материалы образованы частицами, имеющими наноразмеры, по крайней мере, в одном измерении. Нанофибрильную целлюлозу получают, изолируя нанофибриллы из растений; нанокристаллическая целлюлоза, состоящая из палочкообразных частиц с высокой степенью кристалличности, образуется при кислотном гидролизе растительной целлюлозы [2, 3]. Бактериальная целлюлоза получается непосредственно в процессе биосинтеза как в природной среде, так и в искусственно созданных условиях.
Целлюлоза – самый распространенный биополимер, являющийся компонентом клеточных стенок растений. Альтернативным продуцентом целлюлозы служат некоторые виды аэробных бактерий. Первые сообщения о БЦ содержатся в статье Брауна [4], который доказал тождественность химического состава растительной целлюлозы и продуцируемых бактериями пленок. Но при этом растительная целлюлоза, в отличие от БЦ, содержит примеси лигнина и гемицеллюлозы, в процессе удаления которых уменьшается длина полимерных цепочек. БЦ свободна от этих примесей; кроме того, благодаря высокой степени полимеризации в сочетании с трехмерной наноструктурой она обладает значительной сопротивляемостью деформации и разрушению. Нанометровые поперечные размеры фибрилл БЦ обеспечивают высокую пористость и развитую внутреннюю поверхность, а значит, и высокую водоудерживающую способность материала. Эта особенность БЦ открывает возможности ее использования как матрицы-носителя лекарственных препаратов для приема внутрь или в виде покрытия на раны и ожоги [5]. С другой стороны, механические характеристики БЦ позволяют успешно применять ее в качестве армирующего компонента различных композиционных материалов. В качестве прекурсора костной ткани рассматривается композит на основе БЦ и нанокристаллов гидроксиапатита [6, 7]. Высокая востребованность БЦ во многих областях объясняет ее растущую популярность в качестве объекта исследования: так, опираясь на данные, приведенные в [8], можно убедиться в экспоненциальном характере роста числа соответствующих публикаций за последние 15 лет.
Многочисленные исследования, в которых свойства целлюлозных материалов рассматриваются с позиций физико-химической механики, показывают их высокую чувствительность к действию воды и водных растворов. При этом специфической особенностью БЦ является то, что вода всегда присутствует в ее внутреннем пространстве, улучшая или ухудшая эксплуатационные свойства полимера. Поэтому в предлагаемом обзоре рассматриваются результаты работ, посвященных изучению структуры и механических свойств БЦ, определяющих ее отклик на различные воздействия, как правило, в присутствии водных сред.
2. ПОЛУЧЕНИЕ БАКТЕРИАЛЬНОЙ ЦЕЛЛЮЛОЗЫ
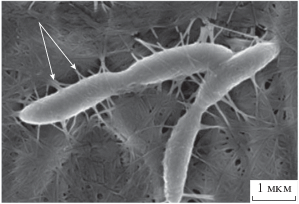
В лабораторных условиях бактерии образуют пленки чистой целлюлозы на границе питательного раствора с воздухом [9]. Бактерии синтезируют целлюлозу из низкомолекулярных соединений (сахаров или других углеводов) и выделяют ее в водную среду в виде нанофибрилл [1] (рис. 1). Причины, по которым бактерии генерируют целлюлозу, окончательно не ясны. Предполагается, что это необходимо для их выживания: пленка предохраняет от потерь воды и кислорода, от ультрафиолетового излучения или действует как барьер против патогенных микроорганизмов [10, 11].
В препаративном синтезе БЦ используются чаще всего грамотрицательные бактерии, среди которых самые известные – Gluconacetobacter (ранее Acetobacter), а также представители родов Agrobacterium, Achromobacter, Azotobacter, Alcaligenes, Aerobacter, Rhizobium, Pseudomonas, Salmonella, G. xylinus, G. hansenii [12–14]. Целлюлоза может синтезироваться и грамположительными бактериями вида Sarcina ventriculi [15], а также сконструированными методами генной инженерии штаммами видов Escherichia coli и Salmonella typhimurium [16].
В качестве питательной среды обычно используют комплекс Шрамма–Хестрина, включающий в себя источник углерода (сахароза, глюкоза и др.), буферный раствор для обеспечения необходимого pH (фосфатный, цитратный и др.) и вспомогательные вещества (пептон, экстракт дрожжей) [14]. Для увеличения продуктивности бактериальных штаммов применяют добавки [17] – карбоксиметилцеллюлозу, альгинат натрия, агар, ксантан, этанол.
В лабораторных условиях БЦ может быть синтезирована в разных режимах. Пленки получают в статическом режиме в колбах, чашках Петри, на подложках-матах. Образующиеся при этом пленки имеют гелеобразный вид. Статический режим БЦ отличается относительно малой продуктивностью и низкой скоростью синтеза, так как в нем участвуют только бактерии, находящиеся на межфазной границе воздух–среда [9]. БЦ, получаемая в режиме погруженных культур (динамический режим), образуется с более высоким выходом благодаря лучшим условиям контакта бактерий с циркулирующим воздухом, что важно при реакторном получении материала. Динамическая БЦ образуется чаще всего в форме гранул и, как отмечается в [18], имеет меньшую степень полимеризации и кристалличности и уступает статической БЦ по механическим характеристикам (прочности и модулю Юнга). Поэтому технологические свойства, необходимые для биомедицинских применений, фактически имеют только культуры, полученные в статическом режиме [19].
3. СТРОЕНИЕ БАКТЕРИАЛЬНОЙ ЦЕЛЛЮЛОЗЫ
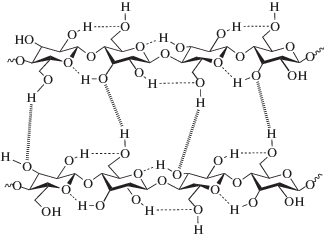
Целлюлоза представляет собой линейную цепь гликозидных колец (C6H10O5)n, связанных между собой 1–4-гликозидной связью, а также водородной связью между гидроксильной группой и кислородом соседней молекулы (рис. 2). Степень полимеризации БЦ по разным данным колеблется в широких пределах и составляет от 1000 до 10 000–14 000 в зависимости от того, в каком режиме (статическом или динамическом) пленки были получены [12].
Полимерные молекулы, синтезированные внутри бактериальной клетки, проходят через ее поры (рис. 1) и формируют уже вне клетки протофибриллы диаметром 2–4 нм [20]. По-видимому, процесс сборки регулируется размерами и формой пор [21, 22]. Протофибриллы затем группируются в микрофибриллы в виде лент, имеющих толщину и ширину 2–6 и 70–140 нм соответственно [9, 23–25].
Возникающие в процессе биосинтеза ван-дер-ваальсовы взаимодействия и межмолекулярные водородные связи обеспечивают параллельную ориентацию целлюлозных цепей, формирующих микрофибриллы. Наличие сетки водородных связей (как внутри-, так и межмолекулярных) придает фибриллам БЦ достаточно высокую осевую жесткость. Ленты образуют плотную трехмерную сетку в форме желатинообразной пленки [26]. Механизм возникновения трехмерной сетки зацепления фибрилл связан с процессом деления клеток, происходящим в одно время с биосинтезом [27]. Сканирующая электронная микроскопия [27] выявила наличие пачек тонких слоев длиной 10–100 мкм, состоящих из переплетенных фибрилл [28]. Отсутствие ориентации фибрилл в слоях подтверждается методом малоуглового рентгеновского рассеяния [29].
В целом фибриллы БЦ в 100–200 раз тоньше фибрилл растительной целлюлозы [30–34] (рис. 3), что в значительной мере обусловливает большую удельную поверхность БЦ. В свою очередь, сильно развитая поверхность БЦ с большим количеством гидроксильных групп обеспечивает, наряду с высокой гидрофильностью, возможность химического модифицирования полимера [9].
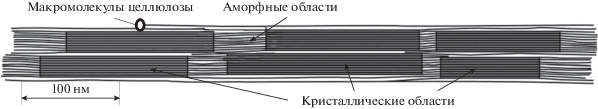
Микрофибриллы БЦ содержат высокоорганизованные (кристаллические) области, обеспечивающие их жесткость, и аморфные участки, делающие микрофибриллы гибкими и податливыми [35] (рис. 4). В модели, предложенной в работе [36], предполагается также наличие мономолекулярных паракристаллических слоев на поверхности кристаллитов. Модель позволяет, исходя из степени кристалличности целлюлозы, рассчитать, например, изотермы сорбции и десорбции паров воды в широком диапазоне давлений пара, теплоту смачивания, а также предсказать механические характеристики материала.
Физико-химические и механические свойства целлюлозы и ее поведение в различных средах определяются ее структурой, прежде всего степенью кристалличности, кристаллической модификацией и распределением кристаллитов по размеру. Для БЦ характерны малые размеры кристаллитов и высокая степень кристалличности [37]. Согласно данным рентгеновской дифрактометрии, степень кристалличности БЦ, полученной в статических условиях, составляет от 70 [12] до 85–100% [38]. Среди шести полиморфных модификаций целлюлозы, известных к настоящему времени, в природных материалах обнаруживается форма целлюлозы I [39–41], которая, в свою очередь, имеет две полиморфных модификации: триклинную Iα и моноклинную Iβ. Рентгеновская дифрактометрия показала, что форма Iα превалирует в целлюлозе, продуцированной бактериями или водорослями, в то время как форма Iβ – в древесной целлюлозе [36, 42, 43]. Так, было обнаружено, что формы Iα и Iβ в образцах, полученных с помощью продуцента A. xylinum, содержатся в отношении, близком к 70 : 30 [44, 45]. Данные ЯМР также говорят о высокой степени кристалличности БЦ с высоким содержанием формы Iα [46, 47]. Между размерами кристаллитов и относительным содержанием формы Iα наблюдается строгая корреляция [37, 48].
Поскольку ни в одном образце нативной целлюлозы не было обнаружено чистой формы Iα, был сделан вывод, что эта низкосимметричная триклинная форма целлюлозы I является метастабильной [49, 50]. Целлюлоза Iα может быть превращена в Iβ путем термической обработки (при 240–270°С) в щелочных растворах или в органических средах [51–53]. Однако полного превращения в форму Iβ, как правило, не происходит. Сосуществование двух полиморфов, имеющих различную стабильность, должно влиять на реакционную способность нативной целлюлозы: так как форма Iα метастабильна, ее реакционная способность выше, чем у Iβ.
4. ПОРИСТОСТЬ И ВОДОСОДЕРЖАНИЕ
Волокнистая структура БЦ обладает высокой пористостью [41, 54, 55], что, наряду с сетчатым строением, определяет ее чрезвычайно большую водоудерживающую способность. В нативном состоянии БЦ представляет собой гидрогель – содержание целлюлозы в исходных пленках не превышает 1% [25, 56]. Пленки способны удерживать воду в течение длительного времени [41]. Водоудерживающая способность БЦ гораздо выше, чем у целлофана и фильтровальной бумаги (содержание воды в этих материалах не превышает 70%).
Содержание воды в целлюлозе обычно характеризуют двумя величинами – водоудерживающей способностью (water holding capacity, WHC) и абсорбционной емкостью (water absorption capacity, WAC). Они определяются соответственно как
Рассчитываемые величины зависят как от способа определения веса нативной целлюлозы, так и от метода осушки. Среди различных способов определения W0 (встряхивание пленки, дренирование горизонтально или вертикально ориентированного образца, удаление воды с поверхности фильтровальной бумагой, вакуумный метод) в работе [57] предпочтение отдается последнему, состоящему в отсасывании жидкости на фильтре Millipore при давлении 98 Па в течение 4 ч. Разумеется, величина WHC при этом оказывается меньше (примерно в 2 раза), чем при использовании других методов, но величина стандартного отклонения уменьшается до 5.5% (по сравнению с 10–15% для других методов).
Бактериальную целлюлозу сушат, выдерживая ее на воздухе при комнатной температуре, в термостате или вакуумном шкафу (при этом пленки зачастую становятся морщинистыми из-за сильной усадки); в некоторых случаях осушку сочетают с прессованием (в этом случае получают плоские пленки, имеющие толщину около 1% от исходной). Используют также метод последовательной замены растворителя, например, в ряду этанол–ацетон–гексан. Для предотвращения необратимого коллапса супрамолекулярной структуры и потери высокой пористости, присущей исходным образцам, чаще всего применяют метод лиофильной сушки (freeze-drying) или сверхкритическую флюидную экстракцию (critical point drying) [58–60].
Сравнение морфологии мембран БЦ, осушенных различными методами, проводилось с использованием инфракрасной спектроскопии и сканирующей электронной микроскопии [61]. При осушке на воздухе структура БЦ нарушается из-за агрегации целлюлозных фибрилл, и пористость оказывается значительно сниженной [62]. При лиофильной сушке связи между макромолекулами оказываются значительно слабее, что приводит к снижению прочности образующихся мембран [63]. Методом диэлектрической релаксации были найдены различия в релаксационном поведении при осушке БЦ разными способами (пошаговой сушке, осушении при постепенном увеличении температуры или при заданной высокой температуре) [64]. Автор связывает это с различными механизмами удаления воды, сорбированной элементами надмолекулярной структуры разного уровня.
Как правило, значения WHC при сушке в печи превышают соответствующие величины, полученные при лиофильной сушке [47]. В то же время величина WAC в последнем случае оказывалась значительно (в несколько раз) выше абсорбционной способности высушенных в печи образцов, что объясняется образованием пористой слоистой структуры, способствующей действию капиллярных сил [41].
Рентгеновская дифрактометрия показывает различную степень кристалличности у образцов БЦ, высушенных различными методами: так, при лиофильной сушке степень кристалличности составила 68%, а при сушке при температуре 60°C – 96.5% [41]. Термогравиметрический анализ показал, что в интервале температур от комнатной до 200°C вес БЦ уменьшается медленно, волокна теряют физически адсорбированную воду, связанную в аморфных областях, в то время как кристаллические области практически не поглощают воду. При дальнейшем увеличении температуры скорость потери воды увеличивается, максимальная потеря веса (до 95%) наблюдается при 303°C.
Исходное количество свободной воды обычно бывает относительно мало: по данным [65], если нативный образец содержит 98% воды, на свободную воду приходится всего 0.3%.
Процесс сушки БЦ и сопутствующие ему изменения механических свойств полимера весьма подробно проанализированы в работе [66]. Кинетика высыхания рассматривается как трехстадийный процесс, включающий обратимый переход воды из связанного в свободное состояние и необратимое испарение свободной воды (предполагается, что конденсации воды на БЦ из атмосферы не происходит). Все три кинетические константы, описывающие эти процессы, зависят от внешних условий и от толщины образца.
При температуре выше 300°C начинается разложение полимера. Термическая стабильность зависит от способа получения и высушивания образца, молекулярной массы БЦ, степени ее кристалличности и других структурных особенностей [67]. Щелочная обработка по данным [68] приводит к увеличению термостойкости полимера: пик деградации на кривых ДСК смещается от 298°C для нативной пленки до 370°C для пленки, обработанной в растворе K2CO3.
5. МЕХАНИЧЕСКИЕ СВОЙСТВА БАКТЕРИАЛЬНОЙ ЦЕЛЛЮЛОЗЫ
Своеобразные механические свойства БЦ определяются высокой степенью ее кристалличности, значительной ориентацией гликозидных цепей в фибриллах и достаточной степенью чистоты. Внутримолекулярные и межцепочечные водородные связи придают фибриллам прочность в сочетании с гибкостью. Их нанометровая толщина обеспечивает высокую концентрацию гидроксильных групп и развитую внутреннюю поверхность, в результате чего образуется прочная сетка нанофибрилл, связанных между собой. По сравнению с растительной целлюлозой, имеющей фибриллы гораздо большего диаметра, плотность межфибрильных водородных связей и, соответственно, прочность БЦ оказывается гораздо выше [31, 69].
При исследовании механических свойств образцов БЦ методом одноосного растяжения, как правило, наблюдается большой разброс данных как из-за неоднородности образцов по толщине (так как в процессе ферментации рост БЦ происходит неравномерно), так и из-за отсутствия преимущественной ориентации фибрилл [56]. Кроме того, механическое поведение любой наноцеллюлозы существенно зависит от содержания в ней влаги.
Синтезированные пленки БЦ содержат бактерии, а также другие примеси, способные влиять на прочность материала, поэтому для определения истинных значений прочности требуется соответствующая очистка. Обычно для этой цели применяют различные поверхностно-активные вещества (например, додецилсульфат натрия) [70] или щелочные растворы [71]. Однако следует иметь в виду, что использование концентрированных растворов щелочи в течение длительного времени может привести к полиморфному превращению целлюлозы I в целлюлозу II. Часто применяют метод двухступенчатой обработки БЦ. Было показано [72], что обработка целлюлозы последовательно растворами NaClO и NaOH с ее последующей сушкой увеличивает модуль Юнга (определенный методом резонансной частоты) от 15 до 30 ГПа. Авторы связывают этот эффект с тем, что при контакте с раствором NaClO значительно (на 80–90%) уменьшается содержание азотсодержащих компонентов, таких как белки и нуклеиновые кислоты. Их удаление приводит к увеличению вероятности образования непосредственных контактов между макромолекулами целлюлозы. Однако обработка в более концентрированных растворах NaClO (выше 0.5 мас. %) может привести к деградации БЦ и увеличению низкомолекулярной фракции. Дальнейшая обработка в растворе NaOH (оптимальная концентрация – 5 мас. %) приводит к удалению низкомолекулярных полисахаридов, что также способствует повышению модуля упругости материала. Важным наблюдением, сделанным в работе [72], является тот факт, что повторные циклы пропитки и сушки практически не влияют на механическое поведение образцов. В работе [73] предлагается другая последовательность: сначала целлюлозу отмывают щелочью и затем раствором гипохлорита. Улучшение механических свойств отмытых таким образом и высушенных пленок авторы связывают с удалением примесей из пор, что облегчает образование водородных связей в процессе сушки.
5.1. Механические свойства осушенной бактериальной целлюлозы
Механические свойства сухих пленок БЦ в значительной степени зависят от метода их высушивания. В работе [47] сравнивали прочность, модуль Юнга и деформацию образцов БЦ, высушенных методом лиофильной сушки или в печи. Измерения проводили при постоянной скорости деформации 1 мм/с. При практически одинаковой деформации до разрыва (3–4%), модуль Юнга для лиофильно высушенных образцов оказался гораздо ниже (6.65 против 18.1 ГПа для образцов, высушенных в печи). Примерно в такой же пропорции различались разрывные усилия (8.5 и 26.5 Н соответственно), в то время как разница в разрывных напряжениях была гораздо более значительной (11.9 и 329.8 МПа). Последнее обстоятельство, безусловно, объясняется различием в плотности высушенных пленок: при лиофильной сушке толщина полученной пленки обычно бывает на порядок больше за счет внутренних пустот.
Часто процесс сушки БЦ как при комнатной, так и при высоких температурах сочетают с прессованием. При этом модуль Юнга, прочность и деформация до разрушения образцов, высушенных при температуре до 200°C и при давлении не выше 500 МПа, остаются практически постоянными (15–20 ГПа, 250 МПа и 2% соответственно). При более высоких давлениях (до 2 ГПа) модуль Юнга не изменяется, однако значения прочности и деформации снижаются в 2 раза [27]. Авторы связывают такое ухудшение механических характеристик с возникновением опасных дефектов под действием высокого приложенного давления.
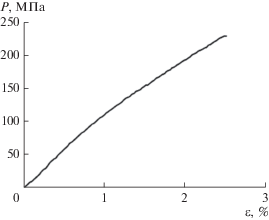
Похожие значения прочности и деформации до разрыва (≈240 МПа и 2.6%) были получены при прессовании пленок БЦ под давлением 2 МПа при 120°C в течение 4 мин до полного удаления воды [74]. Типичная кривая растяжения представлена на рис. 5. Нелинейный характер кривой свидетельствует, по мнению авторов, о том, что при относительной деформации выше 1% начинают происходить разрывы в сетке фибрилл. Модуль Юнга, определенный из наклона начального участка кривой, оказался равным 9.7 ГПа. Аналогичная кривая растяжения для образцов наноцеллюлозы была получена в работе [58]. Параллельно этот же автор измерял распределение деформации между фибриллами, декорируя поверхность образцов тонкими (20 мкм) частицами графита и следя за их перемещением в процессе деформации. Было показано, что равномерное распределение наблюдается только в упругой линейной области (вплоть до деформации около 1%).
Измерения предела текучести наноцеллюлозы показали, что высокая температура и низкая скорость деформации способствуют падению предела текучести, происходящему в результате увеличения сегментальной подвижности макромолекул [75]. Рассчитанная по уравнению Эйринга энергия активации перехода деформации в неупругую область оказалась равной 157 кДж/моль [58], что гораздо выше энергии разрыва водородных связей (20–50 кДж/моль, согласно [76]), но ниже энергии диссоциации ковалентных связей C–C и C–O (300–500 кДж/моль [77]). На основании этого автор высказывает предположение, что неупругая деформация наноцеллюлозы есть следствие повышения сегментальной подвижности макромолекул, которая облегчается в результате разрыва водородных связей.
Эффективным и неразрушающим методом выявления молекулярной деформации целлюлозных материалов служит спектроскопия комбинационного рассеяния света (впервые для целлюлозных материалов она была применена в работе [78]). Метод основан на определении локальной деформации молекул на основе анализа смещения полосы 1095 см–1, соответствующего растяжению гликозидной связи. Жесткость единичной фибриллы оценивается по зависимости относительного смещения полосы от приложенного напряжения. Определенные таким способом модули Юнга высушенной БЦ лежат в пределах от 79–88 ГПа [79] до 114 ГПа [74]. Вместе с тем, проведенные в [74] измерения методом одноосного растяжения того же материала дали значения около 10 ГПа. Такое расхождение связывается авторами с неплотной упаковкой фибрилл. Действительно, возрастание плотности материала при увеличении времени культивации с 3 до 17 дней приводит к возрастанию модуля до 15 ГПа. Другую причину несоответствия авторы видят в ошибках при измерении истинной толщины пленки, имеющей большие пустоты.
Прямые измерения модуля упругости нанофибрилл БЦ проводятся очень редко в первую очередь из-за трудности изоляции индивидуальных фибрилл. В работе [80] использован метод измерения с помощью атомно-силового микроскопа. Высушенные при 60°C фибриллы диаметром менее 100 нм закрепляли между двумя опорами и нагружали по трехточечной схеме кантилевером микроскопа. Измеряя отклонение кантилевера, рассчитывали значения модуля, которые оказались равными 78 ± 17 ГПа. На кривых нагрузки–разгрузки в центре волокна наблюдали отсутствие гистерезиса, свидетельствующее об упругом поведении волокон. Авторы обращают внимание на то, что данный метод позволяет определить механические свойства изолированной фибриллы, не учитывая разрывов и деформаций в сетке беспорядочно ориентированных волокон. Именно с этим связано отличие от значений модуля, обычно получаемых при испытаниях пленок. Вместе с тем, этот метод дает значения модуля фибриллы, содержащей как кристаллическую, так и аморфную фазы.
Для того чтобы измерить модули упругости кристаллических участков субмикронных размеров, пользуются методом рентгеновской дифракции [81]. В работе [82] этот метод был использован для оценки силы, необходимой для растяжения полимерной цепи на 1% (в предположении, что напряжение однородно по всей длине молекулы). Эта величина оказалась равной примерно 4 × 10–10 Н. Для образцов целлюлозы I при различном водосодержании (9 и 32%) были получены одинаковые значения модуля (около 130 ГПа). Вместе с тем, модули, рассчитанные для тех же образцов БЦ из кривых зависимости напряжение–деформация при одноосном растяжении, составили 24 и 12 ГПа соответственно.
Различия в значениях модулей Юнга, определенных разными методами, отражают иерархическую структуру БЦ. Высокие значения модуля (120–130 ГПа), полученные методом рентгеновской дифракции, характеризуют упругую деформацию кристаллических участков нанофибрилл. Характерно, что измеренный таким образом модуль не зависит от влагосодержания образцов, что свидетельствует о нечувствительности кристаллитов к действию воды. Меньший модуль упругости индивидуальной фибриллы (около 80 ГПа) определяется присутствием в ее составе, наряду с кристаллическими, также и аморфных областей [83]. Наконец, на порядок меньшие значения модулей, полученные в условиях одноосного растяжения, свидетельствуют о разрушении межфибрилярных водородных связей в процессе деформации.
Еще одним способом определения модуля Юнга БЦ является расчет, основанный на имеющейся информации о структуре и взаимодействиях в полимерных кристаллах.
При расчетах модуля Юнга кристаллов целлюлозы Iα методом молекулярной динамики, были получены значения модуля кристаллических областей, близкие к определенным экспериментально: 130–160 ГПа [84, 85].
Расчеты модуля Юнга, учитывающие иерархическую структуру наноцеллюлозных материалов, были проведены в работе [58]. На основании построенной двумерной модели сетки макрофибрилл целлюлозы было получено значение, равное 12 ГПа, соответствующее экспериментально получаемым величинам. Модель предсказывает возрастание модуля как с ростом длины фибрилл, приводящим к увеличению числа межфибрильных связей вдоль каждой фибриллы, так и с уменьшением их диаметра, способствующим образованию более плотной структуры. Такое же значение модуля было получено для сетки микрофибрилл со степенью кристалличности 12% [86].
5.2. Влияние воды на механические свойства бактериальной целлюлозы
Характер и степень деформации целлюлозных наноматериалов чрезвычайно сильно зависят от содержания в них влаги.
При испытаниях нативных, не подвергавшихся сушке образцов БЦ в условиях одноосного растяжения с постоянной скоростью [87] сопротивление деформации непрерывно возрастает, причем значения возникающих напряжений остаются на порядки ниже, чем при испытаниях частично высушенной целлюлозы [74, 83]: величина, называемая авторами “кажущимся модулем” (apparent modulus) не превышает 15 МПа. Механические свойства БЦ зависят от времени ферментации. Если возрастание “кажущегося модуля” с 10 до 14 МПа при увеличении времени ферментации от 48 до 72 ч связано с повышением плотности материала (примерно на 25%) и потому достаточно предсказуемо, то его уменьшение после более продолжительной ферментации (96 ч) объяснить довольно трудно. Авторы предполагают, что это может быть связано с увеличением слоистости материала, а также с разрывами целлюлозной сетки из-за относительного повышения содержания бактерий или продуктов их метаболизма. Весьма вероятно, что зарегистрированное в работе [13] уменьшение прочности образцов БЦ с увеличением времени культивирования и, соответственно, их толщины обусловлено теми же причинами.
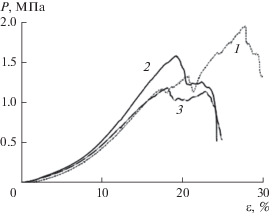
Наличие двойного пика на деформационных кривых (рис. 6) [87] позволяет предположить, что в процессе деформации образца сначала происходит разрыв более коротких цепей, затем, при дальнейшем увеличении деформации разрываются более длинные цепи, достигнув предельной степени вытяжки. Отсутствие линейной зависимости напряжения от деформации на начальном участке кривой свидетельствует о том, что на первых этапах растяжения происходит переориентация исходно беспорядочно ориентированных волокон, которые затем вытягиваются, что соответствует постепенному увеличению наклона деформационных кривых. Такая модель поведения характерна для полимеров с сетчатым расположением фибрилл [88].
Рис. 6.
Кривые деформации образцов БЦ, полученные при временах ферментации 48 (1), 72 (2) и 96 ч (3) [87].
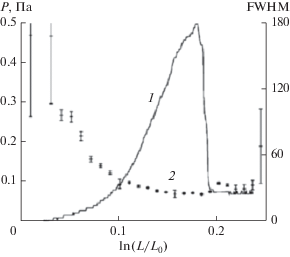
Сопоставление хода деформационных кривых со степенью ориентации макромолекул в образцах проведено в работе [89]. Распределение величин интенсивности малоуглового рентгеновского рассеяния описывается гауссианой, по ширине которой на уровне половинной амплитуды (FWHM) определяется степень ориентации. Было установлено, что в начале деформации процесс ориентации происходит быстро, а затем замедляется вплоть до разрушения образца (рис. 7).
На рис. 8 представлена серия микрофотографий, полученных в сканирующем электронном микроскопе (СЭМ) и прямо подтверждающих эту модель. В отсутствие напряжений сетка состоит из беспорядочно расположенных фибрилл (а), которые затем выстраиваются по направлению деформации (б), что приводит к увеличению наклона деформационной кривой. Место разрыва образца представляет собой поярусное (слоистое) образование (в), что свидетельствует о том, что слои сдвигаются относительно друг друга в момент разрушения. При большем увеличении видны разорванные фибриллы, ориентированные по направлению деформации. После разрушения фибриллы релаксируют (г).
Рис. 8.
СЭМ-изображения образцов нативной БЦ: до испытаний на растяжение (а), растянутые фибриллы (б), место разрыва образца (в), релаксация фибрилл после разрыва (г). Стрелки обозначают направление растяжения [87].

Изучение вязкоупругих свойств гидрогелей БЦ, содержащих исходно 98% воды, проведено в работе [66]. Установлено, что модуль накопления и модуль потерь остаются практически постоянными в интервале деформаций до 0.1 и 1% соответственно, а затем начинают постепенно снижаться, достигая точки кроссовера при деформации, равной примерно 10%. Постепенное уменьшение содержания воды (до 80 и 50% от исходного) приводит к увеличению обоих модулей, и точка кроссовера при этом сдвигается в сторону меньших деформаций. Это означает, что в присутствии воды облегчается деформация и взаимное перемещение фибрилл.
Сравнение механических свойства образцов нативной неосушенной целлюлозы с высушенными образцами показало [47], что максимальная деформация гелеобразных образцов составила 15% (по сравнению с 3–4% для высушенных образцов), а “кажущийся модуль” оказался меньше, по крайней мере, на 3 порядка величины (около 5 МПа).
В работе [41] определяли механические свойства образцов БЦ, полученных в динамическом режиме: сферы разрезали на пластинки, которые испытывали на растяжение. Содержание воды в образцах в 400 раз превосходило вес целлюлозы. Деформация до разрушения таких образцов составила примерно 100%, “кажущийся модуль” – около 15 МПа (то есть, как и для образцов, полученных в статическом режиме, на 3 порядка ниже модуля Юнга сухих образцов).
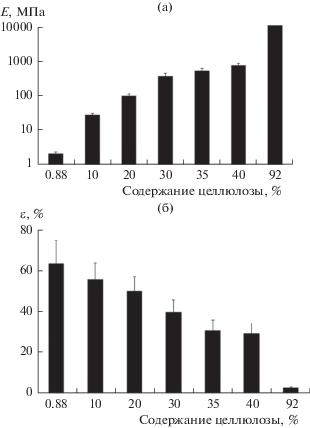
Подробное исследование влияния содержания воды в БЦ на ее механические свойства проведено в работе [56]. Образцы испытывали по методу одноосного растяжения со скоростью 5 мм/мин (рис. 9). Для нативных образцов с содержанием целлюлозы 0.88% получены следующие результаты: “кажущийся модуль” – 2.1 МПа, растяжение до разрыва – 75%. По мере высушивания образцов возрастает модуль и уменьшается разрывная деформация (вплоть до 10 ГПа и 25% соответственно при содержании целлюлозы 92% (рис. 10а, 10б). Для образцов нативной целлюлозы, содержащей много воды, наблюдалась та же тенденция, но в гораздо меньшем диапазоне значений кажущегося модуля: при увеличении содержания целлюлозы от 0.18 до 0.72% модуль возрастал от 1 до 5–6 МПа [90].
Рис. 9.
Кривые деформации образцов БЦ с различным содержанием целлюлозы (мас. %): 0.88 (1), 10 (2), 20 (3), 30 (4), 35 (5), 40 (6), 92 (7) [56].
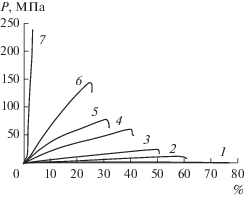
Рис. 10.
Модуль (а) и деформации до разрыва (б) в зависимости от содержания целлюлозы в образцах БЦ [56].
Бактериальная целлюлоза имеет иерархическую структуру в широком интервале масштабов, от нано- до микрометрового [59], поэтому деформация и последующее разрушение осуществляются по механизмам, реализующимся на различных структурных уровнях. Если упругая деформация определяется в основном кристаллической частью фибрилл, то неупругая деформация является следствием наличия в них аморфных областей и, кроме того, может осуществляться за счет проскальзывания макромолекул внутри нанофибриллы [91]. Предполагается [92], что это приводит к разрыву нанофибрилл и последующему разрушению целлюлозного наноматериала.
Согласно другой, более распространенной точке зрения [74], пластическая деформация является результатом разрыва межфибрильных связей; при этом происходит вырывание отдельных фибрилл из сетки и ее разрушение. Ослабление межфибрильных связей, проскальзывание и вырывание фибрилл авторы рассматривают как результат действия воды. По-видимому, в результате сетчатого строения может реализоваться так называемый механизм прерывистого проскальзывания (stick-slip), заключающийся в повторении актов разрыва и восстановления водородных связей в процессе пластической деформации [93], однако прямых экспериментальных доказательств до сих пор не представлено. Косвенным доказательством может служить тот известный факт, что у материалов, не образующих сетки фибрилл, при пропитке водой деформация до разрыва очень мала (не превышает 2% для фильтровальной бумаги и 10% для целлофана). Другим подтверждением этой модели могут служить результаты работы [94], в которой образцы испытывали по методу двухосного растяжения (на образец надавливали округлым индентором и измеряли максимальный прогиб). В то время как одноосная деформация предполагает ориентацию фибрилл и их “вырывание” из спутанных волокон, при двухосной деформации вытягивание волокон не облегчается. С практической точки зрения это означает, что в условиях двухосного растяжения пленки целлюлозы могут оказаться гораздо более прочными, чем при одноосном растяжении.
Присутствие в воде электролитов может значительно изменять степень влияния водной среды на механические характеристики целлюлозы различной структуры. Было показано [95], что в режиме одноосного растяжения устойчивость БЦ к действию воды монотонно возрастает с уменьшением коэффициента активности воды в соответствующем растворе. Измерения длительной прочности БЦ в воде позволили оценить энергию активации разрушения E, которая оказалась близка к приводимым в литературе значениям для гидрофильных полимеров в присутствии воды (около 100 кДж/моль [96]). Изменение этой величины (ΔE) в растворах электролитов (хлоридов щелочных и щелочноземельных металлов) по знаку и величине соответствует значениям ΔE, приведенным в работах [97, 98] в качестве меры изменения подвижности молекул воды в гидратных оболочках по сравнению с чистой водой. Аналогичные результаты были получены ранее для других целлюлозных материалов (целлофан, фильтровальная бумага): была убедительно доказана корреляция подвижности воды в растворах со степенью их действия на полимер [99, 100]. Применимость кинетической теории прочности для объяснения закономерностей влияния водных растворов электролитов на прочность целлюлозы наиболее наглядно подтверждается экспериментами, в которых скорость деформации увеличивали на несколько порядков: в присутствии сильно гидратированных ионов прочность целлофана возрастала вплоть до величин, близких к прочности сухих образцов [99].
6. ЗАКЛЮЧЕНИЕ
Возможности использования бактериальной целлюлозы обусловлены ее уникальными физико-химическими и механическими характеристиками, отличающими ее от материалов на основе целлюлозы растительного происхождения.
Важной особенностью БЦ является широкий диапазон ее отклика на внешние силовые воздействия, связанный с разнообразием элементов ее надмолекулярной структуры и постоянным присутствием тех или иных количеств свободной или связанной воды. Эта особенность объясняет заметные расхождения между данными, опубликованными различными авторами, и приводит к выводу о необходимости проведения механических испытаний БЦ при варьировании режимов и условий в достаточно широких пределах в сочетании со структурным и морфологическим анализом. Дальнейшее развитие таких комплексных исследований должно обеспечить лучшее понимание функциональных возможностей бактериальной целлюлозы и путей ее целенаправленного применения.
Список литературы
Klemm D., Kramer F., Moritz S., Lindstrom T. et al. // Angew. Chem. Int. Ed. 2011. V. 50. P. 5438.
Habibi Y., Lucia L.A., Rojas O.J. // Chem Rev. 2010. V. 110. P. 3479.
Huang Y., Zhu C., Yang J., Nie Y. et al. // Cellulose. 2014. V. 21. P. 1.
Brown A.J. // J. Chem. Soc. 1886. V. 49. P. 432.
Венгерович Н.Г., Хрипунов А.К., Рузанова Э.А. и др. // Фармакология. 2014. Т. 15. С. 620.
Архарова Н.А. Структура композитов на основе целлюлозы Gluconacetobacter xylinus и наночастиц различной природы. Автореферат дис. … физ.-мат. наук. М.: ИК РАН, 2017.
Saska S., Barud H., Gaspar A. et al. // Int. J. Biomat. 2011. V. 2011. P. 1.
Hu W., Chen S., Yang J. et al. // Carbohydr. Polym. 2014. V. 101. P. 1043.
Klemm D., Heublein B., Fink H.P., Bohn A. // Angew. Chem. Int. Ed. 2005. V. 44. P. 3358.
Cannon R.E., Anderson S.M. // Crit. Rev. Microbiol. 1991. V. 17. P. 435.
Vandamme E. J., De Baets S., Vanbaelen A. et al. // Polym. Degrad. Stab. 1998. V. 59. P. 93.
Watanabe K., Tabuchi M., Morinaga Y., Yoshinaga F. // Cellulose. 1998. V. 5. P. 187.
Gromovykh T.I., Sadykova V S., Lutcenko S.V. et al. // Appl. Biochem. Microbiol. 2017. V. 53. P. 59.
Хань Ф.М. Биотехнология бактериальной целлюлозы с использованием штамма-продуцента Gluconacetobacter hansenii GH-1. 2008. Автореферат дис. … канд. биол. наук. М.: МГУ, 2013.
Chawla P.R., Bajaj I.B., Survase S.A. et al. // Food Technol. Biotechnol. 2009. V. 47. P. 107.
Zogaj X., Nimtz M., Rohde M. et al. // Mol. Microbiol. 2001. V. 39. P. 1452.
Islam M.U., Ullah M.W., Khan S. et al. // Int. J. Biol. Macromol. 2017. V. 102. P. 1166.
Czaja W., Romanovicz D., Brown R.M. // Cellulose. 2004. V. 11. P. 3.
Park S.U., Lee B. K., Kim M.S. et al. // Carbohydr. Polym. 2013. V. 92. P. 1432.
Zaar K. // Cell. Biol. J. 1979. V. 80. P. 773.
Delmer D.P., Amor Y. // Plant Cell. 1995. V. 7. P. 987.
Deinema M., Zevenhuizen L.P. // Arch. Microbiol. 1971. V. 78. P. 42.
Yamanaka S., Ishihara M., Sugiyama J. // Cellulose. 2000. V. 7. P. 213.
Iguchi M., Yamanaka S., Budhiono A. // J. Mater. Sci. 2000. V. 35. P. 261.
Bäckdahl H., Helenius G., Bodin A. et al. // Biomaterials. 2006. V. 27. P. 2141.
Machado R.T.A., Gutierrez J., Tercjak A. et al. // Carbohyd. Polym. 2016. V. 152. P. 841.
Yamanaka S., Watanabe K., Kitamura N. et al. // J. Mater. Sci. 1989. V. 24. P. 3141.
Buyanov A.L., Gofman I.V., Revel’skaya L.G. et al. // J. Mech. Behav. Biomed. Mater. 2010. V. 3. P. 102.
Astley O.M., Chanliaud E., Donald A.M. et al. // Int. J. Biol. Macromol. 2001. V. 29. P. 193.
Esa F., Tasirin S.M., Rahman N.A. // Agric. Agric. Sci. Procedia. 2014. V. 2 P. 113.
Митрофанов Р.Ю., Будаева В.В., Сакович Г.В. // Химия в интересах устойчивого развития. 2010. Т. 18. С. 587.
Колосовская Е.А., Лоскутов С.Р., Чудинов Б.С. Физические основы взаимодействия древесины с водой. Новосибирск: Наука, 1989.
Vitta S., Thiruvengadam V. // RSC Adv. 2012. V. 102. P. 1398.
Sokolnicki A.M., Fisher R.J., Harrah T.P. et al. // J. Membr. Sci. 2006. V. 272. P. 15.
Moon R.J., Martini A., Nairn J. et al. // Chem. Soc. Rev. 2011. V. 40. P. 3941.
Ioelovich M. // J. Polym. Sci. Part A. 2016. V. 58. P. 925.
Ruka D.R., Simon G.P., Dean K.M. // Carbohyd. Polym. 2012. V. 89. P. 613.
Szymańska-Chargot M., Cybulska J., Zdunek A. // ASC Sensors. 2011. V. 11. P. 5543.
Алешина Л.А., Глазкова С.В., Луговская Л.А. и др. // Химия растительного сырья. 2001. № 1. С. 5.
Nelson M.L., O’Connor R.T. // J. Appl. Polym. Sci. 1964. V. 8. P. 1325.
Mohite B.V., Patil S.V. // Carbohydr. Polym. 2014. V. 106. P. 132.
Nishiyama Y., Sugiyama J., Chanzy H., Langan P. // J. Am. Chem. Soc. 2003. V. 26. P. 14300.
Zugenmaier P. // Prog. Polym. Sci. 2001. V. 26. P. 1341.
Horii F., Hirai A., Yamamoto H. // Macromol. Symp. 1997. V. 120. P. 197.
Sugiyama J., Vuong R., Chanzy H. // Macromolecules. 1991. V. 24. P. 4168.
Lennholm A., Wallbäcks L., Iversen T. // Nordic Pulp Paper Res. J. 1995. V. 10. P. 46.
Feng X., Ullah N., Wang X. et al. // J. Food Sci. 2015. V. 80. P. E2217.
Yamamoto H., Horii F., Hirai A. // Cellulose. 1996. V. 3. P. 229.
Sugiyama J., Persson J., Chanzy H. // Macromolecules. 1991. V. 24. P. 2461.
Wada M., Sugiyama J., Okano T. // J. Appl. Polym. Sci. 1993. V. 49. P. 1491.
Yamamoto H., Horii F., Odani H. // Macromolecules. 1989. V. 22. P. 4130.
Debzi E.M., Chanzy H., Sugiyama J. et al. // Macromolecules. 1991. V. 24. P. 6816.
Wada M.J. // J. Polym. Sci. B: Polym. Phys. 2002. V. 40. P. 1095.
Dahman Y. // J. Nanosci. Nanotechnol. 2009. V. 9. P. 5105.
Maria L.C.S., Santos A.L.C., Oliveira P.C., Valle A.S.S. // Polímeros: Ciência e Tecnologia. 2010. V. 20. P. 72.
Scionti G. Mechanical Properties of Bacterial Cellulose Implants. MSc Thesis. Chalmers University of Technology, Göteborg, 2010.
Schrecker S.T., Gostomski P.A. // Biotechnol. Lett. 2005. V. 27. P. 1435.
Mao R. Mechanics of Cellulose Nanopapers. PhD Thesis. Queen Mary University, London, 2016.
Zhao Y., Koizumi S., Yamaguchi D., Kondo T. // Eur. Phys. J. Part E. 2014. V. 37. P. 129.
Sehaqui H., Liu A.D., Zhou Q., Berglund L.A. // Biomacromolecules. 2010. V. 11. P. 2195.
Clasen C., Sultanova B., Wilhelms T. et al. // Macromol. Symp. 2006. V. 244. P. 48.
Santos S.M., Carbajo J. M., Quintana E. et al. // Carbohydr. Polym. 2015. V. 116. P. 173.
Zhang C., Wang L., Zhao J., Zhu P. // Adv. Mater. Res. 2011. V. 239–242. P. 2667.
Хайруллин А.Р. Диэлектрические свойства и структура бактериальной целлюлозы Gluconacetobacter xylinus и ее композитов с углеродными наночастицами и фосфатами кальция. Автореферат дис. … канд. физ.-мат. наук. СПб.: ИВС РАН. 2013
Cortázar T.M., Guzmán-Alonso M., Novoa H. et al. // Skin Res. Technol. 2015. V. 21. P. 265.
Rebelo A.R., Archer A.J., Chen X. et al. // Sci. Technol. Adv. Mater. 2018. V. 19. P. 203.
Vazquez A., Foresti M.L., Cerrutti P., Galvagno M. // J. Polym. Environ. 2013. V. 21. P. 545.
George J., Ramana K.V., Sabapathy S.N. et al. // Int. J. Biol. Macromol. 2005. V. 37. P. 189.
Festucci-Buselli R.A., Otoni W.C., Joshi C.P. // Braz. J. Plant Physiol. 2007. V. 19. P. 1.
Gromovykh T.I., Feldman N.B., Tikhonova O.A., Lutsenko S.V. // Int. J. Nanotechnol. 2018. V. 15. P. 288.
Embuscado M.E., Bemiller J.N., Marks J.S. // Food Hydrocoll. 1996. V. 10. P. 75.
Nishi Y., Uryu M., Yamanaka S. et al. // J. Mater. Sci. 1990. V. 25. P. 2997.
Gea S., Reynolds C.T., Roohpour N. et al. // Bioresour. Technol. 2011. V. 102. P. 9105.
Hsieh Y.-C., Yano H., Nogi M., Eichhorn S.J. // Cellulose. 2008. V. 15. P. 507.
Lim J.Y., Donahue H.J., Kim S.Y. // Macromol. Chem. Phys. 2003. V. 204. P. 653.
Bohidar H.B. Fundamentals of Polymer Physics and Molecular Biophysics. Cambridge University Press, 2015.
Blanksby S.J., Ellison G.B. // Acc. Chem. Res. 2003. V. 36. P. 255.
Hamad W.Y., Eichhorn S.J. // ASME J. Eng. Mater. Technol. 1997. V. 119. P. 309.
Tanpichai S., Quero F., Nogi M. et al. // Biomacromolecules. 2012. V. 13. P. 1340.
Guhados G., Wan W., Hutter J.L. // Langmuir. 2005. V. 21. P. 6642.
Sakurada I., Ito T., Nakamae K. // J. Polym. Sci. Part C. 1966. V. 15. P. 75.
Sakurada I., Kaji K. // J. Polym. Sci. Part C. 1970. V. 31. P. 57.
Retegi A., Gabilondo N., Peña C. et al. // Cellulose. 2010. V. 17. P. 661.
Eichhorn S.J., Davies G.R. // Cellulose. 2006. V. 13. P. 291.
Reiling S., Brickmann J. // Macromol. Theor. Simul. 1995. V. 4. P. 725.
Eichhorn S.J., Young R.J. // Cellulose. 2001. V. 8. P. 197.
McKenna B.A., Mikkelsen D., Wehr J.B. et al. // Cellulose. 2009. V. 16. P. 1047.
Drury J.L., Dennis R.G., Mooney D.J. // Biomaterials. 2004. V. 25. P. 3187.
Astley O.M., Chanliaud E., Donald A.M., Gidley M.J. // Int. J. Biol. Macromol. 2003. V. 32. P. 28.
Chen S.-Q., Lopez-Sanchez P., Wang D. et al. // Food Hydrocoll. 2018. V. 81. P. 87.
Haslach H.W. // Mech. Time-Dependent Mater. 2000. V. 4. P. 169.
Henriksson M., Berglund L.A., Isaksson P. et al. // Biomacromolecules. 2008. V. 9. P. 1579.
Zhu H.L., Zhu S.Z., Jia Z. et al. // Proc. Natl. Acad. Sci. USA. 2015. V. 112. P. 8971.
Chanliaud E., Burrows K.M., Jeronimidis G., Gidley M.J. // Planta. 2002. V. 215. P. 989.
Грачев В.С., Скворцова З.Н. // Реология и физико-химическая механика гетерофазных систем. М.: Изд-во ИНХС РАН, 2017. С. 81.
Берштейн В.А. Механо-гидролитические процессы и прочность твердых тел. Л.: Наука, 1987.
Самойлов О.Я. Структура водных растворов электролитов и гидратация ионов. М.: Изд-во АН СССР, 1957.
Родникова М.Н. // Электрохимия. 2003. Т. 39. С. 214.
Анкудинова А.М., Скворцова З.Н., Траскин В.Ю., Перцов А.В. // Докл. РАН. 2004. Т. 397. С. 633.
Траскин В.Ю., Скворцова З.Н., Перцов А.В. и др. // Наносистеми, наноматерiали, нанотехнологiï. 2008. Т. 6. С. 353.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал