Коллоидный журнал, 2019, T. 81, № 5, стр. 599-604
Формирование частиц молибденовых синей при восстановлении раствора молибдата гидрохиноном
М. А. Мячина 1, *, Н. Н. Гаврилова 1, В. В. Назаров 1
1 Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва,
Миусская площадь, 9, Россия
* E-mail: mmyachina@muctr.ru
Поступила в редакцию 04.02.2019
После доработки 04.03.2019
Принята к публикации 11.03.2019
Аннотация
Дисперсии молибденовых синей синтезированы восстановлением молибдата гидрохиноном в кислой среде. Методами спектрофотометрии и фотон-корреляционной спектроскопии исследованы закономерности формирования частиц молибденовых синей (крупных молибденоксидных кластеров) в условиях варьирования соотношения восстановитель/молибдат и pH дисперсионной среды.
ВВЕДЕНИЕ
Молибденоксидные комплексы могут образовывать гигантские полиоксиметаллатные кластеры, в которых молибден находится в степени окисления +5 и +6 [1]. Эти кластеры составляют основу молибденовых синей, интерес к которым обусловлен их уникальными свойствами [2, 3]. Размер таких кластеров в водной среде составляет порядка нескольких нанометров, что позволяет отнести их к объектам коллоидной химии, а водные системы кластеров – к гидрозолям [4].
Среди перспективных областей применения дисперсий молибденоксидных кластеров следует выделить адресную доставку лекарственных средств и катализ [5–7]. Многообещающим методом получения материалов является золь–гель метод с использованием устойчивых дисперсий, свойства которых сохраняются на протяжении длительного времени, в том числе, при золь–гель синтезе нанесенных катализаторов [8].
Ранее, в работах [9, 10] было показано, что агрегативно-устойчивые дисперсии молибденовой сини могут быть синтезированы при использовании глюкозы в качестве восстановителя. При этом было высказано предположение о том, что глюкоза и продукты ее окисления помимо участия в формировании частиц также оказывают стабилизирующий эффект на дисперсии молибденовых синей, включая их агрегативную устойчивость.
С точки зрения понимания процессов, протекающих при формировании частиц/кластеров в молибденовых синях, и их коллоидно-химической природы представляет интерес использование при синтезе органического восстановителя, который участвовал бы исключительно в окислительно-восстановительном процессе. Гидрохинон является распространенным восстановителем и, по литературным данным, не обладает поверхностно-активными свойствами, а также не способен к комплексообразованию с соединениями Mo(V) и Mo(VI) [11].
Целью данной работы являлось установление характера влияния основных параметров синтеза (концентрации и соотношения реагентов, времени синтеза) на закономерности формирования частиц в дисперсиях молибденовых синей при использовании гидрохинона в качестве восстановителя.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез дисперсий молибденовых синей проводили с использованием следующих реагентов: гептамолибдата аммония ((NH4)6Mo7O24 · 4H2O, х. ч.), гидрохинона кристаллического (С6Н8О2, х. ч.), концентрированной соляной кислоты (х. ч.).
Гидрохинон служил восстановителем. Протекание окислительно-восстановительной реакции контролировали по изменению окислительно-восстановительного потенциала (ОВП). Все эксперименты были проведены при комнатной температуре.
Значения ОВП и pH определяли с помощью комбинированного и платинового электродов на pH-метре–милливольтметре HI-8314 (Hanna, Германия). Электронные спектры поглощения измеряли с использованием сканирующего спектрофотометра Leki SS2110 UV (MEDIORA OY, Финляндия) и кварцевых кювет с длиной оптического пути 10 мм.
Гидродинамический радиус частиц в дисперсиях молибденовых синей был определен методом фотон-корреляционной спектроскопии (ФКС) на приборе Photocor Compact-Z (ООО “Photocor”, Россия). Время накопления сигнала составляло 10 мин при мощности лазера 25 мВт и длине волны 658 нм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Формирование молибденоксидных кластеров (частиц молибденовой сини) происходит в результате самоорганизации молибденоксидных комплексов. Для протекания самоорганизации в системе с заданной величиной pH среды должны присутствовать определенные комплексы Mo(V) и Mo(VI) [12].
Поскольку исходной системой является раствор молибдатов, то для формирования комплексов Mo(V) необходимо провести частичное восстановление соединений Mo(VI). Первая часть работы была посвящена исследованию образцов, содержащих раствор гептамолибдата аммония и гидрохинона при значениях мольного соотношения гидрохинон/молибден (обозначаемого далее как R : Mo), равных 1.0, 2.0, 3.0, 4.0, 5.0 и 6.0, но без добавления кислоты. Концентрация молибдена во всех образцах оставалась постоянной и равной 0.07 М.
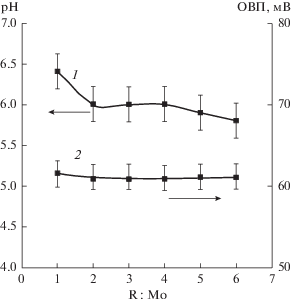
На рис. 1 приведены зависимости значений pH и ОВП раствора смеси молибдата и гидрохинона от величины мольного соотношения восстановитель/молибден сразу после смешения. Как видно из этих данных, в рассматриваемых условиях увеличение соотношения R : Mo не приводит к изменению величины ОВП и практически не влияет на значение рН. Измерение рН и ОВП для этих же образцов через сутки после смешения реагентов показало, что контролируемые параметры не изменились, из чего следует, что окислительно-восстановительный процесс в смеси молибдата и гидрохинона в этих условиях не протекает.
На электронных спектрах поглощения исследуемых образцов не наблюдались полосы поглощения в области 500–900 нм, что также свидетельсвует о том, что в смеси молибдата и гидрохинона соединения Mo(V) отсутствуют [1].
Таким образом, в отличие от системы, содержащей глюкозу в качестве восстановителя, использование гидрохинона в этом качестве не приводит к протеканию окислительно-восстановительного процесса и формированию окрашенных комплексов Mo(V) и Mo(VI) [10], что, вероятно. обусловлено различием в величинах pH и ОВП в этих системах.
Известно, что необходимым условием образования молибденоксидных кластеров большого размера является наличие кислой среды (pH < 2). Именно в таких условиях протекают поликонденсация молибдатов и дальнейшая самоорганизация гигантских молибденоксидных кластеров [13]. С учетом этого на следующем этапе работы было исследовано влияние концентрации кислоты и восстановителя на формирование частиц молибденовых синей. В качестве первого шага в этом направлении была приготовлена серия образцов при постоянной величине pH 1.5 (мольное соотношение Н : Мо = 1.0) с различным мольным соотношением гидрохинона и молибдена, равным 2 : 1, 3 : 1, 4 : 1, 5 : 1 и 6 : 1.
Для контроля процессов формирования частиц молибденовых синей использовались электронные спектры поглощения. Примеры таких спектров, измеренных через 15 суток после смешения реагентов, приведены на рис. 2.
Рис. 2.
Электронные спектры поглощения смесей молибдата с гидрохиноном при соотношении R : Мо = 2.0 (1), 3.0 (2), 4.0 (3), 5.0 (4), 6.0 (5), измеренные через 15 суток после смешения (pH 1.5).
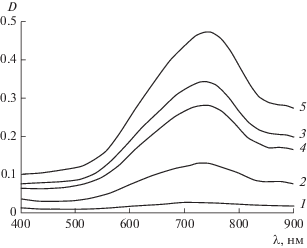
В соответствии с литературными данными [14] наличие максимума поглощения при длине волны 750 нм указывает на образование торообразных молибденоксидных кластеров. С учетом этого оптическую плотность D образцов на длине волны 750 нм, соответствующей максимуму поглощения, измеряли в течение 35 суток после смешения реагентов (см. рис. 3а).
Рис. 3.
Зависимости оптической плотности образцов в максимуме поглощения при 750 нм (а) и ОВП (б) от времени, прошедшего с момента смешения реагентов. R : Мо = 2.0 (1), 3.0 (2), 4.0 (3), 5.0 (4), 6.0 (5); pH 1.5.
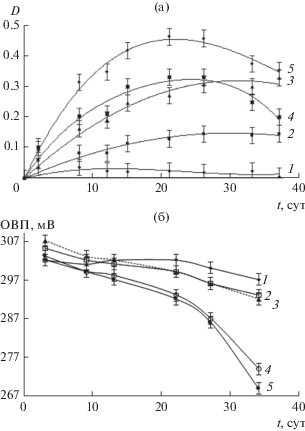
Как видно на рис. 3а, оптическая плотность всех образцов возрастает в течение 21 суток, но в дальнейшем у образцов с соотношениями R : Мо, превышающими 4.0, происходит снижение оптической плотности. Последний эффект, вероятно, обусловлен тем, что избыточное количество восстановителя в системе приводит к дальнейшему протеканию окислительно-восстановительных процессов, приводящих к образованию осадка. На это указывает более резкое падение ОВП во времени у этих образцов (см. рис. 3б).
Следует отметить, что во всех рассматриваемых образцах с соотношением R : Мо, превышающим 2.0, уже через сутки методом ФКС регистрируется образование кластеров, радиус которых стабилизируется через двое суток и составляет около 2 нм.
С учетом полученных данных следующая серия образцов была приготовлена при R : Мо = 4.0 и при той же концентрации молибдата, что и в предыдущей части работы, но при различном мольном соотношении кислоты и молибдена H : Mo, равном 0.4, 0.6, 1.0, 3.0, 4.0 и 5.0. На рис. 4 приведены зависимости окислительно-восстановительного потенциала и pH этих образцов от величины мольного соотношения H : Mo. Из приведенных данных следует, что введение кислоты в систему приводит к значительному росту ОВП по сравнению со смесью молибдата и гидрохинона в отсутствие кислоты (см. рис. 1), до величин порядка 250–300 мВ. Наиболее интенсивный рост величины ОВП происходит до соотношения H : Mo = 1, что соответствует величине pH 1.5.
Рис. 4.
Зависимости pH (1) и ОВП (2) от мольного соотношения H : Mo (измерения проведены сразу после смешения исходных реагентов).
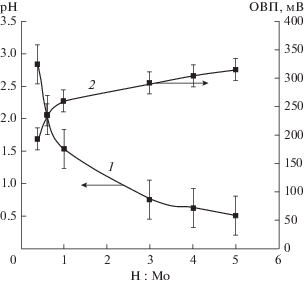
Измерения ОВП и pH, проведенные в течение 20 суток после смешения реагентов, показали, что абсолютные значения этих параметров стабилизируются в течение первых суток после смешения и в дальнейшем существенно не изменяются, что говорит о практически полном завершении окислительно-восстановительного процесса.
Анализ влияния содержания кислоты на процесс формирования частиц проводился с использованием электронных спектров поглощения, приведенных на рис. 5. Из представленных данных видно, что в спектрах образцов с мольным соотношением Н : Мо, равным 0.4 и 0.6, максимум в этой области длин волн практически не наблюдается, в отличие от систем с бóльшими значениями этого соотношения. При этом максимальной оптической плотностью в максимуме поглощения обладает система с Н : Мо = 3.0.
Рис. 5.
Электронные спектры поглощения образцов, измеренные через 2 (а) и 20 суток (б) после смешения исходных реагентов. Н : Мо = 0.4 (1), 0.6 (2), 1.0 (3), 3.0 (4), 4.0 (5), 5.0 (6).
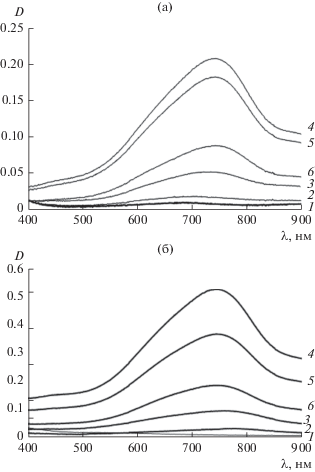
Через 20 суток после смешения реагентов характер электронных спектров поглощения образцов не меняется, но происходит рост оптической плотности, особенно, в максимуме поглощения (см. рис. 5б). Исходя из этого можно предположить, что молибденоксидные кластеры присутствуют в образцах уже на второй день после смешения реагентов, но их концентрация растет, как минимум, в течение двух недель. При этом максимальная концентрация частиц молибденовой сини наблюдается в образце с соотношением Н : Мо = 3.0. Вероятной причиной наблюдаемых закономерностей является то, что избыточное количество вводимой кислоты начинает играть роль электролита-коагулянта, что ведет к коагуляции и падению концентрации кластеров в дисперсионной среде из-за седиментации и, следовательно, к снижению оптической плотности образцов.
На рис. 6 представлены зависимости оптической плотности, измеренной на длине волны 750 нм, от времени, прошедшего после смешения реагентов. Эти кривые построены на основе спектров, приведенных на рис. 5. Как видно из этих данных, оптическая плотность образцов растет в течение примерно 20 суток после смешения реагентов. Однако в дальнейшем в образцах с соотношениями Н : Мо = 3.0 и 4.0 (кривые 4 и 5) наблюдается падение оптической плотности, что указывает на уменьшение концентрации молибденоксидных кластеров, для которых максимум поглощения находится при 750 нм. Снижение концентрации частиц обусловлено формированием кристаллического осадка. У образцов с соотношением Н : Мо = 1.0 и 5.0 (кривые 3 и 6) после 20 суток значения оптической плотности изменяются незначительно. Минимальные значения оптической плотности характерны для систем с мольными соотношениями Н : Мо = 0.4 и 0.6 (кривые 1 и 2).
Рис. 6.
Зависимости оптической плотности образцов в максимуме поглощения при 750 нм от времени, прошедшего с момента смешения реагентов. Н : Мо = 0.4 (1), 0.6 (2), 1.0 (3), 3.0 (4), 4.0 (5), 5.0 (6).
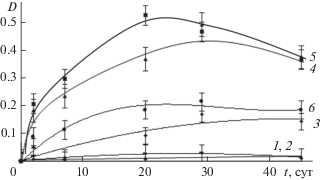
Характер рассматриваемых кинетических кривых отличается от аналогичных зависимостей, полученных при синтезе дисперсий с использованием глюкозы в качестве восстановителя [10]. В образцах с глюкозой, имеющих максимальную оптическую плотность, не наблюдалось ее снижения во времени, то есть концентрация молибденоксидных кластеров оставалась постоянной, что указывает на химическую стабильность и агрегативную устойчивость таких систем. В случае использования гидрохинона на временнóй зависимости оптической плотности наблюдается наличие максимума для образцов с соотношениями Н : Мо = 3.0 и 4.0 (кривые 4 и 5), для которых характерны и наиболее высокие значения оптической плотности по сравнению с другими образцами.
Результаты определения размеров частиц (гидродинамического радиуса) методом фотон-корреляционной спектроскопии представлены на рис. 7. При низких значениях соотношения Н : Мо (менее 1.0) частицы дисперсной фазы не обнаруживаются. Увеличение концентрации кислоты приводит к появлению частиц после смешения реагентов, при этом их гидродинамический радиус составляет около 2 нм и не изменяется в течение 47 суток. При максимальном (из исследованных) мольном соотношении Н : Мо = 5.0 спустя 47 суток после смешения реагентов происходит изменение характера распределения частиц по гидродинамическому радиусу. На дифференциальной кривой распределения частиц помимо максимума, соответствующего радиусу 2.0 нм, появляется второй максимум, отвечающий значению гидродинамического радиуса, равному примерно 200 нм.
Рис. 7.
Зависимость гидродинамического радиуса молибденоксидных кластеров от соотношения Н : Мо и времени хранения дисперсий.
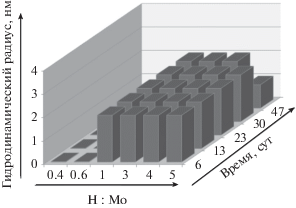
В заключение отметим, что процесс формирования частиц при использовании гидрохинона в качестве восстановителя имеет существенные отличия от аналогичного процесса, протекающего в присутствии глюкозы как восстановителя. Это видно из данных табл. 1, в которой приведены условия синтеза, позволяющие получать дисперсии с максимальным содержанием молибденоксидных кластеров. Из данных этой таблицы следует, что для получения максимальной концентрации частиц в случае системы с гидрохиноном требуется гораздо более высокая концентрация кислоты по сравнению с системой с глюкозой.
Таблица 1.
Условия синтеза дисперсий молибденовых синей с максимальной концентрацией кластеров/частиц
| Параметр | Восстановитель | |
|---|---|---|
| гидрохинон | глюкоза [10] | |
| Мольное соотношение H : Mo | 3.0 | 0.5 |
| ОВП, мВ | 290 | 310 |
| pH | 0.8 | 2.0 |
| Dmax при λmax = 750 нм | 0.52 | 0.42 |
| Время достижения Dmax, сутки | Не более 20 | Не более 21 |
| Время сохранения Dmax, сутки | Не более 10 | Не менее 60 |
| Гидродинамический радиус частиц, нм | 2 | 2 |
Стоит отметить, что, несмотря на то, что времена достижения максимальной концентрации частиц для двух систем очень близки, в случае использования гидрохинона частиц образуется почти на 20% больше, о чем свидетельствует разница в значениях оптической плотности. С другой стороны, система с максимальным содержанием частиц, полученная при использовании гидрохинона, не является стабильной, и со временем происходит образование кристаллического осадка, в отличие от дисперсии, полученной при восстановлении молибдата глюкозой.
Полученные результаты могут служить подтверждением того, что глюкоза и продукты ее окисления оказывают стабилизирующий эффект на дисперсии молибденовых синей, чего не наблюдается при использовании гидрохинона. Дисперсии молибденоксидных кластеров, полученные с использованием гидрохинона, требуют дополнительной стабилизации против образования агрегатов и формирования кристаллического осадка. Это особенно важно, если требуется их относительно длительное хранение для дальнейшего использования, например, в качестве прекурсоров различных материалов.
ЗАКЛЮЧЕНИЕ
Синтезированы образцы дисперсий молибденовых синей с использованием раствора гептамолибдата аммония и гидрохинона в качестве восстановителя. Для синтезированных дисперсий характерны электронные спектры поглощения, соответствующие системам, содержащим торообразные молибденоксидные кластеры. С использованием методов спектрофотометрии и фотон-корреляционной спектроскопии определены условия синтеза, позволяющие получать дисперсии с максимальной концентрацией дисперсной фазы.
Показано, что частицы с гидродинамическим радиусом около 2 нм начинают формироваться спустя одни сутки после смешения реагентов при соотношениях H : Мо более 1.0 и R : Мо = 4.0. Полностью процесс формирования частиц завершается через 20 суток после смешения реагентов.
Список литературы
Руденко В.К. // Координац. химия. 1979. Т. 5. С. 307.
Miras H. N., Wilson E.F., Cronin L. // Chem. Commun. 2009. P. 1297.
Nakamura I., Miras H. // J. Am. Chem. Soc. 2015. V. 137. P. 6524.
Long D., Burkholder E., Cronin L. // Chem. Soc. Rev. 2007. V. 36. P. 105.
Остроушко А.А., Коротаев В.Ю., Тонкушина М.О. и др. // Журн. физ. химии. 2012. Т. 86. С. 1383.
Amini M., Naslhajian H., Farnia, Hołyńska S.M. // Eur. J. Inorg. Chem. 2015. V. 2015. P. 3873.
Остроушко А.А., Тонкушина М.О. // Журн. физ. химии. 2016. Т. 90. С. 256.
Бухаркина Т.В., Баженова М.Д., Гаврилова Н.Н. // Химическая промышленность сегодня. 2013. № 11. С. 4.
Баженова М.Д., Гаврилова Н.Н., Назаров В.В. // Коллоид. журн. 2015. Т. 77. С. 3.
Мячина М.А., Гаврилова Н.Н., Назаров В.В. // Журн. физ. химии. 2018. Т. 92. С. 1743.
Бусев А.И. Аналитическая химия молибдена. М.: Издательство АН СССР, 1962.
Miras H.N., Richmond C.J., Long D.L., Cronin L. // J. Am. Chem. Soc. 2012. V. 134. P. 3816.
Müller A., Diemann E., Kuhlmann C. // Chem. Commun. 2001. V. 4. P. 1928.
Остроушко А.А., Тонкушина М.О. // Журн. физ. химии. 2015. Т. 89. С. 440.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал