Коллоидный журнал, 2019, T. 81, № 5, стр. 667-675
Деформация адсорбента АУК и структура адсорбата при адсорбции н-октана
А. В. Школин 1, *, А. А. Фомкин 1, И. Е. Меньщиков 1, А. Л. Пулин 1, В. Ю. Яковлев 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва,
Ленинский проспект, 31, Россия
* E-mail: shkolin@bk.ru
Поступила в редакцию 17.04.2019
После доработки 06.05.2019
Принята к публикации 08.05.2019
Аннотация
Измерена относительная линейная деформация микропористого углеродного адсорбента АУК, обладающего узким распределением пор по размерам, при адсорбции н-октана в интервале давления от 1 Па до 1.6 кПа при температуре 273, 293, 313, 353 и 393 К. Во всем исследованном диапазоне температур кривые адсорбционной деформации ведут себя схожим образом: в области малых и средних заполнений микропор адсорбент практически не деформируется, а в области высоких заполнений наблюдается его резкое расширение. Проведено численное моделирование методом молекулярной динамики адсорбции молекул н-октана в модельной щелевидной поре со средней эффективной шириной, соответствующей ширине микропор адсорбента АУК. Показано, что поведение деформационных зависимостей в начальной и средней областях заполнения микропор определяется соотношением размеров молекул н-октана и микропор. В области высоких заполнений образование адсорбционных ассоциатов в микропорах приводит к нарастанию внутреннего давления и резкому расширению адсорбента. Рассчитана сжимаемость АУК, полученные значения соответствуют данным, опубликованным ранее.
ВВЕДЕНИЕ
Взаимодействие молекул адсорбата с микропористым твердым телом приводит к реакции, внешне проявляющейся в деформации адсорбента. Первые работы по исследованию адсорбционной деформации [1–7] носили качественный характер и позволили установить общие черты этого явления. В последующих работах [8–17] были предложены разные варианты объяснения и описания адсорбционной деформации пористых твердых тел.
В последние годы были предприняты попытки создания теории адсорбционной деформации микропористых адсорбентов [18–23].
Поскольку сжимаемость твердых тел обычно невелика, то адсорбционная деформация пористых материалов – относительно “жестких” адсорбентов, таких как активные угли, цеолиты, не превосходит 1% [24–27]. При этом адсорбционная деформация расширения при давлениях, близких к давлению насыщенного пара, достигает максимального значения, что в пределе может привести к разрушению гранул адсорбента и ухудшению динамических характеристик адсорбции. Кроме того, адсорбционная деформация при высоких давлениях влияет на поведение термодинамических функций адсорбции.
Исследования адсорбционной деформации крайне важны как при решении фундаментальных проблем теории адсорбционной деформации и волновой сорбострикции [28, 29], так и для практических целей – увеличения срока службы адсорбентов путем оптимизации параметров адсорбционных процессов.
Большинство промышленных адсорбентов имеют широкое распределение пор по размерам и содержат микропоры (до 3.0–3.2 нм), мезопоры (от 3.0–3.2 до примерно 40 нм) и макропоры (от 40 нм и выше) [30], что приводит к большому разнообразию проявления деформационных эффектов при адсорбции.
В связи с этим исследование адсорбционной деформации наиболее активных микропористых адсорбентов, имеющих узкое распределение пор по размерам, важно и актуально. Это позволяет вычленить деформационные эффекты, характерные для заданного типа пор, и создать предпосылки для развития теории адсорбционной деформации адсорбентов с широким распределением пор по размерам.
Данная работа посвящена исследованию особенностей адсорбционной деформации ультрамикропористого адсорбента АУК, имеющего узкое распределение пор по размерам и эффективный размер пор, соизмеримый с эффективным диаметром адсорбируемых молекул н-октана, в широком температурном интервале.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Адсорбент АУК
Исследуемый адсорбент АУК получен из карбида кремния SiС путем термохимического выщелачивания атомов Si в потоке хлора при температуре 1173 К [31] и имеет практически монодисперсные микропоры. Усадка карбида кремния при активации составляет не более 2%. Содержание углерода в таком адсорбенте по данным элементного анализа составляет от 94 до 98% [31]. Наши исследования методом энергодисперсион- ной рентгеновской спектроскопии, выполненные с помощью сканирующего электронного микроскопа (СЭМ) Quanta 650 FEG (FEI, США) при ускоряющем напряжении 30 кВ, показали, что содержание углерода в анализируемом образце равно примерно 94%. Элементный состав поверхности адсорбента приведен в табл. 1. Примеси представлены, в основном, кислородом, кремнием и хлором.
Таблица 1.
Элементный состав поверхности адсорбента АУК
| Элемент | C | O | Si | Cl |
|---|---|---|---|---|
| Содержание, мас. % | 93.9 | 4.2 | 1.0 | 0.9 |
На рис. 1 показан характерный снимок поверхности активного угля АУК, полученный в СЭМ. Гладкий скол частицы образца адсорбента АУК свидетельствует о наличии упорядоченных областей сплошного материала, характерных для исходной материнской кристаллической структуры кристаллов SiC.
Для анализа пористой структуры АУК использовали изотерму адсорбции бензола при температуре 293 K, определенную весовым методом на оригинальном стенде [32]. Полученная изотерма имела Г-образный вид, характерный для микропористых адсорбентов. Изотермы адсорбции и десорбции совпадали. В области давлений, близких к давлению насыщенного пара бензола, на ней отсутствовали подъем и петля адсорбционно-десорбционного гистерезиса, характерная для капиллярно-конденсационных явлений в мезопористой структуре. Все эти факты свидетельствуют о пренебрежимо малом вкладе мезопор в пористую структуру адсорбента.
Структурно-энергетические характеристики АУК определяли с помощью теории объемного заполнения микропор (ТОЗМ) Дубинина [30]. Они таковы: удельный объем микропор W0 = = 0.51 см3/г, стандартная характеристическая энергия адсорбции E0= 29.0 кДж/моль, эффективная полуширина (радиус) микропор x0= 0.41 нм.
Распределение микропор по размерам определяли методом нелокальной теории функционала плотности (NLDFT) для щелевидной модели пор по изотерме адсорбции азота при 77 К, полученной на установке Autosorb iQ (Quantachrome, США). Распределение микропор по размерам адсорбента АУК представлено на рис. 2.
Рис. 2.
Интегральное (1) и дифференциальное (2) распределения объема микропор W0 адсорбента АУК по их размеру d, определенные методом NLDFT для щелевидной модели поры по изотерме адсорбции азота при 77 К.
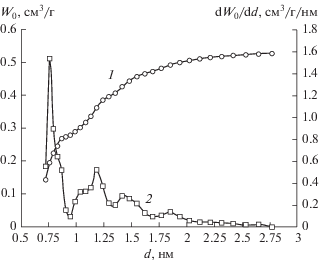
Как следует из рис. 2, средняя ширина микропор, определенная методом NLDFT, составляет 0.76 нм, что близко к значению, рассчитанному, на основании ТОЗМ (0.82 нм).
Адсорбтив н-октан
Для экспериментальных исследований использовали н-октан марки “хроматографически чистый” с массовой долей основного вещества 99.9%. Перед измерением н-октан дегазировали путем криовакуумной перегонки. Чистоту н-октана после дегазации подтверждали путем сверки давления насыщенного пара н-октана при 273 K со справочными данными [33]; различие составило менее 0.1%. Как известно, н-октан обладает следующими физико-химическими характеристиками [33]: молекулярная масса M = 114.22, критическая температура Tcr = 569.2 K, критическое давление Pcr = 2.496 МПа, критическая плотность ρcr= 235.0 кг/м3, температура кипения Тb= = 398.66 K, температура плавления Tm = 216.22 K.
Методы исследования
Измерение величин адсорбционной деформации проводили с использованием дилатометра индукционного типа на универсальной адсорбционно-дилатометрической установке [34]. В опытах измеряли линейную деформацию адсорбента.
Для проведения экспериментов использовали специально приготовленный образец углеродного адсорбента АУК цилиндрической формы длиной 54.0 мм и диаметром 11.4 мм. Его масса составляла 6.63 г. Измерения величин абсолютной адсорбции н-октана проводили на установке для измерения равновесной адсорбции при давлении до атмосферного, разработанной в ИФХЭ РАН [32].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Зависимость относительной линейной деформации адсорбента АУК от давления н-октана
Зависимости относительной линейной адсорбционной деформации микропористого углеродного адсорбента АУК от давления н-октана в интервале давления от 1 Па до 1.6 кПа при температуре 273, 293, 313, 353, 393 K представлены на рис. 3.
Рис. 3.
Зависимость относительной линейной адсорбционной деформации адсорбента АУК от давления н-октана при температуре 273.15 (1), 293 (2), 313 (3), 353 (4) и 393 К (5). Символы – экспериментальные данные. Линии – сплайн-аппроксимация. Пунктиром обозначено давление насыщенного пара рs для соответствующих значений температуры.
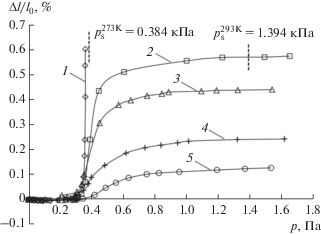
Как следует из рис. 3, изотермы деформации АУК при адсорбции н-октана имеют S-образный вид. За исключением небольшой начальной области, при значениях p, не превышающих 200–300 Па, адсорбционная деформация АУК положительна и растет с увеличением давления во всем исследованном температурном интервале. В начальной области давлений (p < 200–300 Па) величины адсорбционной деформации крайне малы и на два порядка меньше величин деформации в области высоких заполнений, поэтому можно считать, что адсорбент в этой области практически не деформируется. Подобное поведение деформационных кривых в начальной области давлений ранее наблюдалось при исследовании деформации АУК, стимулированной адсорбцией н-пентана [27] и н-гептана [26].
В области давлений, превышающих 200–300 Па, адсорбционная деформация увеличивается с понижением температуры, при этом крутизна изотерм деформации резко возрастает. При температуре 293 K кривая адсорбционной деформации проходит через давление конденсации н-октана в область жидкого состояния адсорбтива без каких-либо изменений ее наклона. Аналогичные результаты были получены при адсорбции на АУК метана [38], н-пентана [27] и н-гептана [26].
Для относительно небольших молекул, таких как, например, диоксид углерода [35], ксенон [36], криптон [37], метан [38] и азот [25], величины начальной деформации (сжатия, расширения) в десятки раз больше, чем для линейных молекул углеводородов, таких как н-октан, н-гептан [26] и н-пентан [27]. Вероятно, такое поведение деформационных зависимостей определяется соотношением между размерами адсорбированных молекул и шириной микропор. В случае исследованных нормальных углеводородов (от н-пентана и выше) молекулы в порах располагаются на таком расстоянии между стенками пор, что находятся в потенциальном минимуме и при малых и средних заполнениях не оказывают заметного деформационного воздействия на углеродный каркас ввиду минимального проявления сил взаимодействия адсорбент–адсорбат.
Чтобы понять причину подобного поведения деформационных зависимостей, необходимо рассмотреть зависимости деформации АУК от величины адсорбции, так как именно эти кривые наиболее наглядно отражают состояние адсорбента в зависимости от степени заполнения его порового пространства.
Для этого исследовали адсорбцию н-октана на АУК. Результаты измерений изотерм адсорбции н-октана на АУК в том же интервале изменения параметров адсорбционного равновесия, что и при измерении зависимостей деформации, представлены на рис. 4. Исследование адсорбции как полного содержания (абсолютной адсорбции) проводили гравиметрическим методом.
Рис. 4.
Изотермы адсорбции н-октана на адсорбенте АУК при температуре 273.15 (1), 293 (2), 313 (3), 353 (4) и 393 К (5). Символы – экспериментальные данные, линии – сглаживающие кривые.
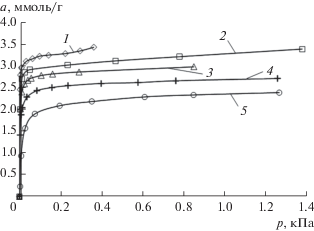
Как следует из рис. 4, адсорбция н-октана падает с ростом температуры. При температуре 273 и 293 K в области давлений, близких к давлению насыщенного пара н-октана, на изотерме адсорбции наблюдается небольшой подъем, вероятно, связанный с конденсацией адсорбата в макропорах и на внешней поверхности адсорбента.
Зависимость относительной линейной деформации адсорбента АУК от адсорбции н-октана
На основе изотерм адсорбции a = f(p) (рис. 4) и изотерм деформации (Δl/l) = f(p) (рис. 3) были построены зависимости относительной деформации адсорбента от величины адсорбции, Δl/l = = f(а), для системы н-октан–АУК. Полученные зависимости представлены на рис. 5. Здесь же для наглядности использована вторая ось абсцисс, на которой приведены значения среднего числа n молекул н-октана в единичной микропоре адсорбента АУК в соответствии с моделью пористой структуры, рассчитанной по [39].
Рис. 5.
Зависимости деформации адсорбента АУК от величины адсорбции н-октана и среднего числа n его молекул в единичной микропоре при температуре 273.15 (1), 293 (2), 313 (3), 353 (4) и 393 К (5). Символы – экспериментальные данные. Линии – сплайн-аппроксимация.
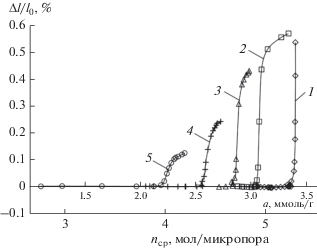
Как следует из рис. 5, для системы н-октан–АУК во всем температурном интервале в области от нуля до средних и высоких заполнений микропор (до 3–5 молекул на единичную микропору в зависимости от температуры) адсорбционная деформация активного угля слабо выражена и резко возрастает лишь в области высоких заполнений. При этом с увеличением температуры крутизна изотерм деформации изменяется слабо.
Подобный ход деформационных зависимостей, вероятно, связан с особенностями взаимодействия адсорбент–адсорбат и адсорбат–адсорбат в случае соизмеримости размера микропор и эффективного диаметра молекул. Для адсорбента АУК эффективная ширина (диаметр) микропор X0 равна 0.82 нм по ТОЗМ (0.76 нм согласно расчетам методом NLDFT), критический диаметр молекул н-октана, определенный по прохождению ими окон синтетических цеолитов, d = 0.49 нм [40]. Малость величин адсорбционной деформации в начальной и средней областях заполнения микропор по сравнению с областью высоких заполнений обусловлена преобладанием взаимодействия адсорбат–адсорбат, приводящего к ассоциации молекул в центральной части пор [26]. При этом сохраняется баланс сил в твердом теле и, как следствие, отсутствую заметные деформационные эффекты.
Резкий рост адсорбционной деформации обусловлен уменьшением среднего расстояния между адсорбированными молекулами и стенками микропор при их заполнении молекулами н-октана, достигающем 70–80% в области высоких относительных давлений. В результате равновесное давление газовой фазы быстро растет, а адсорбция резко замедляется. Конденсация адсорбата вблизи давления насыщения приводит к замедлению роста адсорбционной деформации в этой области (рис. 5).
Численное моделирование адсорбции н-октана в микропорах
Для объяснения поведения зависимостей деформации АУК от величины адсорбции н-октана на необходимо понимать механизм адсорбции и структуру адсорбата в микропорах. Для этого методом молекулярной динамики исследовали адсорбцию н-октана в щелевидных модельных микропорах шириной, соответствующей ширине микропоры адсорбента АУК, определенной по изотерме стандартного пара азота при 77 К.
В качестве модели элементарной микропоры была принята щелевидная пора, стенки которой образованы двумя графеновыми слоями прямоугольной формы со стороной около 1.5 нм. Углерод в этих слоях находится в гексагональной координации. Свободные валентности атомов углерода на краях графеновых слоев компенсированы связями с атомами водорода. Боковая поверхность поры – щель – открыта для адсорбции. Расстояние между графеновыми слоями, или ширина поры X0 = 0.82 нм, выбрана равной средней эффективной ширине поры с учетом радиуса атомов углерода, определенной для адсорбента АУК по ТОЗМ. Средний объем модельной поры выбран, с одной стороны, на основе статистических требований к минимальному количеству молекул в анализируемой системе, а с другой стороны, – с целью экономии машинного времени.
В ячейку моделирования помещали различное количество молекул н-октана, от 20 до 200. Температура системы составляла 293 К. Результаты расчетов показали, что молекулы н-октана статистически достоверно стремятся располагаться в центральной части поры для всех значений заполнения пор, использованных при моделировании.
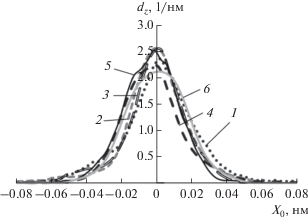
На рис. 6 представлены плотности вероятности распределения от 20 до 200 молекул н-октана по ширине поры, определенные на основе усреднения молекулярно-динамической траектории в течение 1 пс. Здесь X = 0 отвечает положению плоскости, проходящей через центральную часть поры. Как видно на рис. 6, когда в системе моделирования находится всего 20 молекул н-октана, профиль плотности вероятности распределения молекул в поре качественно схож с аналогичным профилем, когда в системе моделирования находится 200 молекул н-октана. Адсорбированные молекулы располагаются, в основном, в центральной части щелевидной поры, взаимодействуя преимущественно между собой. Следует отметить, что уже при наличии 20 молекул н-октана в системе моделирования наблюдается область высоких заполнений микропоры. В этом случае в модельной поре находятся в среднем 19 молекул, в то время как при 200 молекулах в системе моделирования в поре адсорбента находятся в среднем 23 молекулы.
Рис. 6.
Распределение плотности вероятности нахождения dZ молекул н-октана по ширине поры X (X = 0 – центр поры). Число молекул н-октана в системе моделирования 20 (1), 40 (2), 80 (3), 120 (4), 160 (5), 200 (6). Температура 273 К.
На рис. 7а представлен мгновенный снимок молекулярно-динамической реализации позиционирования адсорбированных молекул в модельной микропоре при наличии 20 молекул н-октана в ячейке моделирования.
Рис. 7.
Мгновенный снимок молекулярно-динамической траектории молекул н-октана в модельной щелевидной микропоре при 20 молекулах в системе моделирования: (а) вид сбоку (две структурированные плоскости соответствуют слоям графена, образующим пору), (б) вид сверху (ближайшая к наблюдателю стенка поры исключена для наглядности). Молекулы н-октана представлены в виде цепочек из атомов углерода (черные кружки), с которыми связаны атомы водорода (светлые кружки).
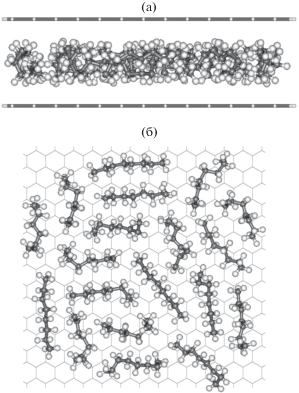
Как следует из рис. 7а, при адсорбции н-октана в центральной части поры образуется адсорбционный ассоциат, плотность которого увеличивается с ростом адсорбции. Поскольку объем модельной микропоры ограничен, то уменьшение среднего расстояния между адсорбированными молекулами и стенками микропоры приводит к резкому нарастанию внутреннего давления на стенки и стремительному росту деформации расширения адсорбента.
Анализ плотности вероятности пространственной ориентации связей C–C молекулы н-октана в модельной поре (рис. 8) позволил установить, что связи C–C молекул н-октана преимущественно находятся в поре в двух состояниях. Первое из них отвечает ориентации связей под небольшим углом, 2°…12°, к плоскости графеновых слоев, т.е. связи C–C ориентируются практически параллельно этим слоям. Часть связей C–C ориентируется преимущественно под углом 70°…80°, т.е. близко к плоскости, перпендикулярной графеновым слоям. При этом доля связей C–C в молекулах н-октана, отвечающих второму состоянию, растет от 25 до 50% при увеличении числа молекул н-октана в системе моделирования от 20 до 200.
Рис. 8.
Плотность вероятности ориентации связей С–С в молекулах н-октана в модельной микропоре, dφ, при количестве молекул в системе моделирования 20 (1), 40 (2), 80 (3), 120 (4), 160 (5), 200 (6). Зависимость построена в полярных координатах. В скобках указаны главные плоскости в системе моделирования, относительно которых анализируется ориентация молекул: (xy) – плоскость, параллельная стенкам модельной поры, z – плоскость, нормальная к стенкам поры.
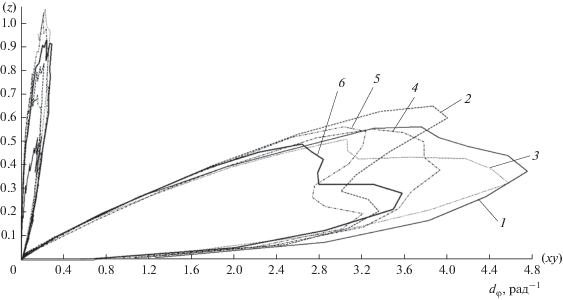
Очевидно, что в области малых и средних заполнений молекулы н-октана будут располагаться в средней части модельной поры в плоскости графеновых слоев, взаимодействуя преимущественно между собой. С ростом адсорбции, в области высоких заполнений, будет увеличиваться взаимодействие адсорбат–адсорбент, которое в системе моделирования проявляется через изменения конформации молекул н-октана, нарастающие с увеличением количества молекул в системе моделирования и, соответственно, в модельной поре.
Расчет предельных величин адсорбционной деформации
Для расчета предельных величин адсорбционной деформации использовали подход, развитый ранее [24]. При высоких заполнениях в микропорах образуются молекулярные ассоциаты высокой плотности, близкой к плотности жидкости. При значениях приведенной температуры T/Tcr > > 0.8 средняя плотность адсорбата в микропорах близка к плотности жидкости [42]. Это свойство использовали для определения сжимаемости микропористого адсорбента.
Изотермическую сжимаемость термодинамической системы [43] определяли по формуле
где $\text{v}$ – удельный объем, p – внешнее давление, Т – температура системы.Относительную деформацию адсорбционной системы определяли как
(2)
${{\left. {{{\Delta V} \mathord{\left/ {\vphantom {{\Delta V} V}} \right. \kern-0em} V}} \right|}_{{T{\text{ = const}}}}} = {\text{ }}{{\gamma }_{{\text{a}}}}(\pi --p),$Считали, что деформация адсорбента изотропна [1], а на линии насыщения p = ps свойства адсорбата термодинамически эквивалентны свойствам свободной жидкости, то есть внутреннее давление π равно кинетическому давлению в жидкости Pkin [43].
Таким образом, относительная линейная адсорбционная деформация, определяемая в эксперименте, может быть рассчитана для случая предельной адсорбции (деформации) на линии давления насыщенного пара по уравнению
(3)
$\begin{gathered} {{\left( {\frac{{\Delta l}}{{{{l}_{0}}}}} \right)}_{{p = {{p}_{{\text{s}}}}}}} = \frac{{{{\gamma }_{{\text{a}}}}}}{3}\left( {{{P}_{{{\text{kin}}}}} - p} \right) = \\ = \frac{{{{\gamma }_{{\text{a}}}}}}{3}\left( {{{ - T{{{\left( {\frac{{{\text{d}}\text{v}}}{{{\text{d}}T}}} \right)}}_{p}}} \mathord{\left/ {\vphantom {{ - T{{{\left( {\frac{{{\text{d}}\text{v}}}{{{\text{d}}T}}} \right)}}_{p}}} {{{{\left( {\frac{{{\text{d}}\text{v}}}{{{\text{d}}p}}} \right)}}_{T}} - p}}} \right. \kern-0em} {{{{\left( {\frac{{{\text{d}}\text{v}}}{{{\text{d}}p}}} \right)}}_{T}} - p}}} \right). \\ \end{gathered} $Сжимаемость адсорбционной системы определяли как
(4)
${{\gamma }_{{\text{a}}}} = {{3{{{({{\Delta l} \mathord{\left/ {\vphantom {{\Delta l} {{{l}_{0}}}}} \right. \kern-0em} {{{l}_{0}}}})}}_{{p = {{p}_{{\text{s}}}}}}}} \mathord{\left/ {\vphantom {{3{{{({{\Delta l} \mathord{\left/ {\vphantom {{\Delta l} {{{l}_{0}}}}} \right. \kern-0em} {{{l}_{0}}}})}}_{{p = {{p}_{{\text{s}}}}}}}} {({{P}_{{{\text{kin}}}}}--p).}}} \right. \kern-0em} {({{P}_{{{\text{kin}}}}}--p).}}$Таблица 2.
Сжимаемость микропористого углеродного адсорбента АУК
| Система | T, К | T/Tcr | Pkin, бар | ${{({{\Delta l} \mathord{\left/ {\vphantom {{\Delta l} {{{l}_{0}}}}} \right. \kern-0em} {{{l}_{0}}}})}_{{p = {{p}_{{\text{s}}}}}}}$ | γа × 106, бар–1 | γа/γm |
|---|---|---|---|---|---|---|
| АУК/н-С8Н18 | 273.0 | 0.725 | 3882 | 0.55* | 6.0* | 2.0 |
| 293.0 | 0.73 | 3925 | 0.58 | 6.4 | 2.1 | |
| АУК/н-С7Н16 | 273.1 | 0.50 | 3404 | 0.65 | 5.7 | 1.9 |
| 293.0 | 0.54 | 3209 | 0.55 | 5.1 | 1.7 | |
| АУК-/н-С5Н10 | 273.1 | 0.58 | 3607 | 0.60 | 5.4 | 1.8 |
| 293.0 | 0.62 | 2588 | 0.55 | 6.4 | 2.1 | |
| 313.0 | 0.67 | 2181 | 0.41 | 5.6 | 1.9 |
Из табл. 2 следует, что средняя сжимаемость адсорбента АУК как пористого твердого тела почти постоянна при разных температурах, не зависит от свойств адсорбата и при адсорбции углеводородов н-С5Н10 и н-С7Н16 в среднем составляет γа = (5.8 ± 0.7) × 10–6 бар–1. По сравнению с непористым графитом, сжимаемость которого γm = 3 × × 10–6 бар–1 [24], сжимаемость адсорбента АУК в среднем выше в 1.9 раза.
Предлагаемый подход может быть принят для предварительной оценки предельной адсорбционной деформации адсорбента.
ВЫВОДЫ
При адсорбции н-октана, в области малых и средних заполнений пор микропористого углеродного адсорбента АУК, адсорбент практически не деформируется из-за оптимального соотношения размеров молекул н-октана и средних размеров микропор. Это было подтверждено путем численного моделирования методом молекулярной динамики на модельной микропоре углеродного адсорбента. Молекулы н-октана располагаются преимущественно в средней части микропоры. При дальнейшем росте величины адсорбции происходит резкое расширение адсорбента из-за нарастания внутреннего давления в микропорах при высоких заполнениях, достигающих 70–80% от предельного. При понижении температуры крутизна кривой расширения адсорбента увеличивается.
Также показана принципиальная возможность использования подхода [24] для определения предельных величин адсорбционной деформации. Для системы АУК–н-октан расчетная сжимаемость адсорбента соответствует значениям, определенным ранее для адсорбционных систем АУК–н-пентан [27] и АУК–н-гептан [26].
Список литературы
Mechan F.T. // Proc. R. Soc. London. Ser. A. 1927. V. 115. P. 199.
Ребиндер П.А. // В сб. VI Съезд русских физиков. М.: ОГИЗ, 1928. С. 20.
Ребиндер П.А. // Успехи физ. наук. 1972. Т. 108. С. 3.
Bangham D.H., Fakhoury N. // Nature. 1928. V. 122. P. 681.
Bangham D.H., Fakhoury N. // Proc. Roy. Soc. 1930. A130. P. 81.
Bangham D.H., Razouk R.J. // Trans. Faraday Soc. 1937. V. 33. P. 1463.
Haines R.S., McIntoch R. // J. Chem. Phys. 1947. V. 15. P. 28.
Flood E.A. // Can. J. Chem. 1957. V. 35. P. 48.
Кононюк В.Ф., Сарахов А.И., Дубинин М.М. // Изв. АН СССР. Сер. хим. 1972. № 5. С. 45.
Беринг Б.П., Красильникова O.K., Серпинский В.В. // Докл. АН СССР. 1976. Т. 231. С. 373.
Warne M.R., Allan N.L., Cosgrove T. // Phys. Chem. Chem. Phys. 2000. V. 2. P. 3663.
Jakubov T.S., Mainwaring D.E. // Phys. Chem. Chem. Phys. 2002. V. 4. P. 5678.
Фомкин А.А., Пулин А.Л. // Изв. РАН. Сер. хим. 1999. № 10. С. 1887.
Фомкин А.А., Регент Н.И., Синицын В.А. // Изв. РАН. Сер. хим. 2000. С. 1018.
Яковлев В.Ю., Фомкин А.А., Твардовский А.В., Синицын В.А., Пулин А.Л. // Изв. АН. Сер. хим. 2003. С. 338.
Fomkin A.A. // Adsorption. 2005. V. 11. P. 425.
Школин А.В., Фомкин А.А. // Физикохимия поверхности и защита материалов. 2016. Т. 52. С. 135.
Ustinov E.A., Do D.D. // Carbon. 2006. V. 44. P. 2652.
Русанов А.И. Термодинамические основы механохимии. СПб.: Наука, 2006.
Русанов А.И. // Коллоид. журн. 2007. Т. 69. С. 861.
Бродская Е.Н., Русанов А.И. // Коллоид. журн. 2014. Т. 76. С. 573.
Русанов А.И. // Докл. АН. 2006. Т. 406. С. 776.
Gor G.Y., Neimark A.V. // Langmuir. 2010. V. 26. P. 13 021.
Фомкин А.А., Школин А.В., Пулин А.Л., Меньщиков И.Е., Хозина У.В. // Коллоид. журн. 2018. Т. 80. С. 610.
Yakovlev V.Yu., Fomkin A.A., Tvardovski A.V. // J. Colloid Interface Sci. 2004. V. 280. P. 305.
Школин А.В., Фомкин А.А. // Физикохимия поверхности и защита материалов. 2013. Т. 49. С. 345.
Школин А.В., Фомкин А.А., Синицын В.А. // Физикохимия поверхности и защита материалов. 2011. Т. 47. С. 451.
Фомкин А.А., Школин А.В. // Докл. АН. 2008. Т. 423. С. 80.
Фомкин А.А., Школин А.В., Петухова Г.А. // Физикохимия поверхности и защита материалов. 2012. Т. 48. С. 138.
Дубинин М.М. Адсорбция и пористость. М.: ВАХЗ, 1972. С. 12.
Федоров Н.Ф., Иванюк Г.К., Гаврилов Д.Н. и др. // Углеродные адсорбенты и их применение в промышленности / Под ред. Плаченова Т.Г. М.: Наука, 1983. С. 20.
Школин А.В., Фомкин А.А. // Измерительная техника. 2018. № 4. С. 55.
Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей. М.: Наука, 1972.
Школин А.В., Фомкин А.А., Пулин А.Л., Яковлев В.Ю. // Приборы и техника эксперимента. 2008. Т. 51. С. 163.
Yakovlev V.Y., Fomkin A.A., Tvardovski A.V. // J. Colloid Interface Sci. 2003. V. 268. P. 33.
Школин А.В., Потапов С.В., Фомкин А.А. // Коллоид. журн. 2015. Т. 77.
Потапов С.В., Школин А.В., Фомкин А.А. // Коллоид. журн. 2014. Т. 76. С. 382.
Школин А.В., Фомкин А.А. // Коллоид. журн. 2009. Т. 71. С. 116.
Дубинин М.М. // Углеродные адсорбенты и их применение в промышленности / Под ред. Плаченова Т.Г. М.: Наука, 1983. С. 100.
Кельцев Н.В. Основы адсорбционной техники. М.: Химия, 1976.
Брек Д. Цеолитовые молекулярные сита. М.: Мир, 1976.
Dubinin M.M., Fomkin A.A., Seliverstova I.I., Serpinsky V.V. // Proceedings of the 5-th International Conference on Zeolites. Naples, Italy. 1980. P. 468.
Гуггенгейм Е.А. Современная термодинамика, изложенная по методу У. Гиббса. Л.-М.: ГНТИ хим. литературы, 1941.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал



