Коллоидный журнал, 2020, T. 82, № 2, стр. 148-154
Исследование необменной сорбции электролитов различной природы гетерогенной сульфокатионитовой мембраной
О. А. Демина 1, И. В. Фалина 1, *, Н. А. Кононенко 1, В. И. Заболоцкий 1
1 Кубанский государственный университет
350040 Краснодар,
ул. Ставропольская 149, Россия
* E-mail: irina_falina@mail.ru
Поступила в редакцию 05.09.2019
После доработки 25.09.2019
Принята к публикации 27.09.2019
Аннотация
Исследована необменная сорбция электролитов различной природы сульфокатионитовой мембраной МК-40 кондуктометрическим методом без разделения фаз раствора и мембраны. На основании сорбционных экспериментов в рамках двухфазной микрогетерогенной модели ионообменного материала определена константа Доннана для мембраны МК-40 в растворах электролитов HCl, NaOH, NaCl, MgCl2, CaCl2 и BaCl2. Установлена зависимость концентрации сорбированного мембраной электролита от природы и концентрации равновесного раствора. Изучены факторы, оказывающие наиболее существенное влияние на концентрацию сорбированного мембраной электролита и величину константы Доннана: удельная влагоемкость мембраны, природа и заряд противо- и коиона. Объемные доли фазы геля и фазы равновесного раствора определены двумя способами: из экспериментальных данных по удельной электропроводности мембраны в растворах различной природы и концентрации и данных по необменной сорбции в рамках микрогетерогенной модели строения мембраны. Показана возможность расчета константы Доннана для мембраны МК-40 в растворах солей упрощенным способом на основании изучения сорбции электролита только одной концентрации при условии известных значений объемных долей проводящих фаз в мембране.
ВВЕДЕНИЕ
Изучение сорбции сильных электролитов ионообменными материалами является фундаментальной задачей химии ионного обмена. Исследование способности ионообменных мембран поглощать сверхэквивалентное количество электролита, начатое в работах Доннана, Глюкауфа и др. [1–4], не утратило своей актуальности и в настоящее время [5–8]. Это связано с развитием электромембранной технологии очистки природных вод и разделения многокомпонентных растворов, поскольку сорбция сильных электролитов оказывает существенное влияние на электротранспортные свойства ионообменных мембран, особенно на их селективность.
Для количественной характеристики необменной сорбции электролита мембраной используют константу Доннана (KD), однако информация о ее величине для ионообменных мембран в растворах электролитов различной природы ограничена, поскольку экспериментальное определение этой характеристики связано с методическими трудностями. В то же время знание величины KD необходимо для теоретической оценки не только сорбции ионов из водных растворов электролитов, но и транспортных свойств ионообменных мембран. Так, например, константа Доннана является одним из шести основных параметров микрогетерогенной модели, позволяющей рассчитать удельную электропроводность и диффузионную проницаемость ионообменной мембраны в разбавленных и умеренно концентрированных растворах электролитов [9, 10]. Однако при выполнении расчетов авторы вынуждены использовать произвольные значения константы Доннана, что снижает точность полученных величин [11, 12].
В связи с этим целью настоящей работы являлось исследование необменной сорбции электролитов различной природы сульфокатионитовой мембраной МК-40 и определение константы Доннана в рамках двухфазной микрогетерогенной модели строения ионообменной мембраны.
ТЕОРИЯ
Микрогетерогенная модель рассматривает мембрану как двухфазную систему, состоящую из гелевых участков и межгелевых промежутков, заполненных равновесным раствором, объемные доли которых, соответственно, равны f1 и f2 ( f1 + f2 = 1). Согласно этой модели, концентрация необменно сорбированного электролита в мембране (C *) может быть представлена уравнением [13, 14]
где $\bar {C}$ и C – концентрации равновесного раствора в гелевой фазе и межгелевых промежутках.Известно, что соотношение Доннана для мембраны в целом не выполняется [1], однако оно справедливо для гелевой фазы и в области разбавленных растворов (C $ \ll $ $\bar {Q}$) может быть представлено в виде аппроксимации
(2)
$\bar {C} = \frac{{K_{{\text{D}}}^{{\left| {{{z}_{2}}} \right|}}}}{{{{{\overline Q }}^{{\left| {{{{{z}_{2}}} \mathord{\left/ {\vphantom {{{{z}_{2}}} {z{}_{1}}}} \right. \kern-0em} {z{}_{1}}}} \right|}}}}}{{C}^{{1 + \left| {{{{{z}_{2}}} \mathord{\left/ {\vphantom {{{{z}_{2}}} {{{z}_{1}}}}} \right. \kern-0em} {{{z}_{1}}}}} \right|}}},$Подстановка уравнения (2) в выражение (1) и последующее деление обеих частей полученного соотношения на C приводит к уравнению вида
(3)
$\frac{{C{\text{*}}}}{C} = {{f}_{1}}\frac{{K_{{\text{D}}}^{{\left| {{{z}_{2}}} \right|}}}}{{{{{\overline Q }}^{{\left| {{{{{z}_{2}}} \mathord{\left/ {\vphantom {{{{z}_{2}}} {z{}_{1}}}} \right. \kern-0em} {z{}_{1}}}} \right|}}}}}{{C}^{{\left| {{{{{z}_{2}}} \mathord{\left/ {\vphantom {{{{z}_{2}}} {z{}_{1}}}} \right. \kern-0em} {z{}_{1}}}} \right|}}} + {{f}_{2}}.$С учетом зарядов противо- и коионов уравнение (3) принимает для 1 : 1-электролитов вид
а для 2 : 1-электролитов(5)
$\frac{{C{\text{*}}}}{C} = {{f}_{1}}\frac{{{{K}_{{\text{D}}}}}}{{{{{\bar {Q}}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}}{{C}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}} + {{f}_{2}}.$Анализ уравнений (4) и (5) показывает, что для нахождения KD с помощью микрогетерогенной модели необходимо:
– экспериментальные данные по необменной сорбции электролита мембраной представить в координатах $\frac{{C{\text{*}}}}{C}$ – $C$ для 1 : 1-электролита и $\frac{{C{\text{*}}}}{C}$ – ${{C}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$ для 2 : 1-электролита,
– путем экстраполяции ${{C{\text{*}}} \mathord{\left/ {\vphantom {{C{\text{*}}} C}} \right. \kern-0em} C}$ на $C = 0$ определить объемную долю межгелевых промежутков ${{f}_{2}},$
– определить объемную долю гелевой фазы (f1 = 1 – f2) и рассчитать ее обменную емкость $\bar {Q},$
– из тангенса угла наклона прямой линии, зная параметры f1 и $\bar {Q},$ рассчитать KD.
Описанный алгоритм использовался в настоящей работе для нахождения константы Доннана и объемной доли равновесного раствора в фазе мембраны.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектом исследования являлась гетерогенная сульфокатионитовая мембрана МК-40 для электродиализа. Обменная емкость мембраны, определенная по стандартной методике [15], составляла 2.36 ммоль/г сухой мембраны. Исследование влияния природы и заряда противо- и коионов на необменную сорбцию электролита мембраной МК-40 было выполнено в растворах хлорида и гидроксида натрия, соляной кислоты и хлоридов магния, кальция и бария. Концентрацию используемых растворов электролитов варьировали от 0.2 до 1.0 моль-экв/л.
Эксперименты по необменной сорбции электролита проводили в статических условиях без разделения фаз раствора и мембраны. Объемное соотношение мембраны и раствора составляло 1 : 3. Контроль установления равновесия осуществляли кондуктометрическим методом с помощью специально изготовленной ячейки-пипетки с платинированными платиновыми электродами. Равновесие в системе мембрана–раствор считалось достигнутым, если значение сопротивления раствора над мембраной оставалось постоянным в течение суток.
Параллельно весовым методом определяли влагосодержание мембраны (W, %) и рассчитывали ее влагоемкость как количество молей воды, приходящееся на моль функциональных групп (n, $\frac{{{\text{моль }}{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}{{{\text{моль SO}}_{{\text{3}}}^{ - }}}$). Плотность набухших образцов мембраны определяли на основании измерения их массы и линейных размеров. Физико-химические характеристики мембраны МК-40 представлены в табл. 1.
Таблица 1.
Физико-химические характеристики сульфокатионитовой мембраны МК-40 в 0.1 моль-экв/л растворах различных электролитов
| Мембрана | Раствор | ρ, $\frac{{{{{\text{г}}}_{{{\text{sw}}}}}}}{{{\text{с}}{{{\text{м}}}^{{\text{3}}}}}}$ |
Q, $\frac{{{\text{ммоль}}}}{{{\text{см}}_{{{\text{sw}}}}^{{\text{3}}}}}$ |
W, % |
n, $\frac{{{\text{моль }}{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}{{{\text{моль SO}}_{{\text{3}}}^{ - }}}$ |
|---|---|---|---|---|---|
| МК-40 | HCl | 1.09 | 1.61 | 37.2 | 14.0 |
| NaOH | 1.17 | 1.73 | 32.3 | 12.1 | |
| NaCl | 1.11 | 1.64 | 32.2 | 12.1 | |
| MgCl2 | 1.14 | 2.06 | 31.1 | 9.5 | |
| CaCl2 | 1.35 | 2.44 | 30.4 | 9.3 | |
| BaCl2 | 1.45 | 2.62 | 20.6 | 6.3 |
Значения удельной электропроводности мембраны в растворах электролитов различной природы и концентрации определяли, измеряя ее электрическое сопротивление ртутно-контактным методом на частоте переменного тока, обеспечивающей равенство мнимой составляющей импеданса ячейки нулю [16]. Полученные концентрационные зависимости электропроводности мембраны использовались для расчета объемных долей проводящих фаз ( f1 и f2) в рамках двухфазной микрогетерогенной модели [9, 10]. Величина параметра f2 находилась как угловой наклон зависимости электропроводности мембраны (κm) от электропроводности равновесного раствора (κ) в билогарифмических координатах в соответствии с уравнением [5]
где $\bar {\kappa }$ – электропроводность гелевой фазы мембраны.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Экспериментально полученные зависимости концентрации необменно поглощенного мембраной электролита от концентрации равновесного раствора различной природы приведены на рис. 1. Как следует из рисунка, в случае 1 : 1-электролитов переход мембраны из Na+- в H+-форму при сохранении общего коиона Cl– приводит к незначительному увеличению сорбции электролита, а замена коиона Cl– на анион гидроксила OH– увеличивает сорбцию практически в 1.5 раза. Это подтверждает известный факт, что природа коиона оказывает существенное влияние на сорбцию электролита [14].
Рис. 1.
Зависимость концентрации сорбированного мембраной электролита от концентрации равновесного раствора: 1 – BaCl2, 2 – CaCl2, 3 – MgCl2, 4 – NaOH, 5 – HCl, 6 – NaCl.
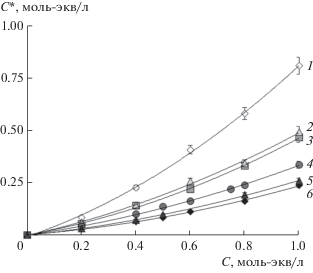
Из рис. 1 также очевидно, что количество сорбированного электролита зависит как от природы коиона и противоиона, так и от заряда последнего. Переход мембраны МК-40, находящейся в Na+- или H+-форме, в форму двухзарядных противоионов Mg2+, Ca2+ и Ba2+ сопровождается резким увеличением концентрации сорбированного электролита. Особенно высокие значения величины C * наблюдаются при сорбции мембраной раствора хлорида бария. Причиной данного эффекта может являться специфическое взаимодействие сульфогрупп мембраны с ионами Ba2+. Образование при этом слабодиссоциирующего комплекса фиксированный ион–противоион приводит к снижению обменной емкости мембраны и, как следствие, к уменьшению доннановского исключения коионов из ее гелевой фазы.
До сих пор дискуссионным остается вопрос о возможности учета структурной неоднородности ионообменных материалов с помощью параметра Z в уравнении Глюкауфа для 1 : 1-электролита
где m*, m – моляльные концентрации электролита в мембране и растворе, KG – константа Глюкауфа. По мнению Глюкауфа, параметр Z учитывает неоднородность распределения ионогенных групп в мембране. В работе [17] показано, что замена в уравнении (8) моляльной концентрации на молярную не приводит к возникновению ошибок при определении параметра Z: где C *, C – молярные концентрации электролита в мембране и растворе, $K = \bar {\omega }\bar {\rho }{{(\omega \rho )}^{{Z - 2}}}{{K}_{{\text{G}}}},$ $\bar {\omega },$ ω – влагоемкость мембраны и массовая доля воды в растворе (кг), $\bar {\rho },$ ρ – плотность мембраны и раствора (кг).Из уравнения (8) следует, что параметр Z можно определить из тангенса угла наклона прямой, полученной при обработке экспериментальных значений концентрации сорбированного электролита и концентрации раствора в билогарифмических координатах lg C *–lg C.
Полученные в настоящей работе экспериментальные данные были использованы для оценки параметра Z. Как видно на рис. 2, они хорошо аппроксимируются прямыми линиями с тангенсом угла наклона 1.29–1.41. Из табл. 2 видно, что величина параметра Z, находится в пределах 0.59–0.71 и слабо зависит от природы равновесного раствора. Согласно литературным данным [9], величина параметра Z для катионообменных мембран в солевых формах может изменяться от 0.6 до 0.8.
Рис. 2.
Зависимость концентрации раствора электролита в мембране от концентрации равновесного раствора электролита в билогарифмических координатах: 1 – NaCl, 2 – HCl, 3 – NaOH, 4 – MgCl2, 5 – C-aCl2, 6 – BaCl2.
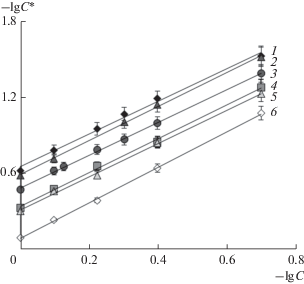
Таблица 2.
Параметр Z теории Глюкауфа, определенный для мембраны МК-40 в растворах электролитов различной природы
| Раствор | HCl | NaOH | NaCl | MgCl2 | CaCl2 | BaCl2 |
|---|---|---|---|---|---|---|
| Z | 0.65 | 0.70 | 0.71 | 0.66 | 0.69 | 0.59 |
В монографии [9] подобный анализ был выполнен для ионообменных мембран разных структурных типов. Было показано, что как для гетерогенных мембран на углеводородной матрице (МК-40 и CRP), так и для гомогенных перфторированных мембран типа Нафион величина параметра Z, находится в пределах 0.60–0.86. Таким образом, величину Z нельзя считать мерой неоднородности ионообменных мембран. Более адекватно неоднородность ионообменных мембран может быть охарактеризована с помощью параметра f2, представляющего собой объемную долю равновесного раствора в фазе мембраны. Определить величину параметра f2 можно как из данных по удельной электропроводности мембран в растворах электролитов различной концентрации, так и из данных по необменной сорбции.
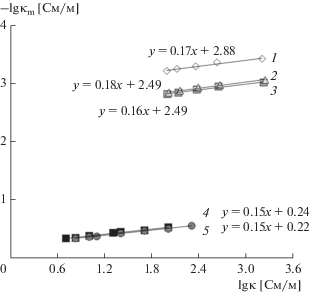
На рис. 3 изображены экспериментальные данные по удельной электропроводности мембраны МК-40 в растворах различной природы и концентрации, обработанные в соответствие с уравнением (6) для нахождения параметра f2 как углового наклона полученных линейных зависимостей.
Рис. 3.
Зависимость удельной электропроводности мембраны МК-40 от удельной электропроводности равновесных растворов в билогарифмических координатах: 1 – BaCl2, 2 – CaCl2, 3 – MgCl2, 4 – NaCl, 5 – NaOH.
На рис. 4а, 4б представлены результаты обработки экспериментальных данных по необменной сорбции мембраной МК-40 растворов электролитов различной природы и концентрации в соответствии с уравнениями (4) и (5). Величина параметра f2. находилась из приведенных на рисунках уравнений прямых линий как отрезок, отсекаемый на оси ординат.
Рис. 4.
Концентрация электролита в мембране, нормированная на концентрацию равновесного раствора электролита, как функция концентрации (а) или квадратного корня из концентрации (б) равновесного раствора электролита: 1 – NaOH, 2 – HCl, 3 – NaCl, 4 – BaCl2, 5 – CaCl2, 6 – MgCl2.
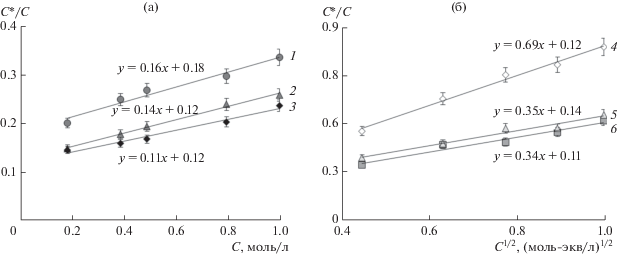
Для сравнения в табл. 3 представлены значения параметра f2, найденные из различных экспериментов. Сопоставление величин f2, определенных двумя способами, показывает, что результаты по сорбции всегда на 10–20% отличаются от результатов, полученных из данных по удельной электропроводности. Подобный эффект отмечался также авторами [18] при анализе значений параметра f2, полученных из данных дифференциальной сканирующей калориметрии, контактной эталонной порометрии и мембранной кондуктометрии.
Таблица 3.
Значения объемной доли межгелевых промежутков и константы Доннана, найденные различными способами
| Раствор | f2 | KD | ||
|---|---|---|---|---|
| согласно уравнению (4) или (5) |
согласно уравнению (7) | согласно уравнению (4) или (5) |
согласно уравнению (9) при 1 моль-экв/л | |
| HCl | 0.12 | 0.26 | 0.29 | 0.01 |
| NaOH | 0.18 | 0.15 | 0.40 | 0.44 |
| NaCl | 0.12 | 0.14 | 0.24 | 0.22 |
| MgCl2 | 0.11 | 0.16 | 0.59 | 0.57 |
| CaCl2 | 0.14 | 0.18 | 0.67 | 0.66 |
| BaCl2 | 0.12 | 0.17 | 1.36 | 1.37 |
| NaCl [14] | 0.10 | 0.11 | 0.12 | 0.08 |
Обращает на себя внимание тот факт, что значения параметра f2 в растворе НСl, найденные из данных по сорбции в 2 раза ниже, чем из данных по электропроводности. Известно, что значения параметра f2 у различных катионообменных мембран в H+-форме, найденные из данных по электропроводности всегда выше, чем для солевых форм мембраны [19–21]. Они, по-видимому, являются “кажущимся” и обусловлены различным механизмом переноса ионов Na+ и H+ не только в растворе, но и в мембране. Сделанное предположение подтверждает экспериментально установленное равенство величин параметра f2, найденных из данных по необменной сорбции для мембраны в Na+- и H+-формах (табл. 3).
В табл. 3 представлены также значения константы Доннана KD, найденные с помощью микрогетерогенной модели в соответствии с уравнениями (4) или (5). Видно, что независимо от природы равновесного раствора электролита величина KD для мембраны МК-40, как правило, меньше 1. Исключение составляет Ba2+-форма мембраны, для которой KD > 1. Можно предположить, что избыточная необменная сорбция хлорида бария мембраной происходит в результате резкого снижения обменной емкости ее гелевой фазы за счет специфического взаимодействия фиксированных сульфогрупп с противоионами Ba2+.
Сравнивая величины KD, полученные для мембраны МК-40 в растворах 1 : 1- и 2 : 1-электролитов, можно заключить, что переход от одно- к двухзарядному противоиону приводит к увеличению константы Доннана примерно в 2 раза. В то же время природа противоионов одинакового заряда при фиксированном коионе практически не влияет на сорбционные характеристики мембраны. Обращает на себя внимание тот факт, что замена в мембранной системе 2 : 1-электролитов (MgCl2, CaCl2) на 1 : 2-электролит (Na2SO4) не оказывает существенного влияния на величину KD. В то же время переход от раствора хлорида натрия к его гидроксиду приводит к значительному росту концентрации электролита, необменно сорбированного мембраной. Полученные результаты свидетельствуют о сложности теоретического предсказания сорбционной способности ионообменных мембран в растворах электролитов различной природы и необходимости экспериментального определения величины KD в каждом конкретном случае.
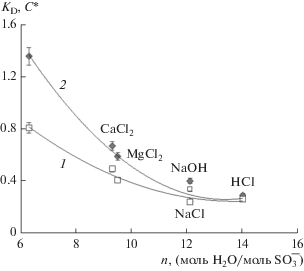
Известно [16, 22, 23], что влагоемкость ионообменных мембран существенно влияет на их транспортные характеристики. Представляло интерес выяснить, влияет ли она и на равновесные свойства ионообменного материала. На рис. 5 представлена зависимость KD от удельной влагоемкости мембраны n, которая изменяется в зависимости от природы противоиона. Видно, что в случае двухзарядных противоионов KD уменьшается с ростом n. Однако величина KD слабо зависит от влагоемкости мембраны в форме однозарядных противоионов. Аналогичный характер имеет и зависимость концентрации сорбированного электролита от удельной влагоемкости исследованных ионных форм мембраны МК-40 (рис. 5, кривая 1).
Рис. 5.
Зависимости концентрации сорбированного электролита (1) и константы Доннана (2) от удельной влагоемкости исследованных ионных форм мембраны МК-40.
С целью упрощения процедуры нахождения KD, авторы работы [14] предложили проводить эксперимент по сорбции при одной концентрации электролита, выбранной в интервале 1–1.5 моль-экв/л, а параметр f2 определять из данных по электропроводности мембраны. Расчет KD в этом случае выполняется по уравнению (3), приведенному к виду
(9)
$K_{{\text{D}}}^{{\left| {{{z}_{2}}} \right|}} = \frac{{\left( {C{\text{*}} - {{f}_{2}}C} \right){{{\bar {Q}}}^{{^{{\left| {{{{{z}_{2}}} \mathord{\left/ {\vphantom {{{{z}_{2}}} {{{z}_{1}}}}} \right. \kern-0em} {{{z}_{1}}}}} \right|}}}}}}}{{{{f}_{1}}{{C}^{{1\,\, + \,\,\left| {{{{{z}_{2}}} \mathord{\left/ {\vphantom {{{{z}_{2}}} {{{z}_{1}}}}} \right. \kern-0em} {{{z}_{1}}}}} \right|}}}}}.$Результаты вычислений KD по уравнению (9) для концентрации раствора, равной 1 моль-экв/л, приведены в последней колонке табл. 3. Сопоставление результатов расчетов, выполненных двумя способами: по уравнениям (4) или (5) и по уравнению (9), – показало, что они совпадают с достаточной степенью точности для всех солевых форм мембраны МК-40. Исключение представляет H+-форма мембраны, для которой в случае подстановки в уравнение (9) значения параметра f2, найденного из данных по удельной электропроводности, получаются значения KD, которые значительно отличаются от значений, найденных из сорбционных экспериментов. Это связано с завышенным значением параметра f2 из-за особого механизма переноса протона. По-видимому, адекватный расчет и объемной доли равновесного раствора в фазе мембраны, и, как следствие, константы Доннана для катионообменной мембраны в растворах кислот невозможен. В то же время упрощенный подход к расчету константы Доннана можно успешно использовать для всех солевых форм мембраны.
ЗАКЛЮЧЕНИЕ
Необменная сорбция электролитов различной природы сульфокатионитовой мембраной МК-40 исследована кондуктометрическим методом без разделения фаз раствора и мембраны. Обнаружено, что наиболее высокие значения концентрации сорбированного электролита наблюдаются при сорбции мембраной раствора хлорида бария из-за специфического взаимодействия сульфогрупп мембраны с ионами бария.
Полученные экспериментальные данные использованы для оценки показателя степени в уравнении Глюкауфа для мембраны МК-40 в растворах хлорида и гидроксида натрия, соляной кислоты и хлоридов магния, кальция и бария. Проанализирована возможность применения этого параметра для оценки неоднородности сульфокатионитовых ионообменных мембран, и показано, что более адекватно неоднородность мембран может быть охарактеризована с помощью параметра, представляющего собой объемную долю равновесного раствора в фазе мембраны. Объемные доли фазы геля и фазы равновесного раствора в мембране определены двумя способами: из экспериментальных данных по удельной электропроводности мембраны в растворах различной природы и концентрации и данных по необменной сорбции.
Выполнен расчет константы Доннана KD в рамках двухфазной микрогетерогенной модели строения ионообменной мембраны, и показано, что для всех исследованных растворов электролитов, за исключением раствора хлорида бария, величина KD для мембраны МК-40 меньше 1. Показана возможность расчета KD в растворах солей упрощенным способом на основании экспериментальных данных по сорбции этих растворов мембраной только при одной концентрации электролита 1 моль-экв/л при условии известных значений объемных долей проводящих фаз. Выявлены ограничения в возможности корректного определения объемных долей проводящих фаз микрогетерогенной модели и, как следствие, величины KD, в растворах кислот, связанные с особым механизмом переноса протона.
Список литературы
Glueckauf E. // Proc. Royal Soc. A: Math. Phys. Eng. Sci. 1962. V. 268. P. 350.
Гельферих Ф. Иониты. М.: Иностр. литература, 1962.
Кокотов Ю.А., Пасечник В.А. Равновесие и кинетика ионного обмена. Л.: Химия, 1970.
Гриссбах Р. Теория и практика ионного обмена. М.: Иностр. литература, 1963.
Galizia M., Benedetti F.M., Paul D.R., Freeman B.D. // J. Membr. Sci. 2017. V. 535. P. 132.
Gimmi T., Alt-Epping P. // Geochim. Cosmochim. Acta. 2018. V. 232. P. 1.
Galama A.H., Post J.W., Cohen Stuart M.A., Biesheuvel P.M. // J. Membr. Sci. 2013. V. 442. P. 131.
Chang K., Luo H., Geise G.M. // J. Membr. Sci. 2019. V. 574. P. 24.
Заболоцкий В.И., Никоненко В.В. Перенос ионов в мембранах. М.: Наука, 1996.
Zabolotsky V.I., Nikonenko V.V. // J. Membr. Sci. 1993. V. 79. P. 181.
Заболоцкий В.И., Лебедев К.А. // Электрохимия. 1989. Т. 25. С. 905.
Заболоцкий В.И., Лебедев К.А., Никоненко В.В., Шудренко А.А. // Электрохимия. 1993. Т. 29. С. 811.
Заболоцкий В.И., Гнусин Н.П., Шеретова Г.М. // Журн. физ. химии. 1985. Т. 59. С. 2467.
Заболоцкий В.И., Никоненко В.В., Костенко О.Н., Ельникова Л.Ф. // Журн. физ. химии. 1993. Т. 67. С. 2423.
ГОСТ 17 552-72. Мембраны ионообменные. Методы определения полной и равновесной обменной емкости. Введен 16.02.72. М.: Изд-во стандартов, 1972.
Berezina N.P., Kononenko N.A., Dyomina O.A., Gnusin N.P. // Adv. Colloid Interface Sci. 2008. V. 139. P. 3.
Гнусин Н.П., Демина О.А., Шеретова Г.М. // Журн. физ. химии. 1998. Т. 72. С. 918.
Брык М.Т., Заболоцкий В.И., Атаманенко И.Д., Дворкина Г.А. // Химия и технология воды. 1989. Т. 11. С. 497.
Tuan L.X., Buess-Herman C. // Chem. Phys. Lett. 2007. V. 434. P. 49.
Демина О.А., Кононенко Н.А., Фалина И.В., Демин А.В. // Коллоид. журн. 2017. Т. 79. С. 259.
Гнусин Н.П., Карпенко Л.В., Демина О.А., Березина Н.П. // Журн. физ. химии. 2001. Т. 75. С. 1697.
Falina I.V., Zabolotsky V.I., Demina O.A., Sheldeshov N.V. // J. Membr. Sci. 2019. V. 573. P. 520.
Koter S., Piotrowski P., Kerres J. // J. Membr. Sci. 1999. V. 153. P. 83.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


