Коллоидный журнал, 2020, T. 82, № 2, стр. 171-176
Инверсия ионообменных свойств монтмориллонита
Т. В. Конькова 1, *, А. П. Рысев 1
1 Российский химико-технологический университет им. Д.И. Менделеева
125480 Москва, ул. Героев Панфиловцев, д. 20, корп. 1, Россия
* E-mail: kontat@list.ru
Поступила в редакцию 17.07.2019
После доработки 20.08.2019
Принята к публикации 26.08.2019
Аннотация
Исследован механизм модифицирования монтмориллонита метасиликатом натрия с целью инверсии его ионообменных свойств. Блокирование межслоевого пространства монтмориллонита аморфными кремнекислородными кластерами, которые образуются в результате гидролиза метасиликата натрия, приводит к затруднению доступа ионов к внутренней отрицательно заряженной поверхности минерала, а также к увеличению силы связи между алюмосиликатными слоями. В результате адсорбция становится возможна только на наружной поверхности частиц, а именно на активных силанольных и алюминольных группах, что подтверждается высокой скоростью процесса, а также появлением способности адсорбировать анионы только при изменении знака заряда поверхности монтмориллонита. Величина адсорбции оксоанионов Cr(VI) модифицированным монтмориллонитом составила 0.26–1.05 мг/г в зависимости от условий получения образцов.
ВВЕДЕНИЕ
В структуре природного слоистого алюмосиликата монтмориллонита содержатся две группы активных центров, обуславливающих его способность адсорбировать как катионы, так и анионы [1]. Адсорбция катионов происходит по механизму ионного обмена, путем замещения межслоевых катионов щелочных или щелочноземельных металлов, компенсирующих отрицательный заряд алюмосиликатных слоев, на эквивалентное количество катионов адсорбтива [2–4]. Отрицательный заряд внутренней поверхности связан с изоморфным замещением алюминия на металл с меньшей валентностью в структуре трехслойных пакетов минерала.
Адсорбция анионов монтмориллонитом потенциально возможна благодаря алюминольным и силанольным группам, расположенным на боковой поверхности алюмосиликатных слоев (рис. 1). Эти группы способны нести отрицательный или положительный заряд в зависимости от pH среды [5]. Вследствие способности межслоевых катионов к гидратации межслоевое расстояние увеличивается и частицы монтмориллонита расслаиваются в водной среде на элементарные алюмосиликатные слои или их агрегаты. Площадь боковых граней частиц мала по сравнению с площадью базальной отрицательно заряженной поверхности, которая становится легкодоступной адсорбтиву после расслаивания. В результате поверхность частиц монтмориллонита несет суммарный отрицательный заряд даже при низких значениях pH, при этом анионы отталкиваются от нее [6, 7].
Рис. 1.
Заряды силанольных/алюминольных групп на боковой поверхности алюмосиликатных слоев в зависимости от рН.
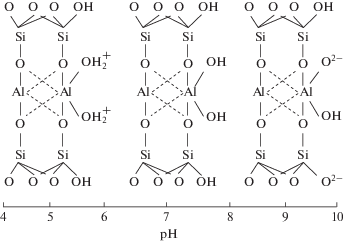
Замещая неорганические межслоевые катионы монтмориллонита на органические катионы солей четвертичных аммониевых соединений, можно добиться гидрофобизации поверхности и уменьшить расслаивание частиц в воде [8]. Одновременное блокирование доступа в межслоевое пространство молекулами модификатора приводит к тому, что доступной для адсорбтива остается лишь наружная поверхность с расположенными на ней силанольными и алюминольными группами. Заряд поверхности модифицированного таким способом монтмориллонита меняет знак на положительный, и материал приобретает способность адсорбировать анионы [9–11]. Недостатком этого способа модифицирования является нестабильность органоминеральной структуры адсорбента вследствие постепенного вымывания органического модификатора в раствор [8, 11].
Значительно более стабильными по утверждению авторов [12] должны являться пилларированные структуры, в которых в межслоевое пространство монтмориллонита встроены кремнекислородные столбцы, родственные по химической структуре Т-сеткам трехслойных пакетов глины и способные препятствовать его расслаиванию, прочно удерживая алюмосиликатные слои вместе.
В представленной работе исследована возможность блокировать доступ адсорбтива к внутренней отрицательно заряженной поверхности монтмориллонита, заполнив его межслоевое пространство аморфным кремнегелем, используя для этой цели концентрированные растворы метасиликата натрия вместо разбавленных, а также суспензии с высоким соотношением SiO2 : монтмориллонит. Целью работы являлся синтез и исследование адсорбента с анионообменными свойствами на основе монтмориллонита.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектом модифицирования являлся природный алюмосиликат Таганского месторождения (Казахстан) с содержанием монтмориллонита 90%.
Для модифицирования навески глины с размером частиц <500 мкм смешивали с водными растворами метасиликата натрия с концентрацией от 5 до 20 мас. %. Содержание SiO2 в смеси с монтмориллонитом варьировали от 10 до 80 мас. %. Полученные суспензии перемешивали от 2 до 5 ч при температуре 20 или 60°C. После отделения от раствора метасиликата натрия, твердую фазу дважды промывали дистиллированной водой и подвергали обработке раствором H2SO4 с pH, равным 1 или 5.5. Соотношение твердая фаза : кислота составляло во всех случаях 1 : 25. Образец А дополнительно промывали водой после кислотной обработки. Материал подвергали старению на воздухе в течение 12 ч при комнатной температуре и прокаливали в течение 3 ч при Tcalc = 200 или 400°C. Условия приготовления образцов приведены в табл. 1. Образец В прокаливали сразу после кислотной обработки. Для приготовления образца Н исходный алюмосиликат подвергали механоактивации на лабораторной мельнице в течение 20 мин.
Таблица 1.
Условия модифицирования монтмориллонита метасиликатом натрия
| Образец | A | Б | В | Г | Д | Е | Ж | З | И | К | Л | М | Н |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ${{C}_{{{\text{N}}{{{\text{a}}}_{2}}{\text{Si}}{{{\text{O}}}_{3}}}}}$, мас. % | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 10 | 5 | 20 |
| SiO2, мас. % | 80 | 80 | 80 | 80 | 80 | 80 | 80 | 80 | 30 | 10 | 80 | 80 | 80 |
| tmod, ч | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 5 | 2 | 2 | 2 | 2 | 2 |
| Tmod, °C | 20 | 20 | 20 | 20 | 20 | 20 | 60 | 20 | 20 | 20 | 20 | 20 | 20 |
| Промывка № 1 | Да | Да | Да | Да | Да | Нет | Да | Да | Да | Да | Да | Да | Да |
| рН кислоты | 1 | 1 | 1 | 1 | 5.5 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Промывка № 2 | Да | Нет | Нет | Нет | Нет | Нет | Нет | Нет | Нет | Нет | Нет | Нет | Нет |
| Старение | Да | Да | Нет | Да | Да | Да | Да | Да | Да | Да | Да | Да | Да |
| Tcalc, °C | 200 | 200 | 200 | 400 | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 |
Текстурные параметры полученных образцов были определены на основе изотерм адсорбции азота, измеренных при 77 К на приборе Nova 1200e (Quantachrome, США). Удельная поверхность (SBET) исходного монтмориллонита и его модифицированных образцов были вычислены методом БЭТ, объем микропор Vmi – по уравнению Дубинина–Радушкевича; суммарный объем мезо- и микропор Vs определяли по изотерме адсорбции азота при значении относительного давления, равном 0.995.
Электрокинетический потенциал поверхности частиц исходного монтмориллонита и модифицированных образцов был измерен методом электрофореза на приборе Zetasizer Nano (Malvern Instruments, Великобритания) в водной суспензии с концентрацией твердой фазы 0.5 г/л.
Катионообменную емкость образцов измеряли при помощи обменной реакции с этилендиаминовым комплексом меди, [Cu(en)2]2+, при pH 8 с использованием буферного раствора состава трис(оксиметил)аминометан–HCl (0.9 : 1) [13].
Рентгенофазовый анализ проводили на дифрактометре D8 ADVANCE (Bruker AXS, Германия) при напряжении на трубке 40 кВ и силе тока 30 мА, используя CuKα-излучение (λ = 1.5418 Å), в диапазоне углов 2θ = 5°–30° с шагом 0.0074°.
ИК-спектры образцов регистрировали с помощью фурье-спектрометра Nicolet 380 (Thermo Fisher Scientific Inc., США) в диапазоне 4000–400 см–1. Разрешающая способность прибора – 4 см–1, количество сканирований – 32.
Элементный анализ образцов был проведен на приборе INCA Energy Analyzer (Oxford Instruments) методом рентгеновской флуоресценции.
Исследования адсорбционной способности образцов глины в отношении анионов были выполнены на примере оксоанионов Cr(VI). 0.1 г каждого образца помещали в 25 мл водного раствора бихромата калия с начальной концентрацией Сr(VI) 5 мг/л. Содержание оксоанионов Cr(VI) в растворе после адсорбции определяли спектрофотометрически по поглощению окрашенного комплекса хрома с 1,5-дифенилкарбазидом на длине волны 540 нм [15].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Практически все модифицированные метасиликатом натрия образцы монтмориллонита приобрели способность адсорбировать анионы, в отличие от исходного минерала (табл. 2). Величина адсорбции оксоанионов Cr(VI) зависит от рН среды. Чем ниже значение рН, тем больше величина адсорбции, и наоборот. Это свидетельствует о том, что центрами адсорбции являются силанольные и алюминольные группы на наружной боковой поверхности алюмосиликатных слоев, поскольку они являются единственными зависящими от pH центрами в структуре монтмориллонита.
Таблица 2.
Адсорбция оксоанионов Cr(VI) исходным и модифицированными образцами монтмориллонита при различных значениях рН
| Образец | Адсорбция, мг/г | Образец | Адсорбция, мг/г | ||||
|---|---|---|---|---|---|---|---|
| рН 3 | рН 7 | рН 10 | рН 3 | рН 7 | рН 10 | ||
| Исходный | 0.07 | 0 | 0 | Ж | 1.07 | 0.84 | 0.61 |
| А | 0.39 | 0.31 | 0.21 | З | 0.84 | 0.79 | 0.42 |
| Б | 1.24 | 0.98 | 0.69 | И | 0.43 | 0.34 | 0.24 |
| В | 0.47 | 0.39 | 0.28 | К | 0.41 | 0.33 | 0.25 |
| Г | 0.8 | 0.68 | 0.47 | Л | 0.68 | 0.57 | 0.46 |
| Д | 0.12 | 0 | 0 | М | 0.54 | 0.42 | 0.35 |
| Е | 0.29 | 0.26 | 0.23 | Н | 1.38 | 1.05 | 0.91 |
Адсорбция на наружной поверхности монтмориллонита подтверждается также значениями параметров текстуры модифицированных образцов, которые претерпевают значительное уменьшение по сравнению с исходными (табл. 3). Ухудшение текстуры, а именно значительное снижение объема микропор обусловлено образованием кремнекислородных кластеров, блокирующих межслоевое пространство частиц монтмориллонита в результате его обработки метасиликатом натрия.
Таблица 3.
Параметры текстуры исходного и модифицированных образцов монтмориллонита
| Образец | SBET, м2/г | Vs, см3/г | Vmi, см3/г | Образец | SBET, м2/г | Vs, см3/г | Vmi, см3/г |
|---|---|---|---|---|---|---|---|
| Исходный | 73.6 | 0.075 | 0.035 | Ж | 2.8 | 0.010 | 0.002 |
| А | 10.8 | 0.037 | 0.004 | З | 6.1 | 0.021 | 0.002 |
| Б | 2.8 | 0.013 | 0.001 | И | 14.4 | 0.035 | 0.006 |
| В | 19.7 | 0.049 | 0.008 | К | 14.9 | 0.014 | 0.007 |
| Г | 14.9 | 0.029 | 0.006 | Л | 7.16 | 0.018 | 0.003 |
| Д | 49.4 | 0.056 | 0.022 | М | 8.9 | 0.028 | 0.004 |
| Е | 17.1 | 0.023 | 0.006 | Н | 2.7 | 0.011 | 0.001 |
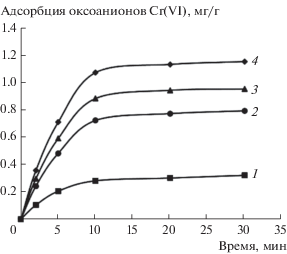
Если бы адсорбция ионов происходила на внутренней поверхности монтмориллонита, ее скорость была бы незначительна из-за сильного внутридиффузионного сопротивления. Однако скорость адсорбции высока (рис. 2), при этом адсорбционное равновесие достигается за 15–20 мин контакта фаз. Кроме того, чем меньше становились значения текстурных параметров модифицированного монтмориллонита, тем выше было значение адсорбции. Следовательно, чем полнее экранирована для адсорбтива внутренняя отрицательно заряженная поверхность монтмориллонита, тем выше его способность адсорбировать анионы.
Рис. 2.
Кинетические кривые адсорбции оксоанионов Cr(VI) на модифицированных образцах монтмориллонита И (1), Ж (2), Б (3), Н (4).
Способность модифицированных образцов монтмориллонита адсорбировать анионы связана с величиной и знаком электрокинетического потенциала поверхности их частиц (табл. 4). Оксоанионы Cr(VI) адсорбировались лишь теми образцами, у которых произошла перезарядка поверхности.
Таблица 4.
Электрокинетический потенциал поверхности частиц исходного и модифицированных образцов монтмориллонита при рН 7
| Образец | ζ-Потенциал, мВ | Образец | ζ-Потенциал, мВ |
|---|---|---|---|
| Исходный | –23.8 | Ж | +4.9 |
| А | +1.8 | З | +3.7 |
| Б | +6.9 | И | +3.1 |
| В | +2.5 | К | +1.7 |
| Г | +4.6 | Л | +3.6 |
| Д | –11.8 | М | +2.9 |
| Е | +0.8 | Н | +10.7 |
Прослеживается связь между изменением параметров текстуры модифицированного монтмориллонита и величиной/знаком электрокинетического потенциала поверхности его частиц. Чем меньше значения этих параметров, тем больше положительный сдвиг ζ-потенциала.
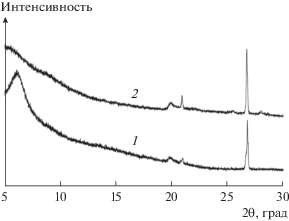
По данным рентгенофазового анализа (рис. 3) в результате модифицирования происходит увеличение межплоскостного (межслоевого) расстояния в монтмориллоните, что сопровождается сдвигом характерного пика при 2θ = 6.5° в область малых углов. Эта тенденция характерна для всех модифицированных образцов. Отсутствие на дифрактограммах модифицированных образцов новых дифракционных пиков свидетельствует, что образовавшиеся кремнекислородные кластеры имеют аморфную структуру. Это позволяет объяснить зависимость величины адсорбции анионов от условий получения образца с позиции золь–гель процесса образования силикагеля. Дифракционный пик при 2θ = 26.7° соответствует наличию примеси кварца в природном алюмосиликате.
Рис. 3.
Рентгеновские дифрактограммы исходного монтмориллонита (1) и модифицированного образца Б (2).
Адсорбционная способность модифицированного монтмориллонита в отношении анионов возрастает вместе с увеличением концентрации модифицирующего раствора метасиликата натрия (сравните образцы Б, Л, М и Н), а также содержания SiO2 в смеси с глиной (сравните образцы Б, И, К и Н). Следовательно, чем выше содержание “блокирующего” агента, тем лучше экранирована внутренняя отрицательно заряженная поверхность алюмосиликата и тем соответственно больше величина адсорбции анионов. Продолжительность и температура обработки монтмориллонита раствором метасиликата натрия (в исследованных диапазонах этих параметров) не оказывают существенного воздействия на конечный результат (сравните образцы Б, Ж и З). Вероятно, двух часов достаточно для заполнения порового пространства монтмориллонита раствором метасиликата натрия. Отметим также, что увеличение времени (tmod) и температуры (Tmod) модифицирования способствует расслаиванию частиц минерала.
Суспензия монтмориллонита с метасиликатом натрия имеет pH 11. Кислотная обработка материала без предварительной промывки (быстрое снижение pH) приводит к образованию большого количества зародышей новой твердой фазы, которые, однако, не успевают вырасти, в результате чего крупные поры монтмориллонита блокируются не полностью (образец Е).
При понижении рН до 5.5 без последующей кислотной обработки (образец Д) образуются сравнительно большие частицы силикагеля, которые не способны блокировать микропоры монтмориллонита. Известно также, что точка нулевого заряда монтмориллонита находится в нейтральной области значений pH [5], и понижение pH до 5.5 не приводит к протонированию наружных силанольных и алюминольных групп.
Следовательно, понижение pH нужно проводить поэтапно, сначала промывкой материала, а затем кислотной обработкой, в результате чего образуются наночастицы силикагеля различного диаметра (1–20 нм), которые блокируют все межслоевое пространство монтмориллонита. Образцы, подвергнутые промывке до кислотной обработки, лучше всего адсорбировали оксоанионы Cr(VI).
Важность стадии старения модифицированного монтмориллонита объясняется явлением синерезиса, в процессе которого формируется окончательная структура кремнекислородных кластеров (сравните образцы Б и В).
Чем выше дисперсность частиц глины, тем большая доля их суммарной поверхности приходится на боковые грани алюмосиликатных слоев, содержащие алюминольные и силанольные группы. Таким образом, измельчение частиц, в нашем случае механоактивация, приводит к положительному результату (сравните образцы Б и Н).
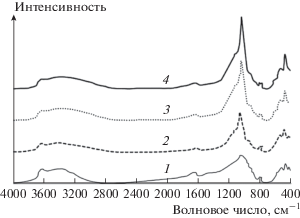
На ИК-спектрах (рис. 4) исходного и модифицированных образцов присутствует ряд полос, типичных для монтмориллонита, а также сопутствующих ему примесей [14, 15]. Слабая полоса при 797 см–1 соответствует примеси кварца. Полосы при 3430 см–1 (валентные колебания групп Н–О–Н) и около 1642 см–1 (деформационные колебания групп Н–О–Н) характерны для адсорбционной воды. Их интенсивность уменьшается на спектрах всех модифицированных образцов вследствие термической дегидратации. Широкая полоса с максимумом при 3630 см–1 соответствует валентным колебаниям Al,Mg–OH. Ее интенсивность незначительно снижается после модифицирования в результате кислотной обработки минерала [16]. Основные изменения в спектрах модифицированных образцов наблюдаются при 1040 см–1 (валентные колебания Si–O), 520 см–1 (деформационные колебания Al–O–Si), а также при 466 см–1 (деформационные колебания Si–O–Si). Интенсивность этих полос у всех модифицированных образцов увеличивается по сравнению с исходным алюмосиликатом. Эти изменения обусловлены образованием в межслоевом пространстве монтмориллонита кремнекислородных кластеров, структура которых родственна тетраэдрам Si–O–Si монтмориллонита. Интенсивность указанных полос становится тем выше, чем больше были концентрация раствора метасиликата натрия и его содержание в системе.
Характерной особенностью модифицированных образцов монтмориллонита является уменьшение их катионообменной емкости по сравнению с исходным минералом (табл. 5), причем тем более сильное, чем меньше становились значения текстурных параметров.
Таблица 5.
Катионообменная емкость исходного и модифицированных образцов монтмориллонита
| Образец | Катионообменная емкость, смоль/кг | Образец | Катионообменная емкость, смоль/кг |
|---|---|---|---|
| Исходный | 82 | Ж | 14.6 |
| А | 29.4 | З | 19.0 |
| Б | 6.8 | И | 31.7 |
| В | 21.8 | К | 35.6 |
| Г | 11.4 | Л | 12.2 |
| Д | 68.4 | М | 14.8 |
| Е | 44.8 | Н | 5.6 |
Согласно данным элементного анализа, суммарное содержание обменных катионов (Ca + Na) после модифицирования остается практически неизменным, около 1.20 мас. %, что может свидетельствовать об их блокировании в межслоевом пространстве монтмориллонита кремнекислородными кластерами.
Таким образом, в результате обработки раствором метасиликата натрия происходит инверсия ионообменных свойств монтмориллонита.
ВЫВОДЫ
Монтмориллонит, обработанный концентрированным раствором метасиликата натрия, приобретает способность к адсорбции анионов, что связано с перераспределением их доступа к различным типам поверхности минерала. Его внутренняя отрицательно заряженная поверхность блокируется аморфными кремнекислородными кластерами, образующимися в межслоевом пространстве в процессе модифицирования. Доступной для анионов остается внешняя боковая поверхность алюмосиликатных слоев с расположенными на ней алюминольными и силанольными группами, выступающими в качестве центров адсорбции. Эти выводы подтверждаются высокой скоростью адсорбции, зависимостью ее величины от pH, а также появлением у монтмориллонита способности адсорбировать анионы только при изменении знака электрокинетического потенциала его поверхности с отрицательного на положительный.
Список литературы
Schoonheydt R.A., Johnston C.T. Handbook of Clay Science / Ed. by Bergaya F., Theng B.K.G., Lagaly G. Elsevier, 2006. V. 1.
Ijagbemi C.O., Dong-Su K. // Environ. Eng. Res. 2009. V. 14. № 1. P. 26.
Ihaddadene B., Sehkri L., Tifouti L., Al-Dujaili A.H., Gherraf N. // J. ChemTech Research. 2016. V. 9. P. 667.
Gu S., Kang X., Wang L., Lichtfouse E., Wang C. // Environ. Chem. Lett. 2019. V. 17. P. 629.
Lagaly G. Handbook of Clay Science / Ed. by Ber-gaya F., Theng B.K.G., Lagaly G. Elsevier, 2006. V. 1.
Fil B.A., Özmetin C., Korkmaz M. // Bulg. Chem. Commun. 2014. V. 46. P. 258.
Lin S.-H., Juang R.-S. // J. Hazard. Mater. 2002. V. 92. P. 315.
Конькова Т.В., Рысев А.П., Мищенко Е.В. // Перспективные материалы (в печати).
Sarkar B., Xi Y., Megharaj M., Krishnamurti G.S.R., Rajarathnam D., Naidu R. // J. Hazard. Mater. 2010. V. 183. P. 87.
Muir B., Andrunik D., Hyla J., Bajda T. // Appl. Clay Sci. 2017. V. 136. P. 8.
Atia A.A. // Appl. Clay Sci. 2008. V. 41. P. 73.
Комаров В.С., Бесараб С.В. Адсорбенты и носители катализаторов. Научные основы регулирования пористой структуры. М.: ИНФРА-М, 2018.
Ammann L., Bergaya F., Lagaly G. // Clay Minerals. 2005. V. 40. P. 441.
Плюснина И.И. Инфракрасные спектры минералов. М.: Изд-во Моск. Университета, 1977.
Chukanov N.V. Infrared Spectra of Mineral Species. N.Y.: Springer, 2014. V. 1.
Temuujin J., Jadamba Ts., Burmaa G., Erdenechimeg Sh., Amarsanaa J., MacKenzie K.J.D. // Ceram. Int. 2004. V. 30. P. 251.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал