Коллоидный журнал, 2020, T. 82, № 2, стр. 252-260
Безэмульгаторная эмульсионная сополимеризация метилметакрилата как метод получения катионных частиц для диагностики вируса клещевого энцефалита
Н. Н. Шевченко 1, *, Г. А. Панкова 1, Б. М. Шабсельс 1, С. Г. Лаишевкина 1, В. А. Байгильдин 2
1 Институт высокомолекулярных соединений Российской академии наук
199004 Санкт-Петербург,
Большой просп., 31, Россия
2 Санкт-Петербургский государственный университет, химический факультет
198504 Санкт-Петербург, Петергоф, Университетский просп., 26, Россия
* E-mail: natali.shevchenko29@gmail.com
Поступила в редакцию 16.09.2019
После доработки 07.10.2019
Принята к публикации 12.10.2019
Аннотация
Методом одностадийной безэмульгаторной сополимеризации метилметакрилата и гидрохлорида 2-аминоэтилметакрилата в присутствии сшивающих агентов (диметакрилата этиленгликоля, N,N'-метиленбисакриламида) синтезированы сшитые катионные частицы диаметром от 150 до 300 нм. Выявлены факторы, позволяющие регулировать морфологию и степень дисперсности образующихся частиц. Показано, что дисперсии частиц остаются агрегативно устойчивыми в физиологических растворах, а также после сорбции биологически активных молекул. Синтезированные частицы могут эффективно выявлять вирус клещевого энцефалита методом реакции латекс-агглютинации, при этом длительность анализа не превышает 10 минут.
ВВЕДЕНИЕ
В последние несколько десятилетий катионные полимерные частицы, полученные различными методами гетерофазной полимеризации, нашли широкое применение в биотехнологии и медицине, например, для иммуноанализа, систем доставки лекарств, очистки антител и разделения клеток [1–4]. Использование в иммуноанализе катионных полимерных частиц обусловлено агрегативной устойчивостью их дисперсий в физиологических средах при pH ниже 7 как до, так и после адсорбции биологически активных веществ [5–9].
В большинстве статей для получения катионных полимерных частиц рассматривается метод эмульсионной полимеризации [10–12]. Это связано с высокой конверсией мономеров, возможностью добавлять мономеры в реактор в процессе полимеризации и получать частицы субмикронного диапазона. Однако существует один существенный недостаток метода эмульсионной полимеризации. Поверхностно-активные вещества, добавляемые в реакционную смесь, локализуются в поверхностном слое частиц и тем самым уменьшают концентрацию поверхностных функциональных групп, которые обеспечивают прохождение специфических реакций в поверхностном слое частиц. Более приемлемым подходом является метод безэмульгаторной эмульсионной полимеризации. Очевидными его преимуществами являются отсутствие эмульгатора в реакционной системе и возможность получения монодисперсных частиц заданного диаметра.
В настоящее время существует несколько подходов к получению катионных полимерных частиц методом безэмульгаторной эмульсионной полимеризации. Первый подход фокусируется на синтезе частиц с использованием катионных мономеров с вторичными или третичными аминогруппами [13, 14] и винилпиридиниевыми группами [15–17]. В этом случае положительный заряд на поверхности частицы образуется только за счет катионных сомономеров. Второй подход заключается в применении двухстадийного синтеза частиц, при этом алифатические аминогруппы формируются на второй стадии в процессе гидролиза N-винилформамида [18] или винилбензилхлорида [12, 19].
В поисках новых подходов к синтезу катионных частиц с поверхностными алифатическими аминогруппами мы разработали простой одностадийный метод безэмульгаторной эмульсионной сополимеризации метилметакрилата (ММА) и гидрохлорида 2-аминоэтилметакрилата (АМГХ) в присутствии сшивающего агента (диметакрилата этиленгликоля (ДМЭГ) или N,N'-метиленбисакриламида (МБА) ). Метилметакрилат был выбран в качестве основного сомономера из-за меньшей его гидрофобности по сравнению со стиролом, что снижает неспецифическое взаимодействие с биологически активными веществами (БАВ) [20]. Гидрохлорид 2-аминоэтилметакрилата имеет в своей структуре алифатическую аминогруппу, которая позволяет химически связывать белки с поверхностью частиц. Как было показано ранее [21], сшивающий агент обеспечивает постоянство структуры и формы частиц при изменении pH, состава среды или температуры.
В настоящей работе изучены влияние природы сшивающего агента на полимеризацию метилметакрилата и гидрохлорида 2-аминоэтилметакрилата и электроповерхностные свойства сформированных частиц. Частицы детально охарактеризованы с помощью динамического и статического рассеяния света и просвечивающей электронной микроскопии; концентрация поверхностных функциональных групп определена методом кондуктометрического титрования. Кроме того, исследовано влияние природы сшивающего агента на кинетику сополимеризации, а также показана принципиальная возможность использования синтезированных частиц в качестве носителей БАВ при выявлении антител вирусного клещевого энцефалита (ВКЭ) с помощью реакции латекс-агглютинации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Синтез полимерных частиц проводили с использованием в качестве мономеров метилметакрилата (98%, Aldrich), очищенного вакуумной перегонкой по стандартной методике, и 2-аминоэтилметакрилата гидрохлорида (Sigma Aldrich). Сшивающими агентами служили диметакрилат этиленгликоля (98%, Aldrich) или N,N'-метиленбисакриламид (99%, Amersco, США), не подвергавшиеся дополнительной очистке. В качестве инициатора полимеризации использовали 2,2'-азо-бис[2-(2-имидозалин-2-ил)пропан] дигидрохлорид (АИП) (Wako Pure Chemical Industries, Япония). Для приготовления растворов и проведения гетерофазной полимеризации использовали бидистиллированную воду. Гидрохинон, N,N-диметилформамид и толуол (все от ООО “ВЕКТОН”) были марки “х. ч.”.
Отрицательно заряженные частицы полистирола (ПСт) с поверхностными карбоксильными группами были использованы в качестве образца сравнения для проведения реакции латекс-агглютинации (РЛА) при выявлении ВКЭ. Они были синтезированы ранее [21] и имели следующие характеристики: диаметр 400 нм, индекс полидисперсности PDI = 0.02, дзета-потенциал –48.1 мВ.
Антигены ВКЭ, инактивированные формалином, сыворотка антител (положительный контроль) и сыворотка, не содержащая антител против ВКЭ (отрицательный контроль), были приобретены у АО “Вектор-Бест” (Новосибирск). Молекулярная масса антигенов составляла 55 000 Да.
Синтез сшитых катионных полимерных частиц
Синтез полимерных частиц проводили в продутом аргоном стеклянном реакторе, снабженном механической мешалкой (скорость перемешивания около 400 об./мин), обратным холодильником, термометром и приспособлением для подачи инертного газа. Дисперсионной средой служила бидистиллированная деионизованная вода. Условия синтеза приведены в табл. 1. Частицы сополимера П(MMA-АМГХ), синтезированы в отсутствие сшивающих агентов (опыт 1а), частицы П(MMA-АМГХ-ДМЭГ) получены в присутствии сшивающего агента ДМЭГ, а частицы П(MMA-АМГХ-МБА) – в присутствии сшивающего агента МБА. Температуру в процессе синтеза поддерживали при помощи водяной бани. Смесь мономеров АМГХ, ММА и ДМЭГ растворяли в 10 мл воды и переносили в трехгорлую колбу, содержащую 80 мл воды. Затем реакционную систему дегазировали при постоянном перемешивании в течение 20 мин под током аргона и нагревали до 70°C. После этого в реакционную систему добавляли инициатор, растворенный в 10 мл воды. Реакцию сополимеризации проводили при температуре Tp = 70 или 80°C и перемешивании в течение 25 мин.
Таблица 1.
Условия синтеза катионных полимерных частиц
| № опыта | Условия сополимеризации | Диаметр, нм | PDI* | Гель-фракция, мас. % | [NH2 + COOH], мкмоль/м2 | Коагулюм, мас. % | |||
|---|---|---|---|---|---|---|---|---|---|
| состав смеси мономеров, мас. % |
Tp, °С | pH0 | ПЭМ | ДРС | |||||
| ММА : АМГХ : ДМЭГ | |||||||||
| 1а | 97 : 3 : 0 | 70 | 3.4 | 240 | 330 | 0.12 | 0 | 0.15 | |
| 2а | 96 : 3 : 1 | 3.4 | 240 | 320 | 0.08 | 22 | 0.27 | ||
| 3а | 94 : 3 : 3 | 3.4 | 250 | 295 | 0.02 | 77 | 1.6 | ||
| 4а | 93 : 3 : 4 | 3.3 | 280 | 320 | 0.05 | 82 | 1.1 | ||
| 5а | 92 : 3 : 5 | 3.2 | 270 | 305 | 0.01 | 93 | 0.92 | 0.24 | |
| 6а | 92 : 3 : 5 | 80 | 3.3 | 205 | 250 | 0.03 | 92 | 0.77 | 0 |
| ММА : АМГХ : МБА | |||||||||
| 1м | 96.8 : 3.1 : 0.1 | 70 | 3.3 | 160 | 195 | 0.01 | 5 | 1.06 | 0 |
| 2м | 96.6 : 3.1 : 0.3 | 3.3 | 200 | 245 | 0.04 | 25 | 1.29 | ||
| 3м | 96.3 : 3.1 : 0.6 | 3.3 | 180 | 225 | 0.01 | 40 | 0.99 | ||
| 4м | 95.9 : 3.1 : 1.0 | 3.4 | 155 | 190 | 0.01 | 57 | 0.88 | ||
| 5м | 96.8 : 3.0 : 5.0 | 3.3 | – | – | – | – | 75 | ||
Полученные частицы очищали от непрореагировавших мономеров перегонкой с водяным паром при 100°C, а от водорастворимых примесей – последовательным трехкратным центрифугированием (10 000 об./мин, 30 мин) и редиспергированием в деионизированной воде. Сухой остаток (С.О.) определяли методом гравиметрического анализа. Для этого определенный объем латекса (1 мл) высушивали до постоянной массы.
Диаметр полимерных частиц определяли в просвечивающем электронном микроскопе (ПЭМ) JEM 100 S (JEOL, Япония). Для этого капли их дисперсий наносили на формваровые подложки, обработанные 1% раствором додецилсульфата натрия, и позволяли им полностью высохнуть. На ПЭМ-изображениях измеряли диаметр 100–500 частиц с помощью лупы, оснащенной 0.1 мм шкалой.
Определение диаметра и ζ-потенциала частиц методом динамического рассеяния света
Методом динамического рассеяния света (ДРС) на приборе Zetasizer Nano ZS (Malvern Instruments, Великобритания) были определены значения гидродинамического диаметра частиц, индекса полидисперсности (PDI) и ζ-потенциала. Каждый образец дисперсии частиц в бидистиллированной воде или в 10–3 М растворе NaCl концентрации 10–4 мас. % (pH от 2 до 10) был измерен трехкратно.
Определение конверсии мономеров
Конверсия мономеров была определена методом гравиметрического анализа. При проведении реакций сополимеризации отбирали по 10 проб через определенные промежутки времени. Отобранные пробы дисперсий переносили в предварительно взвешенные и охлажденные до 5–7°C бюксы с 0.1 мас. % раствором гидрохинона в диметилформамиде, и высушивали до постоянной массы.
Определение молекулярной массы водорастворимых олигомеров
После синтеза полимерных частиц надосадочную жидкость отделяли путем последовательного трехкратного центрифугирования и редиспергирования. Далее надосадочную жидкость высушивали в роторном испарителе Laborota 4011 (Heidolph, Германия) до постоянной массы. Молекулярную массу водорастворимых олигомеров, полученных после выпаривания, определяли методом статического рассеяния света, используя Zetasizer Nano ZS. Стандартом служил толуол. Для проведения анализа готовили 4 раствора олигомеров в диметилформамиде концентрацией от 0.25 до 1.0 г/л. Перед измерениями все растворы были обеспылены с помощью шприцевого фильтра с диаметром пор 0.22 мкм (Microlab Scientific, США).
Определение удельной поверхности частиц
Удельную поверхность синтезированных частиц измеряли с помощью анализатора NOVA 1200e (Quantachrome Instruments, США). Предварительно из дисперсий частиц удаляли воду на роторном испарителе Laborota 4011 при температуре 40°C и пониженном давлении. Перед началом измерений проводили дегазацию образца в токе азота при пониженном давлении.
Определение концентрации функциональных групп методом кондуктометрического титрования
Определение концентрации поверхностных функциональных групп проведено методом обратного кондуктометрического титрования. Титрование проводили для очищенных от водорастворимых примесей полимерных дисперсий на кондуктометре SevenMulti (Mettler Toledo, Швейцария). Для определения слабоосновных амино-, имидазолиновых и алифатических аминогрупп добавляли избыток HCl известной концентрации и затем последовательно оттитровывали 0.01 М раствором NaOH.
Смачиваемость пленок на основе полимерных частиц
Определение угла смачивания пленок, полученных на основе частиц, проводили на приборе DSA 30 (KRUSS, Германия). Пленки из дисперсий частиц формировали с помощью пистолета для распыления MiniJet 4 HVLP (SATA, США) при давлении 2.5 атм на поверхности обеспыленных предметных стекол (BioVitrum, Россия). Углы смачивания водой измеряли как для исходных пленок, так и обработанных хлористым метиленом.
Связывание белка с поверхностью частиц
Способность частиц адсорбировать биологически активные вещества была исследована на примере антигенов ВКЭ. Связывание антигенов ВКЭ с частицами проводили в фосфатном и фосфатно-солевом буферных растворах.
К 200 мкл водной дисперсии полимерных частиц с С.О. 5 мас. % добавляли раствор белка концентрацией от 1 нг/мл до 1 мг/мл, перемешивали систему в ультразвуковой ванне в течение 15 мин и инкубировали при комнатной температуре еще в течение 2 ч при постоянном перемешивании. Полученные коньюгаты оставляли в холодильнике на 20 ч при температуре 5°С, затем центрифугировали в течение 30 мин со скоростью 10 000 об./мин и отбирали 0.5 мл надосадочной жидкости.
Реакция латекс-аглютинации для определения вируса клещевого энцефалита
В основе эксперимента по выявлению ВКЭ с помощью РЛА лежит взаимодействие антиген–антитело, где в качестве антигена выступает антиген ВКЭ, а в качестве антитела – фракция высокоавидных антител, полученных в результате последовательного фракционирования положительных антитоксических сывороток крови и содержащих иммуноглобулины классов G и M (IgG и IgM). В экспериментах использовали частицы, модифицированные антигенами ВКЭ.
Сенсибилизированные антигенами ВКЭ полимерные частицы с С.О. от 1 до 5 мас. % добавляли в сыворотку крови, полученную из Управления федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по республике Башкортостан и содержащую антитела клещевых насекомых родов Ixodes и Dermacentor. Образовавшуюся дисперсию перемешивали, инкубировали в течение 5–15 мин и визуально регистрировали результат по методу четырех крестов. Положительным результатом считали интенсивность агглютинации, соответствующую 2–4 крестам, сомнительным – 1 кресту. При отсутствии агглютинации результат считали отрицательным. РЛА учитывали, если в опыте с положительной контрольной сывороткой наблюдалась агглютинация на 3–4 креста, а с отрицательной сывороткой она отсутствовала.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
С целью синтеза субмикронных полимерных частиц, перспективных в качестве носителей биолигандов при проведении исследований методом РЛА, изучена безэмульгаторная эмульсионная сополимеризация ММА с АМГХ в присутствии сшивающих агентов ДМЭГ и МБА. Использование ММА в качестве основного сомономера предпочтительнее, чем стирола, поскольку ММА имеет более высокую плотность и меньший показатель преломления, что является преимуществом в процессах, требующих быстрого оседания частиц или применения оптических методов контроля прохождения реакций. Для инициирования реакции был использован АИП, который при протонировании обеспечивает положительный заряд. Источником аминогрупп служил АМГХ. Все синтезы проводили в кислой реакционной среде (начальное значение pH (pH0) 3.05–3.82).Такое значение pH0, с одной стороны, обуславливает протонирование имидозалиновых групп инициатора, что обеспечивает электростатическую устойчивость дисперсий полимер-мономерных частиц (ПМЧ) в процессе синтеза, а с другой, создает условия, при которых не происходит гидролиз звеньев ММА с образованием карбоксильных групп. В качестве образца сравнения были получены катионные частицы П(ММА-АМГХ) диаметром 240 нм в отсутствие сшивающих агентов.
Показано, что варьирование концентрации ДМЭГ практически не влияет на размер частиц П(ММА-АМГХ-ДМЭГ). Однако добавление сшивающего агента заметно уменьшает индекс их полидисперсности: PDI = 0.12 в отсутствие ДМЭГ и 0.01 при содержании ДМЭГ 5 мас. % (опыты 1а и 5а, соответственно, табл. 1). Кроме того, увеличение концентрации ДМЭГ от 1 до 5 мас. % приводит к возрастанию гель-фракции с 22 до 93 мас. % (табл. 1). При повышении температуры реакционной системы диаметр частиц П(ММА-АМГХ-ДМЭГ) закономерно уменьшается до 205 нм (табл. 1, опыт 6а). При этом во всех случаях формируются частицы сферической формы (рис. 1). Ведение в реакционную систему 5 мас. % МБА приводит к образованию до 75 мас. % коагулюма (табл. 1, опыт 5м). Уменьшение концентрации сшивателя до 0.1–1.0 мас. % позволило синтезировать частицы П(ММА-АМГХ-МБА) диаметром от 155 до 200 нм с узким распределением по размерам, при этом образование коагулюма не наблюдалось (табл. 1, опыты 1м–4м). Данные ПЭМ также подтверждают формирование частиц сферической формы (рис. 1).
Рис. 1.
ПЭМ-изображения частиц П(ММА-АМГХ-ДМЭГ) (верхний ряд) и П(ММА-АМГХ-МБА) (нижний ряд), см. табл. 1.

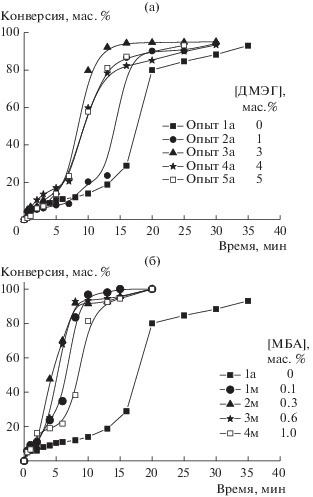
Исследовано влияние концентрации сшивающих агентов ДМЭГ и МБА на скорость реакции и общую конверсию мономеров (рис. 2). Оказалось, что увеличение скорости реакции при синтезе частиц П(ММА-АМГХ-ДМЭГ) наблюдается при добавлении до 3 мас. % ДМЭГ (рис. 2а). Однако при 4 и 5 мас. % ДМЭГ скорость реакции снижается. Такая же тенденция наблюдается при добавлении МБА: увеличение скорости реакции при введении 0.6 мас. %, а затем ее снижение при содержании сшивающего агента 1.0 мас. % (рис. 2б). Такое поведение полимеризационной системы очевидно связано с возрастанием вязкости и ограничением диффузии мономеров в растущих ПМЧ.
Рис. 2.
Кинетика конверсии мономеров при синтезе частиц П(ММА-АМГХ-ДМЭГ) (а) и П(ММА-АМ-ГХ-МБА) (б).
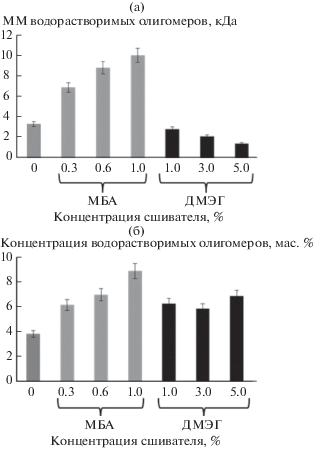
С целью изучения влияния природы и концентрации сшивающего агента на агрегативную устойчивость формирующихся ПМЧ в процессе безэмульгаторной эмульсионной сополимеризации ММА был исследован состав дисперсионной среды. После формирования частиц в дисперсионной среде в основном содержатся водорастворимые олигомеры, молекулярную массу (ММ) которых определяли методом статического рассеяния света. ММ водорастворимых олигомеров при синтезе частиц П(ММА-АМГХ) равна 3.3 кДа. Введение сшивающего агента ДМЭГ уменьшает ММ водорастворимых олигомеров до 2.78–1.40 кДа (рис. 3а), при этом их концентрация составляет от 6.2 до 7.1 мас. %. С увеличением концентрации водорастворимых олигомеров возрастает эффективность стерической стабилизации растущих ПМЧ, количество коагулюма и индекс полидисперсности уменьшаются (табл. 1). Введение в качестве сшивающего агента МБА, более гидрофильного, чем ДМЭГ, привело к увеличению ММ олигомерных цепей до 4.2–9.9 кДа (рис. 3а). При этом их концентрация в водной дисперсионной среде оказалась соизмеримой с концентрацией олигомеров при синтезе частиц П(ММА-АМГХ-ДМЭГ) (рис. 3б). Оба этих фактора способствуют эффективной стерической стабилизации частиц П(ММА-АМГХ-МБА).
Рис. 3.
Молекулярная масса водорастворимых олигомеров (а) и их концентрация в водной дисперсионной среде (б) при использовании разных количеств сшивающих агентов.
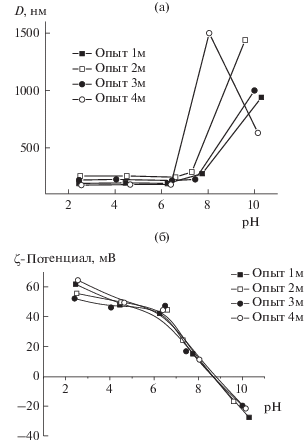
Агрегативную устойчивость дисперсий полимерных частиц исследовали в фосфатно-солевом буферном растворе с концентрацией фонового электролита NaCl 10–3 моль/л при варьировании pH от 2 до 10. При pH от 2 до 6.5 для всех исследуемых образцов не наблюдалось возрастания размера частиц (рис. 4). Однако в нейтральной области pH 7.0–7.4 размер частиц П(ММА-АМГХ-ДМЭГ) и их PDI значительно возрастают. В этих условиях как положительно, так и отрицательно заряженные поверхностные функциональные группы образцов 5а и 6а нейтрализованы, вследствие чего электростатическая стабилизация дисперсии частиц практически невозможна и происходит их флокуляция. Увеличение поверхностной концентрации функциональных групп частиц П(ММА-АМГХ-МБА) приводит к их агрегативной устойчивости при pH 7.5–8.0 (PDI < 0.08) (рис. 5, табл. 1).
Рис. 4.
Зависимости гидродинамического диаметра (а) и ζ-потенциала (б) частиц П(ММА-АМГХ-ДМЭГ) от pH дисперсионной среды.
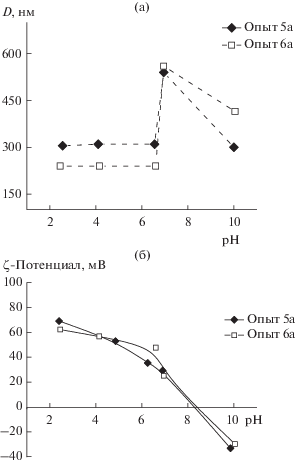
Рис. 5.
Зависимости гидродинамического диаметра (а) и ζ-потенциала (б) частиц П(ММА-АМГХ-МБА) от pH дисперсионной среды.
Связывание БАВ с частицами ПММА, обладающими меньшей гидрофобностью, чем частицы ПСт, способствует уменьшению неспецифических взаимодействий на поверхности полимерного носителя и служит сохранению биологически активной конформации биолигандов. Дисперсии частиц П(ММА-АМГХ-МБА) в буферных растворах сохраняли агрегативную устойчивость в нейтральной области pH. Таким образом, показана принципиальная возможность применения таких частиц в качестве тест-систем для экспресс-иммуноанализа с целью выявления ВКЭ с помощью РЛА.
В качестве исследуемого образца были выбраны частицы 2м, поскольку они оставались агрегативно устойчивыми в буферных растворах, имели высокую концентрацию поверхностных функциональных групп, а также обладали максимальным размером из всех синтезированных частиц П(ММА-АМГХ-МБА) (табл. 1), что является бесспорным преимуществом при проведении РЛА.
В качестве полимерных частиц, выступающих носителями БАВ при проведении РЛА, преимущественно применяют частицы ПСт с отрицательно заряженными поверхностными группами [4]. В качестве образцов сравнения были использованы частицы 1ст на основе ПСт, имеющие размер 400 нм (PDI = 0.02) и ζ-потенциал, равный –48.1 мВ (10–3 M NaCl, pH 7.3). Кроме того, для того чтобы установить влияние функционального сомономера АМГХ и сшивающего агента МБА на адсорбцию антигенов ВКЭ, были также использованы катионные частицы 1пм на основе полиметилметакрилата диаметром 260 нм (PDI = 0.03), имеющие ζ-потенциал +24.3 мВ (10–3 M NaCl, pH 7.3), полученные в присутствии инициатора АИП.
Адсорбция антигенов ВКЭ была проведена в фосфатно-солевом буфере при pH 7.4. В результате были получены кривые адсорбции, выходящие на насыщение, для всех исследуемых образцов частиц (рис. 6). Для частиц сравнения 1ст и 1пм максимальные значения адсорбции составили 3.3–3.4 мг/м2. При использовании частиц 2м значение максимальной адсорбции антигенов уменьшается до 1.6 мг/м2.
Рис. 6.
Изотермы адсорбции антигенов ВКЭ на частицах, синтезированных в опыте 2м, и частицах сравнения 1ст и 1пм.
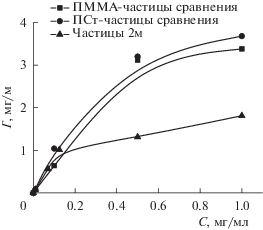
Значительная разница между значениями адсорбции антигенов ВКЭ на образце 2м и образцах сравнения связана с гидрофобными свойствами поверхности последних. Так, угол смачивания водой пленок из частиц ПММА- и ПСт-образцов сравнения составил 83° и 94° соответственно, в то время как для пленки из частиц 2м он равнялся 58°. Однако размер частиц сравнения 1пм после адсорбции антигенов составил 850–2500 нм при PDI = 0.28–0.41, что свидетельствовало о неустойчивости дисперсии этих частиц в фосфатно-солевом буфере и, как следствие, невозможности их дальнейшего применения. Дисперсия ПСт-частиц 1ст оказалась устойчивой при всех значениях концентрации антигенов ВКЭ, при этом размер частиц увеличился до 420–435 нм и PDI составил не более 0.06. Частицы 2м при максимальных значениях адсорбции антигенов также агрегировали, и их диаметр возрастал до 1400 нм при PDI = 0.17. Однако при величине адсорбции, равной 0.081 мг/м2, эти частицы не агрегировали и имели размер 260 нм, а их PDI = 0.03.
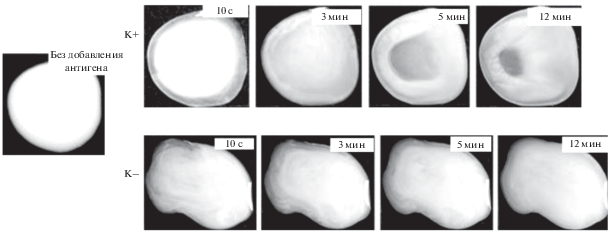
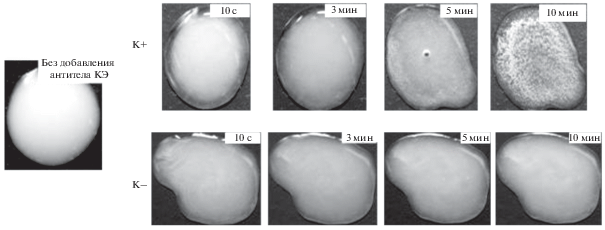
В следующей серии экспериментов была исследована РЛА для выявления антител ВКЭ с использованием систем “частицы 2м + антигены” и “ПСт-частицы + антигены”. В качестве эталонных сывороток, содержащих иммуноглобулины IgM и IgG, были применены наборы реагентов АО Вектор-Бест. РЛА была проведена в течение 10–12 мин, параллельно ставили отрицательный контроль при отсутствии в сыворотке антител. Установлено, что в случае частиц ПСт не наблюдается образование комплекса “частица–антиген–антитело” (рис. 7). Напротив, в случае частиц 2м спустя 10 мин образуется визуально различимый осадок, классифицированный по шкале четырех крестов как 4+ (рис. 8).
Рис. 8.
Фотографии, иллюстрирующие протекание РЛА при использовании частиц П(ММА-АМГХ-МБА), синтезированных в опыте 2м.
Таким образом, показано, что только в условиях синтеза частиц на основе сополимеров метилметакрилата с гидрохлоридом 2-аминоэтилметакрилата с использованием в качестве сшивающего агента N,N'-метиленбисакриламида образуются олигомеры с высокой молекулярной массой, при этом их содержание в реакционной системе максимально, что обеспечивает эффективную стабилизацию растущих полимер-мономерных частиц. Синтезированные частицы П(ММА-АМГХ-МБА) диаметром 205 нм являются эффективными носителями БАВ и остаются агрегативно устойчивыми в фосфатно-солевых буферных растворах при pH 7.4. Адсорбция антигенов вируса клещевого энцефалита на поверхности таких частиц позволяет определять антитела этого вируса методом латекс-агглютинации.
Список литературы
Du C., Zhang N., Ding S., Gao X., Guan P., Hu X. // Polym. Chem. 2016. V. 7. P. 4531.
Lincopan N., Carmona-Ribeiro A.M. // J. Nanosci. Nanotechnol. 2009. V. 9. P. 3578.
Naves A.F., Palombo R.R., Carrasco L.D.M., Carmona-Ribeiro A.M. // Langmuir. 2013. V. 29. P. 9677.
Zataray J., Aguirre A., De La Cal J.C., Leiza J.R. // Macromol. Symp. 2013. V. 333. P. 80.
Baigildin V., Pankova G., Evseeva T., Lavrov N., Shirokova I., Vaganov G., Shevchenko N. // J. Dispers. Sci. Technol. 2017. V. 38. P. 1570.
Miraballes-Martínez I., Forcada J. // J. Polym. Sci. Part A: Polym. Chem. 2000. V. 38. P. 4230.
Ramos J., Forcada J., Hidalgo-Alvarez R. // Chem. Rev. 2014. V. 114. P. 367.
Ortega-Vinuesa J.L., Hidalgo-Álvarez R. // Biotechnol. Bioeng. 1995. V. 47. P. 633.
McCann J., Thaiboonrod S., Ulijn R. V., Saunders B.R. // J. Colloid Interface Sci. 2014. V. 415. P. 151.
Ramos J., Forcada J. // Eur. Polym. J. 2007. V. 43. P. 4647.
Kong X.Z., Zhu X., Jiang X., Li X. // Polymer. 2009. V. 50. P. 4220.
Costoyas Á., Ramos J., Forcada J. // J. Polym. Sci. Part A: Polym. Chem. 2009. V. 47. P. 6201.
Türk H., Bengü Karabacak R., Erdem M. // J. Appl. Polym. Sci. 2015. V. 132. P. 42775.
Dziomkina N. V., Hempenius M.A., Vancso G.J. // Eur. Polym. J. 2006. V. 42. P. 81.
Zhang J., Cheng S., Lu G., Chai S. // J. Appl. Polym. Sci. 2009. V. 111. P. 2092.
Ohtsuka Y., Kawaguchi H., Watanabe S. // Polymer. 1980. V. 21. P. 1073.
Ohtsuka Y., Kawaguchi H., Hayashi S. // Polymer. 1981. V. 22. P. 658.
Байгильдин В.А., Панкова Г.А., Евсеева Т.Г., Меньшикова А.Ю., Шевченко Н.Н. // Коллоид. журн. 2015. Т. 77. С. 9.
Erdem M., Türk H. // React. Funct. Polym. 2008. V. 68. P. 321.
Rembaum A., Yen S.P.S., Molday R.S. // J. Macromol. Sci. Part A - Chem. 1979. V. 13. P. 603.
Шевченко Н.Н., Панкова Г.А., Евсеева Т.Г., Шабсельс Б.М., Байгильдин В.А., Меньшикова А.Ю. // Высокомолек. соед. Б. 2014. Т. 56. С. 144.
Waterborg J.H. // The Protein Protocols Handbook. 2nd ed. / Ed by Walker J.M. Totowa, New Jersey: Humana Press, 2002. P. 7.
Kawaguchi H. // Prog. Polym. Sci. 2000. V. 25. P. 1171.
Ganachaud F., Sauzedde F., Elassari A., Pichot C. // J. Appl. Polym. Sci. 1997. V. 65. P. 2315.
Sauzedde F., Ganachaud F., Elassari A., Pichot C. // J. Appl. Polym. Sci. 1997. V. 65. P. 2331.
Ham G. Copolymerization. New York: Wiley, 1964.
Chain J.N.M., Jirasek A., Schreiner L.J., McAuley K.B. // Phys. Med. Biol. 2011. V. 56. P. 2091.
Bourcier S., Vancaeyzeele C., Vidal F., Fichet O. // Polymer. 2013. V. 54. P. 4436.
Świder J., Tąta A., Sokołowska K., Witek E., Proniewicz E. // J. Mol. Struct. 2015. V. 1102. P. 42.
Nandiyanto A.B.D., Suhendi A., Ogi T., Iwaki T., Okuyama K. // Colloids Surf. A. 2012. V. 396. P. 96.
Williams M., Penfold N.J.W., Armes S.P. // Polym. Chem. 2016. V. 7. P. 384.
Меньшикова А.И., Евсеева Т.Г., Инкин К.С., Скуркис Я.О., Иванчев С.С. // Журн. прикл. химии. 2006. Т. 79. С. 1680.
Galisteo-González F., Puig J., Martín-Rodriguez A., Serra-Domènech J., Hidalgo-Alvarez R. // Colloids Surf. B. 1994. V. 2. P. 435.
Roux K.H. // Int. Arch. Allergy Immunol. 1999. V. 120. P. 85.
Späth P.J. // Sepsis. 1999. V. 3. P. 197.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал