Коллоидный журнал, 2020, T. 82, № 2, стр. 231-237
Получение и характеристики наночастиц Ag–Pd: ингибирование каталитической активности поверхности палладия серебром
Р. Д. Соловов 1, *, А. Ю. Перевозникова 1, Е. В. Абхалимов 1, С. В. Горностаева 1, Б. Г. Ершов 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
117342 Москва, ул. Обручева, 40, Россия
* E-mail: roman_solovov@mail.ru
Поступила в редакцию 26.07.2019
После доработки 12.08.2019
Принята к публикации 21.08.2019
Аннотация
Наночастицы палладия катализируют восстановление ионов Ag+ водородом на своей поверхности, что проводит к образованию биметаллических частиц со структурой “ядро–оболочка”. Атомы серебра на поверхности наночастиц палладия блокируют каталитическую реакцию восстановления метилвиологена водородом при соотношении [Ag] : [Pd] > 1. При соотношении [Ag] : [Pd] ≤ 1 восстановление протекает, но ему предшествует индукционный период тем длительнее, чем больше содержание серебра на поверхности наночастиц. Константа скорости каталитической реакции восстановления, которая начинается после завершения индукционного периода, уменьшается с увеличением содержания серебра на поверхности наночастиц палладия.
ВВЕДЕНИЕ
Наночастицы (НЧ) металлов обладают развитой поверхностью, обеспечивающей существенное увеличение их каталитической активности, а также комплексом уникальных и неожиданных свойств, не характерных для металлов в массивном состоянии. Это обстоятельство инициировало многочисленные исследования, посвященные их получению и изучению свойств. Большой интерес проявляется к НЧ смешанного состава, что объясняется наличием у них оптических, электронных и каталитических свойств, не свойственных НЧ соответствующих индивидуальных металлов [1–3]. В зависимости от выбора реагентов (восстановителя, стабилизатора) и условий синтеза можно получать состоящие из нескольких металлов НЧ, представляющие собой сплавы или имеющие структуру ядро–оболочка, а также различную форму, что дает возможность влиять на их свойства [4–6]. Управление этими параметрами позволяет получать НЧ с заданными характеристиками и свойствами [7].
Палладий известен своей высокой каталитической активностью в реакциях гидрирования. В связи с этим, несомненный интерес предоставляет возможность использования НЧ палладия в качестве катализатора восстановления ионов серебра водородом. В предыдущих работах нами было показано, что НЧ палладия [8] и платины [9] катализируют реакции восстановления ионов меди(II) и серебра(I) соответственно.
Целью данной работы было получение биметаллических НЧ Ag–Pd путем восстановления ионов Ag+ водородом в присутствии НЧ палладия и изучение их каталитических свойств в реакции одноэлектронного восстановления дихлорида метилвиологена водородом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
В работы использованы моногидрат перхлората серебра (AgClO4 · H2O, ≥99%), моногидрат дихлорида тетрамминпалладия ([Pd(NH3)4]Cl2 · H2O, ≥99.99%), дихлорид метилвиологена (>95%) производства Aldrich, химически чистый гидроксид натрия (>99.5%) и водород газообразный чистый (≥99.9999%). В качестве стабилизирующего агента применялся полиакрилат натрия (PANa) с молекулярной массой 2100 (Fluka).
Все растворы готовили на трижды дистиллированной воде, которую деионизировали на установке Водолей (НПП Химэлектроника). Удельная проводимость воды не превышала 0.056 мкСм/см.
Получение затравочных наночастиц палладия
Наночастицы Pd были синтезированы воздействием импульсного УФ-света на водные растворы [Pd(NH3)4]Cl2 по ранее описанной методике [10]. В качестве стабилизатора образующихся НЧ Pd использовали PANa. Полученный гидрозоль характеризуется узким мономодальным распределением НЧ по размеру со средним диаметром 2.5 ± 0.3 нм. Дзета-потенциал НЧ Pd был достаточно большим по абсолютной величине (–61.3 мВ), что указывает на высокую агрегативную устойчивость гидрозоля.
Получение биметаллических наночастиц
Наночастицы Ag–Pd получали насыщением водородом предварительно деаэрированного раствора, содержащего затравочные НЧ палладия ([Pd0] = 0.10 мМ), стабилизатор ([PANa] = 1.0 мМ) и соль AgClO4 в необходимом количестве. Обычно [Ag+] составляла 0.010–0.20 мМ. Восстановление ионов Ag+ водородом проводили в специальной ячейке, снабженной кварцевой кюветой для оптических измерений, объем исследуемых растворов составлял 5.0–20.0 мл.
Исследования каталитической активности биметаллических наночастиц
Для изучения каталитической активности НЧ Pd разного размера использовали реакцию одноэлектронного восстановления метилвиологена MV2+ водородом в щелочной среде, которая катализируется палладием и протекает с образованием катион-радикала MV+∙ (ε600 = 1.1 × 104 M–1 см–1). Кинетические исследования проводили в идентичных условиях при 20.0°C. Раствор, содержащий метилвиологен ([MV2+] = 5.0 мМ), гидроксид натрия ([NaOH] = 1.0 мМ) и биметаллические НЧ Ag–Pd ([Pd0] = 0.010 мМ), деаэрировали и затем энергично перемешивали для насыщения водородом. Константа Генри для водорода составляет kH = 7.8 × 10–4 М атм–1 [11]. Таким образом, 10-кратный избыток второго реагента (метилвиологена) позволяет считать процесс восстановления метилвиологена на начальном этапе реакцией первого порядка по водороду, что и подтверждают результаты экспериментов.
Определение характеристик наночастиц
Оптические спектры измеряли на спектрофотометре Cary 100 Scan (Varian), снабженном ячейкой Пельтье, при температуре T = 293 К.
Гидродинамические диаметры НЧ, характер их распределений и ζ-потенциал определяли методом динамического рассеяния света (ДРС), используя фотон-корреляционный спектрометр Delsa Nano C (Beckman Coulter), при длине волны лазерного излучения 658 нм.
Размеры и распределение частиц по размерам определяли с помощью просвечивающего электронного микроскопа высокого разрешения (ПЭМВР) (Jeol) при ускоряющем напряжении 200 кВ. Элементный анализ проводили при помощи энергодисперсионного рентгеновского спектрометра. Образцы для микроскопии готовили, нанося каплю коллоидного раствора на медную сетку с углеродным покрытием и позволяя ей полностью высохнуть. ПЭМВР-изображения были обработаны вручную с использованием открытого программного обеспечения ImageJ. Гистограммы распределения НЧ по размерам были рассчитаны, как минимум, по 100 случайно выбранным частицам с помощью статистических приложений программного пакета OriginPro 2018. Данные электронной дифракции обрабатывали с использованием программного обеспечения CrysTBox [12].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Получение и характеристики наночастиц Ag–Pd
Молекулярный водород не восстанавливает ионы серебра в водном растворе. Это вызвано с тем, что стандартный электрохимический потенциал E 0 пары Ag+/Ag0, равный –1.8 В, значительно ниже E 0(2H+/H2) = 0 В. Ранее также было установлено, что коллоидное серебро не катализирует восстановление метилвиологена водородом [9]. Однако присутствие наноразмерного палладия инициирует процесс восстановления.
На рис. 1 показана эволюция оптического поглощения ионов Ag+, вызванного их восстановлением водородом в присутствие НЧ палладия. Видно, что на фоне поглощения палладия (нарастающая в УФ-область полоса с максимумом при 220 нм [13]) в ходе реакции появляется полоса плазмонного поглощения серебра в области 400 нм. Эта полоса по мере восстановления ионов Ag+ увеличивается по интенсивности и смещается в коротковолновую область. Видно также, что максимум полосы на ранней стадии восстановления находится при 430 нм, а на конечной, по завершении процесса – уже вблизи 400 нм. Исходя из вида спектра и его изменения в ходе реакции, можно полагать, что образование металлического серебра происходит на поверхности НЧ палладия с формированием структуры ядро–оболочка.
Рис. 1.
Изменение поглощения раствора, содержащего ионы Ag+, вызванного их восстановлением водородом в присутствии НЧ палладия: 1 – исходный раствор, 2 – спустя 20 мин и 3 – спустя 50 мин после насыщения водородом. Состав реакционной смеси: [Pd0] = 0.10 мМ, [Ag+] = 0.15 мМ, [PANa] = 1.0 мМ.
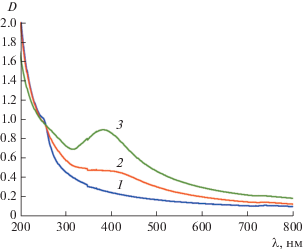
Данные оптических исследований указывают на то, что по мере формирования (утолщения) поверхностного слоя серебра на НЧ палладия заметно изменяются электронные характеристики биметаллических частиц. Известно [14], что полоса плазмонного поглощения серебра очень чувствительна к изменению электронной плотности в металле. Уменьшение электронной плотности проявляется в сдвиге полосы в красную область, а ее увеличение, – напротив, в синюю. Результаты наших опытов показывают, что на начальном этапе восстановления (малая концентрация атомов серебра на поверхности НЧ палладия) полоса находится при 430 нм, т.е. сказывается заметное влияние палладия на электронные свойства серебра, проявляющееся в оттягивании электронов проводимости от серебра на палладий. Сдвиг плазмонной полосы серебра в УФ-область при увеличении толщины его слоя на НЧ Pd свидетельствует об увеличении электронной плотности в серебряной оболочке и достижении уровня, характерного для индивидуальных НЧ серебра (максимум поглощения при 400 нм).
Образование НЧ, содержащих два металла, подтверждают и данные энергодисперсионной рентгеновской спектроскопии (см. ниже).
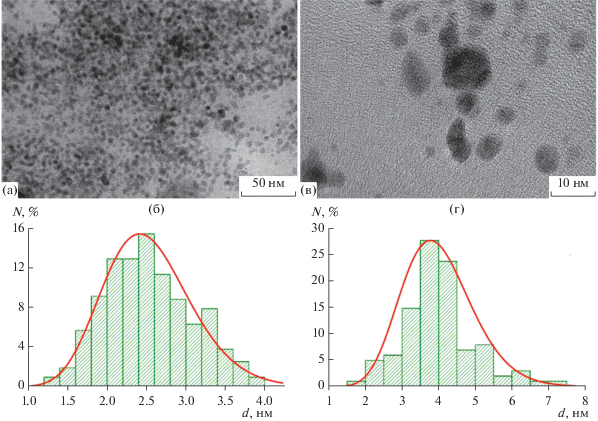
Размеры полученных НЧ и характер их распределения по размерам были определены с помощью ПЭМВР. На рис. 2 представлены микрофотографии и распределения по размерам “затравочных” НЧ палладия и биметаллических НЧ Ag–Pd, полученных в растворах с молярным отношением [Ag] : [Pd] = 2.0. Распределения являются мономодальными и хорошо описываются логнормальным законом. Средние размеры частиц Pd и Ag–Pd составили 2.5 ± 0.6 и 3.9 ± 1.0 нм соответственно.
Рис. 2.
ПЭМВР-изображения и распределения частиц по размерам: (а) и (б) “затравочных” НЧ Pd, (в) и (г) НЧ Ag–Pd. Состав раствора: [Pd0] = 0.10 мМ, [PANa] = 1.0 мМ. Содержание серебра на поверхности НЧ Ag–Pd соответствует отношению [Ag] : [Pd] = 2.0.
На рис. 3 представлены ПЭМВР-изображение и профиль межплоскостных расстояний на поверхности биметаллических НЧ Ag–Pd. Рассчитанное из профиля межплоскостное расстояние составило 2.395 Å. В табл. 1 приведены справочные данные о межплоскостных расстояниях для металлических палладия и серебра. Для плоскости {111} Pd и Ag они равны 2.29 и 2.35 Å соответственно.
Рис. 3.
(а), (б) ПЭМВР-изображения НЧ Ag–Pd с соотношением [Ag] : [Pd] = 2.0 (состав раствора: [Pd0] = 0.10 мМ, [PANa] = 1.0 мМ); (в) электронограмма и профиль интенсивности дифракционных колец; (г) энергодисперсионный спектр НЧ.
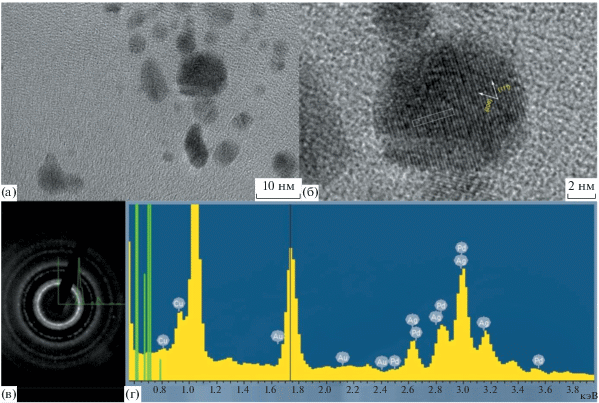
Таблица 1.
Справочные и экспериментальные данные о межплоскостных расстояниях и параметре a кристаллической решетки НЧ Ag–Pd
| Индексы Миллера {hkl} | d(Pd), Å (JCPDS 46-1043) | d(Pd)эксп, Å | d(Ag), Å (JCPDS 4-0783) | d(Ag)эксп, Å |
|---|---|---|---|---|
| {111} | 2.25 | 2.296 | 2.35 | 2.312 |
| {200} | 1.94 | 1.988 | 2.04 | 2.138 |
| {220} | 1.38 | 1.385 | 1.45 | 1.412 |
| {311} | 1.17 | 1.147 | 1.23 | 1.193 |
| a(Pd), Å (JCPDS 46-1043) | a(Pd)эксп, Å | a(Ag), Å (JCPDS 4-0783) | a(Ag)эксп, Å | |
| 3.889 | 3.917 | 4.079 | 4.058 |
Анализ более 100 НЧ Ag–Pd на микрофотографиях, полученных в ПЭМВР, показал отсутствие на поверхности НЧ межатомных расстояний, которые бы соответствовали кристаллической решетке палладия. Таким образом, можно сделать вывод, что исходные НЧ палладия в процессе восстановления ионов Ag+ покрываются слоями серебра и формируются биметаллические НЧ со структурой ядро–оболочка.
Формирование биметаллических НЧ подтверждается также дифракционными данными. Кристаллическая структура НЧ определялась с помощью дифракции электронов. На рис. 3в представлена электронограмма для НЧ Ag–Pd с соотношением [Ag] : [Pd] = 2.0. На ней отчетливо наблюдаются кольца {111}, {200}, {220}, {311} и др. Эти кольца соответствуют гранецентрированной кубической решетке. Значения межплоскостных расстояний и рассчитанного параметра решетки a подтверждают формирование биметаллических НЧ Ag–Pd (см. табл. 1).
Элементный состав полученных НЧ был определен с помощью энергодисперсионной рентгеновской спектроскопии. На рис. 3д представлен энергетический спектр эмиссии характеристического рентгеновского излучения. Полученные количественные данные приведены в табл. 2. Видно, что полученные НЧ состоят из серебра и палладия с атомным соотношением, равным 2 к 1, т.е. соответствующим их соотношению в исходном растворе.
Восстановление метилвиологена водородом, катализируемое наночастицами Ag–Pd
Наночастицы палладия катализируют реакцию одноэлектронного восстановления метилвиологена (MV2+) водородом. НЧ Ag–Pd, полученные восстановлением ионов Ag+ на НЧ палладия при соотношении [Ag] : [Pd] > 1, не катализируют этот процесс так же, как это имеет место в случае чистого коллоидного серебра. Это подтверждает, что биметаллические НЧ имеют структуру ядро–оболочка и серебряная оболочка при указанном соотношении плотно покрывает ядро палладия, блокируя процесс восстановления MV2+. Однако при соотношении [Ag] : [Pd] ≤ 1 восстановление уже имеет место. Соответствующие кинетические кривые приведены на рис. 4. Видно, что при этом процессу восстановления предшествует индукционный период, длительность которого возрастает с увеличением соотношения [Ag] : [Pd].
Рис. 4.
Кинетические кривые восстановления метилвиологена водородом в присутствии НЧ Ag–Pd. Состав реакционной смеси: [Pd0] = 0.010 мМ, [PANa] = = 0.10 мМ, [MV2+] = 0.50 мМ, [OH–] = 5.0 мМ. Содержание серебра на поверхности НЧ Ag–Pd соответствует следующим значениям соотношения [Ag] : [Pd]: 1 – 0, 2 – 0.20, 3 – 0.50, 4 – 0.75, 5 – 1.00.
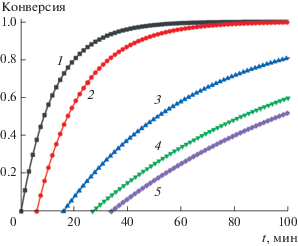
Скорость восстановления метилвиологена зависит также от содержания серебра на НЧ палладия. С увеличением [Ag] : [Pd] она уменьшается (рис. 4). Кинетика восстановления хорошо описывается уравнением реакции первого порядка. На рис. 5 показана зависимость константы скорости от соотношения [Ag] : [Pd].
Рис. 5.
Зависимость константы скорости восстановления метилвиологена водородом от отношения [Ag] : [Pd]. Состав реакционной смеси указан в подписи к рис. 4.
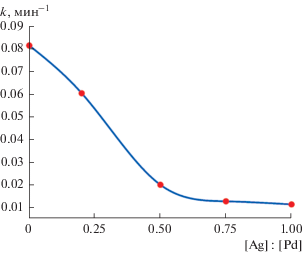
Таким образом, атомы серебра на поверхности НЧ палладия при соотношении [Ag] : [Pd] > 1 блокируют каталитическую реакцию одноэлектронного восстановления метилвиологена водородом. Однако при соотношении [Ag] : [Pd] ≤ 1 восстановление уже имеет место, но ему предшествует индукционный период тем длительнее, чем больше содержание серебра на поверхности НЧ палладия. Появление индукционного периода мы связываем с удалением атомов серебра и появлением свободных участков на поверхности НЧ палладия. Это может происходить в результате окислительно-восстановительных реакций атомов серебра с другими компонентами раствора (водородом, метилвиологеном, ионами H+ и OH–). Чем больше содержание серебра на поверхности НЧ палладия, тем, очевидно, должен быть длительнее индукционный период. Следует также ожидать, что константа скорости восстановления, которое начинается после завершения индукционного периода, будет больше в случае НЧ палладия с малым содержанием серебра на поверхности. Эти предположения согласуются с наблюдаемыми экспериментальными зависимостями τинд и k от соотношения [Ag] : [Pd].
Установим связь между протяженностью периода индукции и содержанием серебра на поверхности НЧ палладия. Время, необходимое для удаления атомов серебра с НЧ палладия, приводящего к появлению на их поверхности активных участков, a priori должно быть тем больше, чем выше содержание этих атомов на поверхности. Механизм процесса, как и состояние образующейся активной поверхности, остается неизвестным. Мы построили графическую зависимость τинд от содержания серебра на НЧ палладия (рис. 6) и вывели следующее эмпирическое уравнение:
где k – константа пропорциональности, равная тангенсу угла наклона указанной линейной зависимости. Из зависимости (1) следует постоянство скорости удаления атомов серебра с поверхности НЧ для всех соотношений [Ag] : [Pd], приводящего к появлению каталитически активных участков. Значение k для условий проведения наших экспериментов, т.е. для НЧ палладия размером 2.5 нм, оказывается равным 3.4 × 106 моль–1 л мин.Рис. 6.
Зависимость индукционного периода от содержания серебра в координатах уравнения τинд = = k[Ag]. Состав реакционной смеси указан в подписи к рис. 4.
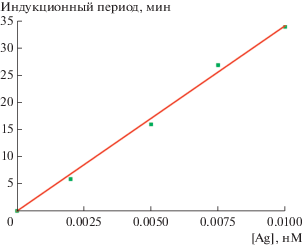
Толщина оболочек серебра на НЧ палладия при концентрации ионов серебра [Ag+] = 0.02, 0.05, 0.075, 0.10 и 0.20 мМ составляет 0.09, 0.21, 0.29, 0.37 и 0.62 нм соответственно. Эти значения соответствуют числу атомных слоев серебра на поверхности НЧ палладия, равному 0.31, 0.72, 1.01, 1.27 и 2.14 соответственно. То есть при значениях концентрации ионов серебра 0.02 и 0.05 мМ только 31 и 72% поверхности НЧ палладия заполнены атомами серебра в предположении их равномерного распределения. Однако такое их содержание оказывается достаточным для блокирования каталитической активности палладия на начальном этапе процесса восстановления метилвиологена. Только в присутствии ≥0.075 мМ ионов серебра степень заполнения поверхности НЧ превышает один слой атомов.
Ранее было установлено, что разряд и ионизация водорода происходят на НЧ палладия по механизму диссоциативной адсорбции [15]. Серебро блокирует этот процесс, и только появление свободных участков на поверхности НЧ палладия его возобновляет. По-видимому, с увеличением содержания серебра на НЧ палладия уменьшается площадь таких участков, что приводит к заметному уменьшению константы скорости каталитической реакции (см. рис. 5).
ЗАКЛЮЧЕНИЕ
Таким образом, НЧ палладия инициируют каталитическое восстановления ионов Ag+ водородом на своей поверхности, в результате чего формируются биметаллические частицы со структурой ядро–оболочка. Показано, что НЧ Ag–Pd при соотношении [Ag] : [Pd] ≥ 2, при котором на поверхности НЧ палладия формируется оболочка из одного и более атомных слоев серебра, не катализируют восстановление метилвиологена водородом. С уменьшением количества введенного серебра каталитическое действие НЧ восстанавливается, причем ему предшествует индукционный период. Индукционный период увеличивается, а константа скорости реакции восстановления метилвиологена уменьшается с увеличением содержания серебра на поверхности НЧ палладия.
Список литературы
Khan Z., Dummer N.F., Edwards J.K. // Philos. Trans. R. Soc. A. 2018. V. 376. P. 20170058.
Wu K.-J., Gao Y., Torrente-Murciano L. // Faraday Discuss. 2018. V. 208. P. 427.
Choi S.-H., Lee S., Kim S.-J., Sohn S.-H., Kang H.-D., Zhang Y.-P., Lee K.-P., Chun J.-H. // Catal. Lett. 2005. V. 105. P. 59.
Ершов Б.Г., Абхалимов Е.В., Ананьев А.В. // Докл. АН. 2011. Т. 439. С. 621.
Azizi-Toupkanloo H., Goharshadi E.K., Nancarrow P. // Adv. Powder Technol. 2014. V. 25. P. 801.
Lee C.L., Tseng C.-M., Wu R.-B., Wu C.-C., Syu S.-C. // Electrochim. Acta. 2009. V. 54. P. 5544.
Chen D., Cui P., He H., Liu H., Yang J. // J. Power Sources. 2014. V. 272. P. 152.
Соловов Р.Д., Абхалимов Е.В., Ершов Б.Г. // Коллоид-. журн. 2016. Т. 78. С. 629.
Абхалимов Е.В., Ершов Б.Г. // Коллоид. журн. 2014. Т. 76. С. 413.
Ершов Б.Г., Соловов Р.Д., Абхалимов Е.В. // Коллои-д. журн. 2014. Т. 76. С. 601.
Sander R. // Atmos. Chem. Phys. 2015. V. 15. P. 4399.
Klinger M. // J. Appl. Crystallogr. 2017. V. 50. P. 1226.
Соловов Р.Д., Ершов Б.Г. // Коллоид. журн. 2014. Т. 76. С. 645.
Henglein A. // J. Phys. Chem. 1993. V. 97. P. 5457.
Ershov B.G., Solovov R.D. // Catal. Commun. 2018. V. 103. P. 34.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


