Коллоидный журнал, 2020, T. 82, № 3, стр. 363-376
Получение и свойства гидрогелей на основе хитозана и пектина
Н. Н. Сигаева 1, *, Р. Р. Вильданова 1, А. В. Султанбаев 2, С. П. Иванов 1
1 Уфимский институт химии УФИЦ РАН
450054 Уфа, проспект Октября, 71, Росси
2 Республиканский клинический онкологический диспансер
450054 Уфа, ул. проспект Октября 73/1, Россия
* E-mail: gip@anrb.ru
Поступила в редакцию 23.04.2019
После доработки 27.11.2019
Принята к публикации 04.12.2019
Аннотация
Получены гидрогели смешением растворов хитозана и пектина, а также растворов их модифицированных производных в водных средах при комнатной температуре. Процесс образования гелей протекает в течение от нескольких секунд до получаса и более в зависимости от его условий. Формирование гидрогеля обусловлено образованием как ковалентных связей между функциональными группами, так и интерполиэлектролитного комплекса за счет взаимодействия аммонийных групп хитозана и карбоксилатных групп пектина. Определены условия образования гидрогеля во всем объеме раствора без отделения жидкой фазы. Исследовано набухание лиофильно высушенных гидрогелей в зависимости от ионной силы и pH водной среды. На примере цитостатиков митомицина C и цисплатина показана возможность пролонгированного высвобождения лекарственного препарата из разработанной полимерной матрицы.
ВВЕДЕНИЕ
Гидрогели на основе как синтетических, так и природных полимеров в настоящее время применяются в сельском хозяйстве, фармацевтике, медицине и других отраслях благодаря ряду уникальных механических и физико-химических свойств, присущих этим материалам [1–15]. Так, использование гидрогелей в качестве лекарственной формы увеличивает эффективность лекарственных препаратов, обеспечивает пролонгирование их действия, адресную доставку, а в некоторых случаях и заметный синергетический эффект действия препарата и фармакопейной основы. При этом особый интерес представляет разработка гидрогелевых материалов на основе биополимеров, которые обладают собственной биологической активностью и способностью к биодеградации, что положительно сказывается при их применении в составе лечебного средства.
Известно [16], что в соответствии с механизмом образования гидрогели делятся на два класса: физические и химические. В случае физических гидрогелей образование сетки обусловлено силами межмолекулярного взаимодействия между полимерными цепями или наночастицами. Химические гели формируются в результате ковалентного или ионного связывания полимерных цепей. Оба типа гелей имеют свои преимущества и недостатки. Гидрогели, полученные путем образования химических связей между полимерными цепями, обладают достаточно высокой механической прочностью и упругостью. Однако в тех случаях, когда проявление высокой механической прочности не требуется, например, при наружном применении, можно получать гидрогели за счет формирования интерполиэлектролитного комплекса (ИПЭК). ИПЭК представляет собой продукт взаимодействия противоположно заряженных полиэлектролитов. Отличительной особенностью ИПЭК является их способность связывать заряженные частицы и реагировать на изменения условий окружающей среды (температуры, pH, ионной силы раствора и т.д.). Благодаря этому ИПЭК нашли широкое применение в качестве регуляторов стабильности коллоидных дисперсий, связующих почв и грунтов, реагентов для разделения биологически активных макромолекул, пролонгаторов действия лекарственных препаратов [17]. При определенных условиях такие комплексы способны формировать гидрогели.
В большинстве случаев для получения химически сшитых гидрогелей проводится предварительная модификация полимеров введением функциональных групп, способных участвовать в реакциях сшивания, либо закреплять лекарственный препарат на полимерной матрице с помощью ковалентных или ионных связей. При этом в некоторых случаях используются достаточно токсичные сшивающие агенты, что недопустимо для гидрогелей медицинского назначения. Кроме того, введение сшивающего агента в систему полимер/лекарственное вещество может привести к изменению биологической активности лекарства в результате его химической модификации. Поэтому методы получения гидрогелей без использования сшивающих агентов, за счет образования поперечных связей между “комплементарными” функциональными группами макромолекул полимеров весьма перспективны.
Наиболее простым способом получения гидрогелей путем формирования ИПЭК является смешение растворов двух полимеров, содержащих функциональные группы, способные взаимодействовать между собой, например, аммонийные у поликатиона и карбоксилатные у полианиона.
В связи с этим целью данной работы было определение условий получения гидрогелей на основе ИПЭК поликатиона хитозана (ХТЗ) и полианиона пектина, а также химически сшитых гидрогелей на основе модифицированных полимеров – сукцината хитозана (СХТЗ) и диальдегида пектина. Кроме того, исследовано влияние ряда факторов на свойства полученных гидрогелей с целью оценки возможности их дальнейшего использования в качестве пролонгаторов действия лекарственных препаратов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В экспериментах использовали хлорид ХТЗ (ЗАО Биопрогресс, Россия), цитрусовый пектин (ЦП, Herbstreirh & Fox KG, Германия) и яблочный пектин (ЯП) марки Unipectine XPP 240 (Швейцария); характеристики этих полимеров, а также СХТЗ приведены в табл. 1. Лекарственными препаратами, иммобилизуемыми в матрице гидрогелей, служили два цитостатика: митомицин C (ММС, С15Н18N4O5) производства ООО Верофарм (Россия) и цисплатин (Pt(NH)2Cl2) в виде раствора (1 мг/мл) в физиологическом растворе (филиал Наукопрофи ФГБУ “РОНЦ им. Н.Н. Блохина”, Россия). Кроме того, использовали физиологический раствор, фосфатный буфер (pH 7.4) и ацетатный буфер (pH 4.5).
Таблица 1.
Характеристики использованных образцов хитозана (ХТЗ) и сукцината хитозана (СХТЗ), цитрусового (ЦП) и яблочного (ЯП) пектинов
| Полиэлектролит | ХТЗ | СХТЗ | ЦП | ЯП | |
|---|---|---|---|---|---|
| Тип полиэлектролита | Поликатион | Полиамфолит | Полианион | Полианион | |
| Массовая доля аминогрупп, % | 75 | 20 | – | – | |
| Массовая доля карбоксильных групп, % | – | 60 | 60 | 40 | |
| Степень этерификации, % | – | – | 40 | 60 | |
| Степень деацетилирования, % | 75 | – | – | – | |
| ММ × 10–3 | 30 | 50 | (150/120)1, 2 | 70 | 26 |
Содержание ионогенных групп в полимерах определяли методом кислотно-основного титрования. Измерения pH среды проводили с помощью pH-метра АНИОН 4100. Величину потенциала растворов измеряли с помощью кулонометрического титратора ТК 100-В.
Получение гидрогелей на основе пектина и хитозана
Готовили растворы ХТЗ, пектина и их модифицированных производных в воде, физиологическом растворе и фосфатном буфере (pH 7.4) различной концентрации (моль звеньев/л): пектина – от 2.75 × 10–3 до 4.4 × 10–1, ХТЗ – от 5.5 × 10–3 до 4.4 × 10–1. При этом максимальная концентрация раствора была ограничена растворимостью полимера. Смешивали растворы ХТЗ и пектина в различных соотношениях при комнатной температуре. За образованием гидрогеля наблюдали визуально (по потере системой текучести). При получении гидрогеля, содержащего ММС, цитостатик вводили в раствор пектина, а затем смешивали растворы полимеров. Гели, содержащие цисплатин, получали смешиванием растворов полимеров в 0.1%-ном растворе цисплатина в физиологическом растворе.
Использование в работе указанных цитостатиков обусловлено следующими причинами. ММС применяется в офтальмологии при лечении глаукомы. Как было показано в работах [18, 19] использование ММС в составе гидрогеля на основе СХТЗ и диальдегида гиалуроновой кислоты способствует значительной стабилизации внутриглазного давления. Кроме того, это дало возможность снизить дозировку препарата до 0.015–0.1 мг. Небольшая дозировка ММС, действующая в течение 1–2 месяцев, позволила ослабить его токсическое действие и в то же время достичь длительного гипотензивного эффекта за счет профилактики рубцовых сращиваний. Замена дорогой гиалуроновой кислоты на пектин должна привести к значительному снижению стоимости конечной лекарственной формы. Препарат цисплатин применяется в онкологии при лечении раковых опухолей брюшной полости. Однако уже в течение 50 мин после его введения в брюшную полость через катетер или шприц он практически полностью выделяется из организма. Поэтому применение цисплатина в составе физически сшитого гидрогеля, проявляющего тиксотропные свойства, т.е. восстанавливающего свою структуру непосредственно в организме после снятия нагрузки, при его введении с помощью шприца должно обеспечить пролонгированное действие препарата и уменьшение его токсичности.
Модификация пектина и хитозана
С целью введения альдегидных групп в макромолекулы пектина проводили его окисление периодатом натрия, в ходе которого часть гидроксильных групп макромолекул превращается в альдегидные. Для осуществления этой реакции к водному раствору пектина концентрации 2.75 × 10–3 моль/л по каплям добавляли раствор периодата натрия концентрации 0.5 моль/л (до эквимольного их соотношения). Реакцию проводили при постоянном перемешивании в темноте при температуре 25 ± 0.1°C в течение разного времени. Оптимальными характеристиками (степень модификации, способность формировать гель) обладал образец, полученный в течение 24 ч, который и был отобран для дальнейших экспериментов. Для инактивации непрореагировавшего периодата в реакционную смесь добавляли этиленгликоль и выдерживали ее в течение еще 2 ч. Модифицированный полимер очищали диализом: раствор помещали в диализный мешочек из целлофана, который погружали в дистиллированную воду. Проводили замену воды до постоянного нейтрального значения pH. После диализа реакционной смеси модифицированный полимер лиофилизировали [18, 19]. Структуру модифицированных пектинов с помощью данных ИК-спектроскопии подтвердить не удалось, поскольку доказательством наличия альдегидных групп в веществе является обнаружение полосы поглощения при 1725 см–1, а в случае пектина она перекрывается полосой поглощения при 1735 см–1, относящейся к сложноэфирным группам, которые присутствуют в нативной структуре пектина.
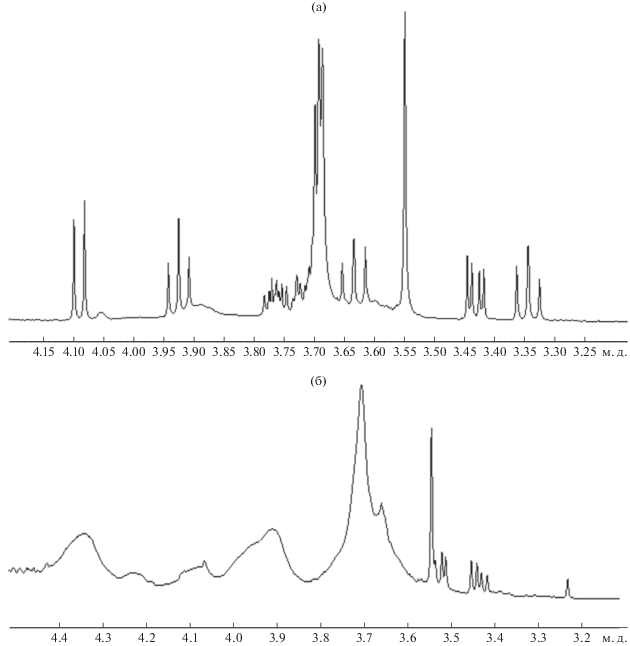
Степень модификации (СМ, %) пектинов рассчитывали, сравнивая интегральные интенсивности сигналов протонов метильной группы ацетамидного фрагмента и суммы сигналов протонов гидратированной формы альдегида, используя спектры 1Н ЯМР.
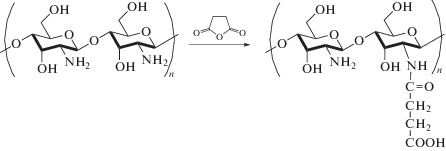
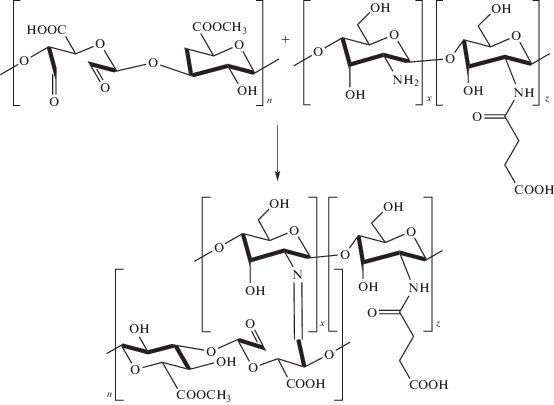
Модификацию ХТЗ с молекулярной массой (ММ), равной 150 × 103, проводили янтарным ангидридом [18, 19]. Для этого 0.5 г ХТЗ растворяли при перемешивании в 40 мл 5%-ного раствора молочной кислоты. Янтарный ангидрид (1.5 г) растворяли в 160 мл метанола и добавляли к раствору ХТЗ. Реакционную смесь выдерживали при постоянном перемешивании в течение 24 ч при температуре 25 ± 0.1°C. Схема реакции модификации ХТЗ приведена на рис. 1. Модифицированный ХТЗ (СХТЗ) осаждали при pH 8 ацетоном. Осадок отфильтровывали, растворяли в воде, подвергали диализу до постоянного нейтрального значения pH. Очищенный продукт осаждали ацетоном и лиофилизировали до постоянной массы.
Полученный образец растворялся в воде при нейтральном значении pH. Степень модификации ХТЗ оценивали с помощью нингидринного анализа и кислотно-основного титрования.
Определение степени набухания полимерных гидрогелей
Для определения степени набухания (α) гидрогелей их предварительно сушили. С этой целью сначала проводили замену растворителя: гель поочередно выдерживали в средах с последовательным ростом содержания метанола, а затем ацетона и лиофильно сушили.
Предварительно высушенный и взвешенный гидрогель погружали в дистиллированную воду. Фиксировали изменение массы геля во времени и по формуле рассчитывали степень набухания [16]:
где m0 – масса исходного высушенного геля, m – масса набухшего геля.Исследование диффузии лекарственного препарата из полимерной матрицы в физиологический раствор
Гидрогель с введенным лекарственным препаратом погружали в физиологический раствор (0.9%-ный раствор NaCl в воде). Методом УФ-спектроскопии регистрировали кинетику изменения оптической плотности в полосе поглощения при λ = 364 нм (для ММС) и по калибровочной кривой рассчитывали изменение концентрации лекарственного соединения в физиологическом растворе во времени.
Количественный анализ диффузии цисплатина из гидрогеля проводили с помощью жидкостного хроматографа Shimadzu LC-20 со спектрофотометрическим диодно-матричным детектором. Использовали колонку с фазой Pursuit XRs C18 (250 мм × 4.6 мм, 5 мкм), а в качестве подвижной фазы – элюент состава ацетонитрил : вода = = 20 : 80 (об. %). Скорость потока составляла 1 мл/мин. Детектирование проводилось при длине волны 215 нм. 50 мкл раствора образца вводили в хроматографическую петлю объемом 20 мкл и записывали хроматограмму.
На первом этапе получали хроматограммы стандартных растворов цисплатина с концентрацией 0.10, 0.25, 0.50 и 1.00 мг/мл. По полученным значениям строили градуировочный график зависимости площади пика на хроматограмме от концентрации цисплатина. Затем анализировали образцы сред после определенного времени контакта с гидрогелем, полученным смешением растворов полимеров в цисплатине.
Оценка комплексообразования в системе полимер/лекарственное вещество/дисперсионная среда
Оценка комплексообразования в системе полимер/лекарственное вещество/вода проводилась методами изомолярных серий (МИС) и мольных отношений (ММО).
При использовании МИС готовили растворы двух компонентов – лекарственного вещества (ЛВ) и полимера (ПМ) – одинаковой молярной концентрации. Полученные растворы смешивали в объемных соотношениях от 1 : 9 до 9 : 1 при постоянном общем объеме раствора (VЛВ + VПМ = V = = const). При этом суммарное число молей обоих компонентов в объеме смеси всегда оставалось постоянным (СЛВ + СПМ = С = const). Измеряли оптическую плотность A растворов в диапазоне длин волн от 200 до 400 нм [20, 21]. Для оптической плотности в максимуме поглощения (на длине волны 301 нм) строили зависимость ΔA (отклонения полученных значений A от закона аддитивности) от мольной доли ЛВ в растворе смесей, затем находили зависимость ΔA от [ЛВ]/[ПМ]. Перпендикуляр, опущенный из максимумов построенных кривых на ось абсцисс, пересекает ее в точке, соответствующей составу образующегося комплекса [20, 21].
При использовании ММО готовили растворы ПМ и соответствующего ЛВ. В 10 мерных колб наливали по 2 мл раствора ПМ и от 0.5 до 8 мл ЛВ. Затем объем смеси доводили до 10 мл и измеряли оптическую плотность растворов на длине волны 301 нм. Расчет константы устойчивости проводили согласно методике, описанной в работах [20, 21].
Определение молекулярной массы методом седиментационного равновесия
Значения ММ использованного образца ХТЗ до и после модификации были определены методом седиментационного равновесия с помощью ультрацентрифуги МОМ-3180 (Венгрия) при скорости вращения ротора 20 000 об./мин в двухсекторной кювете. Шлирен-снимки (угол наклона щели 25°) фиксировали на видеокамеру и затем оцифровывали с помощью специальной программы. Расчеты ММ проводили по известной методике [22].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
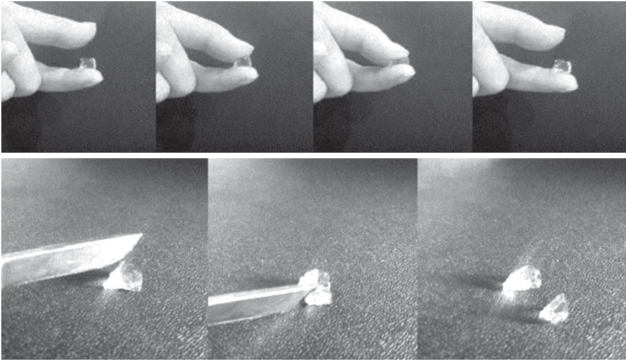
Ранее [23, 24] нами было показано, что при взаимодействии ХТЗ и гиалуроновой кислоты в физиологическом растворе или фосфатном буфере в зависимости от концентрации и соотношения исходных компонентов выпадает осадок, либо формируется золь. Гидрогели получали на основе модифицированных производных – гиалуроновой кислоты, окисленной периодатом, и СХТЗ. Такие гидрогели образуются с одной стороны за счет формирования ИПЭК, с другой стороны – в результате химического взаимодействия аминогрупп ХТЗ и альдегидных групп модифицированной гиалуроновой кислоты. Полученные таким образом гидрогели обладали достаточно высокой механической прочностью и упругостью (рис. 2).
Однако в тех случаях, когда проявление гидрогелями высокой механической прочности не требуется, например, при наружном применении в виде мазей или кремов, или когда необходимо вводить гидрогели с помощью шприца продавливанием через катетер, их можно получать и только за счет формирования ИПЭК.
Условия формирования гидрогеля хитозан–пектин
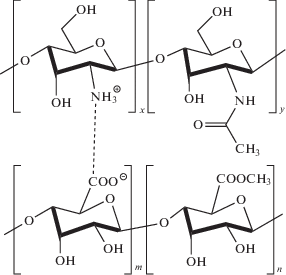
Гидрогели получали путем смешения растворов ХТЗ и пектина различных концентраций и при разном соотношении полимеров. В воде или фосфатном буфере при определенном содержании полимеров формируется ИПЭК.
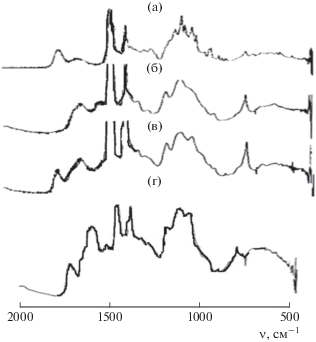
Формирование ИПЭК подтверждено данными ИК-спектроскопии (рис. 3). В спектре комплекса наблюдаются изменения в области 1550–1800 см–1, которые обусловлены взаимодействием ионогенных групп макромолекул: аминогрупп ХТЗ и карбоксилатных групп ЦП (рис. 4).
Рис. 3.
ИК-спектры ЦП (а), ХТЗ (б) и лиофилизованных гидрогелей на основе ЦП и ХТЗ с ММ = 30 × 103 (в, г). Гели получены: (в) из 0.2 мл раствора ХТЗ и 0.8 мл раствора ЦП в фосфатном буфере, (г) из 0.2 мл раствора ХТЗ и 1.2 мл ЦП в 3.33 × 10–3 моль/л водном растворе цисплатина. Концентрация растворов ХТЗ и ЦП – 4.40 × 10–1 и 0.55 × 10–1 моль звеньев/л соответственно.
Данные, представленные в табл. 2, свидетельствуют о том, что при концентрации ХТЗ менее 5.50 × 10–2 моль звеньев/л формирования гидрогеля во всем объеме системы не наблюдается. Это, вероятно, связано со слишком малым содержанием функциональных групп, взаимодействие которых ведет к структурированию системы. При увеличении концентрации растворов обоих полиэлектролитов от 5.50 × 10–2 до 11.00 × 10–2 моль звеньев/л наблюдается диапазон их соотношений, в котором образуется гидрогель без отделения дисперсионной среды, т.е. во всем объеме системы. Кроме того, гидрогель образуется при небольшом (двух- четырехкратном) избытке раствора пектина.
Таблица 2.
Результаты смешения растворов ХТЗ (ММ = 30 000) и ЦП в фосфатном буфере (pH 7.4)
| [ХТЗ] × 102, моль звеньев/л | [ЦП] × 102, моль звеньев/л | ХТЗ : ЦП, моль/моль | Образующаяся система |
|---|---|---|---|
| 2.75 | 1.38 | 2 : 1 | Раствор |
| 1 : 1 | Раствор | ||
| 1 : 2 | Гидрогель–раствор | ||
| 1 : 4 | Осадок–раствор | ||
| 5.50 | 2.75 | 2 : 1 | Осадок–раствор |
| 1 : 1 | Гидрогель–раствор | ||
| 1 : 2 | Гидрогель | ||
| 1 : 3 | Гидрогель–раствор | ||
| 11.00 | 5.50 | 8 : 1 | Осадок–раствор |
| 4 : 1 | Гидрогель–раствор | ||
| 1 : 1 | Гидрогель–раствор | ||
| 1 : 2 | Гидрогель | ||
| 1 : 4 | Гидрогель | ||
| 1 : 6 | Гидрогель–раствор |
Таким образом, в зависимости от условий получения (ММ и концентрации полимеров и их соотношения) комплекс может оставаться в растворимой форме, выпадать в виде осадка, образовывать золь или гель (табл. 2).
Замена цитрусового пектина на яблочный (табл. 3) приводит к тому, что формирование гидрогеля имеет место только при использовании раствора хитозана (ММ = 30 × 103) концентрации 4.40 × 10–1 моль звеньев/л. Это, видимо, обусловлено небольшой ММ яблочного пектина (26 × 103) по сравнению с цитрусовым (70 × 103) либо недостатком свободных карбоксильных групп (в яблочном пектине их 40%, тогда как в цитрусовом 60%). При этом гидрогель образуется во всем объеме системы только при добавлении раствора пектина к раствору ХТЗ, взятому в 8-кратном избытке. При увеличении содержания ХТЗ плотность сетки увеличивается, наблюдается постепенный синерезис дисперсионной среды, что в итоге приводит к выпадению осадка ИПЭК.
Таблица 3.
Условия формирования гидрогелей в системе ХТЗ/ЯП/фосфатный буфер (pH 7.4). ММХТЗ = 30 000
| [ХТЗ] × 101, моль звеньев/л | [ЯП] × 101, моль звеньев/л | ХТЗ : ЯП, моль звеньев/ моль звеньев | Система |
|---|---|---|---|
| 4.4 | 2.75 | 32 : 1 | Осадок–раствор |
| 16 : 1 | Гидрогель–раствор | ||
| 8 : 1 | Гидрогель | ||
| 4 : 1 | Гидрогель | ||
| 2 : 1 | Гидрогель | ||
| 1 : 1 | Раствор |
При использовании в качестве дисперсионной среды водного раствора цисплатина (диаминадихлорида платины) концентрации 3.33 × 10–3 моль/л условия формирования гидрогелей были несколько иными (табл. 4).
Таблица 4.
Условия формирования гидрогелей на основе ХТЗ и ЦП в физиологическом растворе цисплатина (3.33 × 10–3 моль/л). ММХТЗ = 50 × 103
| СЦП× 103, моль звеньев/л | СХТЗ × 101, моль звеньев/л | VХТЗ, МЛ | VЦП, мл | Vцисп, мл | Мольное соотношение ХТЗ : ЦП : цисплатин | X, % | U, % | t, ч | Ск × 103, моль/л |
|---|---|---|---|---|---|---|---|---|---|
| 55 | 4.4 | 0.2 | 0.8 | 1.0 | 29 : 15 : 1 | 100 | 0 | 24 | 3.33 |
| 1.0 | 1.2 | 22 : 14 : 1 | 80 | 20 | 24 | – | |||
| 1.2 | 1.4 | 18 : 13 : 1 | 100 | 0 | 24 | 3.33 | |||
| 0.6 | 0.8 | 29 : 11 : 1 | 90 | 10 | 24 | – | |||
| 55 | 4.4 | 0.2 | 0.8 | 1.0 | 29 : 15 : 1 | 100 | 0 | 24 | 3.33 |
| 1.0 | 1.2 | 22 : 14 : 1 | 80 | 20 | 24 | – | |||
| 1.2 | 1.4 | 18 : 13 : 1 | 100 | 0 | 24 | 3.33 | |||
| 0.6 | 0.8 | 29 : 11 : 1 | 90 | 10 | 24 | – | |||
| 55 | 2.8 | 0.2 | 0.6 | 0.8 | 19 :11 : 1 | 95 | 5 | 0.5 | – |
| 0.8 | 1.0 | 19 : 15 : 1 | 75 | 25 | 0.5 | – | |||
| 1.0 | 1.2 | 14 : 14 : 1 | 90 | 10 | 0.5 | – |
Аминогруппы цисплатина способны взаимодействовать с карбоксильными группами пектина, образуя комплекс [25] и, таким образом, влиять на условия формирования гидрогеля. Формирование комплекса подтверждают и наши результаты. Согласно данным ИК-спектроскопии (рис. 3) для геля, полученного в водном растворе цисплатина, заметны изменения в области поглощения OH-групп. Полоса γOH сдвигается на 20 см–1 в низкочастотную область, что указывает на участие этих групп в образовании комплекса. Об этом же свидетельствуют изменения в области 800–900 см–1 (уширение полосы δОН и ее сдвиг в высокочастотную область).
Согласно исследованию методами МИС и ММО (рис. 5, 6), при мольном соотношении цисплатин : ЦП = 0.1 : 0.4 формируется комплекс с константой устойчивости, равной 3.5 × 103 л/моль (концентрация исходных растворов составляла 1.0 × 10–3 моль/л).
Рис. 5.
Зависимость отклонения оптической плотности на длине волны 301 нм от аддитивного значения от состава изомолярного раствора (мольной доли цисплатина в смеси ЦП/цисплатин). Условия эксперимента: [пектин] = [цисплатин] = 1 × 10–3 моль/л, время выдержки системы 1 (1), 24 (2), 72 ч (3).
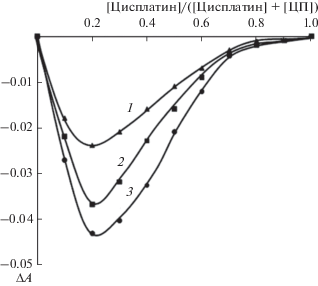
Рис. 6.
УФ-спектры поглощения смесей ЦП и цисплатина. [ЦП] = [цисплатин] = 1 × 10–3 моль/л. Соотношение объемов растворов ЦП и цисплатина (мл/мл): 0 – раствор ЦП, 1 – 2/0.5, 2 – 2/1, 3 – 2/2, 4 – 2/3, 5 – 2/4, 6 – 2/5, 7 – 2/6, 8 – 2/8, 9 – раствор цисплатина.
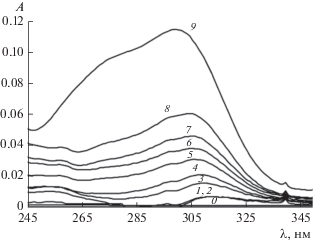
Как следует из данных рис. 5, отклонения оптической плотности от аддитивных значений увеличиваются во времени. Однако спустя трое суток значения оптической плотности уже практически не изменяются. При этом положение минимума на зависимости ΔA от мольной доли цитостатика в растворе также не изменяется, что указывает на формирование комплекса состава 4 : 1, т.е. на каждые четыре звена макромолекулы пектина приходится 1 молекула цисплатина.
Наименьшее время гелеобразования – 0.5 ч наблюдалось в случае гидрогеля, полученного смешением раствора ЦП концентрации 55 × × 10–3 моль звеньев/л и раствора ХТЗ концентрации 4.40 × 10–1 моль звеньев/л. Таким образом, показана возможность и установлены условия формирования физически сшитого гидрогеля хитозан–пектин.
Для получения химически сшитого гидрогеля проводили реакции модификации полимеров. ХТЗ с ММ = 150 × 103 модифицировали янтарным ангидридом (рис. 1). В ходе реакции часть аминогрупп превращается в сукцинатные с карбоксильной группой на конце. СМ (%) ХТЗ оценивали с помощью нингидринного анализа и кислотно-основного титрования.
При проведении реакции в течение 24 ч образец модифицированного ХТЗ становится растворимым в воде. Обнаружено, что модификация ХТЗ янтарным ангидридом сопровождалась небольшим уменьшением его ММ, до 120 × 103. Вероятно, это связано с частичным разрывом β-гликозидных связей в ходе реакции модификации.
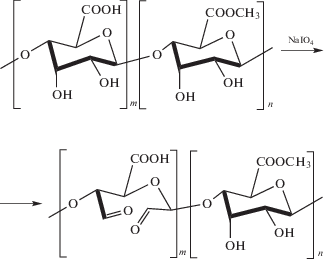
При смешении растворов СХТЗ и ЦП гидрогель получить не удалось, раствор смеси оставался прозрачным. Поэтому пектин модифицировали, окисляя его периодатом натрия. В ходе реакции часть гидроксильных групп макромолекул превращается в альдегидные (рис. 7).
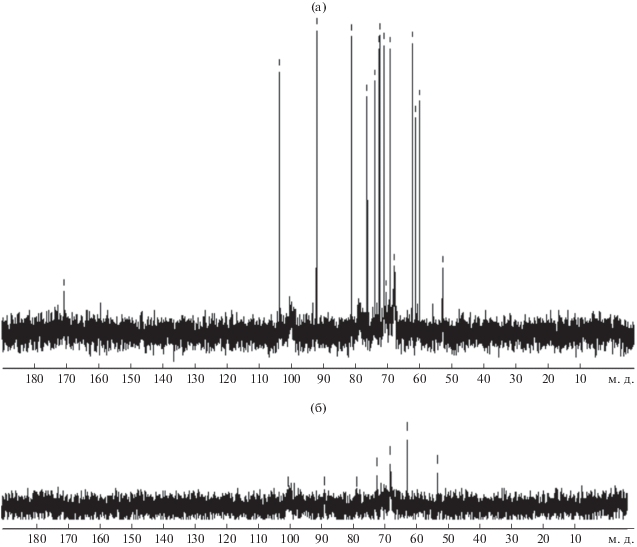
Степень модификации ЯП, которая составила около 5%, рассчитывали сравнением интегральных интенсивностей протонов метильной группы ацетамидного фрагмента и суммы сигналов протонов гидратированной формы альдегида, используя спектры 1Н ЯМР и 13С ЯМР (рис. 8, 9).
При смешении избытка раствора СХТЗ и раствора модифицированного окислением пектина образуется гидрогель (рис. 10). Формирование гидрогеля обусловлено, с одной стороны, образованием ковалентных азометиновых связей –C=N–, а с другой стороны, – взаимодействиями карбоксильных групп пектина и оставшихся после модифицирования аминогрупп СХТЗ.
СВОЙСТВА ГИДРОГЕЛЕЙ ХИТОЗАН–ПЕКТИН
Набухание гидрогелей
Высушенный до постоянной массы гидрогель на основе ХТЗ и пектина погружали в воду и растворы хлорида натрия различной концентрации и следили за изменением массы образца в результате сорбции жидкости.
Чем больше концентрация растворов ХТЗ или пектина, использованных для формирования гидрогеля, тем больше степень набухания α лиофилизованного гидрогеля (рис. 11). По-видимому, это связано с увеличением взаимного отталкивания включенных в сетку геля одноименно заряженных групп. Основная масса дисперсионной среды проникает в гель в течение 1 ч. Затем процесс замедляется и за 6 ч кривая набухания практически выходит на плато.
Рис. 11.
Кинетические кривые сорбции воды лиофилизованными гелями. Условия получения гелей из растворов ХТЗ и пектина в фосфатном буфере: 1 – 0.2 мл раствора ХТЗ (4.4 × 10–1) и 0.8 мл раствора пектина (0.55 × 10–1), 2 – 0.2 мл такого же раствора ХТЗ и 0.8 мл раствора пектина (2.75 × 10–1), 3 – 0.2 мл раствора ХТЗ (2.2 × 10–1) и 0.8 мл раствора пектина (2.75 × 10–1). Все концентрации в скобках указаны в моль звеньев/л. ММХТЗ = 30 × 103.
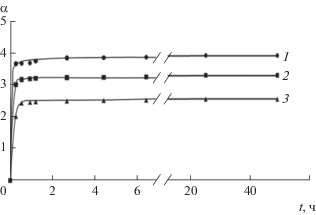
Использование при синтезе гелей хитозана с большей ММ (рис. 11 и 12, кривые 1) в водной среде приводит к некоторому увеличению предельной степени набухания.
Рис. 12.
Зависимость степени набухания от времени для лиофилизированного геля, полученного смешением 1.2 мл раствора пектина (0.55 × 10–1 моль звеньев/л) и 0.2 мл раствора ХТЗ (4.4 × 10–1 моль звеньев/л) в 0.1%-ном водном растворе цисплатина, содержащем 0.9 мас. % NaCl. Температура 25°C, набухание в H2O (1) и в растворах NaCl концентрации 0.5 (2), 0.9 (3) и 1.5% (4). ММХТЗ = 50 × 103.
Как следует из данных, представленных на рис. 12, степень набухания геля уменьшается с ростом концентрации хлорида натрия в воде, т.е. с ростом ионной силы раствора. Это связано с тем, что равновесное набухание гидрогелей на основе ИПЭК определяется балансом двух сил, одна из которых обусловлена упругостью сетки, а другая – осмотическим давлением за счет противоионов диффузного слоя, окружающих фиксированные заряды функциональных групп. Сначала при набухании имеет место практически односторонняя диффузия молекул растворителя в пространственную сетку геля образованного ИПЭК, т.е. осмос растворителя через поры полупроницаемой мембраны. Оба процесса: выход ионов и диффузия растворителя, – обусловлены стремлением системы к выравниванию концентраций компонентов. Механизм набухания сводится к проникновению молекул растворителя в ближайшие слои полимера и сольватации соответствующих участков полимерных цепей. В результате происходит разворачивание макромолекулярных клубков, что облегчает дальнейшее проникновение молекул растворителя как в гель (и увеличение его массы и объема), так и из геля – процесс “отбухания” геля.
При погружении сухого образца в воду противоионы внутри геля оказывают на него давление, и максимальное увеличение объема геля термодинамически выгодно. В результате, когда окружающей средой является вода, т.е. в отсутствие электролитов, гель начинает стремительно увеличивать свой объем. Добавление солей в воду приводит к увеличению ионной силы раствора и соответственно уменьшению степени набухания гидрогеля. Видно (рис. 12, кривые 2–4), что в данном случае при увеличении концентрации NaCl, т.е. с ростом ионной силы раствора от 0.155 М (0.9% NaCl) до 0.255 М (1.5% NaCl) значение равновесной степени набухания уменьшается.
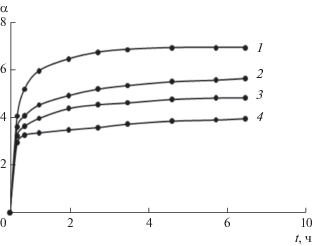
Кинетические кривые набухания гидрогелей, полученных смешением растворов диальдегида яблочного пектина (ДЯП) и СХТЗ, отличаются от кривых, полученных при формировании гидрогелей на основе соответствующих немодифицированных полимеров (см. рис. 13, 14). Рост степени набухания без выхода кинетических кривых на плато имеет место в течение длительного времени – до 190 ч, т.е. 7 суток (рис. 14). Вероятно, это связано с ростом упругих свойств сетки, сформированной дополнительно химическими связями между макромолекулами ДЯП и СХТЗ. Уменьшение исходной концентрации раствора ДЯП вызывает значительное снижение степени набухания гидрогеля (рис. 14).
Рис. 13.
Кинетические кривые сорбции воды высушенными гелями. [СХТЗ] = 2.2 × 10–1 моль звеньев/л, [ДЯП] = 0.275 × 10–1 моль звеньев/л. Мольное соотношение СХТЗ : ДЯП = 8 : 1 (1), 4 : 1 (2); 2 : 1 (3). ММСХТЗ = 120 × 103.
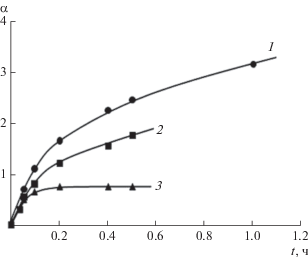
Рис. 14.
Кинетические кривые сорбции воды высушенными гелями. [СХТЗ] = 1.1 × 10–1, [ДЯП] = 0.55 × 10–1, мольное соотношение СХТЗ : ДЯП = 8 : 1 (1) и 4 : 1 (5); [СХТЗ] = 1.1 × 10–1, [ДЯП] = 0.275 × 10–1, мольное соотношение СХТЗ : ДЯП = 8 : 1 (4); [СХТЗ] = 2.2 × 10–1, [ДЯП] = 0.275 × 10–1, мольное соотношение СХТЗ : ДЯП = 32 : 1 (2), ММСХТЗ = 30 × × 103; [CХТЗ] = 1.1 × 10–1, [ДЯП] = 0.275 × 10–1, мольное соотношение СХТЗ : ДЯП = 8 : 1 (3), ММСХТЗ = = 120 × 103. Все концентрации указаны в моль звеньев/л.
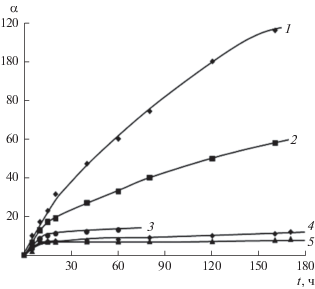
Таким образом, варьируя соотношение полимеров или исходную их концентрацию растворов, можно изменять степень набухания получаемого гидрогеля в десятки раз.
Выход ММС и цисплатина из полимерной матрицы геля в физиологический раствор
Исследовали диффузию ММС из гидрогеля. Для этого в раствор пектина вводили 0.1 мл раствора ММС, затем добавляли раствор ХТЗ. Сформировавшийся в течение нескольких секунд гидрогель помещали в физиологический раствор (0.9% NaCl в воде) и регистрировали кинетику высвобождения ММС по изменению оптической плотности системы на длине волны 364 нм, соответствующей максимуму поглощения ММС.
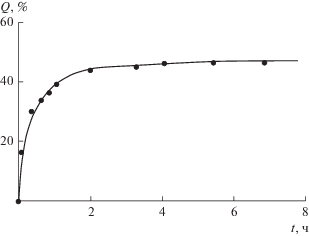
Установлено (рис. 15), что в течение первых суток высвобождается примерно 40–45% ММС, остальное его количество выделяется с небольшой скоростью примерно в течение месяца.
Рис. 15.
Кинетика высвобождения митомицина С из гидрогеля, приготовленного смешением 0.2 мл раствора ХТЗ (4.4 × 10–1 моль звеньев/л) и 0.8 мл раствора пектина (0.55 × 10–1 моль звеньев/л).
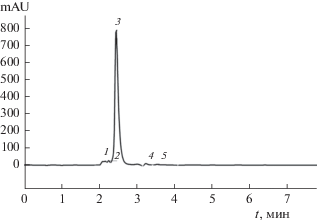
Выход цисплатина из геля оценивали методом высокоэффективной жидкостной хроматографии. На рис. 16 приведена хроматограмма раствора цисплатина концентрацией 0.5 мг/мл. Видно, что имеет место хорошее разрешение пика этого цитостатика (пик 3).
Рис. 16.
Хроматограмма стандартного раствора цисплатина с концентрацией 0.5 мг/мл; пик 3 – цисплатин.
Хроматограмма образца водной среды, отобранного спустя 1 ч после начала диффузии цисплатина из геля, приведена на рис. 17. Время выхода цисплатина на хроматограмме (пик 4) точно совпадает со временем выхода стандартного образца этого цитостатика (2.5 мин).
Рис. 17.
Хроматограмма образца водной среды, отобранного через 60 мин после начала диффузии цисплатина из геля; пик 4 отвечает цитостатику.
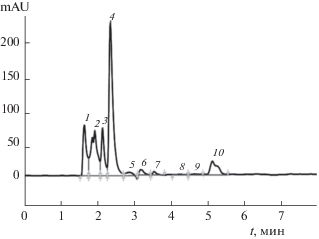
Для оценки кинетики выхода цисплатина из геля первоначально получали градуировочную зависимость площади пика на хроматограмме в зависимости от концентрации цитостатика. Затем исследовали образцы водной среды после определенного времени ее контакта с гелем. Полученные данные о кинетике выхода цисплатина в окружающую среду представлены на рис. 18.
Рис. 18.
Зависимость концентрации цисплатина в водной среде от времени при его выходе из гидрогеля, полученного смешением 0.2 мл раствора ХТЗ (4.40 × 10–1 моль звеньев/л) и 0.8 мл раствора ЦП (0.55 × 10–1 моль звеньев/л), с раствором цисплатина.
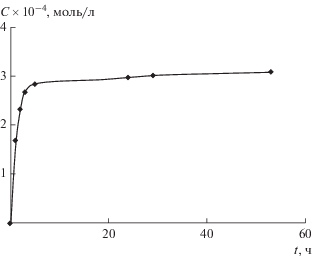
Видно, что основная масса препарата (до 97%) высвобождается из геля в течение 4–5 ч. Остальной же цисплатин далее выделяется в течение месяца.
Таким образом, в результате проведенных исследований доказана возможность и установлены условия получения (значения концентрации растворов, соотношения компонентов, молекулярной массы полимеров) как физического гидрогеля смешением растворов хитозана и пектина, так и химически сшитых гидрогелей смешением растворов сукцината хитозана и диальдегида пектина в водной среде при pH 7.4. Показано, что как химические, так и физические гидрогели способны пролонгировать высвобождение лекарственного препарата-цитостатика и, следовательно, могут быть в перспективе использованы в качестве носителей лекарственных средств (ММС и цисплатина) в офтальмологии, онкологии и других областях медицины.
Список литературы
Patenaude M., Hoare T. // Biomacromolecules. 2012. V. 13. P. 369.
Bhattarai N., Gunn J., Zhang M. // Adv. Drug Deliv. Rev. 2010. V. 62. P. 83.
Tan H., Marra K.G. // Materials. 2010. V. 3. P. 1746.
Краюхина М.А., Самойлова Н.А., Ямсков И.А. // Успехи химии. 2008. Т. 77. С. 854.
Кильдеева Н.Р., Михайлов С.Н. // Хитозан / под ред. Скрябина К.Г., Михайлова С.Н., Варламова В.П. М.: Центр “Биоинженерия” РАН, 2013. С. 271.
Hamidi M., Azadi A., Rafiei P. // Adv. Drug Deliv. Rev. 2008. V. 60. P. 1638.
Peppas N.A, Bures P., Leobandung W., Ichikawa H. // Eur. J. Pharm. Biopharm. 2000. V. 50. P. 27.
Kim S.J., Park S.J., Kim S.I. // React. Funct. Polym. 2003. V. 55. P. 53.
da Costa M.P.M., de Mello Ferreira I.L., de Macedo Cruz M.T. // Carbohydr. Polym. 2016. V. 146. P. 123.
Giacomazza D., Sabatino M.A., Catena A., Leone M., San Biagio P.L., Dispenza C. // Carbohydr. Polym. 2014. V. 114. P. 141.
Панова Т.В.., Быкова Е.В., Рогачева В.Б., Joosten J., Brackman J., Зезин А.Б., Кабанов В.А. // Высокомолек. соед. А. 2004. Т. 46. С. 783.
Барановский В.Ю., Ганев В., Барашкова И.И., Ясина Л.Л., Вассерман А.М. // Коллоид. журн. 2011. Т. 73. С. 9.
Новоскольцева О.А., Черникова Е.В., Рогачева В.Б., Зезин А.Б. // Высокомолек. соед. Б. 2015. Т. 57. С. 140.
Анурова М.Н., Бахрушина Е.О., Демина Н.Б. // Хим.-фарм. журн. 2015. Т. 49. № 9. С. 39.
Casolaro M., Cini R., Del Bello B., Ferrali M., Maellaro E. // Biomacromolecules. 2009. V. 10. P. 944.
Тагер А.А. Физико-химия полимеров. 4-ое изд. М.: Научный мир, 2007.
Sun S., Wang A. // Sep. Purif. Technol. 2006. V. 51. P. 409.
Сигаева Н.Н., Вильданова Р.Р., Куковинец О.С., Володина В.П., Спирихин Л.В., Зайдуллин И.С., Колесов С.В. // Журн. прикл. химии. 2014. Т. 87. С. 1500.
Бикбов М.М., Хуснитдинов И.И., Зайдуллин И.С., Вильданова Р.Р., Сигаева Н.Н. // Молекулярная медицина. 2017. № 1. С. 35.
Булатов М.И., Калинкин И.П. Практическое руководство по фотометрическим методам анализа. Л.: Химия, 1986.
Бек М., Надьпал И. Исследование комплексообразования новейшими методами. М.: Мир, 1989.
Цветков В.Н., Эскин В.Е., Френкель С.Я. Структура макромолекул в растворах. М.: Наука, 1964.
Вильданова Р.Р., Сигаева Н.Н., Куковинец О.С., Зайдуллин И.С., Фазылова Г.Р., Кузнецов С.И., Колесов С.В. // Химия природных соединений. 2014. № 2. С. 205.
Бикбов М.М., Хуснитдинов И.И., Сигаева Н.Н., Вильданова Р.Р. // Практическая медицина. 2017. Т. 2. № 9. С. 38.
Verma A.R., Sachin K. // Curr. Drug Deliv. 2008. V. 5. P. 120.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал