Коллоидный журнал, 2020, T. 82, № 3, стр. 377-385
Линейно упорядоченные ансамбли монодисперсных наночастиц серебра, формируемые на микро/нанофибриллярной целлюлозе
А. В. Скатова 1, С. А. Сарин 1, Ю. А. Щипунов 1, *
1 Институт химии ДВО РАН
690022 Владивосток, проспект 100-летия Владивостока, 159, Россия
* E-mail: YAS@ich.dvo.ru
Поступила в редакцию 15.10.2019
После доработки 16.12.2019
Принята к публикации 21.12.2019
Аннотация
Однородные наночастицы серебра диаметром менее 10 нм синтезированы гидротермальным методом на микро/нанофибриллах целлюлозы, служащей в качестве субстрата, в растворе, состоящем из смеси этиленгликоля (восстановитель) с водой, соли серебра, поливинилпирролидона и затравки в виде хлорида серебра. Целлюлоза выступала в качестве дополнительного мягкого восстановителя, препятствуя слиянию образующихся наночастиц и определяя формирование их линейных ансамблей, в которых плотность наночастиц и зазор между ними регулировались варьированием концентрации соли серебра в реакционной смеси. Показано в экспериментах с красителем родамином 6Ж, что на синтезированных ансамблях серебряных наночастиц наблюдается явление гигантского комбинационного рассеяния (усиленного поверхностью рамановского рассеяния или SERS). Предложенный метод синтеза может быть использован для изготовления недорогих сенсорных элементов для проведения анализа методом спектроскопии комбинационного рассеяния.
ВВЕДЕНИЕ
Наночастицы (НЧ) серебра находят все возрастающее и разнообразное применение, включая такие области как электротехника, электроника, фотоника, текстиль, медицина, санитария и различные отрасли химической промышленности [1–8]. Практическая значимость НЧ объясняется совокупностью химических, электрических, механических, термических и оптических свойств, кардинально изменяющихся при переходе от макроскопического к наноразмерному состоянию. Они обуславливают появление новых функциональных возможностей, востребованных при создании высокотехнологичных изделий [9–12]. Свойства НЧ определяются в значительной степени размером, формой, однородностью, структурой и составом [7, 11, 13–17]. Поэтому их регулированию и получению наноматериалов с заданными, воспроизводимыми характеристиками придается первоочередное значение.
Наноразмерное серебро, как показал анализ литературы, проведенный в [18, 19], стали использовать, по крайней мере, 130 лет назад. Синтез НЧ не представляет значительных трудностей [20]. Их формирование наблюдается при добавлении восстановителя в раствор соли или его освещении солнечным светом. Проблемой является получение НЧ с определенными характеристиками – размером, формой, однородностью и устойчивостью во времени [21]. Они могут резко изменяться даже при небольшом варьировании условий проведения процесса – концентрации реагентов, последовательности их смешения, pH, температуры, при добавлении солей и органических веществ. Особой проблемой является устойчивость НЧ [1, 22–24]. Они обладают более высокой поверхностной энергией в сравнении с макро- и микроскопическими объектами из-за большего отношения площади поверхности к объему, что является причиной отличия в свойствах НЧ и устойчивости их дисперсий [21, 25–27]. Практически сразу после формирования зародыши сливаются в нанокластеры и НЧ, которые затем агрегируют с образованием поликристаллических частиц, не обладающих уникальными свойствами наноразмерных материалов.
Стабилизация НЧ достигается введением органических веществ (лигандов), которые связываются и закрепляются на поверхности металла [1, 11, 21, 22, 24, 28–30]. Они предотвращают контакт и слияние НЧ, снижая поверхностную энергию и выступая в роли стерического барьера. В качестве стабилизаторов используются поверхностно-активные вещества, соединения с меркапто-, амино- и карбоксильными группами, но наиболее широко – полимеры. Значительное распространение получил поливинилпирролидон (ПВП), в результате предпочтительной адсорбции которого на одной из кристаллических граней серебра наблюдается анизотропный рост НЧ, что позволяет регулировать их форму и размеры при синтезе [23, 24, 29, 31].
На ранних стадиях получения наноразмерного серебра использовали природные стабилизирующие добавки. Одну из первых работ, видимо, опубликовал в 1887 г. Muthmann [32]. Он добавил гуммиарабик в раствор наноразмерного серебра, о формировании которого свидетельствовало окрашивание раствора в красный цвет. Окраска несколько изменилась после введения полисахарида, но не исчезала. При высаживании гуммиарабика спиртом формировался красный осадок, а раствор обесцвечивался, что указывало на соосаждение НЧ серебра. При растворении гуммиарабика происходило также и окрашивание раствора. Таким образом, Muthmann впервые показал, что полисахарид связывается с серебряными НЧ, предотвращая их агрегирование. Lea в 1891 г. в аналогичном эксперименте подтвердил стабилизирующее действие полисахаридов, взяв декстрин вместо гуммиарабика [33]. Кроме того, он впервые отметил восстановление ионов серебра под воздействием декстрина.
В это же время были проведены эксперименты с целлюлозой и хитином. Ambronn установил [34], что обработка, включающая пропитку образцов в растворе солей серебра или золота и их последующее восстановление под действием света, приводит к появлению дихроизма, заключающегося в различии окраски в проходящем и отраженном свете или при рассматривании через поляроиды, находящиеся по разные стороны образца. Явление обусловлено образованием оптически активных структур, состоящих, как было показано значительно позже в работах разных авторов [35], из линейных ансамблей наночастиц, ориентированных в одном направлении на фибриллах, на которых они сформировались в процессе восстановления.
В настоящее время полисахариды получили широкое распространение в синтезе наноразмерного серебра. Значительным образом расширен их список. Практически все коммерчески доступные полисахариды, включая крахмал [36, 37], хитозан [38, 39], альгинат [40, 41] и каррагинаны [42], подходят для стабилизации НЧ. Кроме того, они могут выступать в качестве восстановителя, упрощая процесс синтеза НЧ и исключая использование токсичных веществ. Целлюлоза в последнее время, видимо, чаще всего используется при получении наноразмерного серебра. Ее преимуществом является то, что она служит не только восстановителем и стабилизатором, но и субстратом, определяющим структуру и применение образующегося композитного материала – бионанокомпозита [43]. Целлюлоза доступна в традиционном виде (вата, бумага, ткань), а в последнее время и в новых формах – нанобумаги, микрофибрилл, нановискеров, аэрогелей и кристаллических нанофибрилл, выделяемых из волокон, которые получили название наноцеллюлозы. Включение в структуру целлюлозы наноразмерного серебра приводит к появлению новых функциональных свойств – проводимости, поверхностного плазмонного резонанса, дихроизма, усиленного поверхностью комбинационного рассеяния, каталитической и фотокаталитической активности, антибактериального действия [3, 5, 6, 43–45]. Они обусловили резкое расширение применения целлюлозы в областях, в которых она раньше никогда не использовалась.
Наноразмерные частицы в состав целлюлозных материалов вводят двумя основными способами. Первый из них – двустадийный – включает предварительный синтез НЧ коллоидно-химическими методами [8, 46, 47]. Они не требуют ни дорогого специального оборудования, ни высокой квалификации персонала, могут быть реализованы практически в любой химической лаборатории, позволяют регулировать размер и форму НЧ в широких пределах [21], отличаются небольшими затратами. Полученная дисперсия НЧ затем вводится в структуру бумаги, пленок, текстиля или аэрогеля, избыток раствора удаляется, а полученный бионанокомпозит высушивается. Этот метод известен под термином dip-pad-dry-cure, в котором отражены основные стадии процесса,
Второй способ, реализуемый в одну стадию, заключается в получении НЧ серебра непосредственно на целлюлозе после ее пропитки раствором соли. Он был применен впервые в 1896 г. [34]. Ионы Ag+ восстанавливались под действием дневного света. Одностадийное получение НЧ серебра стали широко использовать с 1998 г., когда Laserna с соавт. пропитали фильтровальную бумагу раствором азотнокислого серебра, а затем обработали раствором борогидрида натрия [48]. Восстановление проводится также с помощью цитрата натрия [49], этиленгликоля [23, 25], бутиламина [50], гидразина [26]. Целлюлоза, как и все углеводы, может сама выступать в качестве мягкого восстановителя [45]. Для этого требуется нагрев. Процесс иногда проводится в кипящем растворе. Некоторые авторы затем добавляют восстановитель для его полного завершения [51]. Восстановление in situ приводит к лучшему закреплению НЧ Ag на поверхности целлюлозных структур.
Формирование НЧ серебра определенной формы лучше контролируется при мягком гидротермальном синтезе. В жестких условиях – при высокой температуре и, соответственно, давлении – может происходить карбонизация углеводов с образованием углерод-серебряных нанокомпозитов [52]. Как показывает анализ литературы, в большинстве случаев синтез проводится в одну стадию. При этом обычно формируются НЧ, имеющие большой разброс по размерам и форме [53–55]. Неоднородность может достигать двух порядков величины (от 100 нм до 10 мкм [48]). Подбором условий проведения процесса, например, оптимизацией соотношения концентраций соли серебра и восстановителя, которого в работе [56] взяли в 800 раз меньше, удается улучшить однородность НЧ, но возникают трудности с регулированием их размера. Анализ публикаций показывает также, что одностадийный синтез приводит к получению скорее микроскопических частиц, чем наноразмерных [48].
Повышение степени однородности и регулирование размера и формы НЧ достигается проведением процесса в две стадии [57]. На первой стадии формируются затравочные наноразмерные частицы серебра, которые затем выступают в качестве активных центров, определяя направленность синтеза. В этой роли могут выступать также НЧ хлорида серебра [25, 26].
Целью настоящей работы является синтез однородных НЧ серебра на микро/нанофибриллах целлюлозы, выступающих в качестве субстрата. Это достигается путем предварительного формирования на них затравки из хлорида серебра и последующего восстановления ионов Ag+ в гидротермальных условиях в смеси этиленгликоля с водой при повышенных температуре и давлении. Для повышения степени однородности НЧ добавляется ПВП. В качестве восстановителя выступает в основном этиленгликоль, а также сама целлюлоза. Показано, что микро/нанофибриллы целлюлозы служат в качестве субстрата, определяя формирование линейных ансамблей из однородных серебряных НЧ размером менее 10 нм. На них наблюдается явление гигантского комбинационного рассеяния (усиленного поверхностью рамановского рассеяния или SERS) при адсорбции красителя родамина 6Ж.
МАТЕРИАЛЫ И МЕТОДЫ
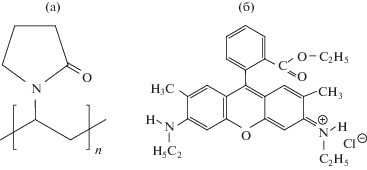
Нитрат серебра (99.9%, Sigma-Aldrich), хлорид натрия (Sigma), ПВП (ММ ≈ 360 000, Sigma-Aldrich), этиленгликоль (99%, Acros Organics), родамин 6Ж (квалификации “для микроскопии”) и целлюлоза (линт) в виде микрочастиц размером примерно 20 мкм (Sigma-Aldrich) использовались в предоставленном виде без дополнительной очистки. Структурные формулы ПВП и красителя приведены на рис. 1. Деионизованная вода подготовлена на установке Rios-Di Clinical (Millipore).
Приготовление микро/нанофибриллярной целлюлозы
Фибриллизацию целлюлозы проводили по модифицированной методике, предложенной ранее [58]. Микрочастицы целлюлозы заливали водой и помещали cначала в ультразвуковую баню на 30 мин, а затем обрабатывали на высокоскоростном гомогенизаторе Yellowline DI 25 Basic Homogenizer (IKA WERKE, Германия) в течение 5 мин. После охлаждения смеси до комнатной температуры обработку повторяли еще 14 раз. Полученная дисперсия целлюлозы в воде была устойчива до одной недели, что выявлялось по отслаиванию воды. Однородное состояние дисперсии легко восстанавливалось после расслоения при легком встряхивании.
Гидротермальный синтез серебряных наночастиц на микро/нанофибриллярной целлюлозе
Подготовленную дисперсию микро/наноразмерной целлюлозы смешивали с 0.01 мМ раствором нитрата серебра на магнитной мешалке в течение 15 мин, а затем по каплям добавляли 0.01 мМ раствор хлорида натрия и оставляли перемешиваться на сутки в темноте. Дисперсную фазу отделяли от раствора центрифугированием (5000 об./мин, 30 мин). Осадок после декантации надосадочной жидкости промывали несколько раз дистиллированной водой и помещали на сутки в термостат при 40°C. Затем его заливали раствором ПВП в смеси этиленгликоля и воды (соотношение 1 : 1), перемешивали на магнитной мешалке в течение 15 мин, добавляли рассчитанный объем раствора AgNO3 для создания нужной концентрации, тщательно перемешивали, переливали в тефлоновый стакан-вкладыш, который помещали в герметично закрываемый стальной автоклав. Реакционную смесь помещали на один час в термостатируемый шкаф, предварительно нагретый до 150°C, после отключения которого автоклав оставляли охлаждаться до комнатной температуры. Целлюлозу с НЧ серебра отделяли центрифугированием (5000 об./мин, 30 мин) от реакционного раствора и трижды промывали водой. Приготовленные образцы хранили при комнатной температуре.
Сканирующая электронная микроскопия
Изображения получены в автоэмиссионном сканирующем электронном микроскопе (СЭМ) JSM-6700 (JEOL, Япония). Образцы для съемки готовили, как описано в [59].
Просвечивающая электронная микроскопия
Снимки НЧ серебра на микро/нанофибриллах целлюлозы получены с помощью просвечивающего электронного микроскопа (ПЭМ) Libra 120 (Carl Zeiss, Германия) при ускоряющем напряжении 120 кВ. Образцы для съемки были подготовлены в соответствии с ранее описанным методом [60] диспергированием образцов целлюлозы с нанесенными НЧ Ag в воде на ультразвуковой бане. Каплю дисперсии помещали на стандартную медную сеточку (SPI, США) с 200 ячейками, покрытую формваром, а затем высушивали при комнатной температуре.
Спектроскопия в УФ и видимой областях
Спектры поглощения реакционных смесей, помещенных в стеклянные кюветы толщиной 1 см, снимали на спектрофотометре UV-2250 (Shimadzu, Япония) в диапазоне длин волн 300–700 нм. В качестве образца сравнения использовали деионизованную воду.
Спектроскопия комбинационного рассеяния (рамановская микроспектроскопия)
Образцы для исследования были приготовлены высушиванием капли дисперсии микро/нанофибрилл целлюлозы с НЧ серебра, нанесенной на покровное стекло для микроскопии. На него затем прикапывали раствор родамина 6Ж в воде.
Съемка спектров комбинационного рассеяния проведена на установке ALPHA300 R (WITec, Германия), состоящей из лазера с длиной волны излучения 532 нм и оптического конфокального микроскопа с системой фокусировки луча на поверхности образца и детектором излучения UHTS 300 VIS. При съемке использовался объектив с кратностью 100× (EC “Epiplan-Neofluar” 100×/0.90 DIC, Carl Zeiss) при минимальной мощности возбуждающего излучения 25 мВт. Сканирование осуществлялось на площади 160 × 160 мкм с разрешением 3.1 точка/мкм2. Время экспозиции в каждой точке при съемке спектра, составляло 2 мс. Вычитание фона проводилось с помощью линейной фильтрации с учетом основных линий вибрационных колебаний родамина 6Ж.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Получение микро/наноразмерной целлюлозы
Применение целлюлозы для создания высокотехнологичных материалов в настоящее время связывают с ее микро/нанофибриллярными формами, в наибольшей степени удовлетворяющими требованиям нанотехнологии [43, 45, 61–64]. В настоящей работе микро/нанофибриллы приготовлены частичной фибриллизацией исходных волокон, взятых в виде хлопкового пуха (линта), с помощью интенсивной механической обработки. Химические методы, которые обычно заключаются в окислении полисахарида, приводящие к значительной деградации (деполимеризации), не использовались [65].
Изображение исходного хлопкового пуха, полученное с помощью СЭМ, показано на рис. 2а. Как можно видеть, линт имеет вид коротких волокон длиной 20–30 мкм и диаметром ~10 мкм. Интенсивная механическая обработка с помощью высокоскоростного гомогенизатора привела к его фибриллизации. На микрофотографии, приведенной на рис. 2б, вместо волокон присутствуют многочисленные фибриллярные структуры. Видны отдельные игольчатые нанофибриллы диаметром порядка 10 нм и длиной 100–300 нм. Они, видимо, представляют собой кристаллические структуры (наноцеллюлозу), формирующиеся в предельном случае [43, 45, 64]. Некоторые из фибрилл имеют разветвленную структуру, представляя собой части исходных волокон (рис. 2а). Их фибриллизация при дальнейшем увеличении времени механической обработки, видимо, могла привести к образованию наноцеллюлозы. В настоящей работе преимущественное получение нанокристаллической целлюлозы не преследовалось. Смесь фибриллярных структур в соответствии с рис. 2б можно с полным основанием назвать микро/наноразмерной дисперсией.
Синтез наночастиц серебра
Наноразмерное металлическое серебро получается восстановлением его ионов, что схематично можно представить следующим образом:
Стандартный окислительно-восстановительный потенциал пары Ag+/Ag0 составляет +0.779 В [26], что требует применения достаточно сильных восстановителей. Подходящим для этой цели считается борогидрид натрия, использование которого встречается во многих публикациях [1, 5, 41]. Восстановление протекает с высокой скоростью, что затрудняет контроль над процессом. НЧ получаются обычно неоднородными, с большим разбросом по размерам [41]. Контроль облегчается при проведении процесса в мягких условиях. Значительное снижение стандартного окислительно-восстановительного потенциала пары Ag+/Ag0 вызывает комплексообразование и формирование нерастворимых соединений [26]. В частности, в случае AgCl он понижается до +0.222 В. Серебро в AgCl можно восстанавливать мягкими восстанавливающими агентами, например, этиленгликолем. В настоящей работе AgCl использовался для понижения стандартного окислительно-восстановительного потенциала и локализации синтеза наноразмерного Ag на целлюлозе. Хлорид серебра сначала осаждали на целлюлозных микро/нановолокнах простым введением небольшого количества хлорида натрия. Полученные наноразмерные частицы AgCl затем выступали в качестве затравочных, на которых происходило восстановление ионов серебра этиленгликолем. При этом высвободившиеся анионы Cl– связывали катионы Ag+ из контактирующего раствора, обуславливая продолжение и локализацию процесса. В то же самое время реакция (1) в растворе, где серебро находилось в виде ионов, для восстановления которых требовались более жесткие условия [26], практически не протекала из-за использования мягкого восстановителя – этиленгликоля. Целлюлоза также могла выступать в роли второго мягкого восстанавливающего агента [45, 66]. Описанная схема позволила добиться максимальной локализации синтеза НЧ серебра на микро/нанофибриллах.Для улучшения контроля над формированием наноразмерных частиц в реакционную систему вводился ПВП. Он широко используется в синтезе НЧ серебра [23, 24, 29, 31]. Контроль объясняется специфическим связыванием полимера с поверхностью металла за счет амидной группы в пирролидоновом кольце [24]. Связь, однако, является относительно слабой. Поэтому оболочка из ПВП может перестраиваться, не ограничивая в значительной степени синтез НЧ, но препятствуя их агрегации. Стабилизирующее действие оказывает также целлюлоза, которая, кроме того, выступает в роли субстрата, на котором происходит формирование НЧ [43, 45, 67, 68],
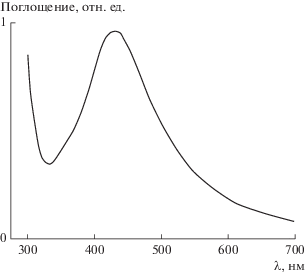
Восстановление ионов серебра в использованной реакционной смеси практически не наблюдалось при комнатной температуре. Оно ускорялось при нагревании. Процесс проводили в гидротермальных условиях, что способствует формированию НЧ металлов с более однородным распределением по размерам [66, 69]. Получение НЧ серебра контролировали спектрофотометрически. На рис. 3 приведен спектр поглощения одного из образцов, синтезированных по описанной схеме. На нем можно видеть полосу c максимумом при 420 нм. Ее наличие при указанной длине волны обусловлено явлением локализованного поверхностного плазмонного резонанса, характерным для наноразмерного серебра [17].
Рис. 3.
Спектр поглощения, характеризующий явление локализованного поверхностного плазмонного резонанса на НЧ серебра, синтезированных в растворе с 64 ммоль AgNO3.
Дополнительное подтверждение было получено с помощью ПЭМ. Соответствующие изображения приведены на рис. 4. Они относятся к образцам, синтезированным в растворах с содержанием AgNO3, равным 16 и 64 ммоль. На снимках хорошо видны многочисленные серебряные НЧ, которые располагаются в виде цепочек. Это указывает на их нахождение на микро/нанофибриллах целлюлозы, которая выступает в качестве субстрата, определяя структурную упорядоченность НЧ в виде линейных структур. Более плотно упакованные НЧ получены в реакционной смеси с бóльшим количеством AgNO3 (рис. 4б). На фотографии, приведенной на рис. 4в, видны нанофибриллы с меньшим числом НЧ. В этом случае хорошо различимы линейные структуры. Следует также отметить однородность НЧ. Подавляющее большинство из них имеет близкий размер. Предварительные оценки показывают, что он варьирует в диапазоне 4–8 нм.
Гигантское комбинационное рассеяние
Отмеченное выше явление локализованного поверхностного плазмонного резонанса (рис. 3) обуславливает резкое возрастание интенсивности комбинационного рассеяния на НЧ серебра. Этот эффект в настоящее время вызывает огромный интерес в связи с возможным его использованием в аналитической химии для анализа ультрамалых количеств органических веществ, вплоть до отдельных молекул [7, 8, 45, 70–72]. При этом гигантское усиление рассеяния, достигающее согласно некоторым публикациям 1011, наблюдается не на отдельных НЧ, а на их ансамблях. Большое значение имеет расстояние (зазор) между ними. Он не должен превышать 2 нм, но прямой контакт между НЧ также нежелателен [7, 45, 72, 73]. В обоих случаях происходит резкий спад интенсивности комбинационного рассеяния. Выполнение условия определенного пространственного расположения НЧ в ансамблях считается одной из наиболее сложных коллоидно-химических проблем, решению которой посвящено большое число публикаций.
Регулирование плотности наночастиц на микро/нанофибриллах целлюлозы без существенного изменения их размера простым варьированием содержания соли серебра в реакционной смеси, достигнутое в настоящей работе (рис. 4), представляет одно из возможных простых решений указанной проблемы. Это было проверено в экспериментах с красителем родамином 6Ж, который в качестве модельного соединения широко используется при изучении явления гигантского комбинационного рассеяния [72, 74].
Примером служат данные, приведенные на рис. 5. На нем показаны спектры комбинационного рассеяния красителя в диапазоне от 600 до 1700 см–1 на двух образцах. Один из них был приготовлен нанесением раствора родамина 6Ж концентрации 10–6 М на чистую поверхность стеклянной пластинки (кривая 1), другой – на поверхность пластинки, покрытую микро/нанофибриллами целлюлозы с НЧ серебра, синтезированными в растворе, содержащем 64 ммоль AgNO3 (кривая 2). Видна очень большая разница в интенсивности спектров, составляющая порядки величины. Кроме того, выявление полос в спектре родамина 6Ж, находящегося на чистой поверхности стекла, потребовало многократного сканирования поверхности, общее время которого составило 300 с (кривая 1), в то время как продолжительность съемки второго спектра составила всего 0.002 с (кривая 2). При этом получены узкие, хорошо разрешимые полосы. Фактор усиления по предварительным оценкам может достигать 107.
Рис. 5.
Зависимости интенсивности комбинационного рассеяния от сдвига по частоте для красителя родамина 6Ж, нанесенного на поверхность чистой стеклянной пластинки (1) и находящегося на микро/нанофибриллах целлюлозы с наночастицами серебра (2); пояснения в тексте. На вставке показана часть спектра в диапазоне 1000–1750 см–1, на которой интенсивности обоих спектров приведены в сопоставимом масштабе. Вертикальными линиями отмечено положение характеристических полос. Синтез НЧ серебра проведен в растворе с 64 ммоль AgNO3. Родамин 6Ж брался в концентрации 10–6 моль/л. После высушивания пластинки с микро/нанофибриллами целлюлозы и НЧ серебра на нее наносилось примерно 20 мг раствора красителя.
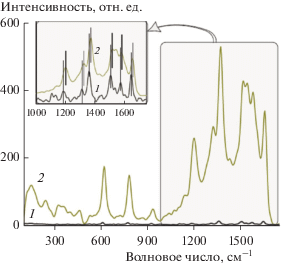
На вставке на рис. 5 показана часть спектра родамина 6Ж, на которой находятся характеристические полосы, относящиеся к красителю. Их положение – 1186, 1312, 1361, 1509, 1577 и 1649 см–1 (кривая 1) – хорошо согласуется с литературными данными. Так, для аналогичных полос в работе [75] приводится следующий ряд значений: 1184, 1311, 1362, 1510, 1576, 1649 см–1. Видно полное соответствие наших данных приведенным в литературе.
Спектр родамина 6Ж, показанный кривой 2, снят на “горячих точках” (hot spots), которые получили такое название из-за очень высокой интенсивности комбинационного (рамановского) рассеяния на них в сравнении с окружающими областями [72–74]. Фактор усиления в горячих точках варьирует от 105 до 1011, что позволяет достичь уровня разрешения отдельных молекул. Рост интенсивности обусловлен резонансными явлениями, что служит основанием называть спектр резонансным. При этом не только возрастает интенсивность полос, но изменяется и их положение [75]. Сдвиги могут составлять 4–7 см–1. Их природа до конца не выяснена. Она может носить комплексный характер, включая квантовые эффекты, размерный фактор, влияние формы НЧ и взаимодействия органического вещества с ними (химический фактор), ориентацию молекул [75, 76]. В нашем случае также наблюдаются сдвиги полос в резонансном спектре (кривая 2) в сравнении со спектром комбинационного рассеяния красителя (кривая 1). Они отмечены на вставке. Сдвиги оказались несколько большими, чем указывается в литературе, что требует проведения дополнительного изучения для выяснения природы такого поведения спектра.
ЗАКЛЮЧЕНИЕ
Проведенное исследование направлено на получение наноразмерного серебра на микро/нанофибриллярной целлюлозе, выступающей в качестве субстрата. Синтез проведен с использованием совокупности известных приемов, сочетание которых позволило добиться формирования однородных НЧ диаметром менее 10 нм с высокой агрегативной устойчивостью. Он осуществлен в гидротермальных условиях в смеси этиленгликоль/вода, содержащей ПВП, с применением затравки в виде хлорида серебра.
Использование целлюлозы в синтезе преследовало три важных цели. Она выступала в качестве дополнительного мягкого восстанавливающего агента, препятствующего слиянию НЧ. Как субстрат, микро/нанофибриллы определяли формирование линейных ансамблей из наноразмерных частиц. Плотность таких ансамблей и соответственно зазор между НЧ серебра регулировался варьированием концентрации соли серебра в реакционной смеси. Показано на примере красителя родамина 6Ж, что на таких структурах наблюдается гигантское комбинационное (рамановское) рассеяние. Разработанный метод может найти применение при изготовлении сенсоров на эффекте гигантского комбинационного рассеяния. Подчеркнем еще раз, что спектроскопия гигантского комбинационного рассеяния (усиленная поверхностью рамановская спектроскопия) в настоящее время рассматривается как один из наиболее высокочувствительных методов анализа органических веществ.
Список литературы
Evanoff D.D., Chumanov G. // ChemPhysChem. 2005. V. 6. P. 1221.
Pelton M., Aizpurua J., Bryant G. // Laser Photonics Rev. 2008. V. 2. P. 136.
Dastjerdi R., Montazer M. // Colloids Surf. B. 2010. V. 79. P. 5.
Gogos A., Knauer K., Bucheli T.D. // J. Agr. Food. Chem. 2012. V. 60. P. 9781.
Chernousova S., Epple M. // Angew. Chem. Int. Ed. 2013. V. 52. P. 1636.
Du X., Zhang Z., Liu W., Deng Y. // Nano Energy. 2017. V. 35. P. 299.
Hamon C., Liz-Marzan L.M. // J. Colloid Interface Sci. 2018. V. 512. P. 834.
Prikhozhdenko E.S., Bratashov D.N., Gorin D.A., Yashchenok A.M. // Nano Res. 2018. V. 11. P. 4468.
Khairutdinov R.F. // Colloid J. 1997. V. 59. P. 535.
de Dios A.S., Diaz-Garcia M.E. // Anal. Chim. Acta. 2010. V. 666. P. 1.
Bensebaa F. // Nanoparticle Technologies: From Lab to Market / Ed. by Bensebaa F. Amsterdam: Elsevier, 2013. P. 1.
Schaefer H.E. Nanoscience. The Science of the Small in Physics, Engineering, Chemistry, Biology and Medicine. Berlin: Springer, 2010.
Kelly K.L., Coronado E., Zhao L.L., Schatz J.C. // J. Phys. Chem. B. 2003. V. 107. P. 668.
Palpant B. // Non-Linear Optical Properties of Matter. From Molecules to Condensed Phases / Ed. by Papadopoulos M.G., Sadlej A.J., Leszczynski J. Dordrecht: Springer, 2006. P. 461.
Rempel A.A. // Russ. Chem. Rev. 2007. V. 76. P. 474.
Дыкман Л.А., Богатырев В.А., Щеголев С.Ю., Хлебцов Н.Г. Золотые наночастицы. Синтез, свойства, биомедицинское применение. М.: Наука, 2008.
Lu Y.Z., Chen W. // Chem. Soc. Rev. 2012. V. 41. P. 3594.
Nowack B., Krug H.F., Height M. // Environ. Sci. Technol. 2011. V. 45. P. 1177.
Nowack B., Krug H.F., Height M. // Environ. Sci. Technol. 2011. V. 45. P. 7593.
Solomon S.D., Bahadory M., Jeyarajasingam A.V., Rutkowsky S.A., Boritz C., Mulfinger L. // J. Chem. Educ. 2007. V. 84. P. 322.
Xia Y., Xiong Y., Lim B., Skrabalak S. // Angew. Chem. Int. Ed. 2009. V. 48. P. 60.
Nair L.S., Laurencin C.T. // J. Biomed. Nanotechnol. 2007. V. 3. P. 301.
Mukherji S., Bharti S., Shukla G., Mukherji S. // Phys. Sci. Rev. 2019. V. 4. 20170082.
Kang H., Buchman J.T., Rodriguez R.S., Ring H.L., He J.Y., Bantz K.C., Haynes C.L. // Chem. Rev. 2019. V. 119. P. 664.
Wiley B., Sun Y.G., Xia Y.N. // Acc. Chem. Res. 2007. V. 40. P. 1067.
Goia D.V. // J. Mater. Chem. 2004. V. 14. P. 451.
Kwon S.G., Hyeon T. // Small. 2011. V. 7. P. 2685.
Forster S., Antonietti M. // Adv. Mater. 1998. V. 10. P. 195.
Pacioni N.L., Borsarelli C.D., Rey V., Veglia A.V. // Silver Nanoparticle Applications: In the Fabrication and Design of Medical and Biosensing Devices / Ed. by Alarcon E.I., Griffith M., Udekwu K.I. Cham: Springer International Publishing Switzerland, 2015. P. 13.
Rozenberg B.A., Tenne R. // Prog. Polym. Sci. 2008. V. 33. P. 40.
Sun Y.G., Xia Y.N. // Science. 2002. V. 298. P. 2176.
Muthmann S. // Ber. Dtsch. Chem. Ges. 1887. V. 20. P. 983.
Lea M.C. // Phil. Mag. Ser. 5. 1891. V. 31. P. 497.
Ambronn H. // Ber. Kgl. Sächs. Ges. Wissensch. Math.-Phys. 1896. V. 48. P. 613.
Caseri W.R. // Polym. Int. 2018. V. 67. P. 46.
Raveendran P., Fu J., Wallen S.L. // J. Am. Chem. Soc. 2003. V. 125. P. 13 940.
Sharma V.K., Yngard R.A., Lin Y. // Adv. Colloid Interface Sci. 2009. V. 145. P. 83.
Tran H.V., Tran L.D., Ba C.T., Vu H.D., Nguyen T.N., Pham D.G., Nguyen P.X. // Colloid Surf. A. 2010. V. 360. P. 32.
Kummari S.V.K.R., Kummara M.R., Palem R.R., Nagellea S.R., Shchipunov Y., Ha C.-S. // Polym. Int. 2015. V. 64. P. 293.
Reddy P.R.S., Rao K.M., Rao K.S.V.K., Shchipunov Y., Ha C.-S. // Macromol. Res. 2014. V. 22. P. 832.
Буркова Ю.Л., Беленёва И.А., Щипунов Ю.А. // Коллоид. журн. 2015. Т. 77. С. 714.
Venkatpurwar V., Pokharkar V. // Mater. Lett. 2011. V. 65. P. 999.
Shchipunov Y., Postnova I. // Adv. Funct. Mater. 2018. V. 26. P. 1 705 042.
Liu H., Qing H.B., Li Z.D., Han Y.L., Lin M., Yang H., Li A., Lu T.J., Li F., Xu F. // Mater. Sci. Eng. R. 2017. V. 112. P. 1.
Ogundare S.A., van Zyl W.E. // Cellulose. 2019. V. 26. P. 6489.
Rai M., Yadav A., Gade A. // Biotechn. Adv. 2009. V. 27. P. 76.
Ngo Y.H., Li D., Simon G.P., Garnier G. // Adv. Colloid Interface Sci. 2011. V. 163. P. 23.
Laserna J.J., Campiglia A.D., Winefordner J.D. // Anal. Chim. Acta. 1988. V. 208. P. 21.
Rehan M., Mashaly H.M., Mowafi S., Abou El-Kheir A., Emam H.E. // Dyes Pigments. 2015. V. 118. P. 9.
Park H.K., Yoon J.K., Kim K. // Langmuir. 2006. V. 22. P. 1626.
Lu Y.D., Wu C.J., Wu Y., You R.Y., Lin G., Chen Y.Q., Feng S.Y. // Materials. 2018. V. 11. P. 1197.
Hoheisel T.N., Schrettl S., Szilluweit R., Frauenrath H. // Angew. Chem. Int. Ed. 2010. V. 49. P. 6496.
Nickel U., Mansyreff K., Schneider S. // J. Raman Spectrosc. 2004. V. 35. P. 101.
Wei H.R., McCarthy A., Song J., Zhou W., Vikesland P.J. // Faraday Discuss. 2017. V. 205. P. 491.
Zhang X., Sun H., Tan S., Gao J., Fu Y., Liu Z. // Inorg. Chem. Commun. 2019. V. 100. P. 44.
Zhu C., Hue J., He J. // J. Nanosci. Nanotechnol. 2009. V. 9. P. 3067.
Schestakow M., Muench F., Reimuth C., Ratke L., Ensinger W. // Appl. Phys. Lett. 2016. V. 108. 213108.
Khlebnikov O.N., Silantev V.E., Shchipunov Y.A. // Mendeleev Commun. 2018. V. 28. P. 214.
Щипунов Ю.А., Силантьев В.Е., Постнова И.В. // Коллоид. журн. 2012. Т. 74. С. 654.
Сергеева К.М., Постнова И.В., Щипунов Ю.А. // Коллоид. журн. 2013. Т. 73. С. 779.
Charreau H., Foresti L., Vazquez A. // Rec. Patents Nanotechnol. 2013. V. 7. P. 56.
Shatkin J.A., Wegner T.H., Bilek E.M., Cowie J. // TAPPI J. 2014. V. 13. P. 9.
Sharifi F., Ghobadian S., Cavalcanti F.R., Hashemi N. // Renew. Sustain. Energy Rev. 2015. V. 52. P. 1453.
Zhu H., Luo W., Ciesielski P.N., Fang Z., Zhu J.Y., Henriksson G., Himmel M.E., Hu L. // Chem. Rev. 2016. V. 116. P. 9305.
Battista O.A., Coppick S., Howsmon J.A., Sisson W.A. // Ind. Eng. Chem. 1956. V. 48. P. 333.
Yang G., Xie J., Deng Y., Bian Y., Hong F. // Carbohydr. Polym. 2012. V. 87. P. 2482.
Chook S.W., Chia C.H., Chan C.H., Chin S.X., Zakaria S., Sajab M.S., Huang N.M. // RSC Adv. 2015. V. 5. P. 88 915.
Tian H., He J. // Langmuir. 2016. V. 32. P. 12 269.
Shenashen M.A., El-Safty S.A., Elshehy E.A. // Part. Part. Syst. Charact. 2014. V. 31. P. 293.
Bell S.E.J., Stewart A. // Surface Enhanced Raman Spectroscopy: Analytical, Biophysical and Life Science Applications / Ed. by Schlucker S. Weinheim: Wiley-VCH, 2011. P. 71.
Luo S.C., Sivashanmugan K., Liao J.D., Yao C.K., Peng H.C. // Biosensors Bioelectron. 2014. V. 61. P. 232.
Schlucker S. // Angew. Chem. Int. Ed. 2014. V. 53. P. 4756.
Fasolato F. Surface Enhanced Raman Spectroscopy for Biophysical Applications Using Plasmonic Nanoparticle Assemblies. Cham: Springer Nature Switzerland, 2018.
Le Ru E., Etchegoin P. Principles of Surface Enhanced Raman Spectroscopy and Related Plasmonic Effects. Amsterdam: Elsevier, 2009.
Majoube M., Henry M. // Spectrochim. Acta. A. 1991. V. 47. P. 1459.
Alvarez-Puebla R.A. // J. Phys. Chem. Lett. 2012. V. 3. P. 857.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал